Чувствительность антибиотикорезистентных коагулазонегативных стафилококков к антисептику пиклоксидину
Автор: Халатян Анаит Суреновна, Будзинская Мария Викторовна, Холина Екатерина Георгиевна, Страховская Марина Глебовна, Колышкина Надежда Александровна, Коваленко Илья Борисович, Жуховицкий Владимир Григорьевич
Журнал: Клиническая практика @clinpractice
Рубрика: Фундаментальная медицина
Статья в выпуске: 1 т.11, 2020 года.
Бесплатный доступ
Актуальность. Коагулазонегативные стафилококки (КНС), в первую очередь Staphylococcus epidermidis, преобладают в нормальной микрофлоре глаза. Вследствие нерациональной антибиотикотерапии среди КНС широко распространяются резистентные штаммы. Цель - изучить чувствительность антибиотикорезистентных изолятов КНС к антисептику пиклоксидину. Методы. Для 39 изолятов бактерий, полученных из посевов проб с конъюнктивы, определены видовая принадлежность, чувствительность к антибиотикам и антисептику пиклоксидину. Методом электронной микроскопии исследована морфология клеток при воздействии антисептика. Результаты. Охарактеризованы 33 изолята S. epidermidis (17 чувствительных или устойчивых к препаратам не более 2 классов антибиотиков и 16 полирезистентных), 2 - Staphylococcus haemolyticus (1 устойчивый к 2 классам антибиотиков и 1 полирезистентный), 3 - Staphylococcus hominis (1 чувствительный и 2 полирезистентных), 1 - Staphylococcus caprae (полирезистентный). В тестах in vitro антисептик пиклоксидин показал высокую эффективность в подавлении роста стафилококков независимо от их чувствительности к антибиотикам, а также бактерицидную активность при концентрациях 15,6-31,2 мкг/мл, близких к таковым для хлоргексидина. В этой концентрации антисептик обладал деструктивным действием на поверхностные структуры клеток бактерий. Заключение. Антисептик пиклоксидин одинаково эффективен в отношении антибиотикочувствительных и резистентных коагулазонегативных стафилококков.
Микрофлора конъюнктивы, коагулазонегативные стафилококки, антибиотикорезистентность, пиклоксидин
Короткий адрес: https://sciup.org/143170831
IDR: 143170831 | DOI: 10.17816/clinpract17543
Текст научной статьи Чувствительность антибиотикорезистентных коагулазонегативных стафилококков к антисептику пиклоксидину
АКТУАЛЬНОСТЬ
Коагулазонегативные стафилококки (КНС), в норме колонизирующие всю поверхность кожи человека, долгое время принято было рассматривать как бактерии-комменсалы [1], которые не продуцируют факторы патогенности, характерные для коагулазопозитивного Staphylococcus aureus , и имеют ограниченное значение для клинической практики. Однако в последнее время бактерии этой группы стали привлекать повышенное внимание, что обусловлено установлением роли КНС в качестве резервуаров генов резистентности к антибактериальным препаратам и ведущих возбудителей нозокомиальных инфекций [2].
Микрофлора конъюнктивы схожа с микрофлорой верхних дыхательных путей и кожи и представлена в основном грамположительными бактериями, среди которых преобладают КНС [3]. Считается, что наряду с позитивной ролью, которая заключается в том, что КНС и их основной вид Staphylococcus epidermidis предотвращают колонизацию конъюнктивы более патогенным S. aureus [4], эпидермальный стафилококк становится одним из наиболее частых возбудителей оппортунистических инфекций глаза — конъюнктивита, кератита и эндофтальмита [3, 5, 6].
У конъюнктивальных штаммов S. epidermidis вследствие нерациональной антибиотикотерапии наблюдается широкое распространение генов резистентности [7–9]. В глазной хирургии это является серьезной проблемой при ведении больных с интравитреальными инъекциями [10, 11]. Многократные курсы местных глазных антибиотиков в качестве периоперационного метода профилактики способствуют развитию резистентности микрофлоры конъюнктивы и повышают риск возникновения не поддающихся антибиотикотерапии постинъекционных инфекционных осложнений [11].
У пациентов с резистентной микрофлорой конъюнктивы наблюдается также резистентность бактерий в носоглотке [7]. В литературе описаны случаи не поддающейся антибиотикотерапии пневмонии с высоким процентом смертельных исходов у больных с частым использованием местных глазных антибиотиков в анамнезе [12].
В операционной при проведении интравитре-альных инъекций для стерилизации глазной поверхности в течение 30 сек проводят ее орошение 5% раствором антисептика повидон-йода [13], а у больных с чувствительностью к повидон-йоду — 0,05% хлоргексидином [14] — антисептиком из группы бигуанидов. В качестве профилактических курсов антибактериальных препаратов до и после интравитреальных инъекций до недавнего времени обычной практикой являлось назначение антибиотиков местного действия в форме глазных капель [11]. В последние годы нецелесообразность подобных профилактических курсов антибиотиков получает подтверждение во многих исследованиях [11, 15]. По нашим данным [15], у пациентов, получивших 20 и более интравитреальных инъекций и сопутствующих курсов антибиотикотерапии, наблюдается двукратное увеличение содержания по-лирезистентных изолятов в составе микрофлоры конъюнктивы, а процент изолятов, резистентных к применяемому антибиотику, достигает 90%.
При инфицировании конъюнктивы резистентными штаммами альтернативой антибиотикам может стать применение местных глазных антисептиков. Наряду с антисептиками повидон-йодом и хлоргек- сидином, которые применяются в глазной хирургии только в операционной, антисептик из ряда бисбигуанидов пиклоксидин (N,N’’-бис[[(4-хлор-фенил)амино]иминометил]-1,4-пиперазиндикарбок-симидамид дигидрохлорид) выпускается в форме глазных капель (0,05%, 500 мкг/мл пиклоксидина дигидрохлорид). Пиклоксидин показан при инфекциях, вызываемых S. aureus, Escherichia coli, Streptococcus faecalis, Eberthella typhosa, Klebsiella pneumoniae, Proteus vulgaris, Shigella dysenteriae, Bacillus subtilis, Chlamydia trachomatis. Однако, несмотря на ведущую роль КНС в инфекциях конъюнктивы, бактерицидные свойства пиклоксидина в отношении КНС не описаны; неизвестно так же, как влияет антибиотикорезистентность стафилококков на их чувствительность к данному антисептику.
Цель исследования — изучить чувствительность антибиотикорезистентных изолятов КНС к антисептику пиклоксидину.
МЕТОДЫ
В исследование включены 39 изолятов КНС, полученных из посевов проб с конъюнктивы пациентов ФГБНУ «НИИ глазных болезней». Пробы с конъюнктивы выполнялись с помощью стерильных одноразовых тампонов по стандартной методике (от латерального угла глаза к медиальному) в нижнем своде конъюнктивы на транспортную систему со средой Эймса. Забор материала осуществлялся таким образом, чтобы контакт с ресницами и кожей век был по возможности минимизирован.
Методы исследования
Пробы пересевали на среду агар Мюллера-Хинтон (Россия, Оболенск) и Columbia агар (Becton Dickinson, Франция) с добавлением 5% бараньей крови. При наличии роста определяли видовую принадлежность выделенного микроорганизма и чувствительность к антибиотикам с помощью автоматизированного бактериологического анализатора BD Phoenix 100.
Подавление роста бактерий в присутствии пи-клоксидина изучали микрометодом серийных разведений антисептика в жидкой питательной среде. Выращивание культур проводили в течение 24 ч на агаре Columbia (Becton Dickinson, Франция) с добавлением 5% бараньей крови и суспендировали в фосфатном буфере (PBS, pH 7,4) до показателя мутности 0,5 МакФарланда. По 20 мкл суспензий вносили в 200 мкл триптиказо-соевого бульона (TSB; Becton Dickinson, Франция) без добавок или с добавлением пиклоксидина в конечных концентрациях 250, 125, 62,5, 31,2 и 15,6 мкг/мл. Культуры выращивали в стерильных 96-луночных планшетах при 37°С. О росте изолятов судили по увеличению оптической плотности культур, которую регистрировали при 490 нм с помощью Perkin Elmer Wallac 1420 Multilabel Counter в начальный момент времени, при внесении бактерий в жидкую питательную среду, а также через 24 и 96 ч роста.
Исследование морфологии клеток бактерий при воздействии антисептика пиклоксидина проводили методом электронной микроскопии с помощью двухлучевого сканирующего ионно-электронного микроскопа Quanta 200 3D (FEI Company, США). Материал агаровых (Columbia agar) культур изоля-тов суспендировали (до показателя мутности 2,0 МакФарланда) в фосфатном буфере (PBS, рН 7,4) без антисептика с 31,2 мкг/мл или 500 мкг/мл пи-клоксидина; инкубировали при комнатной температуре в течение 15 или 60 мин; центрифугировали при 6000 об./мин в пробирках типа эппендорф; ресуспендировали в 1 мл дистиллированной воды, добавляли 2 мл формалина, выдерживали сутки при 4°С и центрифугировали. Осадок наносили на кремниевую подложку, высушивали под восходящим ламинарным потоком стерильного воздуха. Образцы не подвергали дегидратации и напыляли электронопроводящим слоем золота толщиной 5 нм (проба Au999) при помощи модуля для напыления SPI-MODULE Sputter Coater (SPI Supplies, США), затем изучали с помощью двухлучевого сканирующего ионно-электронного микроскопа Quanta 200 3D (FEI Company, США). Исследование проводили в условиях высокого вакуума при ускоряющем напряжении 5,0–10,0 kV. Рабочие увеличения — от 300 до 40 000.
Статистический анализ
Статистический анализ данных проводили в пакете программ Statistica 10.0. Для непрерывных нормально распределенных данных в качестве описательной статистики приводили среднее и стандартное отклонение, для порядковых и качественных — количество данных и проценты. Для сравнения нескольких групп (>2) применяли тест ANOVA, для сравнения двух — двусторонний t-критерий Стьюдента с поправкой Бонферрони на множественные сравнения. Различия в группах считали достоверными при уровне значимости меньше 5% ( p <0,05) для соответствующих критериев.
<линическая’2п20 п эакти ка Том 11 №1
РЕЗУЛЬТАТЫ
Видовой состав и чувствительностьк антибиотикам конъюнктивальных изолятов
Среди 39 исследованных изолятов КНС определены 33 S. epidermidis (из них 2 чувствительных к антибиотикам, 15 устойчивых не более чем к 1–2 препаратам из разных классов антибиотиков и 16 полирезистентных), 2 S. haemolyticus (1 устойчивый к 2 классам антибиотиков и 1 полирезистентный), 3 S. hominis (1 чувствительный и 2 полирезистент-ных), 1 S. caprae (полирезистентный). Чувствительность к антибиотикам конъюнктивальных изолятов приведена в дополнительных материалах.
Влияние пиклоксидина на рост стафилококков в жидкой питательной среде
В табл. 1 приведены параметры роста культур стафилококков, чувствительных или резистентных не более чем к 1–2 антибиотикам разных классов, и полирезистентных изолятов, без и с добавлением пиклоксидина.
Как видно из табл. 1, две группы стафилококков — антибиотикочувствительные и полирези-стентные — в процессе роста характеризуются близкими значениями средней оптической плотности (p<0,05). Незначительное увеличение оптической плотности до 0,25 зарегистрировано только у одного полирезистентного изоля-та — S. epidermidis — через 96 ч роста в присутствии 15,6 мкг/мл пиклоксидина, что отражается в повышении значения стандартного отклонения в группе 20 полирезистентных изолятов. Пиклок-сидин в концентрации 31,25 мкг/мл (см. табл. 1) полностью тормозил рост культур всех изолятов стафилококков в течение 96 ч роста. Для подтверждения бактерицидного действия препарата после регистрации оптической плотности через 96 ч проводили контрольные высевы на твердую питательную среду и выращивали при 37°С в течение 24 ч. За исключением одного упомянутого выше изолята S. epidermidis (оптическая плотность 0,25 в 96 ч роста), все пробы с пиклоксидином дали отрицательный результат, т.е. отсутствие роста при высеве на агаровую среду. Таким образом, пиклоксидин оказывал сходное бактериостатическое и бактерицидное действие на изоляты КНС с различной чувствительностью к антибиотикам: минимальная подавляющая концентрация для 39 изолятов КНС составляла 15,6 мкг/мл, а минимальная бактерицидная концентрация для 38 изолятов КНС — 15,6 мкг/мл и лишь для одного полирезистентного изолята S. epidermidis — 31,2 мкг/мл.
Исследование морфологии клеток бактерий при воздействии антисептика пиклоксидина При воздействии антисептика пиклоксидина на бактериальные клетки в течение 15 мин в суспензии наблюдали появление агрегатов на поверхности клеток в результате их лизиса и выхода внутриклеточного содержимого (рис. 1, А, Б). При воздействии в течение 60 мин уже при концентрации пиклоксидина 31,25 мкг/мл наблюдали потерю правильной округлой формы, образование в клеточных стенках пор диаметром 12–23 нм, появление агрегатов на поверхности клеток в результате лизиса клеток и выхода внутриклеточного содержимого (см. рис. 1, В–Е).
Таблица 1
Влияние антисептика пиклоксидина на рост коагулазонегативных стафилококков в жидкой питательной среде
|
Изоляты, условия роста |
Оптическая плотность, ед. опт. пл. |
||
|
в 0 ч |
в 24 ч |
в 96 ч |
|
|
КНС, группа I, контроль |
0,106±0,002 |
0,723±0,142 |
0,603±0,174 |
|
КНС, группа I, с пиклоксидином 15,6 мкг/мл |
0,108±0,004 |
0,111±0,011* |
0,104±0,010* |
|
КНС, группа I, с пиклоксидином 31,2 мкг/мл |
0,107±0,002 |
0,109±0,008** |
0,102±0,007** |
|
КНС, группа II, контроль |
0,107±0,002 |
0,712±0,189 |
0,667±0,223 |
|
КНС, группа II, с пиклоксидином 15,6 мкг/мл |
0,105±0,006 |
0,119±0,013** |
0,114±0,034** |
|
КНС, группа II, с пиклоксидином 31,2 мкг/мл |
0,106±0,005 |
0,112±0,011** |
0,109±0,011** |
Примечание . Группа I — КНС, чувствительные или резистентные не более чем к 1–2 антибиотикам разных классов ( n =19); группа II — полирезистентные КНС ( n =20). Значения оптической плотности с пиклоксидином в группах I и II, достоверно отличающиеся от таковых в контроле в отсутствие антисептика: * — p <0,05; ** — p <0,01. КНС — коагулазонегативные стафилококки.
Рис. 1. Воздействие антисептика пиклоксидина дигидрохлорида на бактериальные клетки
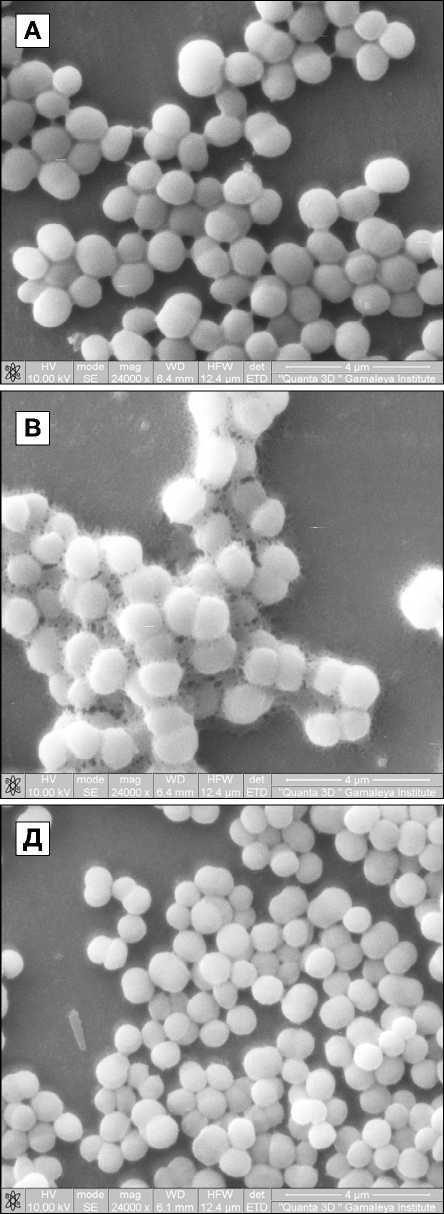

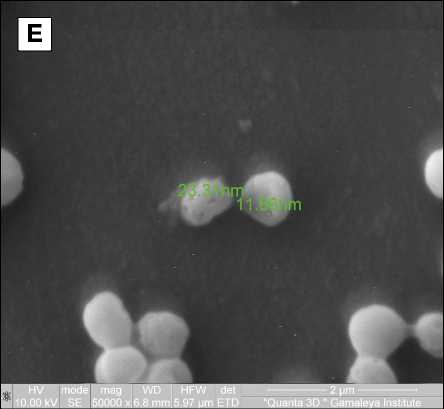
Примечание. Морфология клеток антибиотикочувствительного S. hominis без (А) и при воздействии антисептика 500 мкг/мл в течение 15 мин (Б); полирезистентных S. hominis (В, Г) и S. epidermidis (Д, Е) без (В, Д) или при воздействии антисептика 31,25 мкг/мл в течение 60 мин (Г, Е).
ОБСУЖДЕНИЕ
В результате проведенного анализа мы не обнаружили различий в бактериостатическом действии пиклоксидина на изоляты КНС с различной чувствительностью к антибиотикам: минимальная подавляющая концентрация для всех 39 исследованных изолятов КНС составляла 15,6 мкг/мл. Пиклоксидин также оказывал сходное по эффек-
<линическая’2п20 п эакти ка Том 11 № 1
тивности бактерицидное действие на 19 антибиотикочувствительных и 19 полирезистентных конъюнктивальных изолятов КНС: минимальная бактерицидная концентрация для этих 38 изоля-тов КНС равнялась минимальной подавляющей концентрации (15,6 мкг/мл). Нами был обнаружен только один изолят — S. epidermidis , устойчивый к клиндамицину, эритромицину и хлорамфениколу, для которого минимальная бактерицидная концентрация превышала минимальную подавляющую концентрацию в два раза и составляла 31,2 мкг/мл.
Препаратом сравнения для пиклоксидина может выступать другой антисептик из ряда бисби-гуанидов — наиболее широко изученный хлоргексидин. Полученные нами значения минимальной бактерицидной концентрации для пиклоксидина на КНС, включая 32 изолята S. epidermidis , хорошо соответствуют таковым для хлоргексидина на ряде штаммов S. epidermidis : наибольшее значение минимальной бактерицидной концентрации для хлоргексидина составляло 15 мкг/мл [16].
Результаты электронно-микроскопического исследования демонстрируют, что антисептик пи-клоксидин, как и хлоргексидин [17, 18], оказывает деструктивное действие на бактериальные клетки. Сходные морфологические изменения, в частности образование пор, количество которых нарастало с увеличением времени инкубации бактерий с антисептиком, наблюдали ранее при воздействии хлоргексидина на другой вид грамположительных бактерий — Bacillus subtilis [17]. В процессе инкубации с хлоргексидином происходила потеря белка клетками бактерий, что подтверждало зарегистрированное с помощью электронной микроскопии вытекание клеточного содержимого через поврежденные клеточные стенки. Разрывы клеточных стенок в результате инкубации с хлоргексидином показаны также у S. aureus [18].
Таким образом, пиклоксидин обладает сходными с хлоргексидином эффективностью и механизмом бактерицидного действия. Оба соединения относятся к катионным антисептикам из ряда бис-бигуанидов, но у пиклоксидина в центре молекулы находится пиперазиновое кольцо, а у хлоргексидина — линейный гексан. Молекулы обоих антисептиков несут положительные заряды, что, очевидно, способствует их электростатическому связыванию с отрицательно заряженными группами на клеточных стенках и последующему нарушению барьеров проницаемости бактериальных клеток.
ЗАКЛЮЧЕНИЕ
Как впервые показано в настоящем исследовании in vitro , резистентность КНС к антибиотикам не влияет на их чувствительность к пиклоксидину. Это создает перспективы использования данного антисептика, выпускаемого в форме глазных капель с 0,05% пиклоксидина дигидрохлорида, в качестве альтернативы антибиотикам местного действия в случае заражения конъюнктивы антибиотикорезистентными штаммами КНС, в том числе для профилактики инфекционных осложнений при ежемесячных повторных курсах интравитреальных инъекций, когда возрастает риск выработки анти-биотикорезистентности глазной микрофлоры.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-3490045.
Список литературы Чувствительность антибиотикорезистентных коагулазонегативных стафилококков к антисептику пиклоксидину
- Grice EA. The skin microbiome. Nat Rev Microbiol. 2011;9(4):244-253. DOI: 10.1038/nrmicro2537
- Prola K. Coagulase-negative staphylococci pathogenomics. Int J Mol Sci. 2019;20(5). pii: E1215. DOI: 10.3390/ijms20051215
- Dave SB, Toma HS, Kim SJ. Changes in ocular flora in eyes exposed to ophthalmic antibiotics. Ophthalmology. 2013;120(5):937-941. DOI: 10.1016/j.ophtha.2012.11.005
- Lina G, Boutite F, Tristan A, et al. Bacterial competition for human nasal cavity colonization: role of staphylococcal agr alleles. Appl Environ Microbiol. 2003;69(1):18-23. DOI: 10.1128/aem.69.1.18-23.2003
- Uckay I, Pittet D, Vaudaux P, et al. Foreign body infections due to Staphylococcus epidermidis. Ann Med. 2009;41(2):109-119. DOI: 10.1080/07853890802337045
- Rogers KL, Fey PD, Rupp ME. Coagulase-negative staphylococcal infections. Infect Dis Clin North Am. 2009;23(1):73-98.
- DOI: 10.1016/j.idc.2008.10.001
- Kim SJ, Toma HS, Midha NK, et al. Antibiotic resistance of conjunctiva and nasopharynx evaluation study: a prospective study of patients undergoing intravitreal injections. Ophthalmology. 2010;117(12):2372-2378.
- DOI: 10.1016/j.ophtha.2010.03.034
- Kim SJ, Toma HS. Ophthalmic antibiotics and antimicrobial resistance: a randomized, controlled, study of patients undergoing intravitreal injections. Ophthalmology. 2011;118(7):1358-1363.
- DOI: 10.1016/j.ophtha.2010.12.014
- Dave SB, Toma HS, Kim SJ. Ophthalmic antibiotic use and multidrug-resistant Staphylococcus epidermidis: a controlled, longitudinal study. Ophthalmology. 2011;118(10):2035-2040.
- DOI: 10.1016/j.ophtha.2011.03.017
- Воронин Г.В., Будзинская М.В., Страховская М.Г., Халатян А.С. Резистентность к антибиотикам у пациентов на фоне многократных интравитреальных инъекций // Вестник офтальмологии. - 2019. - Т.135. - №3. - С. 109-112.
- DOI: 10.17116/oftalma2019135031109
- Benoist d'Azy C, Pereira B, Naughton G, et al. Antibioprophylaxis in prevention of endophthalmitis in intravitreal injection: a systematic review and meta-analysis. PLoS One. 2016;11(6):e0156431.
- DOI: 10.1371/journal.pone.0156431
- Costa SF, Newbaer M, Santos CR, et al. Nosocomial pneumonia: importance of recognition of aetiological agents to define an appropriate initial empirical therapy. Int J Antimicrob Agents. 2001;17(2):147-150.
- DOI: 10.1016/s0924-8579(00)00316-2
- Hsu J, Gerstenblith AT, Garg SJ, Vander JF. Conjunctival flora antibiotic resistance patterns after serial intravitreal injections without postinjection topical antibiotics. Am J Ophthalmol. 2014;157(3):514-518.e1.
- DOI: 10.1016/j.ajo.2013.10.003
- Merani R, McPherson ZE, Luckie AP, et al. Aqueous chlorhexidine for intravitreal injection antispepsis: a case series and review of the literature. Ophthalmology. 2016;123(12):2588-2594.
- DOI: 10.1016/j.ophtha.2016.08.022
- Будзинская М.В., Страховская М.Г., Андреева И.В., Халатян А.С. Микрофлора конъюнктивы и ее чувствительность к антибиотикам у пациентов после многократных интравитреальных инъекций // Вестник офтальмологии. - 2019. - Т.135. - №5-2. - С. 135-140.
- DOI: 10.17116/oftalma2019135052135
- Skovgaard S, Larsen MH, Nielsen LN, et al. Recently introduced qacA/B genes in Staphylococcus epidermidis do not increase chlorhexidine MIC/MBC. J Antimicrob Chemother. 2013;68(10):2226-2233.
- DOI: 10.1093/jac/dkt182
- Cheung Y, Wong M, Cheung S, et al.. PLoS One. 2012;7(5):e36659.
- DOI: 10.1371/journal.pone.0036659
- Castillo JA, Clapés P, Infante MR, et al. Comparative study of the antimicrobial activity of bis(Nα-caproyl-l-arginine)-1,3-propanediamine dihydrochloride and chlorhexidine dihydrochloride against Staphylococcus aureus and Escherichia coli. J Antimicrob Chemother. 2006;57(4):691-698.
- DOI: 10.1093/jac/dkl012


