Чувствительность энтеробактерий, выделенных в кардиохирургическом стационаре, к антимикробным препаратам
Автор: Ильина Вера Николаевна, Субботовская Анна Игоревна, Козырева Виктория Сергеевна, Сергеевичев Давид Сергеевич, Шилова Анна Николаевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 3 т.17, 2013 года.
Бесплатный доступ
Приведены данные проспективного исследования чувствительности энтеробактерий, выделенных в кардиохирургическом стационаре за 2011–2012 гг. Изучено 124 штамма энтеробактерий, из них доля БЛРС-продуцентов СТХ-М-типа составила 62,1%. Отмечено, что от 76,6 до 100% штаммов энтеробактерий были нечувствительны к цефалоспоринам III–IV поколения, от 62,0 до 72,7% к ингибиторзащищенным β-лактамным препаратам и 70,1% к фторхинолонам, при этом сохранялась высокая чувствительность к карбапенемам (к эртапенему 90,9%, имипенему и меропенему 94,8%), умеренная к аминогликозидам (амикацину – 77,9%, нетилмицину – 72,7%). Снижение чувствительности к карбапенемам обусловлено появлением штаммов K. pneumoniae с МПК эртапенема от 2 до 16 мкг/мл, меропенема 4–8 мкг/мл и с МПК имипенема 4 мкг/мл.
Карбапенемы, энтеробактерии, β-лактамазы расширенного спектра, минимальная подавляющая концентрация, ctx-m-ферменты
Короткий адрес: https://sciup.org/142140554
IDR: 142140554 | УДК: 616.12-089.166-002
Текст научной статьи Чувствительность энтеробактерий, выделенных в кардиохирургическом стационаре, к антимикробным препаратам
Несмотря на возрастающую роль грампо-ложительных аэробных бактерий и грибов рода Candida в развитии тяжелых инфекций, одной из наиболее серьезных проблем в антимикробной химиотерапии остаются инфекции, вызванные энтеробактериями, продуцирующими β-лактамазы расширенного спектра (БЛРС) [1, 2]. С одной стороны, сложность терапии «БЛРС-инфекции» связана с тем, что инфекции, обусловленные продуцентами БЛРС, чаще развиваются у пациентов в критическом состоянии, длительно находящихся в отделении реанимации и интенсивной терапии и имеющих тяжелую сопутствующую патологию. С другой стороны, тем, что БЛРС-проду-центы гидролизуют все β-лактамные антибиотики, за исключением цефамицинов и карбапенемов [2, 3]. В настоящее время карбапенемы рассматриваются как наиболее эффективные антимикробные препараты для лечения тяжелых внебольничных инфекций с полимикробной этиологией и для лечения тяжелых нозокомиальных инфекций, включая «БЛРС-инфекции» [3, 4]. В последнее время приобретенная устойчивость к препаратам этой группы встречается все чаще, особенно среди возбудителей нозокомиальных инфекций, что существенно затрудняет антимикробную терапию.
Материал и методы
Исследование проводилось в 2011– 2012 гг. В анализ включены все последовательно выделенные в клинике штаммы Enterobacteriaceae . Всего было изучено 124 штамма, выделенных от 123 пациентов. Посев первичного материала проводили общепринятыми методами. Для скрининга БЛРС-продуцентов в традиционный набор питательных сред для посева первичного материала включали хромогенные питательные агары BBLTMCHROMagarTMESBL и BBLTMCHROMagarTMCTX (CHROMagar, Франция). Бактерии семейства Enterobacteriaceae с одинаковой резистентностью (чувствительностью), повторно выделенные у одного пациента, из анализа исключались. Идентификацию проводили на автоматическом анализаторе Phoenix (Becton Dickenson, США).
Чувствительность штаммов энтеробактерий исследовали с помощью дисков, пропитанных антибиотиками (БиоРад, США) на агаре Мюллер-Хинтон (БиоМерье, Франция) диско-диффузионным методом (ДДМ) в соответствии с Методическими указаниями по определению чувствительности микроорганизмов к антибактериальным препаратам (МУК 4.2 1890-04. 2004) [5]. На основании полученных значений зон подавления роста относили к категориям чувствительности – чувствительный (Ч), умереннорезистентный (УР), резистентный (Р), в соответствии с критериями CLSI М100-S22 (Clinical and Laboratory Standards Institute) [6].
Минимальную подавляющую концентрацию (МПК) эрта-пенема, меропенема и имипенема определяли с использованием M.I.C. EvaluatorTMstrip (Oxoid, Великобритания). Интерпретацию полученных значений МПК проводили в соответствии с критериями EUCAST v3.0 (European Committee Antimicrobial Susceptibility Testing) [7].
Для фенотипического выявления продукции БЛРС использовали два метода. Первый заключался в выявлении синергизма между дисками цефотаксимом (30 мкг), цефтазидимом (30 мкг) и диском, содержащим комбинацию амоксициллина с клавулановой кислотой (20/10 мкг). Второй метод – в увеличении зоны задержки роста вокруг дисков, пропитанных цефотаксимом + клавуланат (30/10 мкг) и цефтазидимом + клавуланат (30/10 мкг), в сравнении с цефотаксимом (30 мкг) и цефтазидимом (30 мкг) на ≥5 мм [6].
Для обнаружения карбапенемаз класса А (КРС) использовали Modified Hodge Test (MHT) [6], для выявления продукции карбапенемаз класса В (MBL) – метод «двойных дисков» с этилендиаминтетрауксусной кислотой (ЭДТА) [8].
Контроль определения чувствительности проводили в соответствии с рекомендациями CLSI М100-S22 с использованием референтных штаммов Американской коллекции типовых культур E. coli ATCC 25922 и K. pneumoniae АТСС 700603 и АТСС 35218.
У всех штаммов энтеробактерий методом ПЦР проводили определение гена CTX-M, выделение ДНК из первичного клинического материала проводили согласно инструкции производителя к набору реагентов «ДНК-Сорб-АМ» (ИнтерЛабСервис, Россия). Реакционная смесь для амплификации включала в себя смесь специфичных праймеров и набор реагентов «SsoFastEvaGreen» (Bio-Rad, США). Амплификацию проводили с использованием термоциклера CFX96 (Bio-Rad, США) по следующему протоколу: 1 цикл – 95,0 °С 3 мин; 40 циклов – 95,0 °С по 15 с, 58,0 °С по 20 с, 72,0 °С по 15 с; кривая плавления от 77,0 до 96,0 °С с инкрементом 0,5 °С. По образованию продукта амплификации делали заключение о наличии или отсутствии гена CTX-M. После этого проводили анализ кривых плавления положительных образцов. Заключение о типе гена CTX-M делали по температуре плавления продуктов амплификации: Тпл= 83,0 °С – CTX-M-1, Тпл= 84,5 °С – CTX-M-2, Тпл= 89,0 °С – CTX-M-8, Тпл= 90,5 °С – CTX-M-9.
Результаты
За период 2011–2012 гг. изучено 124 штамма энтеробактерий, из них 72 (58,1%) выделены из мочевыводящих путей, 45 (36,3%) – из респираторного тракта и 7 (5,6%) – из отделяемого в области операционной раны.
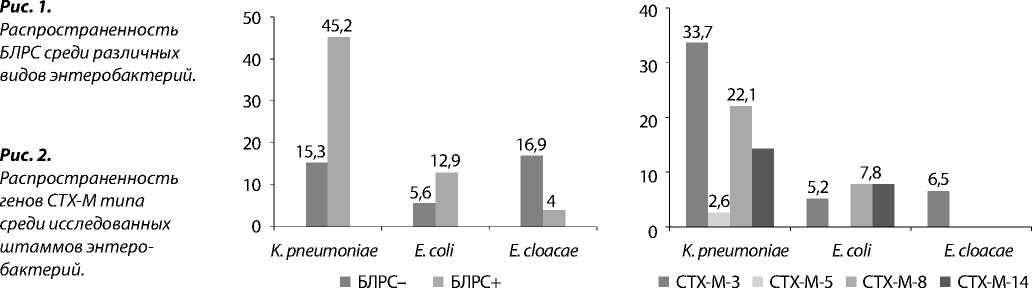
У 77 (62,1%) штаммов выявлена продукция БЛРС. Энтеробактерии, продуцирующие БЛРС, были представлены тремя видами: K. pneumoniae , E. coli и E. cloacae . Наибольшая доля продуцентов БЛРС зарегистрирована среди K. pneumoniae и составила 56 (45,2%), реже среди E. coli – 16 (12,9%) и 5 (4,0%) – среди E. cloacae (рис. 1).
Энтеробактерии, продуцирующие БЛРС, были изолированы в 6 отделениях клиники. Возраст пациентов, инфицированных БЛРС-штаммами, в пределах от 1 недели до 78 лет, средний – 52 года.
БЛРС-продуценты чаще были выделены из респираторного тракта – 37 (29,8%) штаммов, из мочевыводящих путей (МВП) – 35 (28,2%) штаммов и редко из отделяемого в области операционной раны – 5 (4,0%). Преобладающим возбудителем была K. Pneumoniae , доля которой при инфекции МВП составила 20,9% (26), при инфекции нижних дыхательных путей – 20,2% (25). Доля E. coli – 5,6% (7) среди изолятов из МВП и 7,2% (9) среди изолятов из респираторного тракта. E. cloacae – 1,6% (2) и 2,4% (3). При инфекции мягких тканей были выделены только K. pneumoniae , среди которых продуценты БЛРС составили 4,0% (5) (табл. 1).
У всех штаммов энтеробактерий, продуцирующих БЛРС, были выделены гены CTX-M-родственных ферментов. Идентифицированные CTX-M β-лактамазы относились к четырем генетически родственным группам: СТХ-М-1(СТХ-М-3), СТХ-М-2(СТХ-М-5), СТХ-М-8 (СТХ-М-8), СТХ-М-9 (СТХ-М-14) (рис. 2).
Наиболее часто были выделены гены СТХ-М-1(СТХ-М-3)-родственных ферментов, их доля составила 45,4% (35). БЛРС СТХ-М типа, относящиеся ко всем идентифицированным генетическим группам, изолированы в 72,7% (56 штаммов) у K. pneumoniae .
Результаты чувствительности энтеробактерий к антимикробным препаратам (АМП), полученные диско-диффузионным методом, показали широкое распространение нечувствительных штаммов к цефалоспоринам III–IV поколения (от 59 до 77 штаммов). Так, к цефотаксиму чувствительных энтеробактерий выявлено не было, только 3 (3,8%) изолята были умеренно резистентны и 74 (96,2%) резистентны. К цефтазидиму чувствительность сохраняли 14 (18,2%) штаммов, цефепиму – 18 (23,4%) (табл. 2).
Данные, представленные в табл. 2, также свидетельствуют о широком распространении нечувствительных штаммов к β-лактамным ингибиторзащищенным препаратам. Так, к амоксициллину/клавуланату были чувствительны только 23 (29,9%) штамма, 21 (27,3%) – к цефоперазону/сульбак-таму и 30 (38,9%) – к пиперациллину/тазобактаму. К аминогликозидам чувствительность энтеробактерий была выше в сравнении с β-лактамными препаратами. К амикацину были чувствительны 60 (77,9%) штаммов энтеробактерий, к нетилмицину – 56 (72,7%). Из группы фторхино-лонов нами тестировался ципрофлоксацин. К нему были чувствительны 23 (29,9%) изолята. К имипенему и меропе-
Инфекции
Таблица 1
Распределение энтеробактерий с БЛРС и без БЛРС в зависимости от локализации инфекций
|
Бактерии |
мочевыводящих путей |
респираторного тракта |
области операционной раны |
|||
|
БЛРС – |
БЛРС + |
БЛРС – |
БЛРС + |
БЛРС – |
БЛРС + |
|
|
K. pneumoniae |
10 (8,1%) |
26 (20,9%) |
7 (5,6%) |
25 (20,2%) |
2 (1,6%) |
5 (4,0%) |
|
E. coli |
7 (5,6%) |
7 (5,6%) |
– |
9 (7,2%) |
– |
– |
|
E. cloacae |
20 (16,1) |
2 (1,6%) |
1 (0,8%) |
3 (2,4%) |
– |
|
|
Итого |
37 (29,8%) |
35 (28,2%) |
8 (6,4%) |
37 (29,8%) |
2 (1,6%) |
5 (4,0%) |
Таблица 2
Чувствительность энтеробактерий, продуцирующих БЛРС, к антимикробным препаратам, n = 77
Результаты исследования МПК энтеробактерий к карба-пенемам выявили, что диапазон МПК эртапенема находился в пределах от 0,03 до 16,0 мкг/мл, меропенема – 0,12–8,0 мкг/мл и имипенема – 0,12–4,0 мкг/мл. МПК имипенема и меропенема для 50 и 90% штаммов была одинаковой и составила 0,25 и 1,0 мкг/мл, что соответствует категории «чувствительный». МПК эртапенема для 50% штаммов составила 0,12 мкг/мл (категория «чувствительный»), для 90% – 2 мкг/мл («устойчивый») (табл. 3). Диапазон МПК эртапенема, имипенема и меропенема у K. pneumoniae находился в пределах от 0,03 до 16,0, от 0,12
до 4,0 и от 0,12 до 8,0 мкг/мл, у E. coli – 0,06–0,5, 0,12–1,0 и 0,12–1,0 мкг/мл (табл. 4). МПК эртапенема у нечувствительных K. pneumoniae находилась в пределах от 2 до 16,0 мкг/ мл, меропенема – 4–8 мкг/мл и имипенема – 4 мкг/мл.
Из представленных в табл. 4 данных видно, что у 2 штаммов K. pneumoniae МПК имипенема и у 4 штаммов МПК меропенема была выше категории «чувствительный» (имипенема 4 мкг/мл и меропенема 4 и 8 мкг/мл). При этом МПК меропенема у одного штамма соответствовала пограничному значению (8 мкг/мл). К эртапенему у 7 K. pneumoniae МПК соответствовала категории «устойчивый». У всех штаммов K. pneumoniae, не чувствительных к имипенему и меропенему, и у 6, устойчивых к эрта-
Таблица 3
Результаты изучения у энтеробактерий МПК карбапенемов
|
Антибиотик |
Диапазон МПК (мин.–макс.), мкг/мл |
МПК50, мкг/мл |
МПК90, мкг/мл |
|
K. pneumoniae (n = 56) |
|||
|
Эртапенем |
0,03–16,0 |
0,12 |
2,0 |
|
Имипенем |
0,12–4,0 |
0,25 |
1,0 |
|
Меропенем |
0,12–8,0 |
0,25 |
1,0 |
|
E. coli (n = 16) |
|||
|
Эртапенем |
0,06–0,5 |
0,12 |
0,5 |
|
Имипенем |
0,12–1,0 |
0,25 |
1,0 |
|
Меропенем |
0,12–1,0 |
0,25 |
1,0 |
|
Все энтеробактерии (n = 77) |
|||
|
Эртапенем |
0,03–16,0 |
0,12 |
2,0 |
|
Имипенем |
0,12–4,0 |
0,25 |
1,0 |
|
Меропенем |
0,12–8,0 |
0,25 |
1,0 |
Критерий
EUCAST Кол-во энтеробактерий, абс. (%) с различными значениями МПК карбапенемов, мкг/мл Антибиотик v3.0, мкг/мл
Ч ≤ Р > 0,03 0,06 0,12 0,25 0,5 1 2 4 8 16
K. pneumoniae (n = 56)
|
Эртапенем |
0,5 |
1 5 (9,0) |
7 (12,5) |
17 (30,2) |
14 (24,9) |
5 (9,0) – |
3 (5,4) |
1 (1,8) |
2 (3,6) |
2 (3,6) |
|
|
Имипенем |
2 |
8– |
– |
18 (32,1) |
20 (35,7) |
11 (19,6) |
3 (5,3) |
2 (3,6) |
2 (3,6) |
||
|
Меропенем |
2 |
8– |
– |
23 (41,1) |
18 (32,1) |
9 (16,1) |
2 (3,6) |
– |
3 (5,3) |
1 (1,8) |
|
|
E. coli (n = 16) |
|||||||||||
|
Эртапенем |
0,5 |
1 |
5 (31,3) |
6 (37,5) |
4 (25,0) |
1 (6,2) |
|||||
|
Имипенем |
2 |
8– |
– |
4 (25,0) |
7 (43,7) |
2 (12,5) |
3 (18,8) |
– |
– |
– |
|
|
Меропенем |
2 |
8– |
– |
7 (43,7) |
5 (31,2) |
2 (12,5) |
2 (12,5) |
– |
– |
– |
– |
|
Все энтеробактерии (n |
= 77) |
||||||||||
|
Эртапенем |
0,5 |
1 5 (6,5) |
11 (14,3) |
27 (35,1) |
19 (24,7) |
7 (9,1) |
3 (3,9) |
– |
1 (1,2) |
2 (2,6) |
2 (2,6) |
|
Имипенем |
2 |
8– |
– |
25 (32,4) |
29 (37,9) |
13 (16,8) |
6 (7,8) |
2 (2,6) |
2 (2,6) |
||
|
Меропенем |
2 |
8– |
– |
33 (48,8) |
24 (31,1) |
12 (15,6) |
4 (5,2) |
3 (3,9) |
– |
1 (1,3) |
|
Таблица 4
Частотная характеристика МПК карбапенемов у энтеробактерий
пенему, выделены гены СТХ-М-1(СТХ-М-3)-родственные ферменты и только у одного – устойчивого к эртапе-нему – идентифицирован ген СТХ-М-9 (СТХ-М-14) типа.
Обсуждение
Во всем мире основные проблемы терапии энтеробактерий связаны с продукцией БЛРС, при этом в России энтеробактерии, продуцирующие данные ферменты, имеют наиболее широкое распространение (средний показатель 81,4%) [1, 2]. В проведенных нами исследованиях (2008 г. и настоящее исследование) частота штаммов, продуцирующих БЛРС, не превышает 60% [9]. Большинство БЛРС, описанных до конца 1990-х годов, относилось к группам SHV и ТЕМ ферментам. В последние годы во многих странах мира и России отмечается стремительное распространение БЛРС СТХ-М-типа. Особенностью БЛРС CTX-M типа является более высокая способность гидролизовать цефе-пим (в сравнении с генами SHV и TEM) и in vitro сохранять чувствительность к цефтазидиму. Однако in vitro чувствительность к цефтазидиму у БЛРС-продуцентов не имеет клинического значения [1, 3, 10]. В настоящее время выявлены мутации у β-лактамаз CTX-M типа, в результате которых данные ферменты могут гидролизовать цефтазидим [10]. Данные нашего исследования также выявили широкое распространение нечувствительных штаммов к цефалоспоринам III–IV поколения (от 59 до 77 штаммов).
В исследованиях, проведенных в Испании, Израиле, Австрии, Канаде, Италии, Венгрии и России, было обнаружено, что продуценты CTX-M β-лактамаз часто бывают нечувствительны к не-β-лактамным препаратам [2, 8, 12]. По данным нашего исследования, только 23 (29,9%) штамма энтеробактерий сохраняли чувствительность к ципрофлоксацину. К аминогликозидам: амикацину и нетилми-цину – чувствительность была выше и соответствовала 77,9 и 72,7%. Наилучший клинический эффект при лечении инфекций, вызванных продуцентами БЛРС, достигается карбапенемными антибиотиками (прежде всего ими-пенемом и меропенемом) [3, 4]. Нами получены данные, свидетельствующие о сохранении чувствительности к препаратам этой группы большинства штаммов, выде- ленных в кардиохирургическом стационаре (к эртапе-нему – 70, к имипенему и меропенему – 75 и 73 штаммов). В рамках многоцентрового исследования, проведенного в России, получены данные, свидетельствующие о высокой активности цефоперазона/сульбактама в отношении энтеробактерий с БЛРС. По мнению авторов, цефопе-разон/сульбактам может быть использован для терапии инфекций, вызванных продуцентами БЛРС [1, 7]. В нашем исследовании чувствительность сохранял только 21 (27,3%) штамм, что позволяет использовать его для терапии «БЛРС-инфекции» лишь при подтвержденной чувствительности in vitro. Снижение активности цефоперазона/ сульбактама, вероятнее всего, обусловлено широким распространением энтеробактерий с БЛРС СТХ-М-типа [2].
В настоящее время у энтеробактерий выделены гены, ответственные за резистентность к карбапенемам, относящиеся к различным генетическим группам (KPC, NDM, IPM, VIM и OXA) [11, 12]. Нами фенотипически карбапенемазы выявлены не были. Все штаммы продуцировали БЛРС CTX-M типа. Различными авторами было установлено, что резистентность K. pneumoniae к карбапенемам может быть обусловлена и гиперпродукцией БЛРС в комбинации со сниженной проницаемостью наружной клеточной мембраны. Рядом исследователей получены данные об устойчивости K. pneumoniae к карбапенемам, продуцирующих БЛРС CTX-M-типа в сочетании с изменением проницаемости клеточной стенки из-за возникновения дефектов пориновых каналов или активным выведением антибиотика из микробной клетки (эффлюксом) [5, 11–14]. Вероятнее всего, штаммы K. pneumoniae , выделенные нами в кардиохирургическом стационаре обладают одним из указанных механизмов. Более высокая частота устойчивости энтеробактерий к эртапенему показана рядом авторов; эртапенем также может служить скринингом для изучения устойчивости к имипенему и меропенему [14].
Выводы
Проведенное исследование по изучению чувствительности энтеробактерий в кардиохирургическом стационаре выявило:
-
1. Широкое распространение штаммов энтеробактерий, нечувствительных к цефалоспоринам III–IV поколения (от 76,6 до 100%), ингибиторзащищенным β-лактамным препаратам (от 62,0 до 72,7%) и фторхинолонам (70,1%).
-
2. Высокую чувствительность энтеробактерий к карба-пенемам (к эртапенему 90,9%, имипенему и меропенему 94,8%), умеренную к аминогликозидам (амикацину – 77,9%, нетилмицину – 72,7%).
-
3. Снижение чувствительности к карбапенемам обусловлено появлением штаммов K. pneumoniae с МПК эртапе-нема от 2 до 16 мкг/мл, меропенема 4–8 мкг/мл и с МПК имипенема 4 мкг/мл.
-
4. Основным механизмом множественной устойчивости энтеробактерий к АМП является продукция БЛРС CTX-M типа.
Список литературы Чувствительность энтеробактерий, выделенных в кардиохирургическом стационаре, к антимикробным препаратам
- Решедько Г.К., Рябкова Е.Л., Кречекова О.И., и др.//Клин. микробиол. антимикроб. химиотер. 2008. Т. 10. № 2. С. 96-117.
- Эйдельштейн М.В., Страчунский Л.С., исследовательская группа РОСНЕТ//Клин. микробиол. антимикроб. химиотер. 2005. T. 7. № 4. C. 323-336.
- Страчунский Л.С.//Клин. микробиол. антимикроб. химиотер. 2005. Т. 7. № 1. С. 92-96.
- Галкин Д.В.//Клин. микробиол. антимикроб. химиотер. 2007. T. 9. № 2. C. 133-152.
- Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890_04)//Клин. микробиол. антимикроб. химиотер. 2004. T. 6. № 4. P. 307-359.
- CLSI Performance standards for antimicrobial susceptibility testing; Twenty-Second Informational Supplement. 2012. V. 32. № 3.
- EUCAST Breakpoint tables for interpretation of MICs and zone diameters. Breakpoint tables for interpretation of MICs and zone diameters. Version 3.0, 2013 http://www.eucast.org
- Ejikeugwu P.C., Ugwu C.M., Araka C.O. et al.//International Research Journal Microbiology. 2012. V. 3. № 10. P. 339-344.
- Ильина В.Н., Струнин О.В., Соловьев О.Н. и др.//Патология кровообращения и кардиохирургия 2012. № 1. С. 57-60.
- Степанова М.Н.//автореферат на соискание ученой степени кандидата биологических наук 2011 г. С. 23.
- Girlich D, Laurent L., Nordmann P. et al.//Antimicrob. Agents Chemother. 2009. V. 53. № 2. P. 832-834.
- Gupta N., Limbago B.M., Patel J.B., Kallen A.J.//Clinical Infectious Diseases. 2011. V. 53. № 1. P. 60-67.
- Ward M.E., Woodford N., Warner M. et al.//Proceedings 15th Eur. Congress Clinical Microbiology infectious Diseases. Copenhagen. 2005. P. 1266.
- Woodford N., Dallow J.W.T., Hill R.L.R.//International J. Antimicrobial Agents. 2007. V. 29. P. 456-459.


