Циркулирующие в крови стволовые клетки: динамика и значение при остром инфаркте миокарда
Автор: Штатолкина М.А., Рябов В.В., Суслова Т.Е., Марков В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.25, 2010 года.
Бесплатный доступ
В работе изучено значение стволовых клеток, циркулирующих в крови, при развитии острого первичного крупноочагового инфаркта миокарда. Показано, что уже в первые часы острого инфаркта миокарда количество циркулирующих в крови СD34+38-, CD133+, CD117+, CD90+34- клеток значительно увеличивается в сравнении со здоровыми лицами. Приведены данные, демонстрирующие участие исследуемых стволовых клеток в компенсаторно-приспособительных реакциях у больных острым инфарктом миокарда.
Стволовые клетки, циркулирующие в крови, инфаркт миокарда, глобальная функция сердца
Короткий адрес: https://sciup.org/14919288
IDR: 14919288 | УДК: 616.127-005.8
Текст научной статьи Циркулирующие в крови стволовые клетки: динамика и значение при остром инфаркте миокарда
Острый инфаркт миокарда (ИМ) остается основной причиной развития хронической сердечной недостаточности (ХСН), которая приводит к инвалидизации и смертности больных во всем мире. Несмотря на успехи современных консервативных и оперативных методов лечения, проблема прогрессирования данных патологий со- храняется. Относительно новым направлением в лечении ишемической болезни сердца являются клеточные технологии. Несколько лет назад в кардиологической практике начался бум по изучению и применению стволовых клеток (СК). При этом в экспериментальных [1, 2, 11, 14] и клинических [5, 6, 8–10, 16] работах изучались различные типы СК: эмбриональные, фетальные и СК взросло- го организма. Основным или наиболее изученным источником СК является костный мозг (КМ). Фетальный и взрослый КМ содержит три особенно многочисленные популяции СК – гематопоэтические СК (ГСК), мезенхимальные СК (МСК) и предшественники эндотелиоцитов (ПЭ), различающихся по фенотипу [4]. Каково же участие КМ при развитии ишемии органа?
Ишемическое повреждение приводит к выбросу из очага повреждения таких цитокинов, как сосудистый эндотелиальный фактор роста-2 (VEGF-2), фактор стромальных клеток-1 (SDF-1), инсулиноподобный фактор роста-1 (IGF-1), фактор стволовых клеток (SCF) и другие. Эти цитокины, воздействуя на свои рецепторы, обеспечивают выброс СК из КМ и их привлечение в очаг повреждения [3].
Количество СК в крови при остром ИМ возрастает в течение 12 часов после возникновения симптомов и остается значительно более высоким по сравнению с пациентами со стабильной стенокардией и здоровыми лицами [15]. Сходная картина описана и Shintani [12]. Кроме того, в условиях эксперимента показано, что циркулирующие СК КМ принимают участие в процессах восстановительной регенерации миокарда. Это происходит за счет паракринных эффектов данных СК, стимуляции неоангиогенеза, что в конечном итоге приводит к предупреждению дезадаптивного постинфарктного ремоделирования сердца [3]. Имеющаяся небольшая информация по циркулирующим СК при остром ИМ обусловила выбранное нами направление поиска. Цель исследования: определить динамику и значение циркулирующих в крови CD34+38-, CD133+, СD117+, CD90+34- клеток у больных острым первичным крупноочаговым ИМ. CD34+38-клет-ки являются фенотипически чистой популяцией ГСК. По характеристикам светорассеяния данный фенотип СК соответствует малому, среднему или крупному лимфоциту. Данная популяция клеток обладает способностью дифференцироваться в различные типы клеток (клеток крови, кардиомиоциты, гепатоциты) в зависимости от микроокружения [13]. CD133+, СD117+ клетки относятся к незрелым ГСК и являются эндотелиальными клетками-предшественниками костномозгового происхождения. Таким образом, они могут улучшать сердечную функцию после ИМ путем неоваскуляризации. CD90+34-клетки относятся к МСК и клеткам – предшественникам лимфоцитов.
Материал и методы
В исследование включены 19 пациентов, из которых 14 (74%) мужчин и 5 (26%) женщин в возрасте 58±20 лет. У всех пациентов (100%) диагностирован острый первичный передний крупноочаговый ИМ. При поступлении в стационар 4 (47%) больным выполнена первичная ангиопластика. У 2 (11%) больных наступила спонтанная реперфузия инфарктсвязанной коронарной артерии (ИСКА). Остальным 13 (68%) больным проводилась ТЛТ стрептокиназой 1,5 млн ЕД, из которых 2 (15%) больным в последующем выполнена спасительная ангиопластика, а 11 (85%) – отсроченная ангиопластика. Среднее время реканализации ИСКА от начала ИМ составило 5,0 (4,4; 6,0) часов. Клиническое течение ИМ оценивали по данным общепринятых физикального, рентгенологического, электро-, эхокардиографического и лабораторных методов исследования. Все пациенты подписали информированное согласие на проведение клинического исследования.
Всем больным проведен забор цельной крови в количестве 2 мл, взятой с ЭДТА из локтевой вены на 1-е, 3-и, 7-е и 21-е сутки ИМ с целью определения CD34+38-, CD133+, CD117+, CD90+34-клеток методом проточной ци-тофлуориметрии на приборе FACSCalibur (Becton Dickinson, USA). Подсчитывали абсолютное и относительное содержание клеток. Для сравнения проводился однократный забор крови у группы здоровых добровольцев в количестве 6 мужчин, средний возраст – 41±9 лет. На момент включения и обследования добровольцы были абсолютно здоровы. Острых воспалительных заболеваний либо обострений хронических заболеваний не отмечено. Кроме того, обязательным условием включения было отсутствие анамнеза сердечно-сосудистых заболеваний.
Выполняли эхокардиографическое исследование (ультразвуковая система VIVID 7, GE Vingmed Ultrasound, Norway) в день поступления, на 3-и, 7-е и 21-е сутки ИМ. Оценивали показатели глобальной систолической функции левого желудочка (ЛЖ): конечный диастолический объем (КДО), конечный систолический объем (КСО) и фракцию выброса (ФВ) ЛЖ.
Статистический анализ данных выполнен с использованием программы Statistica v6.0. Проверка нормальности распределения производилась методом Колмогорова–Смирнова с поправкой Лиллиефорса. В связи с ненормальным распределением при анализе количественных и качественных признаков применялись непараметрические методы – тест Манна–Уитни и корреляционный анализ с помощью коэффициента Спирмена (R). Средние выборочные значения количественных признаков приведены в тексте в виде Ме (25;75), где Ме – медиана, 25 – нижний квартиль, 75 – верхний квартиль. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05. В случае р более 0,05, но менее 0,1 говорили о тенденции к достоверности различий.
Результаты и обсуждение
Нами впервые продемонстрирована динамика содержания циркулирующих в крови CD34+38-, CD133+, CD117+, CD90+34- клеток у больных острым первичным крупноочаговым ИМ (рис. 1–4). Абсолютное и относительное количество исследованных СК было значительно выше у пациентов с острым ИМ на протяжении всего периода наблюдения в сравнении со здоровыми добровольцами. В большинстве случаев максимальный выброс СК в кровь наблюдается в ранние сроки острой миокардиальной ишемии.
Изучение взаимосвязей между содержанием исследованных СК, циркулирующих в периферическом русле, в 1-е сутки ОИМ и основными клинико-анамнестическими параметрами показало, что такой фактор риска ИБС, как курение влияет на содержание абсолютного и относительного количества CD90+34-клеток; что половой при- знак и наличие отягощенной наследственности в анамнезе взаимосвязаны с исходным уровнем относительного количества CD133+ клеток. А именно: у курильщиков исходный уровень CD90+34-клеток в крови был ниже, чем у больных без данной вредной привычки. У пациентов женского пола и пациентов с отягощенной наследственностью по ССЗ в анамнезе относительное количество CD133+ клеток в крови в 1-е сутки острого ИМ было высоким в отличие от пациентов, не имеющих в анамнезе сердечно-сосудистой патологии.
Проводя индивидуальный анализ изменения количества CD34+38-, CD133+, CD117+, CD90+34- клеток у больных острым ИМ, мы обнаружили нелинейную, разнонаправленную динамику их содержания к 3-м суткам заболевания. В зависимости от этой динамики всех больных разделили на 2 подгруппы: 1-ю подгруппу составили пациенты с исходно низким
CD 117+ клетки, абсолютное кол-во CD 117+ клетки, относительное кол-во

Рис. 1. Динамика абсолютного и относительного количества CD117+ клеток в крови в 1-е, 3-и, 7-е и 21-е сутки острого инфаркта миокарда: * – различия между больными и добровольцами, p<0,05; ** – различия относительно исходных значений внутри группы, p<0,05
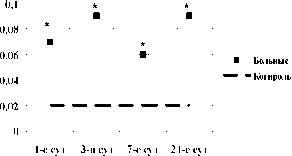
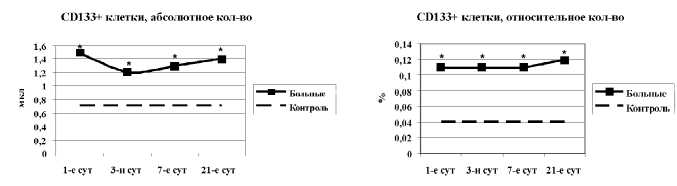
Рис. 2. Динамика абсолютного и относительного количества CD133+ клеток в крови в 1-е, 3-и, 7-е и 21-е сутки острого инфаркта миокарда: * – достоверность различий показателя между больными и добровольцами, p<0,05
содержанием клеток и их повышением на 3-и сутки заболевания, 2-ю подгруппы – пациенты с высоким содержанием клеток в начале ИМ и динамикой их уменьшения на 3-и сутки. Исследуемые подгруппы по основным клинико-анамнестическим, эхокардиографическим показателям были сопоставимы.
Изучались взаимосвязи между содержанием количества CD34+38-, CD133+, CD117+, CD90+34- клеток и основными функциональными параметрами сердца, такими, как КДО, КСО и ФВ ЛЖ. Выявлено, что максимальный выброс CD117+кле-ток в кровь в 1-е сутки ИМ отрицательно коррелирует с КДО на 7-е сутки (R=–0,8; р=0,01) и КДО и КСО ЛЖ на 21-е сутки ИМ (R=–0,8; р=0,004). Мобилизация относительного количества CD133+ клеток в кровь в ранние сроки ИМ положительно коррелирует с уровнем ФВ ЛЖ на 21-е сутки заболевания (R=0,7; р=0,02). Таким образом, данная мобилизация CD117+ и CD133+ клеток ассоциирована с благоприятным течением и прогнозом заболевания. Установлены множественные положительные корреляционные связи между как абсолютным, так и относительным количеством CD34+38-, CD90+34- клеток и КДО, КСО ЛЖ во все сутки ИМ, отрицательные корреляции с ФВ в разные дни заболевания (табл. 1, 2). То есть, высокий выброс CD34+38-, CD90+34- клеток в кровь тесно сопряжен с ремоделированием ЛЖ в виде увеличения объемов и снижения ФВ ЛЖ.
Полученные результаты демонстрируют участие СК в развитии острого первичного крупноочагового ИМ. По-
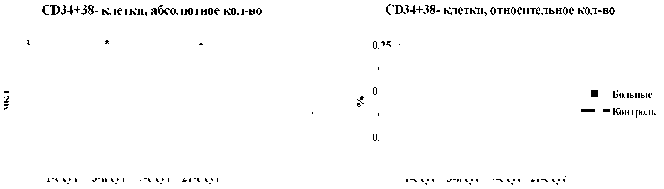
Рис. 3. Динамика абсолютного и относительного количества CD34+38- клеток в крови в 1-е, 3-и, 7-е и 21-е сутки острого инфаркта миокарда: * – достоверность различий изменения показателей между больными и добровольцами, p<0,05
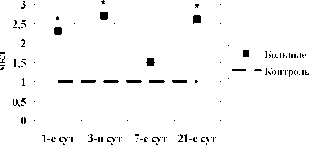
CD90+34- клетки, абсолютное кол-во
s
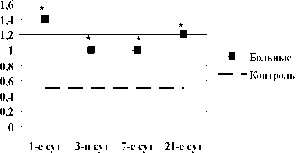
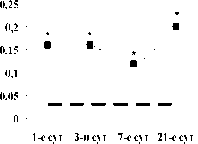
CD90+34- клетки, относительное кол-во

Рис. 4. Динамика абсолютного и относительного количества CD90+34- клеток в крови в 1-е, 3-и, 7-е и 21-е сутки острого инфаркта миокарда: * – достоверность различий изменения показателей между больными и добровольцами, p<0,05
добно нашим данным, S. Shintani и W. Wojakowski описывают возрастание количества СК в крови при остром ИМ в течение 12 ч после возникновения симптомов в срав-
Таблица 1
Коэффициенты корреляции между абсолютным, относительным содержанием CD34+38- клеток в крови и основными эхокардиографическими параметрами у больных острым инфарктом миокарда
|
Показатели |
Абсолютное количество |
Относительное количество |
||||||||||
|
1-е сутки |
3-и сутки |
7-е сутки |
1-е сутки |
3-и сутки |
7-е сутки |
|||||||
|
R |
р |
R |
p |
R |
p |
R |
p |
R |
p |
R |
p |
|
|
КДО 1-е сут |
0,8 |
0,01 |
0,5 |
0,2 |
0,8 |
0,02 |
0,6 |
0,1 |
0,5 |
0,1 |
0,3 |
0,4 |
|
КСО 1-е сут |
0,7 |
0,02 |
0,5 |
0,2 |
0,5 |
0,2 |
0,1 |
0,8 |
0,1 |
0,9 |
–0,2 |
0,5 |
|
ФВ 1-е сут |
–0,1 |
0,9 |
0,1 |
0,8 |
0,4 |
0,2 |
0,5 |
0,2 |
0,4 |
0,3 |
0,6 |
0,07 |
|
КДО 3-и сут |
0,5 |
0,08 |
–0,04 |
0,9 |
0,6 |
0,05 |
0,6 |
0,05 |
0,3 |
0,3 |
0,1 |
0,7 |
|
КСО 3-и сут |
0,4 |
0,2 |
–0,1 |
0,7 |
0,4 |
0,2 |
0,6 |
0,05 |
0,3 |
0,4 |
0,2 |
0,6 |
|
ФВ 3-и сут |
0,4 |
0,2 |
0,4 |
0,2 |
0,4 |
0,2 |
–0,4 |
0,2 |
–0,1 |
0,6 |
–0,6 |
0,04 |
|
КДО 7-е сут |
0,3 |
0,3 |
–0,2 |
0,6 |
0,1 |
0,7 |
0,4 |
0,1 |
0,2 |
0,5 |
0,1 |
0,8 |
|
КСО 7-е сут |
0,2 |
0,5 |
–0,3 |
0,3 |
0,2 |
0,6 |
0,3 |
0,2 |
0,1 |
0,6 |
0,1 |
0,7 |
|
ФВ 7-е сут |
0,03 |
0,9 |
0,4 |
0,2 |
0,04 |
0,9 |
–0,2 |
0,5 |
–0,1 |
0,8 |
–0,1 |
0,8 |
|
КДО 21-е сут |
0,6 |
0,02 |
0,2 |
0,6 |
0,4 |
0,2 |
0,3 |
0,3 |
–0,02 |
0,9 |
–0,1 |
0,6 |
|
КСО 21-е сут |
0,4 |
0,1 |
0,07 |
0,8 |
0,3 |
0,3 |
0,2 |
0,4 |
0,2 |
0,5 |
–0,1 |
0,7 |
|
ФВ 21-е сут |
–0,1 |
0,7 |
0,03 |
0,9 |
–0,1 |
0,7 |
–0,1 |
0,6 |
–0,4 |
0,1 |
0,004 |
1,0 |
|
КДО 6 мес. |
0,2 |
0,5 |
0,1 |
0,8 |
0,2 |
0,6 |
0,5 |
0,07 |
–0,02 |
0,9 |
–0,2 |
0,6 |
|
КСО 6 мес. |
0,1 |
0,7 |
0,1 |
0,8 |
–0,2 |
0,6 |
0,5 |
0,06 |
0,3 |
0,2 |
–0,2 |
0,5 |
|
ФВ 6 мес. |
0,03 |
0,9 |
–0,1 |
0,8 |
0,3 |
0,4 |
–0,4 |
0,1 |
–0,5 |
0,06 |
0,1 |
0,6 |
Таблица 2
Коэффициенты корреляции между абсолютным, относительным содержанием CD90+34- клеток в крови и основными эхокардиографическими параметрами у больных острым инфарктом миокарда
Установлена нелинейная динамика содержания циркулирующих в крови CD34+38-, CD133+, CD117+, CD90+34-клеток на 3-и сутки ИМ в зависимости от их исходного значения. Почему же у одних больных организм моментально реагирует на стрессовую реакцию (острый ИМ) путем выброса СК в кровь, а у других только спустя время? Вероятнее всего, причиной является состояние гемопоэтической и иммунной систем человека в момент “стресса”. Одним из важных компонентов иммунной системы являются цитокины. Количество продуцируемых цитокинов связано с размером очага повреждения, то есть большая зона инфаркта может быть более сильным стимулом для высвобождения цитокинов и, соответственно, клеточной мобилизации в кровь, и наоборот, что подтверждается результатами исследования A.M. Leone [7]. Исходно низкое содержание СК в периферическом русле, возможно, связано с тем, что в зоне большого ИМ синтез, например, SDF-1 или SCF в периинфарктных КМЦ может быть значительно выше и может индуцировать более эффективное привлечение клеток, что ведет к снижению числа клеток в периферической крови по сравнению с менее распространенным ИМ [15].
Заключение
Таким образом, по результатам нашего исследования с учетом выявленных корреляционных взаимосвязей установлено, что у больных острым первичным крупноочаговым ИМ высокий уровень циркулирующих в крови СD117+, CD133+ клеток ассоциирован с благоприятным течением и прогнозом заболевания в виде улучшения сократительной функции сердца. А высокий выброс CD34+38-, CD90+34- клеток тесно сопряжен с процессами ремоделирования ЛЖ в виде увеличения его объемов и снижения ФВ.
Список литературы Циркулирующие в крови стволовые клетки: динамика и значение при остром инфаркте миокарда
- Казаков А.А., Мюллер П., Бельтрами А.П. и др. Стволовые клетки и регенерация миокарда человека//Кардиология. -2005. -Т. 11. -С. 65-75.
- Ставрова Л.А., Фомина Т.И., Плотников М.Б. и др. Фармакологическая регуляция функциональной активности стволовых клеток при восстановлении миокарда в постинфарктном периоде//Клеточные технологии в биологии и медицине. -2005. -№ 4. -С. 190-194.
- Смолянинов А.Б., Лобзин Ю.В., Васильев В.Б. и др. Стволовые клетки в клеточной кардиомиопластике при ишемической болезни сердца//Трансфузиология. -2006. -Т. 2. -С. 4-39.
- Ярыгин К.Н. Роль циркулирующих стволовых клеток в физиологической и репаративной регенерации//Патологическая физиология и экспериментальная терапия. -2008. -№ 1. -С. 2-8.
- Kang H.J., Kim H.S., Zhang S.Y. et al. Effects of intracoronary infusion of peripheral blood stem cells mobilized with granulocyte-colony stimulating factor on left ventricular systolic and restenosis after coronary stenting in myocardial infarction: the MAGIC cell randomized clinical trial//Lancet. -2004. -Vol. 363 (9411). -Р. 751-756.
- Katritsis D.G., Sotiropoulou P.A., Karvouni E. et al. Tpanscoronary transplantation of autologous mesenchymal stem cells and endothelial progenitors into infracted human myocardium//Catheter Cardiovasc. Interv. -2005. -Vol. 65 (3). -Р. 321-329.
- Leone A.M., Rutella S., Bonanno G. et al. Mobilization of bone marrowderived stem cells after myocardial infarction and left ventricular function//Cell Tissue Res. -2008. -Vol. 331. -Р. 283-300.
- Limbourg FP, Drexler H. Bone marrow stem cells for myocardial infarction: effector or mediator?//Circ. Res. -2005. -No. 96. -Р. 6-8.
- Lunde K., Solheim S., Aakhus S. et al. Intracoronary Injection of Monocuclear Bone Marrow Cells in Acute Myocardial Infarction//N. Engl. J. Med. -2006. -Vol. 355. -Р. 1999-1209.
- Meyer G.P., Wollert K.C., Lotz J. et al. Intracoronary Bone Marrow Cell Transfer After Myocardial Infarction. Eighteen Months' Follow-Up Data from the Randomized, Controlled BOOST (BOne marrOw transfer to enhance ST-elevation infarct regeneration) Trial//Circulation. -2006. -Vol. 113. -Р. 1287-1294.
- Orlic D., Kajstura J., Chimenti S. et al. Bone marrow cells regenerate infracted myocardium//Nature. -2001. -Vol. 410. -Р. 701-705.
- Shintani S., Murohara T., Ikeda H. et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction//Circulation. -2001. -Vol. 103. -Р. 2776.
- Theise N.D., Badve S., Saxena R. et al. Derivation of hepatocytes from bone marrow cells in mice after radiationinduced myeloablation//Hepatology. -2000. -Vol. 31 (1). -Р. 235-240.
- Tomita S, Li RK, Weisel RD et al. Autologous transplantation of bone marrow cell inproves damaged heart function//Circulation. -1999. -Vol. 100 (suppl. II). -Р. 247-256.
- Wojakowski W., Michal Tendera, Anna Michalowska, Marcin Majka et al. Mobilization of CD34/CXCR4+, CD34/CD117+, c-met+ Stem Cells, and Mononuclear Cells Expressing Early Cardiac, Muscle, and Endothelial Markers Into Peripheral Blood in Patients With Acute Myocardial Infarction//Circulation. -2004. -Vol. 110. -Р. 3213-3220.
- Zhang S., Guo J., Zhang P. Long-term effects of bone marrow mononuclear cell transplantation on left ventricular function and remodeling in rats//Life Sci. -2004. -Vol. 74 (23). -Р. 2853-2864.


