Цитокин-опосредованные механизмы коррекции агрессивного поведения модулированными in vitro иммунокомпетентными клетками
Автор: Маркова Евгения Валерьевна, Серенко Евгений Владимирович
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (118), 2023 года.
Бесплатный доступ
Нарушение нейроиммунных взаимодействий является важным звеном в патогенезе агрессии, включая формирование агрессивного поведения. Цитокины, являясь мессенджерами межсистемных функциональных связей, играют при этом существенную роль. Ранее нами были получены приоритетные данные о возможности редактирования паттернов агрессивного поведения модулированными ex vivo аминазином иммунокомпетентными клетками. Цель: исследование роли цитокинов в редактировании поведения агрессивных реципиентов модулированными in vitro сингенными иммунокомпетентными клетками. Показано, что коррекция агрессивного поведения после трансплантации сингенных модулированных in vitro аминазином спленоцитов регистрируется на фоне изменения содержания ряда цитокинов в патогенетически значимых для агрессииструктурах головного мозга в сторону снижения провоспалительных цитокинов IL-1 в, IL-2, IL-6, IFN-y и повышения противовоспалительного цитокина IL-4, что свидетельствует о снижении нейровоспаления. Приэтом у агрессивных реципиентов показана также модуляция продукции цитокинов периферическими иммунокомпетентными клетками, что проявилось в снижении стимулированной митогенами продукции спленоцитами IFN-y, IL-2, IL-6 и IL-10. Противоположные изменения уровней цитокинов, наблюдаемые при формировании агрессивного поведения и его купировании, свидетельствуют о цитокин-опосредованном редактировании поведенческого фенотипа агрессивных реципиентов после трансплантации прекультивированных с аминазином сингенных иммунокомпетентных клеток. Визуализация функционально активных спленоцитов, прекультивированных с аминазином в паренхиме не только селезенки, но и головного мозга агрессивных реципиентов, предполагает также непосредственное влияние введенных иммунокомпетентных клеток на клетки ЦНС.
Агрессия, иммунокомпетентные клетки, аминазин, головной мозг, селезенка, цитокины
Короткий адрес: https://sciup.org/142238071
IDR: 142238071 | УДК: 615.37:616.092.4:616.89-008.444.9 | DOI: 10.26617/1810-3111-2023-1(118)-32-40
Текст научной статьи Цитокин-опосредованные механизмы коррекции агрессивного поведения модулированными in vitro иммунокомпетентными клетками
Масштабная межличностная агрессия и насилие являются распространенными симптомами множественных психических расстройств и представляют собой серьезную глобальную проблему для здравоохранения [1, 2, 3, 5, 7]. Использование экспериментальных моделей, которые достоверно фиксируют основные черты насильственных действий человека, в сочетании с новыми технологиями картирования, измерения и манипулирования активностью нейронов в головном мозге значительно расширяют современное понимание этиологии, нейромолекулярных механизмов агрессии, равно как и возможности потенциальных терапевтических подходов купирования чрезмерно агрессивного поведения у людей [1, 2, 7, 8]. Вместе с тем текущие терапевтические стратегии ограничены из-за отсутствия всестороннего понимания нейронных и молекулярных механизмов, лежащих в основе «порочного» перехода нор- мальной адаптивной агрессии в насилие, и триггеров окружающей среды, которые его вызывают. Экспериментальный подход, развиваемый в последние десятилетия, позволяет формировать агрессивный тип поведения у самцов мышей в результате повторного опыта побед в ежедневных внутривидовых конфронтациях [7, 8, 9]. Исследования показали, что по своим проявлениям и последствиям для организма состояние агрессивных животных очень сходно с таковым у людей, проявлявших агрессию и насилие по отношению к другим людям. Представляется, что видоспецифическими и различающимися у животных и людей могут быть только стимулы и условия, запускающие или провоцирующие проявление агрессивного поведения. При этом физиология агрессии, особенно физической, её нейробио-логические механизмы и разрушающие последствия для организма являются общими [1, 7, 8, 9, 10].
В настоящее время имеется большое число клинических и экспериментальных данных, свидетельствующих о взаимосвязанных изменениях функциональной активности основных гомеостатических систем организма при агрессии. Ведущими звеньями патогенетического механизма агрессии является нарушение продукции и взаи-морегуляции цитокинов, нейромедиаторов, нейропептидов, ростовых факторов, гормонов, эффекты которых опосредуются иммунокомпетентными клетками (ИКК). Так, нейрохимическая регуляция агрессивных форм поведения обусловлена включением дофамин-, серотонин-, ГАМК-, норадренергической и опиоидных нейропепти-дергических систем мозга [7, 11, 12, 13]. Установлено, что центральные нейромедиаторные системы, включенные в нейробиологические механизмы агрессивного поведения, также играют важную роль в психонейроиммуномодуляции, влияя на интенсивность иммунного ответа и функциональную активность ИКК. В частности со снижением активности серотонинергической системы при стресс-индуцированной агрессии и доминированием дофаминергической системы мозга, имеющей существенное значение в иммуностимуляции, связывают повышение интенсивности гуморального иммунного ответа у агрессивных мышей [7, 14].
Показано также, что формирование агрессивного поведения у самцов сопровождается перераспределением субпопуляций лимфоцитов в костном мозге, в селезенке и тимусе: увеличением количества СD4+ при снижении количества СD8+-клеток [6, 14]. Кроме того, продемонстрировано усиление цитотоксической активности NK-клеток селезенки и пролиферативного ответа спленоцитов в ответ на Т-зависимый митоген [6]. В формировании агрессивного поведения установлена патогенетическая роль продуцируемых ИКК цитокинов IL-1β, IL-4, IL-6, IL-18, TNF-α, IFN-α, IFN-γ [6, 7, 15, 17, 18, 19]. В ЦНС активи-рованая микроглия, астроциты, нейроны и эндотелиальные клетки также продуцируют ряд цитокинов и экспрессируют рецепторы к ним. Изменение цитокинового профиля и презентации интерлейкиновых рецепторов в патогенетически значимых отделах мозга рассматривается в качестве одного из механизмов иммунной дизрегуля-ции функций ЦНС при агрессии [6, 15, 16].
В лаборатории нейроиммунологии НИИФКИ впервые была установлена возможность и определены основные механизмы направленного формирования/изменения паттернов поведения экспериментальных животных трансплантацией ИКК с определенными функциональными характеристиками [19, 21, 22, 23]; представлены возможность и механизмы коррекции стресс- индуцированного поведения, включая агрессивное поведение, трансплантацией модулированных психоактивным веществом ИКК [24, 25, 26, 27, 28, 29]. Способность ИКК после адоптивного переноса модулировать поведение и когнитивные функции, в том числе и путем непосредственного контакта с клетками ЦНС, показана впоследствии и другими исследователями [30, 31]. Принимая во внимание важную роль цитокинов, продуцируемых как периферическими ИКК, так и клетками ЦНС, в патогенетических механизмах агрессии, была определена цель настоящей работы.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Исследование уровня цитокинов в ЦНС и их продукции периферическими иммунокомпетентными клетками у агрессивных реципиентов после трансплантации модулированных in vitro аминазином сингенных иммунокомпетентных клеток.
МАТЕРИАЛЫ И МЕТОДЫ
На базе лаборатория нейроиммунологии НИИФКИ (Новосибирск) выполнено исследование на мышах-самцах (CBA x C57BL/6)F1, четырехмесячного возраста, весом 22-25 граммов, полученных из питомника НИЛЭМ (Томск). Животных содержали в условиях лабораторного вивария в клетках по 10 особей в каждой, на стандартной диете, при естественном световом режиме. Исследования с животными проводились в соответствии с законодательством Российской Федерации, положениями Директивы 2010/63/EU Европейского парламента и совета Европейского Союза от 22.09.2010 г. по охране животных, используемых в научных целях, требованиями и рекомендациями Руководства по содержанию и использованию лабораторных животных.
Учитывая наличие в популяции половозрелых мышей-самцов (CBA × C57BL/ 6)F1 особей с активным и пассивным типами поведения, характеризующихся различными психофизиологическими реакциями на стрессовые воздействия [19, 20, 31], для формирования однородных экспериментальных групп животных все мыши были предварительно протестированы в «открытом поле». В эксперимент были включены только особи, которые демонстрировали активный тип ориентировочно-исследовательского поведения. Агрессивный фенотип у мышей формировался в результате 20-кратного опыта побед в ежедневных межсамцовых конфронтациях с подчиненным партнером (модель хронического социального конфликта) [9]. Релевантность используемой модели обусловлена тем, что у животных моделей фармакология и нейрохимия агрессии, эмоциональное состояние и поведенческие реакции удовлетворяют формальным критериям, которые приводятся в литературе для обозначения обученной агрессии у людей [1, 2, 10].
Агрессивные самцы (CBA×C57BL/6)F1 использовались в последующих экспериментах в качестве доноров и реципиентов ИКК. ИКК агрессивных доноров были выделены в стерильных условиях из суспензии клеток селезенки, обработаны in vitro аминазином и трансплантированы внутривенно сингенным агрессивным реципиентам, как это было подробно описано ранее [20, 27, 28]. В контрольной группе агрессивных реципиентов подготовка и трансплантация ИКК была проведена в аналогичных условиях, за исключением того, что прекультивирование ИКК проводилось без аминазина.
Количественное содержание цитокинов определяли в лизатах патогенетически значимых для состояния агрессии структур головного мозга (гиппокамп, гипоталамус, стриатум, фронтальная кора) и культуральных супернатантах спленоци-тов сингенных агрессивных реципиентов.
Для определения содержания цитокинов в супернатантах спленоциты культивировали в концентрации 2х106/мл в объеме 2 мл в 24-луночных планшетах для иммунологических исследований (Libro, USA) в полной культуральной среде, содержащей RPMI-1640, 10% инактивированной эмбриональной телячьей сыворотки (Hyclone), 2 мМ L-глютамина (ФГУН ГНЦ ВБ «Вектор»), 10 мМ HEPES-буфера (Sigma) и 80 мкг/мл гентамицина («Синтез») в течение 24 часов ‒ для исследования продукции IL-1β и TNF-α, 48 часов ‒ для IL-2, IL-6 и IL-10, 72 часа ‒ для оценки продукции спленоцитами IFN-γ. Для исследования стимулированной продукции цитокинов в культуральную среду добавляли липополисахарид (ЛПС) E. сoli 011: B4 (Sigma) в качестве митогена для IL-1β, TNF-α и IL-6, конканавалин А (Кон А, Pharmacia) ‒ для IL-2, IFN-γ и IL-10 в концентрациях, стимулирующих субоптимальную продукцию каждого из цитокинов, определенную в серии предварительных экспериментов. По окончании культивирования клеточную суспензию собирали, клетки осаждали центрифугированием, а культуральный супернатант использовали для исследования.
Лизаты отдельных структур мозга получали путем гомогенизирования тканей в неполной среде RPMI-1640 с добавлением 0,1% Triton X-100 (GERBU Biotechnik GmbH), с последующим центрифугированием в течение 3 минут при 10 000 оборотов/мин. Надосадочную жидкость использовали для исследования.
Для выявления трансплантированных ИКК в паренхиме селезенки и головного мозга сингенных агрессивных реципиентов была проведена прижизненная окраска прекультивированных с аминазином спленоцитов витальным красителем CFSE (Invitrogen, USA) по методике фирмы-производителя. Агрессивных реципиентов забивали путем цервикальной дислокации на 3-и сутки после трансплантации клеток с последующим выделением селезенки и головного мозга. Клеточную суспензию ткани головного мозга перед проведением цитометрического исследования разделяли на трёхступенчатом градиенте перкол-ла (Sigma) по описанной методике для обогащения образцов лимфоцитарной фракцией [33]. Цитометрический анализ проводили с помощью проточного цитофлюориметра BD FACSVerse и программного обеспечения BD FACSuite (BD Biosciences, USA).
Статистическую обработку данных проводили с помощью пакета программ SPSS 11.0. При анализе количественных данных проверку на нормальность распределения фактических данных проводили с помощью W-критерия Шапиро-Уилка. Для каждой из непрерывных величин определяли среднее (М) и стандартное (SD) отклонение. При проведении сравнений независимых выборок (при числе групп, равном 2) в случае нормального распределения и равных дисперсий в группах применяли t-критерий Стьюдента для независимых наблюдений; при отклонении распределения от нормального применяли U-критерий Манна-Уитни. Для множественного сравнения показателей использовали H-критерий Краскела-Уоллиса. Критический уровень значимости при проверке статистических гипотез в исследовании принимался p≤0,05. Объем выполненных исследований позволял оценить результаты со статистической значимостью 95-99% при использовании соответствующих статистических методов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Цитокины, являясь как иммунорегуляторами, так и нейромодуляторами, обладают выраженными психо- и нейротропными свойствами и вовлекаются в механизмы формирования агрессивного поведения, индуцированного социальным стрессом. Известно, что формирование агрессивного поведения ассоциировано как с модуляцией продукции цитокинов периферическими ИКК, так и с изменением цитокинового профиля в ряде структур головного мозга, где при формировании агрессивного фенотипа установлено повышение уровней провоспалительных цитокинов IL-1β, IL-2 и IL-6 [7, 14, 15, 16, 17, 18, 19], что подтверждено и в собственных исследованиях. Ранее нами также было обнаружено, что прекультивирование с аминазином спленоцитов агрессивных мышей (CBA x C57BL/6)F1 вызывает модуляцию функциональной активности указанных клеток. В частности это проявляется в снижении продукции цитокинов IL-2, IL-6 и ИНФ-γ; а внутривенное введение указанных ИКК приводит у сингенных агрессивных реципиентов к снижению агрессивной мотивации, уровня агрессивности, тревожности и локомоторной активности [20, 27, 28, 29].
В настоящем исследовании выявлено, что редактирование характерных для состояния агрессии паттернов поведения у реципиентов модулированными аминазином спленоцитами регистрировалось на фоне изменения количественного содержания ряда цитокинов в патогенетически значимых для агрессии структурах головного мозга (рис. 1).
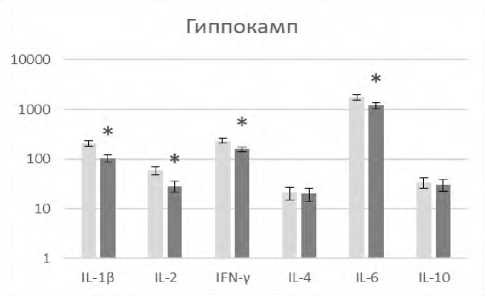
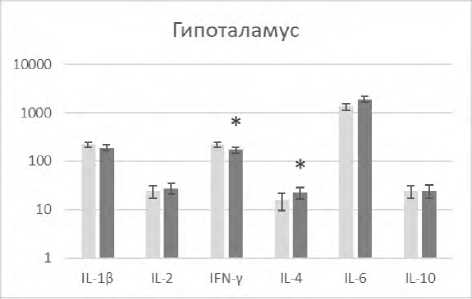
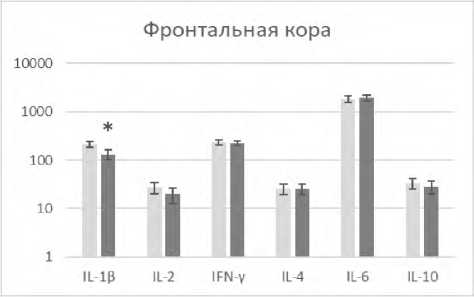
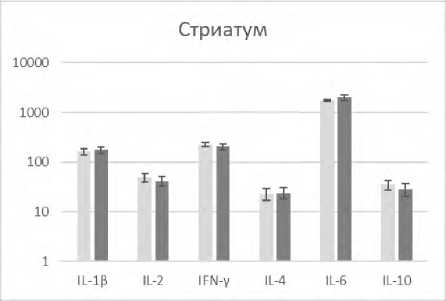
Р и с у н о к 1. Содержание цитокинов (пг/мл) в лизатах патогенетически значимых структур головного мозга агрессивных реципиентов (CBA x C57Bl/6)F1 после трансплантации сингенных спленоцитов, модулированных in vitro аминазином
П р и м е ч а н и я: ■ – образцы супернатантов лизатов соответствующей структуры головного мозга агрессивных реципиентов после трансплантации спленоцитов, прекультивированных без аминазина (контроль); ■ ‒ образцы супернатантов лизатов соответствующей структуры головного мозга агрессивных реципиентов после трансплантации спленоцитов, прекультивированных с аминазином (опыт).
Результаты представлены в виде M±SD; n=12 в каждой группе; * ‒ p<0,05 между соответствующими показателями клеток в контрольной и опытной группах реципиентов.
Так, в гиппокампе наблюдалось снижение IL-1β, IFN-γ, IL-2, IL-6, в гипоталамусе ‒ снижение IFN-γ и повышение IL-4, во фронтальной коре ‒ снижение IL-1β. Выявленный вектор изменения уровней указанных регуляторных цитокинов в сторону снижения ряда провоспалительных и повышения противовоспалительного IL-4 свидетельствует о снижении нейровоспаления. Подтверждением тому служат также полученные нами данные о снижении экспрессии маркера воспаления белка Iba-1 в указанных структурах мозга у агрессивных реципиентов после трансплантации модулированных аминазином сплено-цитов (данные не приводятся).
В связи с тем, что цитокины из периферической крови могут проникать в мозг и индуцировать в нем выработку собственных цитокинов, важным является оценка их продукции иммунокомпетентными клетками у агрессивных реципиентов.
В результате проведенных исследований установлено, что трансплантация спленоцитов с модулированной in vitro аминазином функциональной активностью сингенным реципиентам с агрессивным фенотипом вызывала у последних изменение стимулированной продукции ряда цитокинов: снижение ИНФ-γ, IL-2, IL-6 и IL-10 и повышение TNF-α (рис. 2).
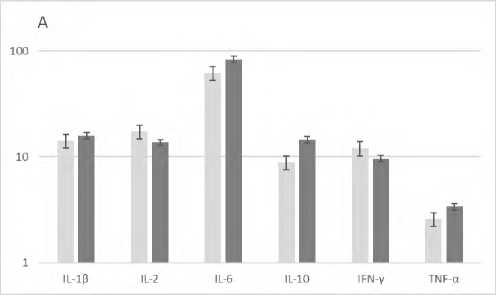
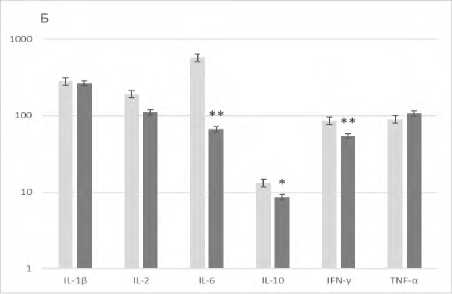
Р и с у н о к 2. Продукция цитокинов (пг/мл) клетками селезенки агрессивных реципиентов (CBA x C57Bl/6)F1 после трансплантации сингенных спленоцитов, модулированных in vitro аминазином
П р и м е ч а н и я: А ‒ спонтанная продукция цитокинов, Б – митоген-стимулированная продукция цитокинов, ■ – образцы супернатантов клеток селезенки агрессивных реципиентов после трансплантации сплено-цитов, прекультивированных без аминазина (контроль), ■ – образцы супернатантов клеток селезенки агрессивных реципиентов после трансплантации спленоцитов, прекультивированных с аминазином (опыт).
Результаты представлены в виде M±SD; n=10 в каждой группе; * ‒ p<0,05; ** ‒ p<0,01 между соответствующими показателями в контрольной и опытной группах клеток.
Можно полагать, что в качестве триггерных факторов, приводящих к изменениям функциональной активности ЦНС у агрессивных реципиентов после внутривенного введения модулированных аминазином ИКК, выступают продуцируемые этими клетками цитокины, равно как и цитокины, продуцируемые собственными ИКК реципиентов. При этом изменение функциональной активности последних может быть обусловлено
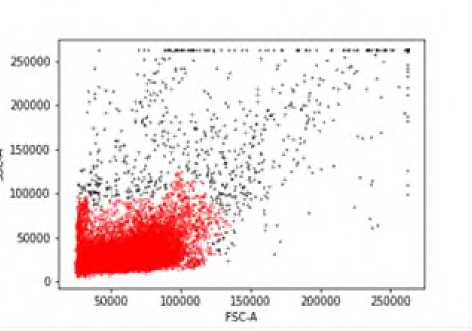
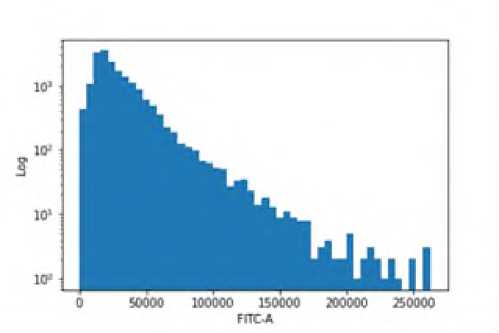
А хоумингом трансплантированных клеток и их межклеточным контактом с клетками селезенки реципиентов. Подтверждением тому служат полученные нами данные о визуализация прекуль-тивированных с аминазином спленоцитов агрессивных доноров в паренхиме селезенки сингенных агрессивных реципиентов (рис. 3).
Р и с у н о к 3. Прекультивированные с аминазином, меченные CFSE спленоциты агрессивных доноров (CBA x C57BL/6)F1 в паренхиме селезенки сингенных агрессивных реципиентов
П р и м е ч а н и е. Цитограмма А не гейтирована (ungated): выделение популяции спленоцитов (выделено красным) по параметрам бокового (SS) и прямого (FS) светорассеяния. Гистограмма Б (гейтированная): показатель CFSE, гейтированный по области спленоцитов цитограммы А, для выявления относительного содержания меченных CFSE спленоцитов от общего числа спленоцитов.
Б
По всей видимости, головной мозг реагирует на изменение цитокинового профиля на периферии и отвечает на этот стимул модуляцией как собственного локального синтеза цитокинов, так и активности центральных нейромедиаторных систем, включённых в нейробиологические механизмы, контролирующие различные типы агрессивного поведения [7, 11, 14, 16]. Цитокины, таким образом, вовлекаются в механизмы, лежащие в основе развития агрессивных реакций, следствием чего и являются регистрируемые нами изменения характерных для состояния агрессии паттернов поведения. Выявленные противоположные изменения уровней цитокинов в патогенетически значимых структурах головного мозга и в культуральных супернатантах спленоцитов, наблюдаемые при формировании агрессивного поведения [15, 16, 17, 18, 19] и его редактировании модулированными аминазином ИКК, под- тверждают цитокин-опосредованный механизм коррекции агрессивного поведения реципиентов.
Имеются также данные о том, что не только цитокины, но и иммунокомпетентные клетки могут проникать в головной мозг и изменять функциональное состояние ЦНС, включая поведенческие реакции, путем непосредственного контакта с клетками головного мозга [30, 31]. Обусловленная нейровоспалением повышенная проницаемость гематоэнцефалического барьера при индуцированной хроническим социальным стрессом агрессии предполагает и этот механизм влияния трансплантированных ИКК на функции мозга, включая синтез цитокинов с их последующим регулирующим влиянием на поведенческие реакции. Подтверждением чему служит визуализация лимфоцитарной фракции прекультивированных с аминазином спленоцитов в паренхиме головного мозга агрессивных реципиентов (рис. 4).
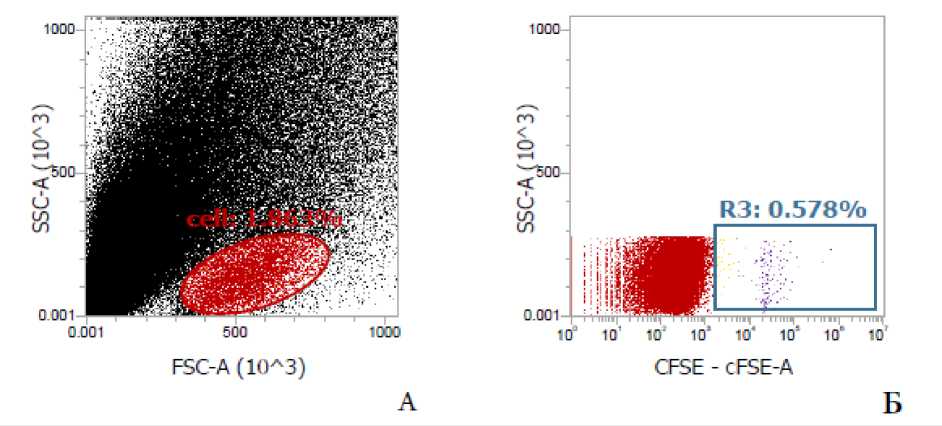
Р и с у н о к 4. Цитограмма лимфоцитарной фракции клеток головного мозга агрессивных реципиентов (CBA x C57BL/6)F1 после внутривенного введения меченных CFSE сингенных спленоцитов, прекультивированных с аминазином
П р и м е ч а н и я: А ‒ диаграмма фронтального-бокового рассеяния, [cell] – область лимфоцитарного облака, Б ‒ диаграмма бокового рассеяния против CFSE, гейтирована по области [cell] цитограммы А, предназначена для выявления относительного содержания меченных CFSE лимфоцитов от общего числа лимфоцитов.
Обращает на себя внимание тот факт, что на момент тестирования (3-и сутки после системного введения клеток) регистрируются, как минимум, две выраженных генерации лимфоцитов (рис. 4, цитограмма Б), свидетельствующие об их пролиферативной активности, что убедительно свидетельствует о том, что введенные ИКК в мозге функционально активны и показанные выше изменения в уровнях цитокинов в головном мозге в том числе могут быть и результатом непосредственного влияния трансплантированных иммунокомпетентных клеток, модулированных ex vivo аминазином, на клетки ЦНС.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные результаты собственных исследований позволяют рассматривать существование относительно независимых цито-кин-опосредованных механизмов редактирования агрессивного поведения системно введенными ИКК с модулированной in vitro аминазином функциональной активностью.
Список литературы Цитокин-опосредованные механизмы коррекции агрессивного поведения модулированными in vitro иммунокомпетентными клетками
- Tordjman S. Aggressive behavior: A language to be understood. Encephale. 2022 Sep;48 Suppl 1:S4-S13. doi: 10.1016/j.encep.2022.08.007. Epub 2022 Sep 7. PMID: 36088175.
- de Boer SF. Animal models of excessive aggres-sion: implications for human aggression and vio-lence. Curr Opin Psychol. 2018 Feb;19:81-87. doi: 10.1016/j.copsyc.2017.04.006. PMID: 29279228.
- Parshukova D, Smirnova LP, Ermakov EA, Bokhan NA, Semke AV, Ivanova SA, Buneva VN, Nevin-sky GA. Autoimmunity and immune system dysregulation in schizophrenia: IgGs from sera of patients hydrolyze myelin basic protein. J Mol Recognit. 2019 Feb;32(2):e2759. doi: 10.1002/jmr.2759. PMID: 30112774.
- Ветлугина Т.П. Клиническая психонейроимму-нология: итоги и перспективы. Сибирский вестник психиатрии и наркологии. 2008. № 1 (48). С. 12-17. Vetlugina TP. Clinical psychoneuroim-munology: results and prospects. Siberian Herald of Psychiatry and Addiction Psychiatry. 2008;1(48):12-17 (in Russian).
- Ветлугина Т.П., Никитина В.Б., Лобачева О.А., Невидимова Т.И. Основы клинической психо-нейроиммунологии. Томск: Книго, 2014. 80 c. Vetlugina TP, Nikitina VB, Lobacheva OA, Nevi-dimova TI. Fundamentals of clinical psychoneuro-immunology. Tomsk: Publishing House Knigo, 2014:80 (in Russian).
- Альперина Е.Л., Бочаров Е.В., Бочарова О.А., Василенко А.М., Ветлугина Т.П., Вотинцева М.В., Захарова Л.А., Зотова В.В., Зубарева О.Е., Ивашкова Е.В., Идова Г.В., Клименко В.М., Клюшник Т.П., Крыжановский Г.Н., Кучеряну В.Г., Ланцова В.Б., Магаева С.В., Морозов С.Г., Невидимова Т.И., Петров А.М., Семке В.Я., Сепп Е.К., Столяров И.Д. Чейдо М.А. Актуаль-ные проблемы нейроиммунопатологии. М., 2012. 423 с. Alperina EL, Bocharov EV, Bo-charova OA, Vasilenko AM, Vetlugina TP, Votintseva MV, Zakharova LA, Zotova VV, Zuba-reva OE, Ivashkova EV, Idova GV, Klimenko VM, Klyushnik TP, Kryzhanovsky GN, Kucheryanu VG, Lantsova VB, Magaeva SV, Morozov SG, Nevidimova TI, Petrov AM, Semke VYa, Sepp EK, Stolyarov ID Cheido MA. Relevant problems of neuroimmunopathology. Moscow, 2012:423 (in Russian).
- Takahashi A, Flanigan ME, McEwen BS, Russo SJ. Aggression, Social Stress, and the Immune System in Humans and Animal Models. Front Behav Neu-rosci. 2018 Mar 22;12:56. doi: 10.3389/fnbeh.2018.00056. PMID: 29623033; PMCID: PMC5874490.
- Kudryavtseva, N.N. Positive fighting experience, addiction-like state, and relapse: Retrospective analysis of experimental studies. Aggress. Viol. Behav. 2020; 52:101403. doi: 10.1016/j.avb.2020.101403
- Kudryavtseva NN, Smagin DA, Kovalenko IL, Vishnivetskaya GB. Repeated positive fighting experience in male inbred mice. Nat Protoc. 2014 Nov;9(11):2705-17. doi: 10.1038/nprot.2014.156. Epub 2014 Oct 23. PMID: 25340443.
- Кудрявцева Н.Н. Нейробиология агрессии: Мы-ши и люди. Новосибирск: Наука-Центр, 2013. 271 с. Kudryavtseva NN. Neurobiology of aggression: Mice and humans. Novosibirsk: Publishing House Nauka-Center, 2013:271 (in Russian).
- Narvaes R, Martins de Almeida RM. Aggressive behavior and three neurotransmitters: dopamine, GABA, and serotonin ‒ A review of the last 10 years. Psychology & Neuroscience. 2014;7(4):601-607. doi.org/10.3922/j.psns.2014.4.20
- Peeters D.G.A., Lange W.G., von Borries A.K.L., Franke B., Volman I., Homberg J.R., Verkes R.J., Roelofs K. Threat-Avoidance Tendencies Moderate the Link Between Serotonin Transporter Genetic Variation and Reactive Aggression. Front Behav Neurosci. 2020; 14:562098. doi: 10.3389/fnbeh.2020.562098.
- Smagin D.A., Galyamina A.G., Kovalenko I.L., Kudryavtseva N.N. Altered Expression of Genes Associated with Major Neurotransmitter Systems in the Reward-Related Brain Regions of Mice with Positive Fighting Experience. Int. J. Mol. Sci. 2022; 23,13644. doi.org/10.3390/ijms232113644
- Идова Г.В., Альперина Е.Л., Геворгян М.М., Жукова Е.Н. Психонейроиммуномодуляция. Агрессия и иммунитет. Патогенез. 2014. Т. 12, № 3. С. 27-32. Idova GV, Alperina EL, Gevorgyan MM, Zhukova EN. Psychoneuroimmunomodula-tion. Aggression and immunity. Pathogenesis. 2014;12(3):27-32 (in Russian).
- Alperina E, Idova G, Zhukova E, Zhanaeva S, Ko-zhemyakina R. Cytokine variations within brain structures in rats selected for differences in aggres-sion. Neurosci Lett. 2019 Jan 23;692:193-198. doi: 10.1016/j.neulet.2018.11.012. Epub 2018 Nov 10. PMID: 30423398.
- Zalcman SS, Siegel A. The neurobiology of aggres-sion and rage: role of cytokines. Brain Behav Im-mun. 2006 Nov;20(6):507-14. doi: 10.1016/j.bbi.2006.05.002. PMID: 16938427.
- Idova GV, Markova EV, Gevorgyan MM, Alperina EL, Zhukova EN. Changes in production of cyto-kines by C57Bl/6J mouse spleen during aggression provoked by social stress. Bull Exp Biol Med. 2016 Mar;160(5):679-82. doi: 10.1007/s10517-016-3248-y. Epub 2016 Mar 29. PMID: 27021091.
- Girard D, Tardif JC, Boisclair Demarble J, D'Anto-no B. Trait Hostility and Acute Inflammatory Re-sponses to Stress in the Laboratory. PLoS One. 2016 Jun 6;11(6):e0156329. doi: 10.1371/journal.pone.0156329. PMID: 27270459; PMCID: PMC4894569.
- Salvador AF, de Lima KA, Kipnis J. Neuromodula-tion by the immune system: a focus on cytokines. Nat Rev Immunol. 2021 Aug;21(8):526-541. doi: 10.1038/s41577-021-00508-z. Epub 2021 Mar 1. PMID: 33649606.
- Маркова Е.В. Иммунокомпетентные клетки и регуляция поведенческих реакций в норме и патологии. Красноярск: Научно-инновационный центр, 2021. 184 с. Markova EV. Immune cells and regulation of behavioral reactions in health and disease. Krasnoyarsk: Scientific and Innovation Center, 2021:184. doi: 10.12731/978-5-907208-67-4 (in Russian).
- Маркова Е.В., Абрамов В.В., Козлов В.А. Им-мунокомпетентные клетки и регуляция поведения у животных. Бюллетень Сибирского отделения Российской академии медицинских наук. 2007. № 2. С. 6-9. Markova EV, Abramov VV, Kozlov VA. Immunocompetent cells and regulation of behavior in animals. Bulletin of the Siberian Branch of the Russian Academy of Medical Sci-ences. 2007;2:6-9. doi: 10.12731/978-5-907208-67-4 (in Russian).
- Markova E.V., Abramov V.V., Korotkova N.A., Kozlov V.A. Effect of transplantation of immuno-competent cell on orientation and exploratory be-havior and cytokine gene expression in the brain of experimental animals. Bull. Exp. Biol. Med. 2006; 142(3):338-340. doi: 10.1007/s10517-006-0360-4.
- Маркова Е.В., Княжева М.А., Козлов В.А. Клеточные механизмы нейроиммунных взаимодействий в регуляции ориентировочно-исследова-тельского поведения. Сибирский вестник психиатрии и наркологии. 2013. № 1 (76). С. 49-52. Markova EV, Knyazheva MA, Kozlov VA. Cellu-lar mechanisms of neuroimmune interactions in the regulation of exploratory behavior. Siberian Herald of Psychiatry and Addiction Psychiatry. 2013;1(76):49-52 (in Russian).
- Markova E.V., Knyazheva M. A. Immune cells as a potential therapeutic agent in the treatment of de-pression. Medical Immunology (Russia). 2021;23(4): 699-704. doi: 10.15789/1563-0625-ICA-2277.
- Markova EV, Knyazheva MA, Tikhonova MA, Amstislavskaya TG. Structural and functional char-acteristics of the hippocampus in depressive-like recipients after transplantation of in vitro caffeine-modulated immune cells. Neurosci Lett. 2022 Aug 24;786:136790. doi: 10.1016/j.neulet.2022.136790. Epub 2022 Jul 15. PMID: 35839995.
- Маркова Е.В., Княжева М.А., Амстиславская Т.Г. Модуляция функциональной активности нервной системы у экспериментальных животных с агрессивно-подобным поведением трансплантацией клеток иммунной системы, обработанных in vitro нейролептиком. Российский иммунологический журнал. 2016. Т. 10 (19). № 2. С. 136-138. Markova EV, Knyazheva MA, Amstislavskaya TG. Nervous system functional activity modulation in experimental animals with aggressively similar be-havior by the transplantation of immune cells treated in vitro with neuroleptics. Russian Journal of Immu-nology. 2016;10(19),2:136-138 (in Russian).
- Markova EV, Serenko EV, Knyazheva MA. Ag-gressive behavior correction by the transplantation of in vitro modulated immune cells. Medical Im-munology (Russia). 2021. Т. 23, № 4. С. 693-698. doi: 10.15789/1563-0625-ABC-2263.
- Маркова Е.В., Серенко Е.В. Коррекция паттернов агрессивного поведения модулированными ex vivo иммунокомпетентными клетками: экс-периментальное исследование. Сибирский вестник психиатрии и наркологии. 2022. № 3 (116). С. 5-13. Markova EV, Serenko EV. Correction of aggressive behavior patterns by ex vivo modulated immunocompetent cells: an experimental study. Si-berian Herald of Psychiatry and Addiction Psychia-try. 2022;3(116):5-13. doi: 10.26617/1810-3111-2022-3(116)-5-13 (in Russian).
- Markova E., Serenko E., Knyazheva M. Aggressive phenotype editing by modulated immune cells. Eu-ropean Psychiatry. 2022 Sept: 65(S1):S95-S96. DOI:10.1192/j.eurpsy.2022.278
- Radjavi A, Smirnov I, Kipnis J. Brain antigen-reactive CD4+ T cells are sufficient to support learning behavior in mice with limited T cell reper-toire. Brain Behavior Immunity. 2014;35:58-63. doi: 10.1016/j.bbi.2013.08.013.
- Clark SM, Vaughn CN, Soroka JA, Li X, Tonelli LH. Neonatal adoptive transfer of lymphocytes res-cues social behaviour during adolescence in im-mune-deficient mice. Eur J Neurosci. 2018 Apr;47(8):968-978. doi: 10.1111/ejn.13860. Epub 2018 Feb 23. PMID: 29430738; PMCID: PMC5902418.
- Немец В.В., Виноградова Е.П. Стресс и стратегии поведения. Национальный психологический журнал. 2017. № 2 (26). С. 59-72. Nemets VV, Vinogradova EP. Stress and neurobiology of coping styles. National Psychological Journal. 2017;2(26):59-72 doi: 10.11621/npj.2017.0207. in Russian).
- Prasad S, Hu S, Sheng WS, Singh A, Lokensgard JR. Tregs modulate lymphocyte proliferation, acti-vation, and resident-memory t-cell accumulation within the brain during MCMV infection. PLoS One. 2015 Dec 31;10(12):e0145457. doi:
- 10.1371/journal.pone.0145457. PMID: 26720146; PMCID: PMC4697843.


