Цитопенический синдром у ВИЧ-положительных пациентов (анемия, тромбоцитопения, нейтропения, МДС)
Автор: Дудина Г.А., Оганнисян А.А., Мабудзаде Ч.К., Кремнева Н.В., Петрова Е.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Гематология: вчера, сегодня, завтра
Статья в выпуске: 3 т.19, 2023 года.
Бесплатный доступ
Цитопения является частым гематологическим синдромом у пациентов с инфекцией, вызванной вирусом иммунодефицита человека (ВИЧ). Однако распространение, факторы риска появления и прогрессирования цитопенического синдрома у пациентов с ВИЧ-инфекцией практически не исследованы. В гемограмме могут выявляться анемия, тромбоцитопения, нейтропения, лимфоцитопения или их комбинации. В патогенезе цитопенического синдрома важная роль отводится гликопротеинам поверхностной оболочки ВИЧ, которые могут способствовать активации воспалительных путей, влияющих на микроокружение костного мозга. При этом цитокины воздействуют на гемопоэтические стволовые клетки, в частности интерлейкин-6, воздействует на гепсидин, изменяя гомеостаз железа. Вирус иммунодефицита человека может снижать уровень эндогенного гранулоцитарного колониестимулирующего фактора (Г-КСФ). Оппортунистические инфекции, особенно с теми микроорганизмами, которые традиционно приводят к гранулематозному воспалению, включая микобактерии, грибы, паразиты, могут привести к миелофиброзному поражению костного мозга. Хотя распространенность цитопений у ВИЧ-инфицированных снизилась с введением новых препаратов АРТ-терапии, даже полностью контролируемая ВИЧ-инфекция остается фактором риска развития анемии, нейтропении и тромбоцитопении.
ВИЧ, анемия, тромбоцитопения, нейтропения, лейкопения, АРТ
Короткий адрес: https://sciup.org/170199867
IDR: 170199867
Текст научной статьи Цитопенический синдром у ВИЧ-положительных пациентов (анемия, тромбоцитопения, нейтропения, МДС)
Больные ВИЧ-инфекцией относятся к группе повышенного риска развития цитопении [1,2]. Низ- кий уровень CD4+ клеток, более высокая вирусная нагрузка, запущенные стадии заболевания и побочные эффекты лекарственных препаратов, используемых для лечения ВИЧ, являются факторами риска появления цитопении у ВИЧ инфицированных пациентов [3]. При ВИЧ-инфекции цитопенический синдром часто связан с прогрессированием заболевания в стадию СПИД, что сопровождается наличием вторичных инфекций, вызванных бактериальными и грибковыми возбудителями, оппортунистическими вирусами с высокой ранней летальностью (рисунок 1).
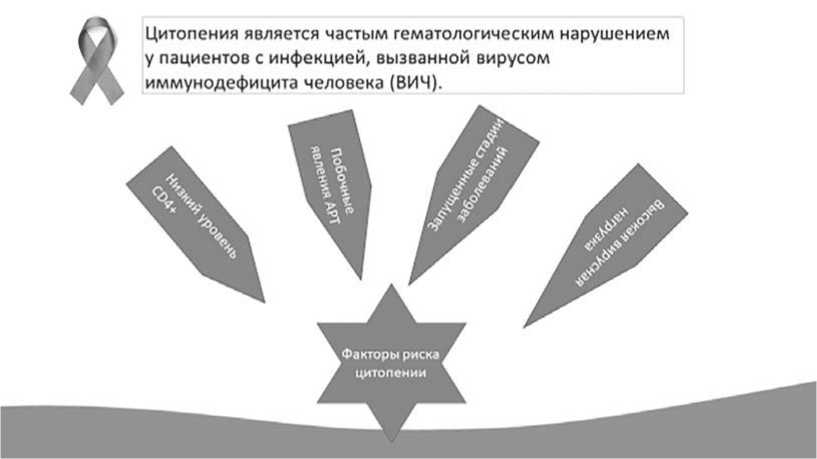
Факторы риска цитопемии
Цитопения является частым гематологическим нарушением у пациентов с инфекцией, вызванной вирусом иммунодефицита человека (ВИЧ).
Рисунок 1. Причины цитопенического синдрома при ВИЧ
ВИЧ-инфекция связана с многочисленными нарушениями кроветворения, воздействуя на все три ростка гемопоэза на уровне стволовых клеток кроветворения, при этом данные об их частоте в настоящий момент остаются противоречивыми. В литературных источниках крайне редко встречаются обзоры исследований гематологических показателей с включением ВИЧ-больных. Это связано со сложностью аккумулирования сведений гематологических проблем при ВИЧ-инфекции. Одним из самых крупных является исследование Пекинской больницы Дитань столичного медицинского университета, в которое с ноября 2004 г. по август 2016 г. было включено 5047 ВИЧ-инфицированных пациентов, находившихся на диспансерном наблюдении после назначения АРТ в отделении инфекционных болезней. Были собраны демографические и клинические данные о пациентах, ранее не получавших АРТ, включая пол, возраст, рост, вес, путь передачи, начальное время лечения АРТ и стадию заболевания по классификации ВОЗ. Лабораторные данные, такие как: абсолютное число нейтрофилов, концентрация гемоглобина, абсолютное количество тромбоцитов и абсолютное количество CD4+ Т-клеток определяли у всех пациентов при включении в исследование. Цитопения была выявлена у 824 (19,1%) пациентов в данной когорте, причем из них у 662 (15,3%) больных была уницитопения, у 144 (3,3%) — бицитопения, у 18 (0,4%) — панцитопения. Среди случаев уницитопении у 287 (6,63%) больных выявлялась изолированная анемия, у 306 (7,7%) — изолированная нейтропения, у 69 (1,6%) — изолированная тромбоцитопения. Среди случаев бицитопении 96 (2,2%) имели анемию и нейтропению, 26 (0,6%) – анемию и тромбоцитопению и 22 (0,5%) – тромбоцитопению и нейтропению. Распространенность цитопении показана на рисунке 2. [2,4].
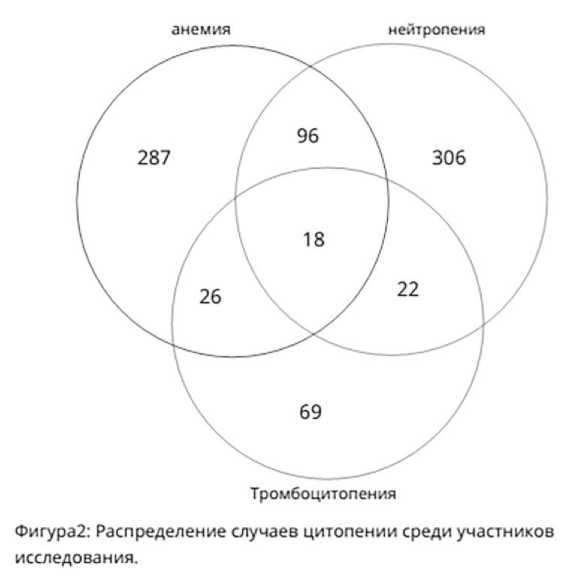
Рисунок 2. Распространенность цитопении
Явное разрешение цитопении наблюдалось в среднем через 24 месяца АРТ. Процент восстановления цитопении показан в таблице 1. Обнаружено, что доля нейтропении, анемии, тромбоцитопении, бицитопении и панцитопении уменьшилась после 6, 12 и 24 месяцев антиретровирусной терапии [4].
Таблица 1
Доля цитопений на исходном уровне и через 6, 12, 24 месяцев антиретровирусной терапии
|
Цитопения |
Исходный уровень |
Через 6 месяцев АРТ |
Через 12 месяцев АРТ |
Через 24 месяцев АРТ |
|
нейтропения |
285 (46,6%) |
97 (18%) |
92 (15,1%) |
69 (11,3%) |
|
анемия |
349 (57,1%) |
91 (14,9%) |
56 (9,2%) |
48 (7,9%) |
|
тромбоцитопения |
118 (19,3%) |
27 (4,4%) |
26 (4,3%) |
15 (2,5%) |
|
уницитопения |
483 (79,1%) |
155 (25,4%) |
133 (21,8%) |
108 (17,7%) |
|
бицитопения |
111 (18,2%) |
21 (3,4%) |
16 (2,6%) |
12 (2%) |
|
панцитопения |
16 (2,6 %) |
6 (1%) |
3 (0,5%) |
1 (0,2%) |
Патогенез влияния ВИЧ на кроветворение
Цитопенический синдром часто может быть обусловлен вторичной дисплазией клеток костного моз-га/периферической крови ВИЧ-инфицированных лиц. Сам ВИЧ может быть ответственен за:
-
1. нарушение кроветворения через прямое инфицирования ГСК-клеток ВИЧ,
-
2. ВИЧ-индуцированный апоптоз ГСК-клеток,
-
3. нарушение оптимального функционирования сети стромальных клеток костного мозга,
-
4. ВИЧ-ассоциированные аутоиммунные реакции;
-
5. ВИЧ-индуцированные изменения в клеточных сигнальных событиях, регулирующих пролиферацию и дифференцировку ГСК-клеток [5].
Нарушение кроветворения через прямую инфекцию ГСК-клеток
Хемокиновый рецептор типа 5 с мотивом CC (CCR5) и хемокиновый рецептор типа 4 с мотивом CXC (CXCR4) представляют собой корецепторы, которые вместе с CD4 обеспечивают опосредованное рецептором проникновение ВИЧ в клетки-хозяина, такие как CD4 +Т-клетки [6]. Поскольку ГСК экспрессируют низкий уровень CD4 и переменные уровни CCR5 и CXCR4, они потенциально восприимчивы к ВИЧ-инфекции. Тем не менее, до сих пор нет единого мнения относительно того, способен ли ВИЧ напрямую инфицировать ГСК. Большинство исследований, в которых изучалась способность ВИЧ инфицировать ГСК, проводились в лабораторных условиях.
Из-за этических и логистических проблем, связанных с получением достаточных объемов аспирата костного мозга от ВИЧ-инфицированных пациентов, ex vivo исследований недостаточно. В изоли- рованном исследовании Редди и соавт. сообщалось, что ВИЧ-1 подтипа С (ВИЧ-1С), но не ВИЧ-1 подтипа В (ВИЧ-1В), может инфицировать ГСК (рисунок 3) [7].
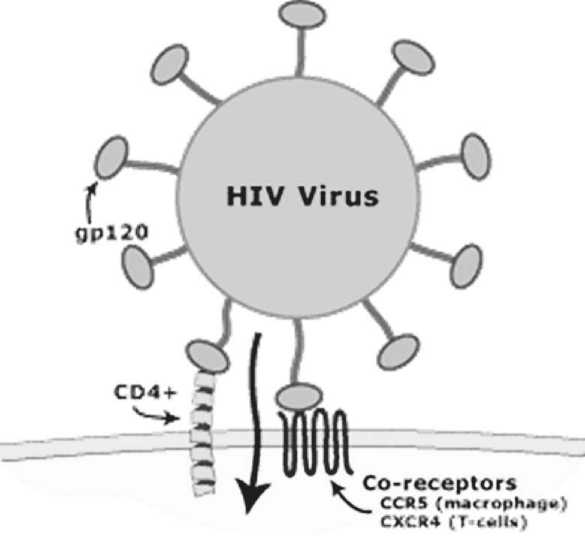
Хемокиновый рецептор типа 5 с мотивом СС (CCR5) и хемокиновый рецептор типа 4 с мотивом CXC(CXCR4} представляют собой корецепторы, которые вместе с CD4 обеспечивают опосредованное рецептором проникновение ВИЧ в клетки-хозяева, такие как CD4 +Т-клетки
Рисунок 3. Инфицирование ГСК вирусом иммунодефицита
ВИЧ-индуцированный апоптоз ГСК-клеток
В нескольких исследованиях показано, что комплексы антитело/вирусный белок, такие как комплексы анти-gp120/gp120, способны с высокой аффинностью связываться с молекулами CD4, экспрессируемыми на поверхности ГСК, и тем самым индуцировать апоптоз через Fas-зависимый механизм. Этот механизм не зависит прямо от ВИЧ-инфицирования ГСК. Вирусные белки, такие как gp120 и Tat, по-видимому, не только играют роль в ВИЧ-опосредованном апоптозе ГСК, но также нарушают пролиферацию ГСК, увеличивая продукцию трансформирующего фактора роста β1 (TGFβ1), негативного регулятора гемопоэза [5].
Нарушение оптимального функционирования сети стромальных клеток костного мозга
Строма костного мозга состоит из гетерогенного пула клеток, включая макрофаги, эндотелиальные клетки, мезенхимальные стромальные клетки и шванновские клетки. Оптимальная микросреда стромы костного мозга необходима для поддержания регуляции, пролиферации и дифференцировки ГСК. ВИЧ-инфекция может приводить к изменениям стромальной структуры костного мозга. Например, в костном мозге ВИЧ-инфицированных, наблюдается повышенное количество фибробластов и макрофагоподобных клеток. Кроме того, макрофаги, ассоциированные с костным мозгом, чувствительны как к CCR5-, так и к CXCR4-тропным штаммам ВИЧ-1 [8]. ВИЧ-инфекция также приводит к изменению муль- типотентного клоногенного потенциала мезенхимальных стромальных клеток, ассоциированных с костным мозгом. Исследования показывают, что мезенхимальные и эндотелиальные клетки, происходящие из костного мозга, могут быть напрямую инфицированы ВИЧ, что приводит к изменению передачи сигналов цитокинов и, следовательно, к гибели ГСК. Эти связанные с ВИЧ изменения в составе стромы костного мозга и в клеточной сигнальной среде приводят к созданию поддерживающей микросреды. В результате возникает нарушение кроветворения [9].
ВИЧ - ассоциированные аутоиммунные реак ции
Основной причиной ВИЧ-ассоциированной иммунной тромбоцитопении является иммуноопос-редованное разрушение тромбоцитов вследствие аутоиммунной реакции, в результате которой антитела против белков оболочки ВИЧ перекрестно реагируют с эпитопом GPIIIa, присутствующим на поверхности тромбоцитов. Также предполагается, что перекрестная реакция между антителами к эритропоэтину (анти-EP1) и вирусным фрагментом Gag-аутоантител приводит к нарушению эритропоэза и последующему проявлению анемии. Опосредованное разрушение эритроцитов может приводить к проявлению аутоиммунной гемолитической анемии (АИГА). Патофизиология ВИЧ-ассоциированного АИГА до конца не выяснена, и было предложено несколько потенциальных механизмов. Предполагае- мые механизмы включают аномальную регуляцию В-клеток ВИЧ-инфицированными Т-клетками, прямую ВИЧ-индуцированную активацию В-клеток и ответ В-клеток на ЦМВ или вирус Эпштейна-Барр. Предполагается, что эти механизмы приводят к ВИЧ-ассоциированному нарушению регуляции выработки антител [10].
ВИЧ - опосредованное нарушение клеточной сигнальной сети
ВИЧ изменяет среду цитокинов в строме костного мозга. Выявляемое ВИЧ-опосредованное нарушение передачи сигналов цитокинов включает различные цитокины и гемопоэтические факторы, такие как интерлейкин (IL)-1, IL-6, IL-18, гранулоцитарный колониестимулирующий фактор (G-CSF) и другие. Эти цитокины играют основную роль в регуляции и поддержании нормального кроветворения, и любой дисбаланс может негативно повлиять на кроветворение. Несколько исследований показали, что профили цитокинов плазмы ВИЧ-инфицированных людей отличаются от профилей неинфицированных людей. В плазме ВИЧ-инфицированных пациентов обнаружены более высокие уровни ИЛ-1, ИЛ-6, ИЛ-7, Г-КСФ и фактора некроза опухоли α (ФНОα). Также было обнаружено, что провоспалительные цитокины ФНОα, ИЛ-1 и ИЛ-6 и хемокины макрофагального воспалительного белка (MIP)-1α, MIP-1β и RANTES активируются в костном мозге ВИЧ-инфицированных одновременно. Это хроническое нарушение регуляции клеточных сигнальных путей оказывает негативное влияние на пролиферацию и дифференцировку ГСК. ВИЧ-инфекция также вызывает снижение эндогенного Г-КСФ, что, в свою очередь, приводит к нарушению пролиферации и дифференцировки GMP, предшественников нейтрофилов, моноцитов и макрофагов. Было обнаружено, что лечение ГКСФ вызывает увеличение количества нейтрофилов и восстановлению функции нейтрофилов у ВИЧ-инфицированных лиц, снижая риск коинфекции у пациентов с нейтропенией [8].
Анемия у ВИЧ - положительных пациентов
Анемия – снижение гемоглобина и/или эритроцитов, самый частый цитопенический синдром, встречаемый в гемограмме ВИЧ-инфицированных больных, нередко сочетается с другими цитопениями. Тяжесть анемии часто используется как показатель неблагоприятного прогноза заболевания независимо от количества CD4+. Однако, это совсем неправильно, поскольку некоторые причины анемии, например, дефицит питательных веществ, не связан с ВИЧ-инфекцией и стадией заболевания. Факторы, вызывающие анемию у ВИЧ-инфицированных, можно условно разделить на три основные категории:
-
1) снижение продукции эритроцитов;
-
2) усиление разрушения эритроцитов;
-
3) неэффективное производство эритроцитов из-за дефицита питательных веществ.
Поэтому несмотря на широкое применение АРТ, анемия, связанная с ВИЧ, остается серьезной проблемой. Однако недавние сообщения указывают на то, что ВИЧ-инфицированные пациенты, находящиеся на АРТ, имеют меньший риск смерти от анемического синдрома [11].
Гематологические аспекты анемии у ВИЧ - положительных пациентов
Анемия у ВИЧ+ часто связана с низким содержанием ретикулоцитов, что свидетельствует о ее гипо-регенеративных свойствах, вследствие угнетения кроветворения в костном мозге. Это подавление является многофакторным, отражая воздействие вирусной инфекции, воспаления, недоедания, злокачественных новообразований и, в некоторых случаях лекарственной токсичности АРТ. В этом контексте ВИЧ нарушает микроокружение костного мозга, что приводит к увеличению уровня воспалительных цитокинов, иммуноглобулинов и белков острой фазы в ответ организма-хозяина на вирусную инфекцию. Дисбаланс цитокинов может по-разному влиять на гемопоэтические клетки-предшественники.
Оппортунистические инфекции у ВИЧ+ являются важной причиной развития анемии, так как некоторые из этих инфекций традиционно связаны с нарушением кроветворения. Бактерии, такие как микобактерии туберкулеза, грибы, паразиты, а также плазмодии часто инфильтрируют костный мозг, нарушая его нормальную архитектуру и подавляя созревание клеток предшественников [15].
Гепатит С, вирусная инфекция Эпштейна-Барр, цитомегаловирусная инфекция и туберкулез также являются инфекциями, при которых часто встречается анемия. Несмотря на то, что это преимущественно гипорегенеративная анемия, гемолиз также может быть причиной развития анемии у ВИЧ+. Образование антиэритроцитарных антител вследствие гипергаммаглобулинемии является основной причиной гемолитической анемии у ВИЧ+, а прямой тест Кумбса положителен у 18% госпитализированных ВИЧ+. Другими причинами гемолитической анемии у ВИЧ+ являются микроангиопатическая гемолитическая анемия и лекарственная анемия у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы [15].
В Африке коинфекция ВИЧ и малярии является основной причиной тяжелой анемии и смертности ВИЧ+. Нормоцитарная нормохромная анемия является наиболее частой; однако в исследованиях также была описана высокая частота макроцитоза (например, обычно связанного с лечением зидовудином). Он может нарушать репликацию ДНК и деление клеток эритробластов, вызывая макроцитоз зрелых эритроцитов. Это явление происходит из-за того, что зидовудин конкурирует с природными дезоксинуклеозидтрифосфатами за связывание с обратной транскриптазой и за включение во вновь синтезированные вирусные нити ДНК, ингибируя вирусную обратную транскриптазу и клеточную ДНК-полимеразу млекопитающих. Развитие макро-цитоза у ВИЧ+ может свидетельствовать о соблюдении режима антиретровирусной терапии зидовудином [16,17].
Несмотря на то, что лечение повышает уровень гемоглобина, даже у пациентов, получающих АРТ, может длительно персистировать анемический синдром без каких-либо отчетливых клинических симптомов. Крайне важно обеспечить регулярное проведение общего анализа крови у всех пациентов, чтобы контролировать прогрессирование анемии и планировать как диагностические, так и лечебные опции для снижения потенциальных рисков, связанных с этим сопутствующим заболеванием. Кроме того, выбор АРТ имеет важное значение для предотвращения развития анемии, учитывая, что схемы на основе зидовудина показали возможную связь с анемическим состоянием. Поскольку низкий гемоглобин является установленным неблагоприятным прогностическим маркером, своевременное выявление анемии может привести к улучшению качества жизни и уменьшению смертности пациентов с ВИЧ-инфекцией.
Лечение анемии у ВИЧ - больных
В настоящее время для коррекции анемии при различных состояниях используются три терапевтические стратегии:
-
1. Препараты железа, фолиевая кислота, витамин В12
-
2. Эритропоэз-стимулирующие агенты (эритропоэтины)
-
3. Гемотрансфузии
В отношении ВИЧ-инфекции нет исследований, в которых бы на статистически значимой выборке больных изучалась эффективность лечения анемии каким-либо из представленных выше подходов. Терапия должна быть полностью ориентирована как на патогенез анемического синдрома, так и, самое главное, на уровень гемоглобина и эритроцитов. С учетом представленных данных о патогенезе анемии у этой категории больных правильным будет утверждение о том, что прежде всего необходимо оценить, какая именно анемия развилась у каждого конкретного больного: АХЗ (функциональный дефицит железа) или ЖДА (абсолютный дефицит железа). В случае развития анемии легкой степени тяжести в большинстве случаев достаточно применения специфической АРТ для увеличения концентрации гемоглобина [18-20].
Тромбоцитопения у ВИЧ - положительных па циентов
Тромбоцитопения очень часто является первым гематологическим проявлением ВИЧ-инфекции. Степень выраженности тромбоцитопении может меняться в зависимости от CD4+, возраста, наличия коинфекции ВГС/ВГВ, оппортунистических инфекций и схемы АРТ. Возникновение тромбоцитопении является предиктором тяжести заболевания и более высокой летальности у ВИЧ+ пациентов (рисунок 4).
Аутоиммунизация через GPIIIa тромбоцитов и др120 и р24 ВИЧ
Миелосупрессия на фоне APT и сопутствующей терапии
Прямое инфицирование СК и мегакариоцитов
Рисунок 4. Гематологические аспекты и причины тромбоцитопении у ВИЧ-положительных (ВИЧ+)
(thrombocyte)
Причины снижения тромбоцитов у ВИЧ+ многофакторны и могут возникать в результате разрушения тромбоцитов или снижения их продукции [21]. Исследование, проведенное в Бразилии с участием 55 ВИЧ+ пациентов с тромбоцитопенией, показало, что у 63,6% пациентов была идиопатическая тромбоцитопеническая пурпура, а у 25,5% – недостаточность продукции тромбоцитов, в обоих случаях вторичная по отношению к ВИЧ-инфекции [22].
Периферическое разрушение обычно происходит в начале инфекции из-за перекрестной реактивности между гликопротеином 120 в оболочке вируса и гликопротеином IIIa тромбоцитов. Эта перекрестная реактивность антител способствует захвату и лизису тромбоцитов в ретикулоэндотелиальной системе селезенки или раннему апоптозу, что приводит к иммунной тромбоцитопении. Исследование, проведенное в Канаде, показало, что у 0,6% ВИЧ+ развилась тяжелая иммунная тромбоцитопеническая пурпура, из них у 55% было клиническое кровотечение, а 33,3% ранее не получали АРТ [23].
Точно так же 5% ВИЧ+ имели антитромбоцитар-ные антитела в крупном исследовании, проведенном в Уганде [24].
Напротив, снижение продукции тромбоцитов обычно происходит на более поздних стадиях СПИДа. Мегакариоциты в костном мозге экспрессируют рецепторы CD4 и корецепторы, необходимые для ВИЧ-инфекции, и клинические исследования показывают, что мегакариоциты интернализуют ВИЧ и экспрессируют вирусную РНК.В результате ВИЧ-инфекции незрелые мегакариоциты снижают экспрессию рецептора тромбопоэтина. Таким образом, созревание мегакариоцитов нарушается из-за нарушения сигналинга колониеобразующих единиц роста мегакариоцитов [25].
ВИЧ-инфицированные мегакариоциты также демонстрируют морфологические изменения и повышенную скорость апоптоза [26].
Коинфекция вирусами гепатита С (ВГС) и В (ВГВ) также может вызывать тромбоцитопению у ВИЧ+ из-за возможного поражения печени, ответственного за снижение продукции тромбопоэтина. Исследование, проведенное с участием 38 ВИЧ+ больных, показало, что у пациентов с нормальным количеством тромбоцитов уровень тромбопоэтина в сыворотке был выше, чем у пациентов с тяжелой тромбоцитопенией. Кроме того, все пациенты с тяжелой тромбоцитопенией дали положительный результат на антитела к ядерному антигену вируса гепатита В [27].
Учитывая, что тромбоцитопения может быть первым гематологическим проявлением ВИЧ-инфекции и тесно связана с развитием СПИДа, количество тромбоцитов может предсказать эволюцию бессимптомной ВИЧ-инфекции в СПИД. Мониторинг развития тромбоцитопении еще более важен у ВИЧ+ с коинфекциями ВГС и ВГВ, поскольку они могут усугублять тромбоцитопению у этих пациентов. Охват АРТ выступает как независимый фактор профилактики тромбоцитопении, что оправдывает универсальное лечение всех ВИЧ+.
Лечение тромбоцитопении у ВИЧ - больных
Несмотря на то, что в литературе описаны случаи спонтанной нормализации количества тромбоцитов у обсуждаемой категории пациентов, данное явление рассматривается как достаточно нередкое, а сама тромбоцитопения требует при наличии геморрагического синдрома активного терапевтического вмешательства [28].
Связь количества тромбоцитов с клиническими проявлениями позволяет прогнозировать возможность выполнения медицинских манипуляций при тромбоцитопении (таблица 2).
Таблица 2
Связь количества тромбоцитов с клиническими проявлениями
|
Количество тромбоцитов |
Значение |
|
≥100 х 109/л |
Полностью обеспечивает гемостаз. Позволяет проводить оперативные вмешательства и родоразрешение без риска кровотечений |
|
>50 х 109/л |
Безопасная концентрация тромбоцитов. Отсутствие спонтанного геморрагического синдрома. При появлении признаков кровоточивости при данном количестве тромбоцитов следует искать дополнительные провоцирующие факторы или учитывать наличие сосудистой патологии у пациентов преклонного возраста |
|
30-50 х 109/л |
Терапия проводится только при наличии геморрагического синдрома |
|
<10 х 109/л |
Критический для развития опасных для жизни геморрагических проявлений уровень тромбоцитов. Пациенты с такой тромбоцитопенией нуждаются в безотлагательной терапии, независимо от степени клинических проявлений геморрагий |
Принципиальным отличием терапевтического подхода при ВИЧ-ассоциированной тромбоцитопении является приоритетность антиретровирусной терапии. Эффективность данного подхода объясняется различными механизмами влияния АРТ препаратов на тромбоцитопению. При неэффективности или недостаточной эффективности АРТ, при исключении других механизмов тромбоцитопении, а также при отсутствии отшнуровки тромбоцитов в костном мозге при увеличенном количестве мегакариоцитов, выявлении тромбоцит-ассоциирова-ных антител в качестве второй линии терапии выступают стандартные для лечения ИТП препараты: глюкокортикостероиды и ВВИГ. В данном качестве могут применяться преднизон или преднизолон из расчета 0,5-1 мг/кг/сутки перорально 2-3 недели с последующей постепенной отменой в течение 3-4 недель. Альтернативной схемой применения ГКС является высокодозная терапия дексаметазоном 40 мг перорально или внутривенно 1-4 дни, в сумме до 4 циклов с промежутками в 2-4 недели между циклами. При проведении данной схемы терапии обязательно нужно предварительное исключение активных оппортунистических инфекций с поражением легочной ткани, туберкулеза, предварительное исследование иммунологического статуса и вирусной нагрузки. Учитывая иммуносупрессивный эффект ГКС, у ВИЧ-положительных пациентов рекомендуется их применение в минимальной эффективной дозе.
При неэффективности стандартной терапии могут применяться агонисты тромбопоэтиновых рецепторов – тромбопоэтина (миметики тромбо-поэтина), ромиплостим (Энплейт) и элтромбопаг (Револейд). Миметики тромбопоэтина – препараты неиммуносупрессивного действия, стимулирующие выработку тромбоцитов за счет активации рецепторов к тромбопоэтину на тромбоцитах и мегакариоцитах. Элтромбопаг является агонистом рецепторов, которые локализуются не только на мегакариоцитах и тромбоцитах, но и на стволовых клетках крови. Связывается с трансмебранным доменом тромбопоэтиновых рецепторов, не конку- рируя с эндогенным тромбопоэтином, и обладает иммуномодулирующими свойствами посредством активации Т-регуляторных клеток. Рекомендации относительно дозировки ромиплостима установлены в пределах 1-10 мкг/кг/неделю подкожно с началом терапии с минимальной дозы с необходимостью ее дальнейшего титрования в зависимости от количества тромбоцитов.
Нейтропения у ВИЧ - положительных пациен тов
Широкий диапазон частоты нейтропении, связанной с ВИЧ, вероятно, обусловлен тяжестью ВИЧ-инфекции и использованием профилактических препаратов, таких как ко-тримоксазол, который, как известно, вызывает супрессию костного мозга за счет ингибирования метаболизма фолиевой кислоты. Низкое количество CD4 Т-клеток и высокая вирусная нагрузка ВИЧ в плазме являются факторами риска развития нейтропении. Таким образом, нейтропения особенно распространена у лиц с прогрессирующим заболеванием и обычно связана с другими цитопениями, т.е., бицитопе-нией и панцитопенией. Кроме того, тяжесть нейтропении связана с риском оппортунистической коинфекции. Доброкачественная этническая нейтропения широко распространена среди лиц африканского происхождения. Таким образом, у лиц с низким числом нейтрофилов (<2500 клеток/ мкл) следует исключить этническую нейтропению [29,30].
Гематологические аспекты и причины ней тропении у ВИЧ - положительных ( ВИЧ +)
Патогенез нейтропении при ВИЧ многогранен: прямое и опосредованное миелосупрессивное действие ВИЧ и оппортунистических инфекций, таких как цитомегаловирус, Mycobacteriumavium, Histoplasma. Лейкемизация костного мозга опухолевыми лимфоцитами при лимфопролиферативных заболеваниях, частота которых повышается при наличии положительного ВИЧ статуса. Возможное миелосупрессивное действие медикаментов, применяемых при терапии ВИЧ и сопутствующих данному диагнозу состояний, и т.д. [31].
Главный механизм возникновения нейтропении при ВИЧ объясняется тропностью данного вируса к гемопоэтическим CD34+ клеткам, экспрессирующим CD4, CXCR4, CCR5, которые являются рецепторами для ВИЧ-1, с нарушением процессов их дифференцировки и индукцией апоптоза. Происходит стимуляция синтеза таких цитокинов, как ФНО-альфа, ИЛ-1, трансформирующий фактор бета, обладающих супрессивным действием на гра-нулопоэз. Также доказана ингибирующая клетки-предшественники роль антител к вирусному гликопротеину gp120. Немаловажная роль отводится инфицированию ВИЧ клеток микроокружения в костном мозге, критически важных для нормального гемопоэза. С прогрессией инфекции растет также дисфункция нейтрофилов. Отмечено снижение синтеза супероксидных анионов, нарушение процесса дегрануляции, ослабление хемотаксиса и фагоцитоза, необходимых для адекватной антибактериальной активности нейтрофилов. Точные механизмы данных явлений до конца не установлены [32].
Цитомегаловирус (ЦМВ), подобно ВИЧ, напрямую может инфицировать клетки-предшественники гемопоэза, снижая их чувствительность к факторам роста. Дополнительно моноциты, поражённые ЦМВ, синтезируют вышеупомянутый ИЛ-1, имеющий миелосупрессивный эффект. Подобное действие в также характерно для Mycobacterium avium и Mycobacterium intracellulare [33].
Ганцикловир, фоскарнет и цидофовир хорошо известны своим миелосупрессивным потенциалом. В исследовании с 320 участниками, принимавшими ганцикловир из расчёта 3 г/кг массы тела, у 54% имела место нейтропения. Аналогичные данные (66% из 750 исследуемых) были получены при внутривенной терапии данным агентом. Ко-тримоксазол, часто применяемый для антибактериальной профилактики и терапии уже имеющейся бактериальной инфекции, вызывает миелосупрессию примерно у половины получающих его пациентов [34,35].
Таким образом, можно выделить пациентов с высоким риском нейтропении в зависимости от наличия нижеперечисленных критериев (таблица 3).
Таблица 3
Факторы , увеличивающие риск развития нейтропении
Зидовудин-содержащая АРТ
Наличие активной оппортунистической инфекции
Наличие ганцикловира и/или ко-тримоксазола в схеме лечения
Чрезмерное употребление алкоголя
Наличие злокачественного новообразования, связанного с ВИЧ-инфекцией
Наличие сопутствующего аутоиммунного заболевания
Лечение нейтропении у ВИЧ-больных
Приоритетной терапевтической рекомендацией относительно нейтропении у ВИЧ-положительных пациентов является АРТ. При этом предпочтительным является выбор линии терапии, не содержащей зидовудин. В норме Г-КСФ играет главную роль в поддержании гомеостаза гранулоцитов, также будучи центральным фактором при развитии лейкоцитоза инфекционных и воспалительных процессов. Помимо чисто стимулирующего пролиферацию эффекта, молекула также оказывает активирующее действие на хемотаксис, адгезию, метаболизм кислорода, фагоцитоз и т.д. Данные эффекты особенно примечательны, так как потеря нейтрофилами их качественных свойств при инфицировании ВИЧ играет важную роль в повышении риска бактериемий. Учитывая положительное влияние на качественную и количественную стороны нейтропении, применение Г-КСФ выглядит очевидным. Другим стимулирующим агентом с аналогичным в отношении нейтрофилов действием является гранулоцитарный макрофагальный колониестимулирующий фактор (ГМ-КСФ) [36,37].
ВИЧ и миелодиспластический синдром
Миелодиспластический синдром (МДС) – поражение костного мозга, связанное с неэффективным кроветворением, цитопениями и склонностью к трансформации в острый миелоидный лейкоз. Наблюдая значительное количество необъяснимых двух/трехлинейных цитопений у пациентов с ВИЧ, связь между заболеваниями остается неясной из-за недостатка данных в литературе.
У ВИЧ-инфицированных часто проявляется цитопения, особенно на фоне неконтролируемой виремии и хронических инфекций. До появления антиретровирусной терапии (АРТ) анемия, нейтропения и тромбоцитопения отмечались примерно у 70%, 50% и 40% больных СПИДом соответственно. Несмотря на то, что частота цитопений значительно снизилась в эпоху высокоактивной АРТ, она по-прежнему является частой находкой у ВИЧ-позитивных пациентов. На самом деле, МДС является наиболее распространенной причиной необъяснимой цитопении и диагностируется с большей частотой из-за включения секвенирования и других генетических тестов во время диагностической работы. Известно также, что ВИЧ связан с развитием диспластических изменений в костном мозге, но причина и исходы этих случаев до конца не изучены [38-40].
В одноцентровом исследовании в Медицинском центре Монтефиоре (MMC) в период с 1997 по 2016 год была проанализирована самая большая группа ВИЧ-инфицированных пациентов с МДС, о которой сообщалось на сегодняшний день, и изучено клиническое значение соматических мутаций при молекулярном анализе у ВИЧ-инфицированных пациентов [41].
Этот ретроспективный анализ показывает, что ВИЧ является плохим прогностическим признаком у пациентов, у которых впоследствии развивался МДС. Пациенты с ВИЧ, у которых диагносцировали МДС в более молодом возрасте, имеют худший общий прогноз, более высокий риск трансформации в ОМЛ, более быструю трансформацию из МДС в ОМЛ и повышенную распространенность соматических мутаций с более высоким риском и цитогенетических изменений. Кроме того, несмотря на то что они были моложе и изначально подходили для интенсивной химиотерапии, ни один из пациентов не получил терапии с лечебной целью, такой как ТГСК.
Мы заметили, что высокая доля ВИЧ+ пациентов, у которых развивается МДС, имеет делецию хромосомы 7 либо отдельно, либо как часть сложного кариотипа. Существует несколько патофизиологических гипотез, объясняющих развитие ОМЛ или МДС у ВИЧ-инфицированных пациентов [42,43].
Поскольку ВИЧ сопровождается воспалительной средой стромы костного мозга, вполне возможно, что эта микросреда способствует росту и развитию клеток, инициирующих МДС, и приводит к клиническим проявлениям в более молодом возрасте. Клональный гемопоэз с приобретением соматических мутаций, который обычно происходит с возрастом, также вовлечен в развитие МДС. Давно предполагалось, что у пациентов с ВИЧ наблюдается ускоренное старение и, таким образом, развивается больше сопутствующих заболеваний, чем можно было бы ожидать для их возраста. ВИЧ-инфицированные пациенты с МДС имеют повышенный риск соматических мутаций высокого риска, включая ASXL1, TP53 и DMNT3A, а также высокую и быструю скорость трансформации в ОМЛ, что указывает на необходимость дальнейшего анализа, включая более масштабные эпидемиологические исследования [44].
Обсуждение
Анализируя исследования, посвященные изучению цитопении при ВИЧ, мы обнаружили, что АРТ – это эффективный метод лечения цитопенического синдрома. Наряду с восстановлением CD4+ Т-клеток, уровни клеток крови (нейтрофилов, тромбоцитов и эритроцитов) также повышались. Женский пол, низкий уровень CD4+ Т-клеток (исходно), продвинутая стадия и коинфекция ВГВ были факторами риска развития персистирующей цитопении после на- чала АРТ, что свидетельствует о важности раннего начала терапии у пациентов с цитопенией при ВИЧ-инфекции. Было проведено большое количество исследований распространенности анемии, тромбоцитопении, лейкопении и нейтропении, которые показали, что у ВИЧ-1-инфицированных пациентов более часто наблюдается снижение двух или трех линий клеток крови. Панцитопения была связана с более высокой смертностью. Наиболее распространенным типом цитопении является уницитопения, за которой следуют бицитопения и панцитопения. Среди уницитопений нейтропения наиболее распространенная цитопения, а нейтропения и анемия более распространенные бицитопении.
CD4 <200 клеток, поздняя клиническая стадия ВОЗ, более высокая вирусная нагрузка ВИЧ, возраст ≥40 лет, и коинфекция ВГВ на исходном уровне оцениваются как факторы риска цитопениче-ского синдрома и после начала АРТ. Связь низкого количества клеток CD4 с цитопенией может быть объяснена влиянием ВИЧ на функцию ранних гемопоэтических клеток-предшественников. Исследования показывают, что доля нейтропении, анемии и тромбоцитопении уменьшается после комплаентного шестимесячного приема АРТ. Разрешение цитопении у большинства пациентов связано с восстановлением уровня CD4+ Т-клеток, что указывает на то, что подавление вируса и иммунологическое восстановление могут способствовать нормализации клеток крови. Низкий уровень CD4+ Т-клеток и поздняя стадия перед началом АРТ являются предикторами персистирующей цитопении после 24 месяцев АРТ.
Даже в эпоху широко распространенной антиретровирусной терапии у 35% ВИЧ-инфицированных пациентов выявляется анемический синдром. До 18% ВИЧ-инфицированных пациентов могут иметь положительную пробу Кумбса, но клинически значимая аутоиммунная гемолитическая анемия встречается редко. Дефицит витамина B12 может возникнуть у 30% пациентов, вероятно, в результате нарушений, связывающих B12 белков и транспорта в сыворотке. Положительный прямой антиглобулиновый тест может быть у трети ВИЧ-инфицированных и связан с анемией, особенно при более поздних стадиях ВИЧ-инфекции. Инфекция парвовирусом B19 может вызывать преходящую эритроцитарную аплазию или хроническую анемию у ВИЧ-инфицированных лиц из-за неспособности вырабатывать нейтрализующие антитела. Диагноз парвовирусной инфекции необходимо заподозрить при длительно сохраняющейся нормоцитарной анемии с отсутствием ретикулоцитов и подтвердить с помощью ПЦР-анализа. При железодефицитной анемии желательно выполнить исследование на скрытую кровь в кале, наличие которой может свидетельствовать о опухолевом поражении желудочно-кишечного тракта.
Макроцитарные анемии при СПИДе нередко являются результатом хронического заболевания печени, связанного с хроническим алкоголизмом или гепатитом, особенно при инъекционном употреблении наркотиков. Иногда они также могут быть результатом использования препаратов, действующих как антагонисты фолиевой кислоты (триметоприм сульфаметоксазол).
Определяется повышенная частота диагностирования тромбоцитопении с числом тромбоцитов <150 000/мкл у пациентов с ВИЧ-инфекцией, но менее 1% из них имеют тяжелую ВИЧ ассоциированную тромбоцитопению с числом тромбоцитов <50 000/мкл. Риск появления тромбоцитопении увеличивается с уменьшением числа лимфоцитов CD4+. Снижение тромбоцитов редко бывает достаточно серьезным, чтобы вызвать спонтанное кровотечение.
Нейтропения, как правило, прогрессирует по мере увеличения продолжительности ВИЧ-инфекции. Нейтропения часто является частью панцитопении у ВИЧ-инфицированных пациентов. Абсолютная нейтропения <1000/мкл, часто со сдвигом влево, наиболее вероятна, когда количество CD4+ снижается до 30/мкл. Хотя эпизоды нейтропении обычно длятся <2 недель, надир может достигать 500/мкл почти в половине случаев. У части пациентов нейтропения может возникать на ранних стадиях ВИЧ-инфекции и увеличивает риск заражения оппортунистическими инфекциями, что ухудшает прогноз заболевания.
Раннее начало АРТ и комплексный мультидисци-плинарный подход к лечению ВИЧ-инфекции способствуют восстановлению подавленного иммуни- тета и, чаще всего, уменьшают степень цитопении.
Заключение
Тяжесть цитопений (за исключением тромбоцитопении) у пациентов, инфицированных ВИЧ, обычно связана с прогрессирующей стадией заболевания. Таким образом, клиницисты должны иметь высокий индекс подозрения на возможную ВИЧ-инфекцию у любого пациента с цитопенией. Причина цитопений на фоне ВИЧ-инфекции обычно многофакторная. У пациентов без лихорадки и с бессимптомным течением заболевания причиной цитопенического синдрома может быть сам ВИЧ. Предполагаемые механизмы ВИЧ-нарушения кроветворения включают механизмы, не связанные с взаимодействием ВИЧ (например, вызванные лекарственными препаратами и/или коинфекцией), косвенное влияние ВИЧ на ГСК (например, вызванные ВИЧ изменения в цито-киновой сигнальной среде) и механизмы, в которых ВИЧ непосредственно воздействует на функционирование и выживаемость ГСК (например, прямое инфицирование ГСК ВИЧ). Диагностические исследования цитопений должны быть рациональными, с тщательным использованием анамнеза и клинического обследования вместе с логичным пошаговым использованием лабораторных тестов до того, как будет рассмотрен вопрос о взятии образцов костного мозга. Наконец, необходимы дальнейшие исследования для выяснения взаимодействия между ВИЧ и ГСК. Лучшее понимание этих взаимодействий может способствовать раскрытию потенциала генетически модифицированных клеточных методов лечения пациентов, инфицированных ВИЧ.
Список литературы Цитопенический синдром у ВИЧ-положительных пациентов (анемия, тромбоцитопения, нейтропения, МДС)
- Pathology of HIV/AIDS 33rd Edition by Edward C. Klatt, MD Professor of Pathology Department of Biomedical Sciences Mercer University School of Medicine Savannah, Georgia, USA May 24, 2022.
- Lina Fan., Cuilin Li., Hongxin Zhao. Prevalence and Risk Factors of Cytopenia in HIV-Infected Patients before and after the Initiation of HAART // BioMed Research International. – 2020. Article ID 3132589. https://doi.org/10.1155/2020/3132589.
- Kyeyune R., Saathoff E., Ezeamama A. E. et al. Prevalence and correlates of cytopenias in HIV-infected adults initiating highly active antiretroviral therapy in Uganda // BMC Infectious Diseases. – 2014. – Vol. 14, N 1. – P. 496.
- Tamir Z., Alemu J., Tsegaye A. Anemia among HIV infected individuals taking art with and without zidovudine at Addis Ababa, Ethiopia // Ethiopian Journal of Health Sciences. – 2018. – Vol. 28, N 1. – P. 73–82.
- Durandt C., Potgieter J.C., Mellet J. et al. HIV and haematopoiesis // S Afr Med J. – 2019. – Vol. 109, N 8b. – P. 40-45.
- Alkhatib G. The biology of CCR5 and CXCR4 // Curr Opin HIV AIDS. – 2009. – Vol. 4, N 2. – P. 96-103.
- Avalos R., Essex M. Infection of hematopoietic progenitor cells by HIV-1 subtype C, and its association with anemia in southern Africa // Blood. – 2007. – Vol. 110, N 9. – P. 3143-3149.
- Gill V., Shattock R.J., Freeman A.R. et al. Macrophages are the major target cell for HIV infection in long term marrow culture and demonstrated dual susceptibility to lymphocytotropic and monocytotropic strains of HIV-1 // Br J Haematol. – Vol. 1996. – Vol. 93, N 1. – P. 30-37.
- Isgro A., Audi A., Leti W. et al. Immunodysregulation of HIV disease at bone marrow level // Autoimmune Rev. – 2005. – Vol. 4, N 8. – P. 486-490.
- Saif M.W. HIV-associated autoimmune hemolytic anemia: An update // AIDS Patient Care STDS. – 2001. – Vol. 15, N 4. – P. 217-224.
- Marchionatti A., Parisi M.M. Anemia and thrombocytopenia in people living with HIV/AIDS: a narrative literature review // Int Health. – 2021. – Vol. 13, N 2. – P. 98-109.
- Madzime M., Rossouw T.M., Theron A.J., Anderson R. Steel HC. Interactions of HIV and Antiretroviral Therapy With Neutrophils and Platelets // Front Immunol. – 2021. – Vol. 12. Published online 2021 Mar 12. doi: 10.3389/fimmu.2021.634386
- Paltiel O., Falutz J., Veilleux M., Rosenblatt D.S., Gordon K. Clinical correlates of subnormal vitamin B12 levels in patients infected with the human immunodeficiency virus // Am J Hematol. – 1995. – Vol. 49, N 4. – P. 318–322.
- Obirikorang C., Issahaku R.G., Osakonor D.N., Osei-Yeboah J. Anaemia and iron homeostasis in a cohort of HIV-infected patients: a cross-sectional study in Ghana // AIDS Res Treat. - 2016; 2016: 1623094. Published online 2016 Mar 22. doi: 10.1155/2016/1623094
- Volberding P.A., Levine A.M., Dieterich D. et al. Anemia in HIV infection: clinical impact and evidence-based management strategies // Clin Infect Dis. – 2004. – Vol. 38, N 10. – P. 1454–1463.
- Sanyaolu A.O., Fagbenro-Beyioku A.F., Oyibo W.A., Badaru O.S., Onyeabor O.S, Nnaemeka C.I. Malaria and HIV co-infection and their effect on haemoglobin levels from three health-care institutions in Lagos, southwest Nigeria // Afr Health Sci. – 2013. – Vol. 13, N 2. – P. 295–300.
- Adediran A., Osunkalu V., Wakayama T. et al. Impact of HIV infection and zidovudine therapy on RBC parameters and urine methylmalonic acid levels // Interdisciplinary Perspectives on Infectious Diseases. - 2016;2016:5210963. Published online 2016 Feb 24. doi: 10.1155/2016/5210963
- Henry D.H., Dahl N.V., Auerbach M., Tchekmedyian S., Laufman L.R. Intravenous ferric gluconate significantly improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy // Oncologist. – 2007. – Vol. 12, N 2. – P. 231–242.
- O’Lone E.L., Hodson E.M., Nistor I., Bolignano D., Webster A.C., Craig J.C. Parenteral versus oral iron therapy for adults and children with chronic kidney disease. Cochrane Database Syst Rev 2019;2:CD007857.
- Анемии. Краткое руководство для практических врачей всех специальностей / под. ред. О.А. Рукавицына. – 2-е изд., перераб. и доп. – Москва: ГЭОТАР-Медиа, 2021. – 352 с.
- Vishnu P., Aboulafia D.M. Haematological manifestations of human immune deficiency virus infection // Br J Haematol. – 2015. – Vol. 171, N 5. – P. 695–709.
- Nascimento F.G., Tanaka P.Y. Thrombocytopenia in HIV-infected Patients // Indian J Hematol Blood Transfus. – 2012. – Vol. 28, N 2. – P. 109–111.
- Ambler K.L,Vickars L.M., Leger C.S. Clinical features, treatment, and outcome of HIV-associated immune thrombocytopenia in the HEART Era // Adv Hematol. – 2012; 2012:910954. Published online 2012 May 28. doi: 10.1155/2012/910954
- Taremwa IM, Muyindike WR, Muwanguzi E, Bouml, 2nd Natukunda B. Prevalence of HIV-related thrombocytopenia among clients at Mbarara Regional Referral Hospital, Mbarara, southwestern Uganda // J Blood Med. – 2015 Vol. 6. – P. 109–113.
- Gibellini D, Clara, Moroni S, Miserocchi A, PontiC, Re MC. Effects of human immunodeficiency virus on the erythrocyte and megakaryocyte lineages. World J Virol. 2013;2(2):91–101.
- Scaradavou A. HIV-related thrombocytopenia // Blood Rev. – 2002. – Vol. 16, N 1. – P. 73–76.
- Ciernik I.F., Cone R.W., Fehr J., Weber R. Impaired liver function and retroviral activity are risk factors contributing to HIV-associated thrombocytopenia // Swiss HIV Cohort Study AIDS. – 1999. – Vol. 13, N 14. – P. 1913–1920.
- Neunert C., Terrell D.R., Arnold D.M. et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia // Blood Adv. – 2019. – Vol. 3, N 23. – P. 3829-3866.
- Katembe C., Muzoo R., Muwanguzi E. et al. Hematological abnormalities in HIV-antiretroviral therapy naïve clients as seen at an immune suppression syndrome clinic at Mbarara Regional Referral Hospital, southwestern Uganda // J Blood Mud. – 2018. – Vol. 9. – P. 105-110.
- Ramsuran V., Kulkarni H., He W. et al. Duffy-null–associated low neutrophil counts influence HIV-1 susceptibility in high-risk South African black women // Clin Infect Dis. – 2011. – Vol. 52, n 10. – P. 1248- 1256.
- Shi X., Sims M.D., Hanna M.M. et al. Neutropenia during HIV infection: adverse consequences and remedies // Int Rev Immunol. – 2014. – Vol. 33, N 6. – P. 511-536.
- Pitrak D.L., Bak P.M., DeMarais P., Novak R.M., Andersen B.R. Depressed neutrophil superoxide production in human immunodeficiency virus infection // J Infect Dis. – 1993. – Vol. 167, N 6. – P. 1406-1410.
- Hakawi A.M., Alrajhi A.A. Tuberculosis of the bone marrow: clinicopathological study of 22 cases from Saudi Arabia // Int J Tuberc Lung Dis. – 2006. – Vol. 10. – P. 1041–1044.
- Jaresko G.S. Etiology of neutropenia in HIV-infected patients // Am J Health Syst Pharm. – 1999. – Vol. 56, Suppl 5. – P. S5-S8.
- Rubinstein D.B., Farrington G.K., O’Donnell C. et al. Autoantibodies to leukocyte alphaMbeta2 integrin glycoproteins in HIV infection // Clin Immunol. – 1999. – Vol. 90. – P. 352–359.
- Hermans P, Rozenbaum W, Jou A, et al. Filgrastim to treat neutropenia and support myelosuppressive medication dosing in HIV infection. G-CSF 92105 Study Group. AIDS. 1996; 10:1627–1633. [PubMed: 8970682]
- Kuritzkes D.R., Parenti D., Ward D.J. et al. Filgrastim prevents severe neutropenia and reduces infective morbidity in patients with advanced HIV infection: results of a randomized, multicenter, controlled trial. G-CSF 930101 StudyGroup // AIDS. – 1998. – Vol. 12, N 1. – P. 65-74.
- Firnhaber C., Smeaton L., Saukila N. et al. Comparisons of anemia, thrombocytopenia, and neutropenia at initiation of HIV antiretroviral therapy in Africa, Asia, and the Americas // Int J Infect Dis. – 2010. – Vol. 14. – P. e1088–e1092.
- Aiswal S., Fontanillas P., Flannick J. et al. Age-related clonal hematopoiesis associated with adverse outcomes // N Engl J Med. – 2014. – Vol. 371. – P. 2488–2498.
- Chelucci C, Hassan HJ, Locardi C, et al. In vitro human immunodeficiency virus-1 infection of purified hematopoietic progenitors in single-cell culture // Blood. – 1995. – Vol. 85. – P. 1181–1187.
- Kaner J.D., Thibaud S., Jasra S. et al. HIV portends a poor prognosis in myelodysplastic syndromes // Leukemia & Lymphoma. – 2019. – Vol. 60. https://doi.org/10.1080/10428194.2019.1633631.
- Woll P.S., Chowdhury O. et al. Myelodysplastic syndromes are propagated by rare and distinct human cancer stem cells in vivo // Cancer Cell. – 2014. – Vol. 25. – P. 794–808.
- Jan M., Snyder T.M., Corces-Zimmerman M.R. et al. Clonal evolution of preleukemic hematopoietic stem cells precedes human acute myeloid leukemia // Sci Transl Med. -2012. – Vol. 4. – P. 149- 158.
- De Francesco D., With F.W., Burkle A. et al. Do people living with HIV experience greater age advancement than their HIV-negative counterparts? // AIDS. – 2019. – Vol. 33. – P. 259–268.


