Диагностика рака предстательной железы
Автор: Теврюкова Н.С., Богатырев В.Н., Очиргоряев А.Б.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (32), 2009 года.
Бесплатный доступ
Представлены результаты исследования уровня простатоспецифического антигена 2279 пациентов. Уровень ПСА более 4 ng/ml явился показанием к проведению трансректальной пункционной биопсии простаты. Цитологическое исследование полученного материала проведено у 194 (8,5 %) больных, при этом рак предстательной железы диагностирован в 145 (74,7 %), доброкачественная гиперплазия предстательной железы - в 49 (25,3 %) случаях. Выявленный рак предстательной железы был представлен аденокарциномой разной степени дифференцировки. Проведено исследование плоидности опухолевых клеток из архивного материала у 23 больных РПЖ. Преобладали анеуплоидные опухоли (76,0 %), более половины (64,8 %) из них содержат свыше 70 % анеуплоидных клеток
Рак предстательной железы, простатоспецифический антиген, цитологическая диагностика, плоид- ность и пролиферативная активность опухолевых клеток
Короткий адрес: https://sciup.org/14055135
IDR: 14055135 | УДК: 616.65-006.6-076.5
Текст научной статьи Диагностика рака предстательной железы
Своевременно распознать рак предстательной железы (РПЖ) – ответственная задача, которая наиболее точно решается с помощью комплекса современных клиниколабораторных, морфологических исследований, УЗИ, трансректального ультразвукового исследования (ТРУЗИ), КТ и пальцевого ректального исследования (ПРИ). Среди этих диагностических мероприятий основное внимание уделяют исследованию простатоспецифического антигена (ПСА) и морфологического исследования материала, полученного при трансректальной пункционной биопсии (ТПБ) простаты [1, 4, 5, 9, 14]. Исследование уровня ПСА и данные мультифокальной трансректальной биопсии значительно улучшают диагностику РПЖ на ранних стадиях [7, 8, 10,
-
14] . В связи с успехами ранней диагностики заболевания изменился и подход к его лечению [3, 8, 9, 14].
Цитологическое исследование – один из основных методов диагностики, который активно используется при обследовании больных с патологией предстательной железы [6, 12]. По его результатам можно получить большой объем информативного материала. Анализ плоидности при РПЖ дает важную прогностическую информацию, дополняющую патоморфологическое исследование. В литературе подтверждена важность прогностических факторов, в частности плоидности опухолевых клеток, при их учете для определения показаний к радикальной простатэктомии эффективность лечения достигает 80 % [2, 10, 11, 13, 15, 16].
Цель настоящей работы – оценить клиническую значимость исследований ПСА, а также сопоставить показатели уровня ПСА с морфологическими данными, полученными при ТПБ предстательной железы, и параметрами лазерной ДНК-проточной цитофлуорометрии.
Материалы и методы
Проведено обследование 2279 пациентов на ПСА твердофазным иммунопероксидазным методом типа «Сэндвич» на основе моноклональных антител к ПСА, использовались тест-системы Can Ag EIA («Can Ag Diagnostics», Швеция). Для измерения результатов использовали иммуноферментный анализатор «Униплан» («Пикон», г. Москва).
Материал для цитологического исследования получали с помощью ТПБ предстательной железы, с использованием автоматического устройства для биопсии «Magnum» («BARD», США), иглами 18-го калибра. Биоптаты брали из 6 точек – так называемая «секстантная» биопсия.
Мазки для цитологического исследования получали путем прокатывания полученных столбиков ткани простаты по обезжиренному предметному стеклу. Цитологические препара- ты, после высушивания на воздухе, окрашивали по методике Паппенгейма, изучали в световом микроскопе. Изучались морфологические особенности цитологических препаратов при РПЖ и ДГПЖ. Диагноз заболевания у всех пациентов установлен на основании данных цитологического исследования, верифицированных гистологически. При изучении цитологических препаратов придерживались классификации ВОЗ (1993).
Изучены количественные параметры клеток опухоли у больных РПЖ с помощью лазерной ДНК-проточной цитофлуорометрии и компьютерной программы Multicycle (Phoenix + Epicx XL, From System, США). Материалом для исследования служил архивный гистологический материал, полученный во время оперативного вмешательства у 23 больных РПЖ разной степени морфологической дифференцировки и стадии.
Результаты и обсуждение
В результате проведенного исследования выявлены 194 (8,5 %) больных с повышенным показателем уровня ПСА. В клиническом плане наиболее важен подъем концентрации ПСА сыворотки крови при РПЖ. Показатели уровня ПСА выше нормы получены у 145 (74,7 %) боль-
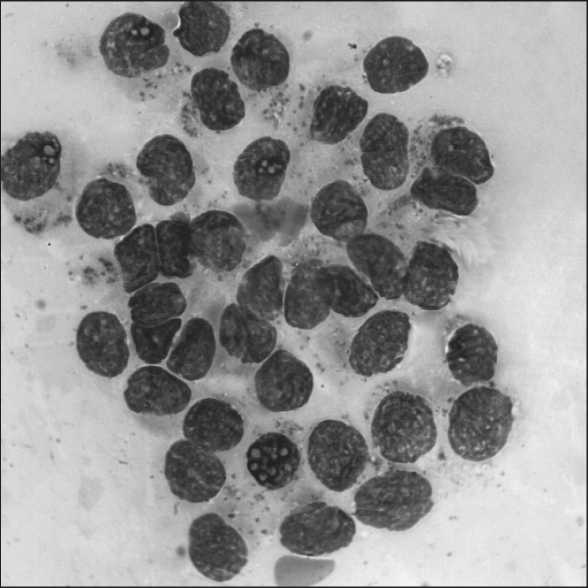
Рис. 1. Комплекс клеток высокодифференцированной аденокарциномы предстательной железы. Окраска по
Паппенгейму. х900
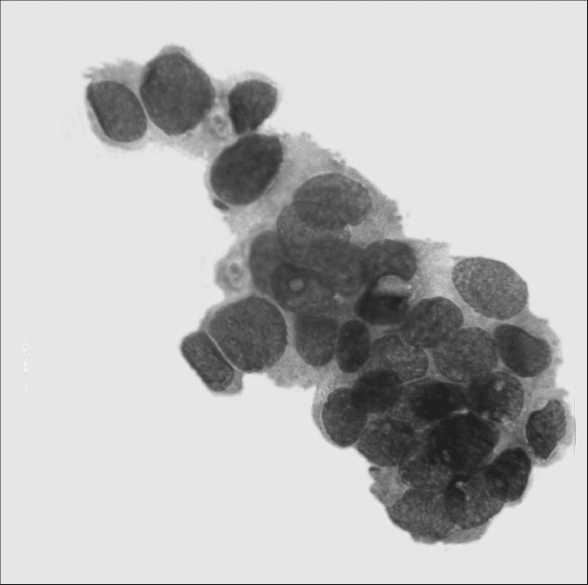
Рис. 2. Комплекс клеток умереннодифференцированной аденокарциномы предстательной железы. Окраска по Паппенгейму. х900
ных с РПЖ и у 49 (25,3 %) больных с доброкачественной гиперплазией предстательной железы (ДГПЖ). При этом уровень ПСА у пациентов с РПЖ варьировал в пределах от 4,0 до 58 ng/ml, тогда как при ДГПЖ его предельные значения были ниже – в пределах от 4 до 13,8 ng/ml.
При цитологическом исследовании материала, полученного при ТПБ простаты у 138 больных с показателями ПСА 4–10 ng/ml, в 92 случаях диагностирован рак простаты, в 46 – ДГПЖ. Уровень ПСА в пределах 10–20 ng/ml был повышен у 61 больного, из них в биопсийном материале выявлен РПЖ в 58 случаях, в 3 – диагностирована ДГПЖ. При ПСА более 20 ng/ml диагноз РПЖ установлен во всех случаях, у 41 больного. Таким образом, чувствительность ПСА составила 71,1 %, специфичность – 80,1 %.
При цитологическом исследовании материала ТПБ простаты у 46 (31,7 %) больных диагностирована высокодифференцированная аденокарцинома, которая была представлена клетками типа кубического и призматического эпителия с незначительными признаками полиморфизма, с интенсивно окрашенными ядрами, имеющими глыбчатое строение хроматина, Цитологическая картина высокодифференцированной аденокарциномы часто напоминает наблюдающуюся при аденоме (ДГПЖ), и иногда трудно их различить (рис. 1). В 64 (44,1 %) наблюдениях диагностирована умереннодифференцированная аденокарцинома. Цитологическая картина представлена тесно располагающимися опухолевыми клетками, без четких границ, ядра полиморфные, гиперхромные, с увеличенными ядрышками, много голых ядер (рис. 2). Для низкодифференцированной аденокарциномы (35 (24,2 %) случаев) характерны выраженная атипия клеток, их разрозненное расположение, а также бесформенные, беспорядочные скопления. Часто отмечаются мелкие группы раковых клеток с выраженным полиморфизмом, многие клетки располагаются изолированно друг от друга, много голых ядер (рис. 3).
Окончательное стадирование опухолевого процесса проводилось после оперативного вмешательства. По результатам выполненной простатэктомии у 125 (86,2 %) больных РПЖ, выявленных с помощью ПСА, опухоль была в пределах органа. Соответственно, распределе-
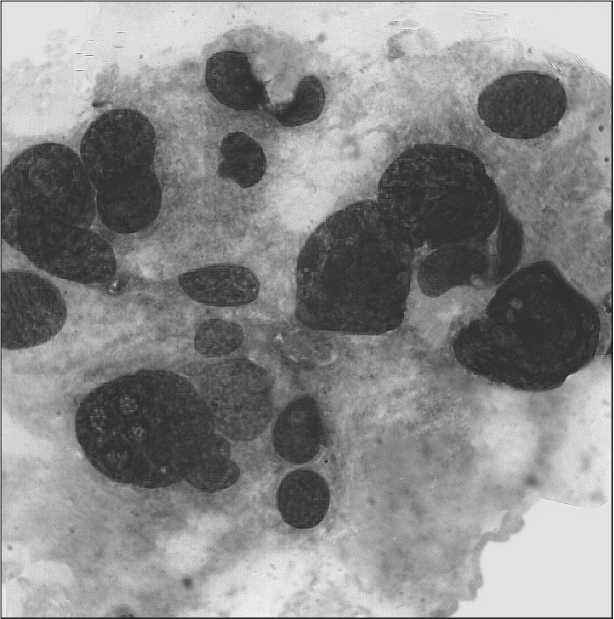
Рис. 3. Комплекс клеток низкодифференцированной аденокарциномы предстательной железы. Окраска по Паппенгейму. х900
ние по стадиям заболевания было следующим: I стадия – у 17 (11,7 %) больных, II стадия – у 57 (39,3 %), III стадия – у 51 (35,2 %), IV стадия – у 20 (13,8 %) пациентов. Совпадение цитологического и гистологического диагноза составило 96 %.
При изучении плоидности опухоли и количественных параметров ДНК методом проточной цитофлуорометрии у 23 больных РПЖ, в 6 (26 %) случаях обнаружено диплоидное содержание ДНК в ядрах опухолевых клеток, в 17 (74 %) – выявлены анеуплоидные опухоли. Индекс ДНК (ИДНК) при диплоидных опухолях равнялся 1,0, при анеуплоидных – 1,43 ± 0,14. У 8,7 % больных ИДНК опухоли был меньше 1,0, то есть наблюдалась потеря хромосомного материала в клетках опухоли, в 65,2 % отмечалась анеуплоидия в пределах митотического цикла: ИДНК был 1,1–1,7 и более. По полученным в исследовании данным, у больных РПЖ преобладают анеуплоидные опухоли (76 %), более половины (64,8 %) из них содержат свыше 70 % анеуплоидных клеток.
Анализ изучаемых параметров клеток опухоли в зависимости от уровня ПСА позволил обнаружить, что у больных РПЖ частота анеу- плоидных опухолей увеличивалась при повышении этого показателя. При уровне ПСА от 4 до 10 ng/ml у 4 (50 %) больных РПЖ опухоли были анеуплоидными. При ПСА в пределах от 10 до 20 ng/ml анеуплоидные опухоли наблюдались у 3 (100 %) больных РПЖ. При повышении ПСА более 20 ng/ml отмечено значительное увеличение количества пациентов с анеуплоидной опухолью, их было – 10, что составило 83,3 % (p<0,05).
У больных с высоким уровнем ПСА отмечена тенденция к увеличению числа опухолей, содержащих менее 80 % клеток в G0/1-фазе клеточного цикла. Так, при ПСА от 4 до 10 ng/ml такие опухоли наблюдались у 2 (25 %) больных, при показателе ПСА более 20 ng/ml – у 4 (33,3 %) больных. При уровне ПСА от 10 до 20 ng/ml менее 80 % клеток в опухоли больных не обнаружены, в этой группе было мало наблюдений. У больных с ПСА более 20 ng/ml вообще отсутствовали опухоли, содержащие более 90 % клеток в G0/1- фазе клеточного цикла (p<0,05). У больных с повышенным показателем уровня ПСА отмечается тенденция к увеличению содержания клеток в S-фазе клеточного цикла. Опухоли, содержащие более 6 % клеток в S-фазе клеточного цикла при показателе уровня ПСА от 4 до 10 ng/ml, наблюдались у 4 (50 %) больных, от 10 до 20 ng/ml – у 2 (66,7%) больных, более 20 ng/ml – у 11(91,7 %) из 12 больных (p<0,05). При анализе зависимости между показателем уровня ПСА и содержанием клеток в G2+M-фазе клеточного цикла и индекса пролиферации отмечалось увеличение частоты опухолей с повышенной пролиферативной активностью опухолевых клеток и числом митозов у больных с высоким показателем уровня ПСА.
Пятилетняя выживаемость при уровне ПСА от 4 до 10 ng/ml у больных с диплоидными опухолями составила 75 %, у больных с ПСА более 20 ng/ml она равнялась 50 %. В нашем исследовании не было больных с диплоидными опухолями при показателях ПСА от 10 до 20 ng/ml.
Установлена более низкая пятилетняя выживаемость больных с анеуплоидными опухолями при высоких показателях уровня ПСА. Пятилетняя выживаемость при показателях ПСА от 4 до 10 ng/ml составила 50,0 %, при ПСА от 10 до
20 ng/ml – 33,3 %. В группе больных с уровнем ПСА более 20 ng/ml пятилетняя выживаемость составила 10,0 %.
При анализе изучаемых параметров клеток опухоли в зависимости от степени морфологической дифференцировки было отмечено, что со снижением степени морфологической дифференцировки РПЖ чаще наблюдалась анеуплоидия клеток опухоли. Анеуплоидные опухоли выявлены у 4 (57,1 %) больных с высокодифференцированной аденокарциномой. При умереннодифференцированной аденокарциноме анеуплоидные опухоли выявлены у 5 (71,4 %) больных, при низкодифференцированной аденокарциноме анеуплоидные опухоли обнаружены у 8 (88,9 %) больных (p<0,05).
При анализе содержания клеток в G0/1-фазе клеточного цикла и степени морфологической больных РПЖ установлено, что при низкодифференцированной аденокарциноме отмечена тенденция к увеличению числа опухолей, содержащих менее 80 % этих клеток. Такие опухоли наблюдались у 2 (28,6 %) больных с высокодифференцированной аденокарциномой, у 1 (14,3 %) – с умереннодифференцированной, у 4 (44,4 %) – с низкодифференцированной аденокарциномой. При низкодифференцированной аденокарциноме вообще отсутствовали опухоли, содержащие более 90 % клеток в G0/1-фазе клеточного цикла (p<0,05 при сравнении с группой больных с высокодифференцированной и умереннодифференцированной аденокарциномой).
При низкой степени морфологической дифференцировки опухоли у больных РПЖ наблюдалось повышение содержания клеток в S-фазе клеточного цикла. Если при высокодифференцированной и умереннодифференцированной аденокарциноме наблюдалось сходное содержание более 6 % клеток опухоли в S-фазе клеточного цикла – у 4 (57,1 %) и у 4 (57,1%) больных соответственно, – то при низкодифференцированной аденокарциноме это явление отмечено у 9 (100 %) больных (p<0,05).
При прогностически неблагоприятной морфологической низкой степени дифференцировки РПЖ отмечалось увеличение числа опухолей с повышенным содержанием клеток G2+M-фазе клеточного цикла. Так, при высокодифференци- рованной аденокарциноме простаты G2+M-фазе клеточного цикла выявлено более 10 % клеток опухоли у 1 (14,3 %) больного, сходное содержание этих клеток наблюдалось при умереннодифференцированной аденокарциноме – у 1 (14,3 %) пациента, тогда как при низкодифференцированной аденокарциноме у 3 (33,3 %) больных в G2+M-фазе клеточного цикла выявлено более 10 % клеток в опухоли (p<0,05).
У больных с низкодифференцированной аденокарциномой было отмечено увеличение индекса пролиферации. Так, у больных РПЖ с высокодифференцированной аденокарциномой индекс пролиферации менее 18 % наблюдался в 6 (85,7 %) случаях, так же как и у больных с умереннодифференцированной аденокарциномой – в 6 (87,5 %), при низкодифференцированной аденокарциноме – у 2 (33,3 %) больных. Индекс пролиферации 18–25 % наблюдался у 5 (55,6 %) больных РПЖ, и только при низкодифференцированной аденокарциноме. Индекс пролиферации более 25 % наблюдался у 1 (14,3 %) больного с высокодифференцированной аденокарциномой, сходная пролиферативная активность выявлена при умереннодифференцированной аденокарциноме – у 1 (14,3 %) больного, при низкодифференцированной аденокарциноме – у 2 (22,2 %) больных При сравнении групп с разной степенью морфологической дифференцировки получены достоверные статистические различия (p<0,05).
По данным анализа пятилетней выживаемости больных РПЖ в зависимости от степени морфологической дифференцировки и пло-идности опухоли она составила 67,0 % при высокодифференцированной аденокарциноме у больных с диплоидными опухолями. В группе больных с умереннодифференцированной аденокарциномой пятилетняя выживаемость составила 50 %, с низкодифференцированной аденокарциномой пятилетняя выживаемость – 0 %.
Самая низкая пятилетняя выживаемость отмечена у больных с анеуплоидными опухолями, в этом случае при высокодифференцированной аденокарциноме она равнялась 50,0 %, при умереннодифференцированной аденокарциноме – 40 %, при низкодифференцированной аденокарциноме – 0 %.
Таким образом, несмотря на некоторые ограничения, ПСА в настоящее время является лучшим скрининговым маркером для диагностики РПЖ в ранней стадии с наибольшим потенциалом в плане успешности терапии [1, 4, 5, 8, 9]. Представленные данные убедительно доказывают, что с помощью ПСА диагностируется наибольшее количество ранних стадий РПЖ.
В комплексе диагностических мероприятий особое значение приобретают методы, способствующие цитологической верификации, так как известно, что именно морфологическая структура новообразования определяет наиболее рациональный план лечения. Цитологическое исследование материала ТПБ у больных с повышенным показателем уровня ПСА позволяет установить правильный диагноз.
Отмечено, что анеуплоидия сочетается с неблагоприятными клинико-лабораторными факторами РПЖ. Частота анеуплоидных опухолей увеличивалась при повышении показателей уровня ПСА у больных РПЖ. В группе больных с анеуплоидной опухолью и повышенным показателем уровня ПСА чаще наблюдалось высокое содержание более 70 % анеуплоидных клеток в опухоли. У больных с высоким показателем уровня ПСА отмечено снижение содержания клеток в G0/1-фазе клеточного цикла и высокая пролиферативная активность клеток в S-фазе клеточного цикла.
Плоидность явилась прогностическим фактором у больных с высоким показателем уровня ПСА. Это свидетельствует о корреляции между показателем уровня ПСА и плоидностью опухоли (p<0,05).
Со снижением степени морфологической дифференцировки РПЖ чаще наблюдались анеуплоидные опухоли, высокое содержание более 70 % анеуплоидных клеток в опухоли. У больных отмечена высокая пролиферативная активность опухолевых клеток в G2+M-фазе клеточного цикла и высокая пролиферативная активность опухолевых клеток в S-фазе клеточного цикла. Наиболее низкая выживаемость отмечена у больных с анеуплоидным низкодифференцированным РПЖ. Таким образом, определение показателей уровня ПСА позволяет существенно повысить раннюю диагностику РПЖ, цитологическое исследование материала, полученного при ТПБ простаты явилось неотъемлемым, а в некоторых случаях завершающим этапом диагностики РПЖ. Плоидность является прогностическим фактором у больных с высокими показателями уровня ПСА и низкой степенью дифференцировки опухоли при РПЖ.
Выводы
-
1. Определение ПСА наряду с цитологическим исследованием эффективно используется в диагностике РПЖ на дооперационном периоде.
-
2. Цитологический метод оптимизирует морфологическую диагностику РПЖ по материалам ТПБ.
-
3. Использование метода лазерного ДНК-проточной цитофлуорометрии предоставляет возможность получить важнейшие характеристики РПЖ, которые позволяют уточнить биологические особенности злокачественной опухоли, очень сильно влияющие на прогноз болезни.


