Диагностика вируса бычьего иммунодефицита методом полимеразной цепной реакции
Автор: Ахмедов Р.Б., Нам И.Я., Заякин В.В.
Статья в выпуске: 4 т.244, 2020 года.
Бесплатный доступ
В настоящей работе предложен и описан способ ПЦР- диагностики вируса бычьего иммунодефицита. Проведенное исследование включало подбор праймеров для проведения ПЦР и выявления ВБИ, оптимизацию концентрационных и температурно-временных условий ПЦР диагностики провируса иммунодефицита крупного рогатого скота, проведение скрининга крупного рогатого скота, изучение особенностей распространения ВБИ. По результатам представленного исследования были выбраны и синтезированы праймеры для ПЦР-диагностики ВБИ. Определены оптимальные концентрационные и температурновременные условия проведения ПТЦР-диагностики вируса иммунодефицита с предложенным набором праймеров. Проведен скрининг 157 голов крупного рогатого скота. Выявлено 101 инфицированное ВБИ животное, отмечена широкая распространенность вируса на территории Брянской области.
Вирус бычьего иммунодефицита (вби), праймеры, полимеразная цепная реакция (пцр)
Короткий адрес: https://sciup.org/142226081
IDR: 142226081 | УДК: 636.082.2:636.034 | DOI: 10.31588/2413-4201-1883-244-4-31-36
Текст научной статьи Диагностика вируса бычьего иммунодефицита методом полимеразной цепной реакции
Иммунодефицит крупного рогатого скота – это хроническое прогрессирующее заболевание, которое поражает крупный рогатый скот во всем мире, в частности, в научной литературе есть данные о диагностике ВБИ у крупного рогатого скота и буйволов в Бразилии, Пакистане, Камбодже [6]. Первоначально вирус бычьего иммунодефицита (ВБИ) был выделен в США в 1969 году Мартином Ван Дер Матеном и коллегами, которые назвали этот изолят R29. Вирус был изолирован из тканей коровы с низкими надоями и синдромом истощения, персистирующим лимфоцитозом, лимфоидной гиперплазией, нейропатией, прогрессирующей слабостью.
В 1987 году было продемонстрировано, что изолят ВБИ R29 представляет собой лентивирус с поразительным сходством с вирусом иммунодефицита человека (ВИЧ) [9]. Особое внимание к вирусу бычьего иммунодефицита вызвано его филогенетической близостью к вирусу иммунодефицита человека-1 (ВИЧ-1), показано, что антисыворотка к р26 ВБИ перекрестно реагировала с р24 ВИЧ-1 [10]. Молекулярное клонирование R29 и двух его клонов, R29-127, R29-106, показало значительную структурную и генетическую гомологию между ВБИ и ВИЧ.
Геном ВБИ состоит из двух одинарных (+) цепей РНК с размером 9200 нуклеотидов каждая. Диаметр вириона – 80-100 нм, «шипы» длиной 8 нм равномерно рассеяны по всей поверхности. Нук-леокапсид концентрический палочковидный или в форме конуса. Геном вируса иммунодефицита КРС включает обязательные ретровирусные гены gag, pol и env, а также пять открытых рамок считывания между генами ревертазы и белка оболочки. Репликация проходит через стадию образования двухспиральной ДНК провируса, которая эффективно интегрируется с геномом клетки–хозяина [1].
Роль ВБИ в развитии болезней животных слабо изучена. Существуют данные о его иммунносупрессирующем действии, которое проявляется в прогрессировании у скота других инфекций [12]. Вирус характеризуется пожизненной персистенцией и наличием только субклинических проявлений [7]. ВБИ во многом гомологичен вирусу иммунодефицита человека, и интересен как модельный организм для изучения иммунодефицитных состояний [11]. Первый вирусный изолят получил обозначение R29 [5], на данный момент известны и другие формы этого патогена.
Крупный рогатый скот в нашей стране и мире, помимо вируса лейкоза, зачастую инфицирован вирусом бычьего иммунодефицита (ВБИ) [2].
По результатам ПЦР-скрининга, проведенного в Ставропольском крае, было выявлено большое количество инфицированных BIV животных, более 20 % от изученной выборки [3]. Более крупное исследование на крупном рогатом скоте Московской области показало похожий уровень вирусоносительства в 15,8 % [2]. Образцы говядины из нескольких Европейских стран, Южной Америки и России содержали провирусную ДНК в 8,8-80 % случаев [1].
В России впервые исследования по распространению вируса бычьего иммунодефицита были проведены Колотвиным и соавторами (2006, 2007). Ими была разработана методика анализа ВБИ с применением ПЦР и праймеров gagl/gag2, ро11/ро12. В трех неблагополучных по лейкозу (38-86 %) животноводческих хозяйствах Московской области, было показано присутствие ВБИ-положительных коров от 11 до 67 %, в группах было по 50100 животных. В работах, проведенных в неблагополучных по лейкозу хозяйствах 5 районов Ставропольского края, Колотви-ным и соавторами, было показано, что ВБИ выявляется в группах коров из 4 районов 11,4-33,3 %.
Колотвин и соавторы (2007) провели исследование 70 туш импортной бескостной говядины, полученной из стран Восточной Европы, Евросоюза, Южной Америки, и выявили ДНК провируса ВБИ в образцах мяса из Бразилии, Парагвая, Украины, Италии и Франции. Анализ образцов партий отечественной говядины (Курская и Нижегородская области), также показал наличие в них вируса.
Для изучения распространенности ретровирусных инфекций крупного рогатого скота широко применяются серологические исследования. При этом, как уже отмечалось ранее, использование иммунологических методов может привести к недостоверным результатам, связанным со снижением титра антител в латентной стадии инфекционного процесса.
Вирус бычьего иммунодефицита первоначально был идентифицирован методами иммуноблоттинга и иммунофлюоресценции [11]. Методика Вестерн-блот-гибридизации в течение многих лет являлась одной из наиболее распространенных для серологической диагностики ВБИ и позволяла выявлять антитела сразу к нескольким антигенам ВБИ (gp110, р32, р26, р19, р16 и р13) [8, 13]. Методом секвенирования было показано, что штаммы gp110, р32, р26, р19, р16 и р13 имели 92,693,6 % гомологии с нуклеотидной последовательностью клона R29-127.
Методом Вестерн-блоттинга была показана инфицированность ретровирусами животных в Бразилии: из 238 коров 11,7 % имели антитела к р26 ВБИ, а 2,1 % имели антитела к gp51 ВБЛ (использовался метод РИД). В моноцитах периферической крови ВБИ-серопозитивных животных с помощью PCR была обнаружена ДНК провируса ВБИ. Скрининговые исследования, проведенные методами иммунофермент-ного и иммунофлуоресцентного анализа, а также иммуноблоттинга, позволили показать уровень носительства BIV до 84 % на скотоводческих фермах Северной Америки [14].
В настоящее время более перспективно проводить скрининг пораженного вирусом иммунодефицита скота с использованием методов ПЦР, позволяющих напрямую выявлять провирусную ДНК на любой стадии инфекционного процесса. Это высокочувствительный и специфичный метод диагностики ВБИ, позволяющий выявить непосредственно вирус (а не антитела) в крови животного или в культуре клеток. Важнейшим преимуществом ПЦР является, возможность выявления провируса ВБИ в разнообразных физиологических жидкостях животных (кровь, сперма, молоко, мышечная ткань и т.д.), а также в культуре клеток, инфицированных ВБИ. Метод ПЦР можно использовать для диагностики инфекции на ранних стадиях развития, до начала синтеза антител. Для проведения масштабного мониторинга популяций крупного рогатого скота на распространенность инфекции, вызванной ВБИ, многими лабораториями этот метод, вне зависимости от применения серологических методов диагностики и источников исследуемого материала.
Например, ПЦР применяют для подтверждения инфекционного статуса РИД-положительного животного по ВБИ при исследовании возможности вертикальной передачи ВБИ, при сравнении геномов различных штаммов и изолятов ВБИ, полученных из разных стран, при исследовании тропизма ВБИ к различным клеткам и органам крупного рогатого скота.
Методом полугнездовой полимеразной цепной реакции с амплификацией области pol вирусного генома BIV, была исследована провирусная ДНК в 607 образцах крови водяных буйволов из 10 ферм, расположенных в штате Пара. Показано, что 4,4 % образцов были положительными на BIV провирусную ДНК. Ам-плифицированные фрагменты, были клонированы и секвенированы. Доказано, что полученная последовательность имела 99 % сходство с эталонным штаммом R-29 [6].
Для разработки анализа ВБИ методом ПЦР разные авторы использовали праймеры, комплементарные разным генетическим структурам: gag, pol и env. Ли-манской (2005) был разработан набор праймеров, позволяющий посредством полимеразной цепной реакции (ПЦР) осуществлять детекцию провирусной ДНК вируса бычьего иммунодефицита [4]. В работах Колотвина (2007), Бурбы (2009) и Криворучко (2012) с соавторами, для проведения ПЦР были подобраны видоспецифические праймеры gagl/gag2, роl1/роl2.
Решением проблемы изучения эпидемиологической ситуации по распространению ВБИ является разработка метода ПЦР-анализа для выявления пораженных вирусом животных, что и являлось целью данной работы.
Материал и методы исследований. Для проведения анализа использовали венозную кровь животных с антикоагулянтом. Анализ включал следующие этапы: выделение ДНК, электрофорез геномной ДНК, ПЦР, электрофоретическое разделение продуктов ПЦР. Выделение геномной ДНК проводили с использованием гуанидин тиоционатного лизирующего раствора и сорбента силики. Для ПЦР использовали оригинальные олигонуклеотиды, разработанные в настоящей работе.
В ходе исследования была решена задача выбора нескольких вариантов пар праймеров для проведения ПЦР. Для выбора областей провирусной ДНК проводилось сравнение существующих сиквенсов вирусного гена env. Для этих целей использовалось программное обеспечение Vector NTI Advance. Необходимые сиквен-сы гена находили с использованием электронно-поисковой системы PubMed, а также генетической базы данных GenBank. Всего было исследовано 32 нуклеотидные последовательности генетически различных вирусных изолятов.
Результаты исследований. Анализ найденных сиквенсов показал, что, в отличие от вируса лейкоза крупного рогатого скота, изоляты вируса бычьего иммунодефицита имеют значительные генетические различия, вследствие чего невозможно выделить достаточно длинных консервативных участков для подбора праймеров. Это обстоятельство не позволяет подобрать одну универсальную пару праймеров для выявления всех генетических вариантов вируса. Поэтому была выбрана группа родственных референтному вирусному штамму R-29 изолятов для подбора специфических праймерных участков.
Анализ генетического родства рассматриваемых изолятов позволяет сделать вывод о перспективности подбора специфических праймерных участков для референтного вирусного штамма R-29, а также кластера близких по генетике изолятов, в том числе изолята ОК.
Для подбора праймеров и анализа олигонуклеотидных последовательностей изолятов ВБИ на возможность образования вторичных структур использовали программу Vector NTI Advance. В ходе анализа были выбраны консервативные области нуклеотидной последовательности, на основе которых были синтезированы следующие олигонуклеотиды (Таблица 1).
Таблица 1 – Характеристика олигонуклеотидов-праймеров
|
№ п/п |
Показатель |
Кол-во НКД |
Нуклеотидная последовательность |
Особенности олигонуклеотида |
|
1 |
BIV_env_F |
18 |
cgg-tga-gat-cca-ccc-ttg |
Специфичен для биотипа R29 и близких изолятов. |
|
2 |
BIV_env_R |
20 |
cag-ttc-ctg-cca-tag-tga-ga |
Специфичен для биотипа R29 и близких изолятов. |
|
3 |
BIV_env_R29 |
19 |
agt-act-ttg-atc-gtc-gtc-g |
Специфичен для биотипа R29 |
Подбор оптимальных температурных и концентрационных условий проводили с использованием программируемых термостатов «АНК-32» и «Терцик». Поиск положительных контролей для оптимизации условий проводили в группе возрастного потенциально инфицированного ВБИ скота с гематологическими проявлениями лейкоза.
В ходе подбора температурновременных условий был экспериментально определен основной показатель – температура отжига, равная 68 оС. Подобранные условия ПЦР позволили наиболее качественно проводить диагностику ВБИ (Таблица 2).
Серия экспериментов по амплификации фрагмента гена env ВБИ с последующим электрофоретическим разделением продуктов позволила получить фрагменты ДНК необходимой длины по двум комбинациям праймеров (Рисунок 1).
Таблица 2 – Температурно-временной режим ПЦР-РВ
|
№ п/п |
Этап |
Температура, °С |
Время, сек. |
Количество циклов |
|
1 |
Первичная денатурация |
94 |
240 |
|
|
2 |
Денатурация |
94 |
25 |
47 |
|
3 |
Отжиг |
66-67 |
15-30 |
|
|
4 |
Элонгация |
72 |
35 |
|
|
5 |
Финальный синтез |
72 |
240 |
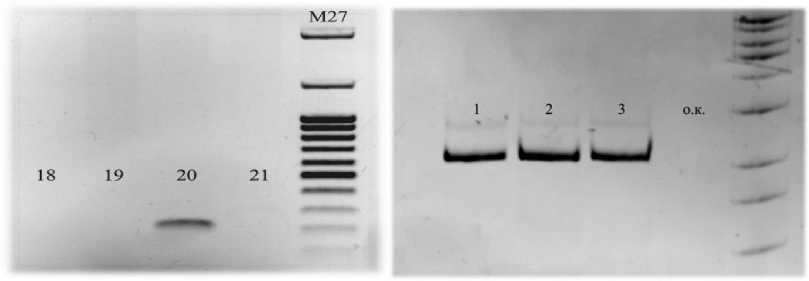
А Б
Рисунок 1 – Электрофореграмма продуктов ПЦР, где А – праймеры BIV_env_F и BIV_env_R, фрагмент 230 п.н. Положительный образец – 20, отрицательные – 18, 19, 21. Б – Праймеры BIV_env_F и BIV_env_R29, фрагмент 256 п.н. Положительные образцы – 1,2,3
Таблица 3 – Результаты скрининга КРС на инфицированность ВБИ
|
Хозяйство |
Количество животных |
Пораженные ВБИ |
|
|
n |
% |
||
|
ОАО «Бежицкое» Брянский район |
94 |
40 |
43 |
|
ОАО «Гетманобудский» Новозыбковский район |
50 |
50 |
100 |
|
ООО «Гетуновка» Погарский район |
13 |
11 |
85 |
Как видно на рисунках, полученные фрагменты ДНК имеют ожидаемый размер ампликонов по двум комбинациям праймеров. Данный результат указывает на специфичность полученных фрагментов.
С целью изучения эпидемиологической обстановки на наличие провируса иммунодефицита КРС был проанализирован ранее исследованный на носительство ВЛКРС генетический материал 157 голов взрослого скота из хозяйств Брянской области. Анализ выявил 101 животное носителя провируса иммунодефицита крупного рогатого скота, что составляет более 64 % всей изученной выборки (Таблица 3).
Заключение. По результатам проведенного исследования были выбраны и синтезированы праймеры для ПЦР-диагностики ВБИ. Определены оптимальные концентрационные и температурно- временные условия проведения ПЦР-диагностики вируса иммунодефицита. Проведен скрининг 157 голов крупного рогатого скота. Выявлено 101 инфицированное ВБИ животное, что говорит о широком распространении вируса на территории Брянской области. Показано, что предлагаемый набор праймеров может использоваться для выявления ВБИ в виде провируса в крови КРС.
Список литературы Диагностика вируса бычьего иммунодефицита методом полимеразной цепной реакции
- Колотвин, В.В. Вирус иммунодефицита крупного рогатого скота: индикация инфекции и распространенность в хозяйствах Российской Федерации / Колотвин В.В. // Автореферат дис.. кандидата биологических наук: 03.00.23, 16.00.03. - Москва. 2007. - 22 с.
- Колотвин, В.В. Выявление вируса иммунодефицита крупного рогатого скота в Московской области / Колотвин В.В., Капитонов А.В., Абакин С.С. [и др.] // Российский ветеринарный журнал (сельскохозяйственные животные). - Москва. - 2006. - № 2. - С.18-20.
- Криворучко, С.В. Вирус иммунодефицита крупного рогатого скота в хозяйствах Ставропольского края / С.В. Криворучко, С.С. Абакин, Г.А. Дубравная // Ветеринарная патология. - № 2. - 2012. -С. 35-38.
- Лиманская, О.Ю. Детекция провирусной ДНК вируса иммунодефицита крупного рогатого скота посредством полимеразной цепной реакции / О.Ю. Лиманская [и др.] // Вопросы вирусологии. -2005. - Т.50. - № 2. - С. 38-42.
- Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В., Фомина Н.В. Вирусные болезни животных / В.Н. Сюрин, А.Я. Самуйленко, Б.В. Соловьев, Фомина Н.В. -М.: Издательство ВНИТИБП, 1998. - 928 с.
- Albernaz, T.T. Molecular detection of bovine immunodeficiency virus in water buffaloes (Bubalus bubalis) from the Amazon region, Brazil / T.T. Albernaz, R.C. Leite, J.K. Reis [et al.] // Trop Anim Health Prod. -2015. - Vol. 47 (8). - P. 1625-1638.
- Belloc, C. Bovine immunodeficiency virus: facts and questions / C. Belloc, B. Polack, I. Schwartz [et al.] // Vet Res. -1996. - Vol. 27. - P. 395-402.
- Carpenter, S. Characterization of early pathogenic effects after experimental infection of calves with bovine immunodeflclency-like virus / S. Carpenter, L. D. Miller, S. Alexandersen [et al.] // J. Virol. 1992. Vol. 66. P. 1074-1083.
- Corredor, A.G. Molecular and biological aspects of the bovine immunodeficiency virus / A.G. Corredor, M. C. St-Louis, D. Archambault // Curr HIV Res. - 2010. - Vol. 8 (1). - P. 2-13.
- Corredor, A.G. The Bovine Immunodeficiency Virus Rev Protein: Identification of a Novel Nuclear Import Pathway and Nuclear Export Signal among Retroviral Rev, Rev-Like Proteins / A.G. Corredor, D. Archambault // J. Virol. -2012. - Vol. 86 (9). - P. 4892-4905.
- Gonda, M.A. Characterization and molecular cloning of a bovine lentivirus related to human immunodeficiency virus / M.A. Gonda, M.J. Braun, S.G. Carter // Nature. - 1987. - Vol. 330. - P. 388-391.
- Gonzalez, G.C. Very low prevalence of bovine immunodeficiency virus infection in western Canadian cattle / G.C. Gonzalez, J.B. Johnston, D.D. Nickel [et al.] // Cancer J. Vet. Res. - 2001. - Vol. 65. - P. 73-76.
- Jacobs, R.M. Prevalence of bovine immunodeficiency-like virus in buuls as determined by serology and proviral detection / R.M. Jacobs, B.J. Jefferson, D.L. Suarez // Can J. Vet. Res. - 1998. - Vol. 62. - P. 231233.
- Snider T.G., Luther D.G., Jenny B.F., Hoyt P.G., Battles J.K., Ennis W.H., Balady J., Blas-Machado U., Lemarchand T.X., Gonda M.A. Encephalitis, lymphoid tissue depletion and secondary diseases associated with bovine immunodeficiency virus in a dairy herd / T.G. Snider, D.G. Luther, B.F. Jenny [et al.] // Comp. Immunol. Microbiol. Infect. - 1996. - Vol. 19. - P. 117-131.


