Дифференциация изолятов возбудителя ложной мучнистой росы подсолнечника на основе SNP-маркеров
Автор: Рамазанова С.А., Антонова Т.С., Ивебор М.В.
Статья в выпуске: 1 (146-147), 2011 года.
Бесплатный доступ
Представлен обзор исследований по поиску молекулярных маркеров для дифференциации рас возбудителя ложной мучнистой росы Plasmopara halstedii (Farl.) Berl. et de Toni. Описаны возможности применения для генетических исследований маркеров, основанных на выявлении однонуклеотидных замен SNPs и методы, выявляющие эти мутации. Изучен полиморфизм ДНК локуса Pfa74 для изолятов возбудителя ложной мучнистой росы из разных стран. Показано, что все изоляты из Краснодарского края РФ идентичны по локусу Pfa74, имеют один и тот же аллель.
Ложная мучнистая роса, раса, молекулярные мар-керы, пцр
Короткий адрес: https://sciup.org/142150972
IDR: 142150972 | УДК: 633.72:632.11:581.1
Текст научной статьи Дифференциация изолятов возбудителя ложной мучнистой росы подсолнечника на основе SNP-маркеров
Заболевание подсолнечника ложной мучнистой росой, вызываемое облигатным грибным патогеном Plasmopara halstedii (Farl.) Berl. et de
Toni, является одним из самых вредоносных на подсолнечнике. В настоящее время идентифицировано 36 патотипов патогена [1], описанных с помощью трёхзначной номенклатуры, принятой в 2000 г. [2]. В последние годы в мире активно проводятся исследования по поиску молекулярных маркеров для идентификации рас патогена с целью выявления структуры популяций возбудителя болезни.
Молекулярно-генетические маркеры, в частности ДНК-маркеры, позволяют идентифицировать различные виды и расы грибов, устанавливать между ними филогенетические связи, степень дивергенции разных видов и подвидов, следить за процессом расообразова-ния и процессом обособления рас в отдельные виды. Они равномерно распределены по всему геному, могут относиться как к структурным генам, так и к некодирующим участкам генома, часто имеют кодоминантное наследование, и их проявление не зависит от условий окружающей среды. Все это и обусловило их широкое распространение.
По мере развития ДНК-технологий, появления новых типов ДНК-маркеров ведется и поиск информативных, удобных в применении, высокополиморфных и воспроизводимых маркеров для идентификации рас Plasmopara halstedii. Roeckel-Drevet et al. (1997) была выполнена работа по анализу генетической вариабельности 58 французских изолятов пяти патотипов различного географического происхождения P. halstedii [3]. Авторами было тестировано 196 RAPD (Random Amplified Polymorphic DNA) праймеров методом полимеразной цепной реакции. Полиморфные фрагменты ДНК были обнаружены лишь с 30 (15 %) праймерами. Для выявления внутрира-совых различий использовали 16 праймеров из 30 полиморфных. Изменчивости среди изоля-тов одной расы обнаружено не было. Для изучения межрасовых различий было использовано всего 75 RAPD праймеров. Полиморфные фрагменты были получены с 25 праймерами. Полученные фрагменты были обычно минорными фракциями, мажорные полиморфные фракции выявлены лишь по 6 праймерам. Им удалось дифференцировать между собой расы 100, 300, 700, 703, 710 и два изолята, обладающих устойчивостью к апрону. Расчетный коэффициент сходства Жаккарда, показал, что изученные изоляты очень сходны – от 88,6 до 99 % сходства.
Roeckel-Drevet et al. [4] была изучена вариабельность P. halstedii на мировом уровне. Ими было собрано 77 изолятов из 12 стран четырех континентов и изучен полиморфизм по 21 RAPD праймеру. Индекс сходства между изо-лятами составил от 89 до 100 %. Обнаруженный полиморфизм был очень слабым независимо от расы и географического происхождения.
Среди изолятов P. halstedii , собранных в районах Германии, обнаружен полиморфизм, по минисателлитным и микроcателлитным маркерам (SSR – simple-sequence repeat), также не кореллирующий ни с принадлежностью к физиологической расе, ни с географическим происхождением. Вместе с тем праймерные комбинации генерировали амплифицирован-ные фракции, позволяющие отличить один изолят от другого [5].
В лаборатории иммунитета и электрофореза (ВНИИМК) была начата работа по идентификации рас Plasmopara halstedii. Был исследован внутривидовой полиморфизм у 42 изолятов шести рас возбудителя ложной мучнистой росы Plasmopara halstedii, поражающих подсолнечник в Краснодарском крае, выявляемый молекулярными маркерами с применением 36 праймеров (RAPD, SSR, ISSR – inter-simplesequence repeat) и их комбинаций. Степень полиморфизма была оценена как слабая, поскольку лишь 10 праймеров и праймерных комбинаций выявили полиморфизм. Не было найдено маркеров, позволяющих четко различать расы патогена между собой. Однако следует отметить, что изученные изоляты расы 300 выделились в отдельный субкластер. Это показывает, что она генетически удалена от остальных, вероятно, в силу происхождения с другого континента [6].
В ходе работ по определению полных нуклеотидных последовательностей ряда модельных организмов возник практический интерес к молекулярным маркерам, основанным на тестировании однонуклеотидных замен (SNPs – Singl Nukleotide Polymorphism). SNPs – это однонуклеотидные позиции в геномной ДНК, для которых в некоторой популяции имеются различные варианты последовательностей (аллели), причем, частота встречаемости редкого аллеля не менее 1 % [7]. Это ограничение было введено, чтобы отличить SNPs от редких мутаций. Вопреки формальному определению, к этой группе маркеров относят все небольшие изменения геномных последовательностей: ин-серции/делеции (indels) и изменения нескольких нуклеотидов [8; 9]. SNPs – это не совсем новый тип ДНК-маркеров. ПДРФ-маркеры (самые первые ДНК-маркеры) тоже относятся к этому типу маркеров.
Обычно SNPs представлены двумя аллельными вариантами. На практике трехаллельные SNPs встречаются, но крайне редко. Например, в геноме человека они составляют 0,1 % от всех SNPs (10). Двухаллельные SNPs могут быть четырех различных типов: один вид тран-зиций С<=>T (G<=>A) и три типа трансверсий: С<=>А (G<=>T), C<=>G (G<=>C) и T<=>A (A<=>T). Транзиции составляют две трети SNPs человека. Возможно, это связано с происхождением С<=>T (G<=>A) в реакции деаминирования 5-метилцитозина [9].
Однонуклеотидные замены широко распространены в геномах всех организмов. Количество SNPs в геноме человека по разным оценкам – от 3 до 10 миллионов, причем количество «распространенных», с частотой встречаемости редкого аллеля более 20 %, составляет около 100 000. Среднее расстояние между маркерами – 30 т.п.н. Предполагается, что на каждый известный ген приходится в среднем по два маркера [8; 9]. Никакой другой тип геномных различий не имеет такой плотности картирования.
Помимо высокой плотности SNPs имеют низкий уровень мутаций на поколение (~10-8). Это делает их очень удобными при изучении крупномасштабных эволюционных событий [9].
В 2008 г. французскими учеными была проведена работа по поиску маркеров, выявляющих однонуклеотидные замены (SNPs), пригодных для дифференциации рас Plasmopara halstedii, так как предыдущие исследования по поиску полиморфных RAPD-, SSR-, ISSR-маркеров не дали положительных результатов, вероятно, потому, что эти молекулярные маркеры не специфичны для данного патогена. Авторами было сконструировано 12 пар праймеров для ПЦР, выявляющих однонуклеотидные замены в геномной ДНК Plasmopara halstedii. Результаты применения этих маркеров для различения рас ложной мучнистой росы позволяют надеяться, что проблема будет успешно решена. Авторы сообщают, что ими было дифференцировано 14 рас патогена, собранных в разных областях Франции [11].
Эффективное использование SNPs зависит от разработки надежных, дешевых и простых в исполнении способов их тестирования. В настоящее время применяется много методик выявления (детекции) аллельных вариантов SNPs, которые условно делят на несколько групп. В таблице 1 представлены наиболее распространенные методы детекции однонуклеотидных замен. Поэтому задача исследователя заключается прежде всего в том, чтобы подобрать метод тестирования однонуклеотидных замен в зависимости от поставленных задач и имеющихся технических возможностей лаборатории.
Таблица 1 – Основные методы детекции аллельных вариантов SNPs (9)
Ферментативные методы:
-
- полиморфизм длин рестрикционных фрагментов (RFLP);
-
- полиморфизм длин амплифицированных фрагментов (AFLP);
-
- расщепление гетеродуплексов структурноспецифическими эндонуклеазами (CFLP, EMD, CAPS);
-
- анализы, основанные на лигазной реакции (LDR, LCR, Padolock);
-
- инвазивное расщепление олигонуклеотидов (Invader);
-
- случайная амплификация полиморфной ДНК (RAPD, AP-PCR);
-
- ПЦР с прямой терминацией синтеза (DT-PCR);
-
- аллель-специфическая ПЦР (AS-PCR).
Химические методы:
-
- химическое расщепление гетеродуплексов;
-
- химическое лигирование.
Методы, основанные на различной электрофоретической подвижности полиморфных участков ДНК:
-
- анализ конформации одноцепочечных фрагментов (SSCP);
-
- гетеродуплексный анализ;
-
- секвенирование ДНК.
Детекция на твердой фазе:
-
- гибридизация на олигонуклеотидных матрицах;
-
- оптиковолоконный ДНК гибридизационный анализ;
-
- элонгация иммобилизованных праймеров (мини-сиквенс);
-
- пиросиквенс.
Хроматографические методы:
-
- денатурирующая HPLC.
Физические методы:
-
- масс-спектрометрия;
-
- резонансное тушение флуоресценции (FRET);
-
- люминесценция, зависящая от локального окружения.
Анализ in silico:
-
- сравнение имеющихся в базах данных геномных и EST последовательностей.
В своей работе Giresse с соавторами использовали для выявления найденных ими полиморфных SNP-маркеров четыре разных метода [11; 12]. Они представлены в таблице 2.
Таблица 2 – Методы детекции аллельных вариантов SNPs для идентификации патотипов возбудителя ложной мучнистой росы [11; 12]
Как видно из таблицы 2, только для локуса Pfa74 был использован электрофорез в агарозном геле. Для пяти локусов Pfa6, Pfa54, Pfa56, Pfa82 и Pfa99 была проведена обработка продуктов амплификации ДНК ферментами эндонуклеазами рестрикции (CAPS, Cleaved Amplfied Polymorphic Sequence) с последующим электрофорезом в агарозном геле. Благодаря простоте и надежности этот метод широко используется, но при условии, что изменения в последовательности ДНК затрагивают сайт рестрикции. У двух локусов для выявления SNPs применяли метод однонитево-го конформационного полиморфизма ДНК (SSCP – Single Strand Conformaision Polymor-fism). Он заключается в том, что продукты амплификации денатурируют и полученные однонитевые молекулы разделяют в полиакриламидном геле. Любая нуклеотидная замена приводит к изменению заряда однонитевого фрагмента, а следовательно, и к его электрофоретической подвижности. Для других четырех локусов авторы использовали секвенирование полученных продуктов амплификации ДНК. Секвенирование, безусловно, самый точный метод выявления SNP. Но это дорогой и трудоемкий процесс.
В нашей работе мы изучали пока только один локус Pfa74, так как выявление мутации в нем не требует дополнительных затрат. Была изучена ДНК коллекции изолятов возбудителя ложной мучнистой росы, собранных в Краснодарском крае, и образцов, любезно предостав- ленных нам французскими коллегами (INRA, UMR santé Vegtale (INRA-ENITA).
В таблице 3 представлены результаты исследования полиморфизма изолятов разных рас возбудителя по локусу Pfa74. Было выявлено 2 аллеля, которые представляют собой фрагменты ДНК с разной электрофоретической подвижностью. Фрагмент размером 370 п.н. обозначен нами, как аллель 2, а фрагмент 430 п.н. – аллель 1. У отечественных изолятов не было обнаружено полиморфизма, у всех рас – аллель 2. У изолятов из других стран выявлены оба аллеля. На рисунке 1 показана электрофореграмма продуктов амплификации ДНК некоторых российских изолятов, а на рисунке 2 – иностранных.
Следует отметить, что среди рас гриба 330, 730 и 710 из Краснодарского края не было выявлено не только межрасовой, но и внутрира-совой изменчивости по аллельному состоянию локуса Pfa74. Достаточно большие выборки изолятов каждой из этих рас имеют аллель – один и тот же аллель 2. Раса 700 довольно редко встречается в этом районе. Однако пять ее изолятов были собраны в разных районах Краснодарского края с расстоянием между ними 50-200 км. Поэтому с некоторой долей вероятности можно говорить об отсутствии полиморфизма в данном локусе и у этой расы. Самая старая раса 100 исключительно редко встречается в Краснодарском крае. Единственный ее изолят показал идентичность с образцом ДНК расы 100 из Франции. А образцы ДНК расы 710 из Краснодарского края и Франции наоборот отличаются по локусу Pfa74. Образец ДНК расы 330 из Испании отличается от таковых из России и США, которые оказались идентичны между собой (табл. 3, рис. 2). Указанные различия труднообъяснимы, необходима достаточная выборка изоля-тов зарубежного происхождения. Судить по одному образцу сложно. Возможно, что локус Pfa74 имеет изменчивость в зависимости от географических условий.
Таким образом, несмотря на идентичность локуса Pfa74 у изолятов гриба из Краснодарского края разной расовой принадлежности, его необходимо изучать с целью идентификации новых биотипов паразита из регионов возделывания подсолнечника в РФ.
Дальнейшие наши исследования будут направлены на изучение полиморфизма SNP-локусов, для выявления которых может использоваться ферментативный метод, то есть обработка продуктов амплификации эндонуклеазами рестрикции.
Таблица 3 – Аллельное состояние рас ложной мучнистой росы по локусу Pfa74
ВНИИМК, Краснодар, 2010 г.
|
Раса |
Количество изоля-тов |
Аллель |
Раса |
Коли чество изолятов |
Аллель |
Раса |
Количество изоля-тов |
Аллель |
|
330 (Россия) |
30 |
2 |
330 (США) |
1 |
2 |
330 (Испания) |
1 |
1 |
|
730 (-//-) |
11 |
2 |
730 (Франция) |
1 |
2 |
717 (Франция) |
1 |
1 |
|
710 (-//-) |
20 |
2 |
710 (-//-) |
1 |
1 |
703 (-//-) |
1 |
1 |
|
700 (-//-) |
5 |
2 |
700 (-//-) |
1 |
2 |
304 (-//-) |
1 |
1 |
|
100 (-//-) |
1 |
2 |
100 (-//-) |
1 |
2 |
704 (-//-) |
1 |
1 |
|
310 (-//-) |
2 |
2 |
714 (-//-) |
1 |
1 |
707 (-//-) |
1 |
2 |
|
307 (-//-) |
1 |
2 |
300 (-//-) |
1 |
2 |
|||
|
334 (-//-) |
1 |
1 |
314 (-//-) |
1 |
2 |
-
3. Roeckel-Drevet, P. Lack of genetic variability in French identified races of Plamopara halstedii, the cause of downy mildew in sunflower Helianthus annu-us / P. Roeckel-Drevet, V. Coelno, J. Tourvieille, P. Nicolas, D. Tourvieille de Labrouhe // Can. J. Microbiol. – 1997. – V. 43. – P. 260-263.
-
4. Roeckel-Drevet, P. Molecular variability of sunflower downy mildew, Plasmopara halstedii from
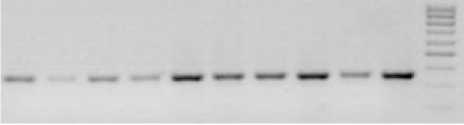
330 330 330 330 730 710 730 710 700 700 М
Рисунок 1 – Электрофоретические спектры продуктов амплификации ДНК по локусу Fha74 у рас возбудителя ложной мучнистой росы (л.м.р.). 330, 730, 710, 700 – расы возбудителя л.м.р. из Краснодарского края
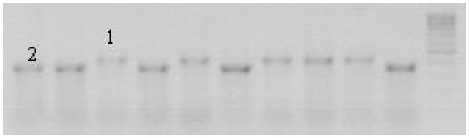
730 707 717 700 334 300 710 704 330'330 М
Рисунок 2 – Электрофоретические спектры продуктов амплификации ДНК по локусу Fha74 у рас возбудителя ложной мучнистой росы (л.м.р.). 1, 2 – аллели локуса, 730, 707, 717, 700, 334, 300, 710, 704, 330 – расы возбудителя л.м.р.
из Франции, 330’ – раса из Испании


