Дифференциальная диагностика негиперваскулярных нейроэндокринных опухолей поджелудочной железы и протоковой аденокарциномы по данным МСКТ с внутривенным болюсным контрастированием
Автор: Амосова Е.Л., Кармазановский Г.Г.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Резюме Цель исследования: оценить возможности МСКТ с внутривенным контрастированием в дифференциальной диагностике негиперваскулярных нейроэндокринной опухоли (НЭО) поджелудочной железы и протоковой аденокарциномы. Материалы и методы. Проанализированы результаты предоперационных МСКТ- исследований 74 пациентов с нейроэндокринными опухолями поджелудочной железы и 80пациентов с протоковой аденокарциномой. Оценивали следующие МСКТ-признаки опухоли: размеры, гомогенность, инвазия в сосудистые структуры парапанкреатической жировой клетчатки, отношение плотности (ед. Н.) опухоли к паренхиме поджелудочной 148 железы во все фазы исследования. Все НЭО были поделены по характеру контрастирования в артериальную фазу на две группы: гиперваскулярные и негиперваскулярные. Результаты. Было выявлено 43 гиперваскулярных и 31 негиперваскулярных нейроэндокринных опухолей. Негиперваскулярные НЭО, по сравнению с протоковыми аденокарциномами, чаще имели ровные и четкие контуры и кистозный компонент в структуре (p
Мскт, поджелудочная железа, нейроэндокринная опухоль, протоковая аденокарцинома
Короткий адрес: https://sciup.org/149132079
IDR: 149132079
Текст научной статьи Дифференциальная диагностика негиперваскулярных нейроэндокринных опухолей поджелудочной железы и протоковой аденокарциномы по данным МСКТ с внутривенным болюсным контрастированием
Нейроэндокринные опухоли поджелудочной железы возникают из APUD-клеток (Amine Precursor Uptake and Decarboxylation) поджелудочной железы [17]. Среди функционирующих опухолей наиболее часто встречаются инсулиномы (60 – 75%) и гастриномы (20 – 30%), остальные опухоли, глюкагономы, VIP-омы, соматостатиномы, АКТГ-омы и др., встречаются значительно реже [2, 132]. Нефункционирующие опухоли часто остаются бессимптомными до тех пор, пока их рост не начинает вызвать компрессию или инвазию окружающих органов, сосудов [1]. В 2010 году Всемирной Организацией Здравоохранения (ВОЗ) была предложена современная классификация нейроэндокринных опухолей [7]. На основании количества митозов в клетках опухоли в 10 репрезентативных полях зрения и значения индекса пролиферации Ki-67 было выделено 3 степени злокачественности (grade) НЭО: высокодифференцированные НЭО (включающие grade 1 и grade 2) и нейроэндокринные карциномы (grade 3).
Использование МСКТ или МРТ с внутривенным болюсным контрастным усилением позволяет определить локализацию и стадию опухоли и является неотъемлемым этапом в диагностическом процессе. Типичным признаком НЭО, ввиду хорошо развитой капиллярной сети, является интенсивное накопление контрастного препарата в артериальную фазу динамического контрастирования, тем не менее, до 41% НЭО поджелудочной железы являются гиповаскулярными [11].
Диагностика нефункционирующих НЭО поджелудочной железы затруднена, так как такие опухоли не имеют специфической клинической симптоматики, и часто они выявляются на более поздней стадии. [5, 20]. В таких ситуациях необходимо проведение дифференциальной диагностики с другими образованиями поджелудочной железы, в частности, с протоковой аденокарциномой [3, 9, 10]. Целью настоящего исследования являеюся изучение признаков, характерных для гиповаскулярных НЭО, и оценка возможностей МСКТ с внутривенным контрастированием в дифференциальной диагностике гиповаскулярных нейроэндокринных опухолей поджелудочной железы и протоковых аденокарцином.
Материалы и методы
В ретроспективный анализ включены 74 пациента, оперированных в Институте хирургии им. А.В. Вишневского по поводу НЭО поджелудочной железы в период с сентября 2011 по октябрь 2017 г. Группу сравнения составили 80 пациентов, прошедших хирургическое лечение в связи с удалением протоковой аденокарциномы поджелудочной железы (с июня 2017 по июнь 2018 г.).
МСКТ проводили на мультидетекторных компьютерных томографах Philips Brilliance CT 64 и Philips Brilliance iCT 256. Были использованы следующие параметры сканирования: ширина среза 1 – 2 мм, питч 1, скорость вращения трубки 0,75 с. Использовалось напряжение на трубке 120 кВт, сила тока- 150 – 500 мАс. Введение контрастного препарата производилось со скоростью 4 – 5 мл/сек. Болюс контрастного препарата сопровождался “преследователем болюса”. Для запуска сканирования использовали программный пакет bolus tracking. Локатор устанавливали на нисходящую аорту на 3 -5 см выше уровня диафрагмы. Для получения артериальной, венозной и отсроченной фаз сканирования начинали исследования на 10-й, 35-й и 180-й секундах после достижения порогового уровня плотности в просвете аорты.
Качественный и количественный анализ полученных изображений
Описывали локализацию патологического очага в ткани поджелудочной железы, наличие в структуре образования кальцинатов и очагов некроза, инвазию в парапанкреатическую жировую клетчатку и окружающие органы (двенадцатиперстную кишку, желудок) и наличие регионарных и отдаленных метастазов. Описывали контуры образования: четкие или нечеткие. По своей структуре все очаги были разделены на 2 группы: солидные и солидно-кистозные. Образования разделяли по характеру накопления контрастного препарата солидным компонентом на гомогенные и негомогенные. Размеры опухоли измеряли по наибольшему диаметру в мм.
На одном и том же уровне сканирования во все фазы контрастного усиления замеряли плотность в ед. Н в очаге и прилежащей ткани поджелудочной железы (ROI не менее 1 см2).
Также измерялось отношение плотности опухоли к плотности паренхимы поджелудочной железы в различные фазы контрастирования, которое рассчитывалось по формуле: k = Xt/Xp, где Xt - плотность опухоли в ед. Н, Хр - плотность прилежащей паренхимы поджелудочной железы в ед. Н.
Все НЭО были разделены на две группы: гиперваскулярные НЭО (плотность которых выше чем плотность прилежащей паренхимы поджелудочной железы как минимум на 10 ед. Н) и негиперваскулярные НЭО.
Методы статистической обработки данных
Для каждого количественного параметра были определены: среднее значение (M), среднеквадратическое отклонение (δ), стандартная ошибка (m), 95% доверительный интервал, для качественных данных - частоты (%). Для сравнения числовых данных использовали t-критерий Стьюдента или U-критерий Манна Уитни для 2-х независимых выборок. Для оценки соответствия распределений качественных МСКТ-признаков в выборках использовали критерий Хи-квадрат Пирсона с поправкой Йейтса, точный критерий Фишера. Статистически значимыми считали отличия при p<0,05 (95% уровень значимости).
Результаты
По характеру контрастирования в артериальную фазу контрастного усиления все
НЭО были разделены на две группы: гиперваскулярные (43/74, 58%) и негиперваскулярные (31/74, 42%) (Рис. 1, 2). В группу сравнения входили пациенты с протоковыми аденокарциномами поджелудочной железы (n=80). Статистически доказанных различий по полу и возрасту, а также локализации опухоли в поджелудочной железе между группами пациентов выявлено не было.
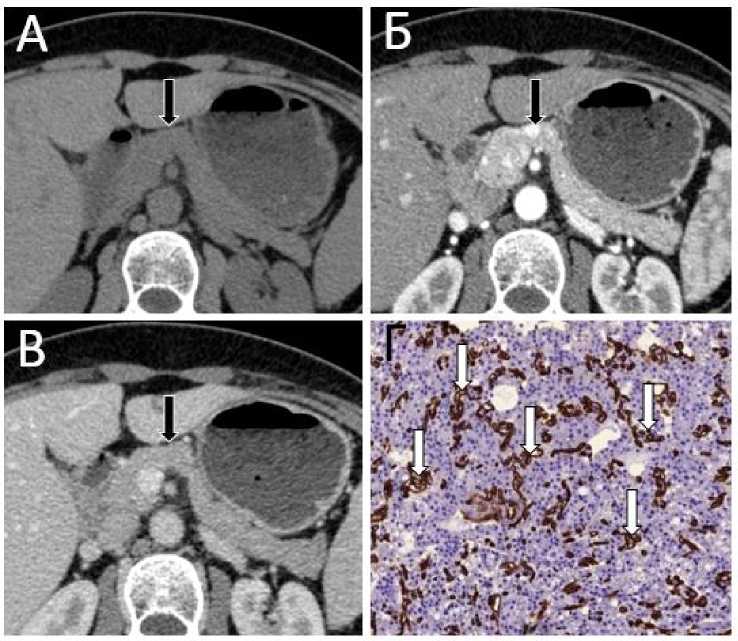
Рисунок 1 . Пример гиперваскулярной нейроэндокринной опухоли поджелудочной железы.
Пациентка 40 лет с гистологически верифицированной нейроэндокринной опухолью поджелудочной железы Grade 1 (Ki-67 - 2%). Серия КТ-изображений полученных в нативную (А), артериальную (Б) и венозную (В) фазы контрастного усиления. В перешейке поджелудочной железы визуализируется гомогенное образование малых размеров с чёткими контурами (черная стрелка), интенсивно накапливающее контрастный препарат, максимально в артериальную фазу контрастного усиления. Г – иммуногистохимическое исследование, экспрессия CD34 в эндотелии сосудов опухоли, увеличение х 200 (белая стрелка). MVD=8,8 %, что свидетельствует о высокой степени васкуляризации опухоли.
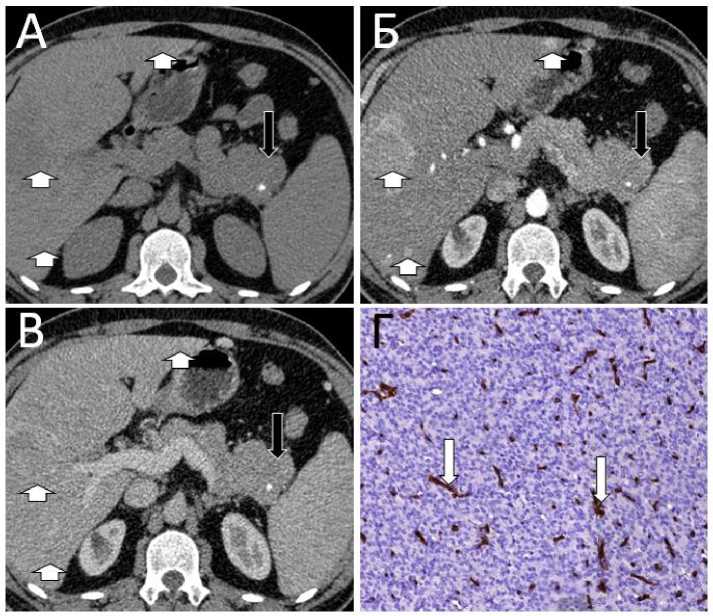
Рисунок 2 . Пример негиперваскулярной нейроэндокринной опухоли поджелудочной железы. Пациент 36 лет с гистологически верифицированной нейроэндокринной опухолью поджелудочной железы Grade 3 (Ki-67 более 20%). Серия КТ-изображений полученных в нативную (А), артериальную (Б) и венозную (В) фазы контрастного усиления. В хвосте поджелудочной железы визуализируется образование с нечёткими неровными контурами, гиподенсное в артериальную и венозную фазы контрастирования (черная стрелка). В структуре опухоли в нативную фазу визуализируется гиперденсный кальцинат. В паренхиме печени определяются метастазы нейроэндокринной опухоли
(короткая стрелка). Г – иммуногистохимическое исследование, экспрессия CD34 в эндотелии сосудов опухоли, увеличение х х200 (белая стрелка). MVD=2,0 %, что свидетельствует о низкой степени васкуляризации НЭО.
Большинство гиперваскулярных опухолей имели степени злокачественности Grade 1 (74%), в то время как большинство негиперваскулярных НЭО имели степень злокачественности Grade 2 и Grade 3, p<0.001. Негиперваскулярные опухоли чаще были нефункционирующими и не имели специфической клинической симптоматики (в 58 % случаев), в то время как гиперваскулярные НЭО чаще были функционирующими (в 67% случаев), p=0.029.
Негиперваскулярные НЭО, по сравнению с протоковымиаденокарциномами, чаще имели ровные и четкие контуры и чаще имели кистозный компонент в структуре. Кальцинаты в структуре протоковых аденокарцином отсутствовали и встречались только в структуре негиперваскулярных НЭО (Табл. 1).
Таблица 1. Сравнение МСКТ-признаков гиперваскулярных НЭО, негиперваскулярных НЭО и протоковых аденокарцином поджелудочной железы во все фазы исследования
|
МСКТ-признак |
Негиперваскулярные НЭО (n=31) |
Протоковая аденокарцинома (n=80) |
Р |
|
Размер (мм) |
24.8 ± 11.2 |
26,1 ± 8.8 |
0,794 |
|
Контур опухоли |
|||
|
Четкий |
18 |
20 |
0.001 |
|
Нечеткий |
13 |
60 |
|
|
Наличие в структуре кальцинатов |
|||
|
Есть |
4 |
0 |
0.001 |
|
Нет |
27 |
80 |
|
|
Расширение панкреатического протока (>3 мм) |
|||
|
нет |
25 |
3 |
<0.0001 |
|
есть |
6 |
77 |
|
|
Структура опухоли |
|||
|
кистозно-солидная |
8 |
2 |
0.0001 |
|
солидная |
23 |
78 |
|
|
Накопление контрастного препарата |
|||
|
гомогенное |
18 |
54 |
0.350 |
|
негомогенное |
13 |
26 |
|
|
Инвазия в окружающую жировую клетчатку |
|||
|
нет |
23 |
15 |
<0.0001 |
|
есть |
8 |
65 |
|
|
Инвазия в сосуды |
|||
|
нет |
24 |
38 |
0.011 |
|
есть |
7 |
42 |
|
Протоковые аденокарциномы поджелудочной железы, в свою очередь, чаще вызывали расширение главного панкреатического протока, инвазию в окружающую жировую клетчатку и окружающие сосуды. При сравнении значений относительного контрастного усиления опухолей (отношении плотности образования к плотности паренхимы поджелудочной железы) было выявлено, что среднее значение отношения плотности опухоли к плотности паренхимы поджелудочной железы в венозную фазу у негиперваскулярных НЭО было значительно выше, чем у протоковых аденокарцином поджелудочной железы. (Табл. 2, Рис. 3).
Таблица 2. Сравнение параметров контрастирования гиперваскулярных НЭО, негиперваскулярных НЭО и протоковых аденокарцином поджелудочной железы все фазы исследования
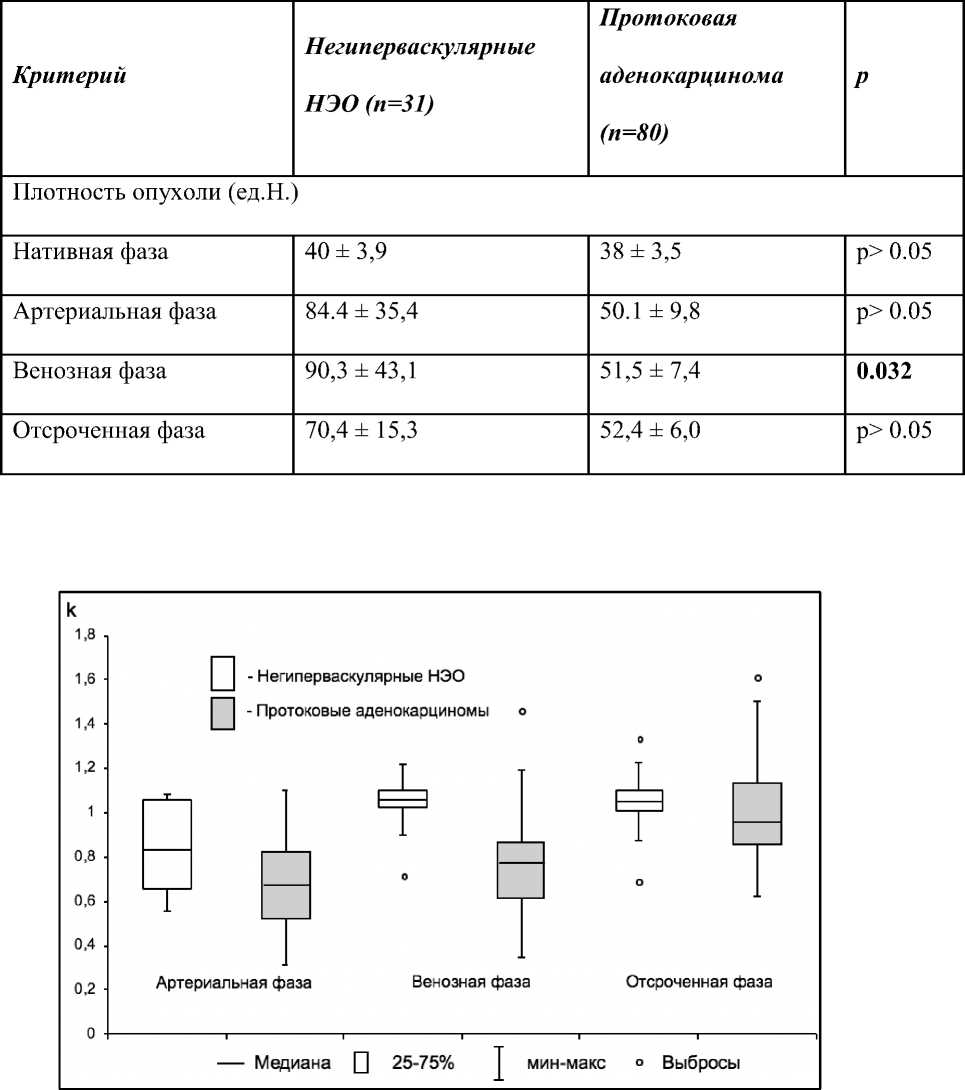
Рисунок 3. Отношение плотности опухоли к плотности паренхимы поджелудочной железы (k) в артериальную, венозную и отсроченные фазы контрастного усиления (график «ящик с усами»).
Таким образом, были определены МСКТ-признаки, обладающие наибольшей чувствительностью в дифференциальной диагностике между негиперваскулярными НЭО и протоковыми аденокарциномами поджелудочной железы. Были рассчитаны чувствительность, специфичность, прогностическая ценность положительного результата (ppv), прогностическая ценность отрицательного результата (npv) для каждого из выбранных МСКТ-признаков (Табл.3).
Таблица 3. Диагностические возможности МСКТ с в/в контрастированием в дифференциальной диагностике негиперваскулярных НЭО от протоковых аденокарцином поджелудочной железы
|
МСКТ-критерий |
чувствитель ность |
специфич ность |
ppv |
npv |
точнос ть |
|
Четкий контур опухоли |
58,06% |
74,58% |
46,95% |
82,11% |
69,96% |
|
Наличие кальцинатов в структуре опухоли |
12,90% |
100,00% |
100,00% |
74,77% |
75,68% |
|
Отсутствие расширения ГПП |
80,65% |
96,61% |
90,21% |
92,80% |
92,15% |
|
Отсутствие инвазии сосудов |
74,19% |
52,54% |
37,73% |
84,01% |
58,59% |
|
Отсутствие инфильтрации парапанкреатической жировой клетчатки |
71,88% |
81,36% |
60,66% |
87,85% |
79,36% |
|
Наличие кистозного компонента в опухоли |
25,81% |
94,92% |
66,29% |
76,75% |
75,61% |
|
(k) вен. более 0,9 |
75,00% |
76,36% |
48,00% |
91,30% |
76,06% |
Наибольшей точностью в определении негиперваскулярных нейроэндокринных опухолей обладали: отсутствие расширения панкреатического протока (точность 92%), отсутствие инфильтрации парапанкреатической клетчатки (79%), отношение плотности опухоли к плотности паренхимы поджелудочной железы в венозную фазу более 0,9 (76%). Обсуждение
Типичным признаком нейроэндокринных опухолей поджелудочной железы, ввиду хорошо развитой капиллярной сети, является интенсивное накопление контрастного препарата в артериальную фазу динамического контрастирования. Тем не менее, до 41% НЭО поджелудочной железы являются гиповаскулярными [11]. Низкая степень накопления контрастного препарата некоторыми НЭО объясняется меньшей степенью васкуляризации опухоли, то есть плотностью мелких сосудов на единицу площади – microvascular density (MVD) [8]. Также низкая интенсивность контрастирования может быть обусловлена выраженным фиброзом или наличием некроза в структуре опухоли, которые чаще встречаются в НЭО с более высокой степенью злокачественности (Grade 2 и 3) [6].
По результатам нашего исследования, 42% среди всего числа нейроэндокринных опухолей были изо- или гиподенсными относительно прилегающей паренхимы поджелудочной железы. Наши результаты сходны с результатами других авторов. По данным Rodallec и соавт., 39% нэйроэндокринных опухолей поджелудочной железы были изо- или гиподенсны относительно окружающей паренхимы поджелудочной железы [19].
По данным предыдущих исследований, степень васкуляризации НЭО поджелудочной железы, косвенно определяемая при МСКТ с внутривенным контрастированием, позволяет предсказать на дооперационном этапе степень злокачественности опухоли. Нейроэндокринные опухоли низкой степени злокачественности обычно имеют типичные признаки, такие как ровные четкие контуры, гомогенное контрастное усиление и гиперденсность в артериальную и венозную фазы контрастного усиления [15]. Напротив, опухоли с высокой степенью злокачественности обычно имеют нетипичные признаки, такие как нечеткие контуры, неоднородное контрастное усиление, гиповаскулярность в артериальную и венозную фазы контрастного усиления, расширение главного панкреатического протока.
По результатам нашего исследования также была выявлена корреляция между характером контрастирования нейроэндокринной опухоли и степенью её злокачественности. Среди 43 гиперваскулярных НЭО 32 образования (74%) имели степень злокачественности Grade 1, 10 образований – Grade 2 и всего одно – Grade 3, p=0.0001. При этом среди негиперваскулярных НЭО большинство образований (24, 77%) имели степень злокачественности Grade 2 – 3, и всего 7 образований (23%) имели степень злокачественности Grade 1.
Негиперваскулярные НЭО достаточно сложно отличить от других солидных образований поджелудочной железы, в частности, от протоковых аденокарцином. Протоковая аденокарцинома поджелудочной железы – это злокачественное новообразование, исходящее из эпителия железистой ткани или протоков поджелудочной железы. Рак поджелудочной железы является самым часто встречаемым злокачественным новообразованием поджелудочной железы (до 90% всех опухолей) [4].
Протоковые аденокарциномы наиболее часто визуализируются как гиповаскулярные (гиподенсные) солидные образования в структуре поджелудочной железы [18]. Наиболее типичный признак протоковой аденокарциномы поджелудочной железы – это расширение главного панкреатического протока и атрофия паренхимы поджелудочной железы проксимальнее уровня блока. Тонкоигольная аспирационная биопсия образования также является неотъемлемым этапом в диагностике рака поджелудочной железы. НЭО поджелудочной железы, по сравнению с протоковой аденокарциномой, имеют лучший прогноз и не требуют столь расширенного оперативного вмешательства [12, 13, 20].
По результатам нашего исследования, расширение главного панкреатического протока являлось признаком, обладающим наибольшей чувствительностью и специфичностью в выявлении протоковой аденокарциномы (p<0.0001). Нейроэндокринные опухоли поджелудочной железы, в отличие от протоковых аденокарцином, не произрастают из протокового эпителия и, за исключением крупных опухолей с масс-эффектом, редко вызывают обструкцию панкреатического протока [14].
Также в нашем исследовании негиперваскулярные НЭО чаще, чем протоковые аденокарциномы имели чёткие и ровные контуры (58% vs. 25%, p<0.001) и кистозносолидную структуру (26% vs. 2,5%, p<0.001). Наличие кальцинатов в структуре опухоли являлось признаком, обладающим наибольшей специфичностью (100%) в выявлении НЭО. Относительное контрастное усиление опухоли в венозную фазу у протоковых аденокарцином было значительно ниже (0.78 ± 0.20) чем у негиперваскулярных НЭО (1.02 ± 0.14), p= 0,012. Во многом наши результаты схожи с данными литературы.
Kim и соавт. сравнивали 31 нейроэндокринную опухоль с нетипичными проявлениями на МСКТ и 29 протоковых аденокарцином поджелудочной железы. Было выявлено, что расширение панкреатического протока являлось единственным независимым предиктором протоковой аденокарциномы поджелудочной железы [16]. Однако было выявлено, что протоковые аденокарциномы чаще характеризовались гомогенным контрастным усилением (p=0.019). Вероятно, различие в наших результатах объясняется различными критериями включения в исследование.
Выводы
По результатам нашего исследования, расширение главного панкреатического протока являлось признаком, обладающим наибольшей чувствительностью и специфичностью в выявлении протоковой аденокарциномы (p<0.0001). Также в нашем исследовании негиперваскулярные НЭО чаще, чем протоковые аденокарциномы имели чёткие и ровные контуры (p<0.001) и кистозно-солидную структуру (p<0.001). Наличие кальцинатов в структуре опухоли являлось признаком, обладающим наибольшей специфичностью (100%) в выявлении НЭО.
Характер накопления контрастного препарата негиперваскулярными НЭО и протоковыми аденокарциномами также существенно различался. Относительное контрастное усиление опухоли в венозную фазу у протоковых аденокарцином было значительно ниже (0.78 ± 0.20) чем у негиперваскулярных НЭО (1.02 ± 0.14), p= 0,012.
Наибольшей точностью в определении негиперваскулярных нейроэндокринных опухолей обладали: отсутствие расширения панкреатического протока (точность 92%), отсутствие инфильтрации парапанкреатической клетчатки, отношение плотности опухоли к плотности паренхимы поджелудочной железы в венозную фазу более 0,9 (76%).
Таким образом, МСКТ с внутривенным контрастированием является достаточно эффективным дополнительным инструментом, позволяющим проводить дооперационную дифференциальную диагностику между негиперваскулярными НЭО и протоковыми аденокарциномами поджелудочной железы. Совместная интерпретация патоморфологической и рентгенологической картины должна привести к снижению ложной диагностики негиперваскулярных НЭО как протоковых аденокарцином поджелудочной железы и определению более подходящей тактики лечения.
Список литературы Дифференциальная диагностика негиперваскулярных нейроэндокринных опухолей поджелудочной железы и протоковой аденокарциномы по данным МСКТ с внутривенным болюсным контрастированием
- Делекторская В.В. Нейроэндокринные опухоли пищеварительной системы: морфологические и молекулярные особенности. Успехи молекулярной онкологии. 2015. № 1. С. 52-60.
- Кочатков А.В., Коваленко З.А. Эпидемиология нейроэндокринных неоплазий. Хирургия. Журнал им. Н.И. Пирогова. 2016. № 9. С. 94-100.
- Кочатков А.В., Кубышкин В.А., Кригер А.Г. и др. Диагностика нейроэндокринных неоплазий поджелудочной железы. Хирургия. Журнал им. Н.И. Пирогова. 2014. Т. 2. С. 8-15.
- Мартынова Н.В, Нуднов Н.В. Современное состояние проблемы лучевой диагностики новообразований поджелудочной железы (обзор литературы). Медицинская визуализация. 2015. № 5. С. 22-31.
- Arnold R. Endocrine tumours of the gastrointestinal tract. Introduction: definition, historical aspects, classification, staging, prognosis and therapeutic options. Best Pract Res Clin Gastroenterol. 2005. V. 19. No. 4. P. 491-505.
- Belousova E., Karmazanovsky G., Kriger A., et al. Contrast-enhanced MDCT in patients with pancreatic neuroendocrine tumours: correlation with histological findings and diagnostic performance in differentiation between tumour grades. Clin Radiol. 2017. V. 72. No. 2. P. 150-158.
- Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumours of the digestive system. Fourth Edition. Lyon. IARS. 2010. 417 p.
- d'Assignies G., Couvelard A., Bahrami S., et al. Pancreatic endocrine tumours: tumour blood flow assessed with perfusion CT reflects angiogenesis and correlates with prognostic factors. Radiology. 2009. V. 250. No. 2. P. 407-416.
- Dixon E., Pasieka J.L. Functioning and nonfunctioning neuroendocrine tumors of the pancreas. Curr Opin Oncol. 2007. V. 19. No. 1. P. 30-35.
- Franko J., Feng W., Yip L.J., et al. Non-functional neuroendocrine carcinoma of the pancreas: incidence, tumor biology, and outcomes in 2,158 patients. J Gastrointest Surg. 2010. V. 14. No. 3. P. 541-548.
- Halfdanarson T.R., Rabe K.G., Rubin J., Petersen G.M. Pancreatic neuroendocrine tumours (pNETs): incidence, prognosis and recent trend toward improved survival. Ann Oncol. 2008. V. 19. No. 10. P. 1727-1733.
- Jensen R.T., Cadiot G., Brandi M.L., et al. Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology. 2012. V. 95. No. 2. P. 98-119.
- Jensen R.T., Cadiot G., Brandi M.L., et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Barcelona Consensus Conference. Neuroendocrinology. 2012. V.95. No. 2. P. 98-119.
- Kawamoto S., Shi C., Hruban R.H., Choiti M.A., et al. Small serotonin-producing neuroendocrine tumor of the pancreas associated with pancreatic duct obstruction. AJR Am JRoentgenol. 2011. V. 197. No. 3. P. W482-488.
- Kim D.W., Kim H.J., Kim K.W., et al. Neuroendocrine neoplasms of the pancreas at dynamic enhanced CT: comparison between grade 3 neuroendocrine carcinoma and grade 1/2 neuroendocrine tumour. Eur Radiol. 2015. V. 25. No. 5. P. 1375-1383.
- Kim J.H., Eun H.W., Kim Y.J., et al. Pancreatic neuroendocrine tumour (PNET): Staging accuracy of MDCT and its diagnostic performance for the differentiation of PNET with uncommon CT findings from pancreatic adenocarcinoma. Eur Radiol. 2016. V. 26. No. 5. P. 1338-1347.
- Pearse A.G. The cytochemistry and ultrastructure of polypeptide hormone-producing cells of the APUD series and the embryologic, physiologic and pathologic implications of the concept. J Histochem Cytochem. 1969. V. 17. No. 5. P. 303-313.
- Prokesch R.W., Chow L.C., Beaulieu C.F., et al. Isoattenuating pancreatic carcinoma at multi-detector row CT: secondary signs. Radiology. 2002. V. 224. No. 3. P. 764-768.
- Rodallec M., Vilgrain V., Couvelard A., et al. Endocrine pancreatic tumours and helical CT: contrast enhancement is correlated with microvascular density, histoprognostic factors and survival. Pancreatology. 2006. V. 6. No. 1-2. P. 77-85.
- Serafini S., Da Dalt G., Pozza G., et al. Collision of ductal adenocarcinoma and neuroendocrine tumor of the pancreas: a case report and review of the literature. World J Surg Oncol. 2017. V. 15. No. 1. P. 93.


