Дифференциальная диагностика злокачественных опухолей головного мозга
Автор: Красникова О.В., Кондратьева А.Р., Пискунова М.С., Красникова Д.М., Кондрашина О.В., Кольтюкова Н.В.
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Рубрика: Медицина
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
В настоящее время диагностика различных видов злокачественных опухолей головного мозга (далее - ЗОГМ) осуществляется с использованием целого ряда методов визуализации (магнитно-резонансная томография, электроэнцефалография, позитронно-эмиссионная томография, биопсия головного мозга), которые имеют ряд недостатков, таких как неточность и инвазивность, влекущие за собой определенные риски для здоровья пациента. В связи с этим одной из актуальных задач современной медицинской науки является поиск более достоверных и безопасных способов диагностики глиом, в том числе поиск биомаркеров данного вида злокачественных опухолей в крови. Многочисленные исследования свидетельствуют об изменении содержания циркулирующей ДНК в крови при различных видах рака, в том числе ЗОГМ. В связи с чем целью работы стало качественное и количественное определение продуктов распада ДНК в сыворотке крови больных с разными видами злокачественных опухолей головного мозга. В ходе работы было установлено, что продукты распада ДНК присутствуют в плазме крови и у здоровых добровольцев и больных с злокачественными опухолями головного мозга. В частности, в серии клинических исследований с использованием метода ИК-спектроскопии выявлено снижение содержания пуриновых оснований в растворе плазмы крови больных ЗОГМ. Визуализация ИК-спектров плазмы крови больных с глиобластомой и анапластической астроцитомой позволила дифференцировать эти опухоли между собой.
Злокачественные опухоли головного мозга, глиобластома, астроцитома, инфракрасная спектроскопия, продукты распада днк, циркулирующая днк
Короткий адрес: https://sciup.org/148330469
IDR: 148330469 | УДК: 616-006.48 | DOI: 10.18101/2306-1995-2024-3-32-40
Текст научной статьи Дифференциальная диагностика злокачественных опухолей головного мозга
Введение. В настоящее время актуальным вопросом в медицине остается поиск потенциальных предикторов злокачественных опухолей головного мозга в жидких средах организма, таких как спинномозговая жидкость и кровь.
Для диагностики заболеваний в медицине используют биомаркеры — биологические индикаторы патологического процесса или фармакологического ответа на терапевтическое воздействие [1]. С их помощью определяется или подтверждается наличие заболевания, устанавливается подтип заболевания [2]. В кровь и ликвор поступает содержимое опухолей, продукты метаболизма злокачественных клеток, и их как количественное, так и качественное определение в данных жидкостях может выступать в роли диагностического критерия. Так, например, диагностическими биомаркерами глиом могут выступать микроРНК, внеклеточные нуклеиновые кислоты, белки и отдельные аминокислоты, циркулирующие клетки опухоли, экзосомы, микроэлементы и другие вещества [3].
Свободно-циркулирующие ДНК (сцДНК) — это низкомолекулярные двухцепочечные молекулы геномной ДНК, фрагментированные на короткие (70-200 пар оснований) и длинные (до 21 тыс. пар оснований) отрезки, устойчивые к РНКазам и проназам, но расщепляемые с помощью ДНКазы I [4; 5].
В настоящее время растет число исследований, посвященных анализу сцДНК плазмы крови, совершенствуются методы, позволяющие проводить их изучение, однако до сих пор недостаточно изучены механизмы высвобождения и циркуляции сцДНК, а также их биологическая роль в прогрессировании онкологии. Существенными недостатками в изучении сцДНК являются гетерогенность опухолевой ткани, отсутствие высокочувствительных методов анализа, а также малые выборки больных, включенных в программы клинических исследований.
По нашему мнению, инфракрасная спектроскопия является перспективным методом диагностики в этом направлении [6; 7]. Известны исследования авторов по изучению ИК-спектроскопии опухолевых тканей в диагностике опухолей головного мозга и в определении молекулярно-генетического профиля опухоли, в частности определение мутации изоцитратдегидроеназы (IDH). Авторами показано, что ИК-спектры опухолевых и неопухолевых тканей при разной онкопатологии, серого и белого вещества головного мозга, тканей астроцитом и глиобластом отличаются друг от друга [8; 9]. Всеми авторами отмечается высокая эффективность и чувствительность метода ИКС тканей в диагностике и дифференциальной диагностике опухолевых заболеваний [11; 12]. Имеются немногочис- ленные работы по применению инфракрасной спектроскопии сыворотки крови для дифференциальной диагностики ОГМ и определения их степени злокачественности [13–15].
Цель работы: качественное и количественное определение продуктов распада ДНК в сыворотке крови больных с разными видами злокачественных опухолей головного мозга.
Материалы и методы исследования. Исследование проводили в научноисследовательской лаборатории кафедры общей химии Приволжского исследовательского медицинского университета г. Нижнего Новгорода.
Исследовали венозную кровь больных со злокачественными опухолями головного мозга: анапластическая астроцитома (grade III) (n=5), анапластическая глиобластома (grade IV) (n=5) — пациенты находились на лечении в Университетской клинике ПИМУ, а также сыворотку крови здоровых добровольцев (n=5) (сотрудники ПИМУ). От пациентов было получено добровольное согласие.
Образец крови готовили следующим образом: кровь в количестве 5 мл забирали у обследуемых больных из кубитальной вены утром натощак до приема медикаментов. Затем ее центрифугировали в течение 15 мин при 1000 об/мин. Полученную сыворотку в объеме 1,0 мл высушивали в сухожаровом шкафу в чашке Петри при температуре 25 °С в течение 12 часов.
Для качественного определения компонентов циркулирующей ДНК в плазме крови проводили аналитические реакции по выявлению пуриновых оснований, дезоксирибозы и фосфорной кислоты в плазме крови.
Пуриновые основания определяли в качественной реакции с аммиачным раствором нитрата серебра. Для этого в пробирку добавляли 0,015 г сухой плазмы крови, 2 мл дистиллированной воды, 2 мл 10% NaOH и 10 капель 1%-ного раствора AgNO 3 . О наличии в исследуемых пробах пуриновых оснований судили по образованию осадка их серебряных солей, окрашенных в светлокоричневый цвет.
Дезоксирибозу и рибозу определяли в качественной реакции с дифениламином. К 0,015 г сухой плазмы крови добавляли 20 капель 1%-ного раствора дифениламина и кипятили на водяной бане в течение 15 минут.
О наличии в пробах дезоксирибозы судили по развитию синего окрашивания, имея в виду, что ее нагревание в кислой среде способствует образованию фурфурола, оксилевулинового альдегида и ряда других хромогенов, конденсирующихся с дифениламином и образующих соединения, имеющих синий цвет. В свою очередь, о наличии в пробах рибозы судили по развитию зеленого окрашивания.
Фосфорную кислоту определяли в молибденовой пробе. К 0,015 г сухой плазмы крови добавляли 10 капель молибденового реактива (раствора молибденовокислого аммония в азотной кислоте) и кипятили на водяной бане. Затем охлаждали пробирки под струей воды и наблюдали образование лимонножелтого осадка молибдатофосфата аммония.
В основе данной методики лежит реакция образования молибдатофосфата аммония при взаимодействии молибдата аммония с фосфорной кислотой:
Н 3 РО 4 +12(NH 4 ) 2 MoO 4 +21HNO 3 →(NH 4 ) 3 PO 4 •12MoO 3 +21NH 4 NO 3 +12Н 2 О
Количественное определение продуктов распада ДНК осуществляли с помощью физико-химического метода — ИК-спектроскопии. Высушенный образец сыворотки крови измельчали и перемешивали с растворителем — вазелиновым маслом. Регистрацию инфракрасных спектров производили на спектрофотометре Specord 75 IR в области волновых чисел 1200– 800 см-1 [16–18].
Результаты работы и их обсуждение. На первом этапе исследования проводили качественное определение содержания продуктов распада ДНК в сыворотке крови.
Сыворотку крови больных анапластической глиобластомой, анапластической астроцитомой и здоровых добровольцев взвешивали на электронных весах (0,015 г) и растворяли в дистиллированной воде (2 мл). Проводили качественные реакции определения компонентов циркулирующей ДНК в плазме крови по выявлению пуриновых оснований, дезоксирибозы и фосфорной кислоты в плазме крови. По появлению характерного окрашивания исследуемых растворов делали вывод о наличии всех перечисленных компонентов распада ДНК в сыворотке крови.
Таким образом, в ходе проведенных реакций нам удалось качественно обнаружить продукты распада в плазме крови — пуриновые азотистые основания, дезоксирибозу и фосфорную кислоту.
На втором этапе исследования методом ИК-спектроскопии количественно определяли изменение содержания пуриновых азотистых оснований в плазме крови при разной степени злокачественности. Для этого высушили осадки серебряных солей пуриновых оснований в плазме крови больных ЗОГМ анапластической глиобластомой, анапластической астроцитомой и здорового добровольца в чашках Петри, а затем проводили регистрацию ИК-спектров образцов нативной сыворотки и сыворотки с осадками в диапазоне длин волн 1200–800 см- (рис. 1–3).
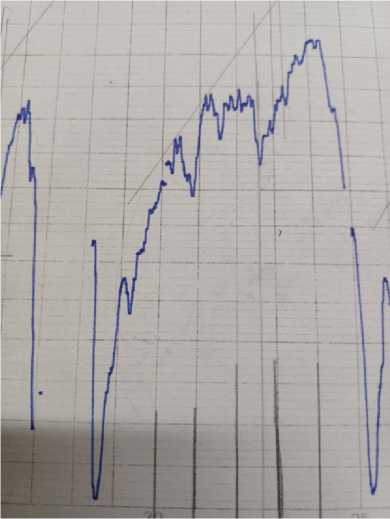
Рис. 1. ИК-спектр плазмы крови больного анапластической глиобластомой и плазмы с осадком
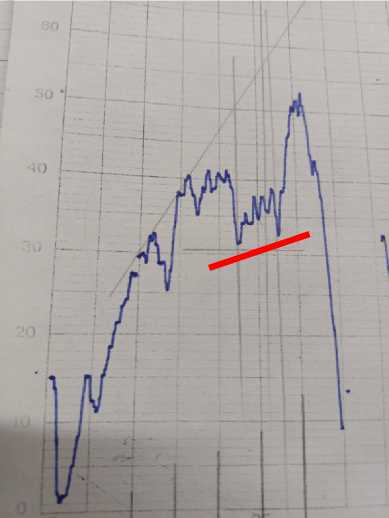
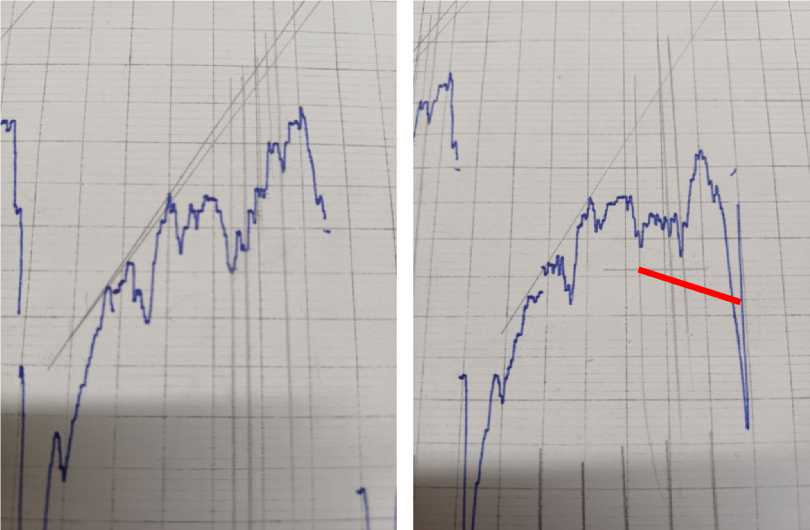
Рис. 2. ИК-спектр плазмы крови больного анапластической астроцитомой и плазмы с осадком
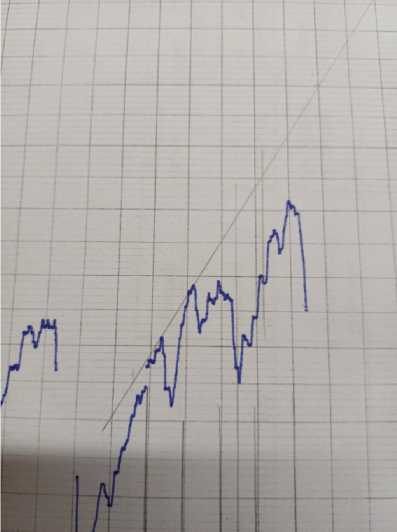
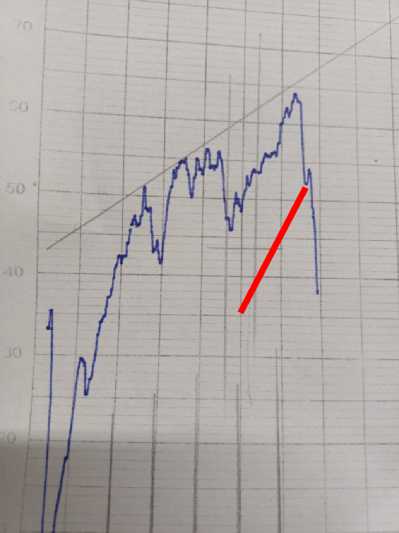
Рис. 3. ИК-спектр плазмы крови здорового добровольца и плазмы с осадком
Было выявлено усиление максимумов при полосах поглощения 940 и 878 см-1 ИК-спектра, которые на основании литературных данных и справочников являются полосами поглощения именно пуриновых азотистых оснований — гуанина и аденина.
Таким образом, используя простой метод визуализации, можно делать заключение о наличии и степени злокачественности опухоли мозга.
Далее рассчитали величину максимумов данных пиков. Для этого измерили расстояние в мм до касательной, проведенной по выступающим точкам спектра (табл. 1, 2).
Таблица 1 Изменение параметров ИК-спектров крови
|
Максимум, мм |
940 см-1 |
878 см-1 |
940/878 cм-1 |
|
Глиобластома+осадок |
28±1 |
36±3 |
0,78 |
|
Астроцитома+осадок |
27±1 |
41±1 |
0,66 |
|
Норма+осадок |
20±2 |
14 ±3 |
1,43 |
Как видно из таблицы 1, при глиобластоме частное от деления уменьшается на 45%, при астроцитоме — на 55%, что свидетельствует об уменьшении количества пуриновых оснований в плазме крови.
Таблица 2
Изменение параметров ИК-спектров крови
|
Максимум, мм |
940 см-1 |
878 см-1 |
940/878 cм-1 |
|
Глиобластома |
30±1 |
26±2 |
1,15 |
|
Астроцитомак |
29±1 |
24±1 |
1,21 |
|
Норма |
31±2 |
24 ±2 |
1,29 |
Как видно из таблицы 2, при глиобластоме частное от деления уменьшается на 11%, при астроцитоме — на 6 %, что коррелирует с данными по содержанию осадка и свидетельствует об уменьшении количества пуриновых оснований в плазме крови.
Заключение. Продукты распада ДНК, а именно пуриновые азотистые основания, дезоксирибоза и фосфорная кислота, имеют важное прогностическое значение. В ходе работы установили, что они присутствуют в плазме крови и у здоровых добровольцев и больных с ЗОГМ. Количественное определение содержания этих веществ методом ИК-спектроскопии показало снижение содержания пуриновых оснований, следовательно, и дезоксирибозы и фосфорной кислоты в растворе плазмы крови больных ЗОГМ. Визуализация ИК-спектров плазмы крови больных с глиобластомой и анапластической астроцитомой позволила дифференцировать эти опухоли между собой.
Список литературы Дифференциальная диагностика злокачественных опухолей головного мозга
- Биомаркеры в медицине: поиск, выбор, изучение и валидация / Е. С. Дон, А. В. Тарасов, О. И. Эпштейн, С. А. Тарасов // Клин. лаб. диагностика. 2017. Т. 62, № 1. С. 52–59. Текст: непосредственный.
- Califf R. M. Biomarker Definitions and Their Applications. Exp. Biol. Med. (Maywood). 2018; 243(3): 213–221. DOI: 10.1177/1535370217750088
- Müller Bark J., Kulasinghe A., Chua B., Day B.W., Punyadeera C. Circulating Biomarkers in Patients with Glioblastoma. Br. J. Cancer. 2020; 122(3): 295–305. DOI: 10.1038/s41416-019-0603-6
- Fleischhacker M., Schmidt B. Circulating nucleic acids (CNAs) and cancer - a survey. Biochim Biophys Acta. 2007; 1775(1): 181–232.
- Jahr S., Hentze H., Englisch S. et al. DNA fragments in the blood plasma of can- cer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001; 61(4): 1659–1665.
- Диагностика предраковых заболеваний слизистой оболочки рта методом инфракрасной спектроскопии / Л. Н. Казарина, А. С. Гордецов, О. В. Красникова [и др.] // Медико-фармацевтический журнал «Пульс». 2019. Т. 21, № 12. С. 77–82. Текст: непосредственный.
- Патент на изобретение RU 2664444 C1. Способ дифференциальной диагностики шизофрении и злокачественных новообразований головного мозга / А. С. Гордецов, О. В. Красникова, Л. Н. Касимова, А. А. Минаева, Е. К. Павлова. 17.08.2018. Заявка № 2017123470 от 03.07.2017.
- Fabelo H., Ortega S., Casselden E., Loh J., Bulstrode H., Zolnourian A., Grundy P., Callico G.M., Bulters D., Sarmiento R. SVM Optimization for Brain Tumor Identi- fication Using Infrared Spectroscopic Samples. Sensors (Basel). 2018; 18(12): 4487.
- Hollon T. C., Orringer D.A. Shedding Light on IDH1 Mutation in Gliomas. Clin Cancer Res. 2018; 24(11): 2467–2469.
- Cameron J. M., Butler H. J., Smith B. R., Hegarty M. G., Jenkinson M.D., Syed K., Brennan P.M., Ashton K., Dawson T., Palmer D., Baker M.J. Developing infrared spectroscopic detection for stratifying brain tumour patients: glioblastoma multiforme vs. lymphoma. Analyst. 2019; 144(22): 6736–6750.
- Патент на изобретение RU 2519151 C1, 10.06.2014. Способ дифференциальной диагностики новообразований головного мозга / А. С. Гордецов, О. В. Красникова, И. А. Медяник, И. Г. Терентьев. Заявка № 2013101333/15 от 10.01.2013.
- Medyanik I. A., Fraerman A. P., Gordetsov A. S., Krasnikova O. V., Terentev I. G., Lobanov I. A., Radovsky V. V., Karyakin N. N. The study of glioblastoma differentia- tion. Modern Technologies in Medicine. 2014; 6(2): 93–102.
- Hands J. R., Abel P., Ashton K., Dawson T., Davis C., Lea R.W, McIntosh A. J., Baker M. J. Investigating the rapid diagnosis of gliomas from serum samples using infrared spectroscopy and cytokine and angiogenesis factors. Anal Bioanal Chem. 2013; 405(23): 7347–7355.
- Hands J. R., Dorling K. M., Abel P., Ashton K. M., Brodbelt A., Davis C., Dawson T., Jenkinson M. D., Lea R. W., Walker C., Baker M. J. Attenuated Total Re- flection Fourier Transform Infrared (ATR-FTIR) spectral discrimination of brain tu- mour severity from serum samples. J Biophotonics. 2014; 7(3): 189–199.
- Hands J. R., Clemens G., Stables R. Brain tumour differentiation: rapid strati- fied serum diagnostics via attenuated total reflection Fourier-transform infrared spec- troscopy. J. Neurooncol. 2016; 127: 463–472.
- Красникова О. В., Гордецов А. С., Крылов В. Н. Изменение параметров ИК-спектров плазмы крови животных-опухоленосителей на фоне введения биологически активных добавок // Современные технологии в медицине. 2011. № 4. С. 18–21. Текст: непосредственный.
- Изменение параметров ИК-спектров биологических тканей животных-опухоленосителей на фоне совместного введения доксорубицина и озона / О. В. Красникова, А. С. Гордецов, К. Н. Конторщикова [и др.] // Современные технологии в медицине. 2011. № 3. С. 83–87. Текст: непосредственный.
- Изменение параметров ИК-спектров плазмы крови животных-опухоленосителей на фоне комплексного введения доксорубицина и озона / О. В. Красникова, А. С. Гордецов, К. Н. Конторщикова [и др.] // Вестник Нижегородского университета им. Н. И. Лобачевского. 2011. № 5–1. С. 105–109. Текст: непосредственный.


