Динамическая рефрактометрия живых клеток
Автор: Дам Тхе Лали Хунговна, Семин П.А., Кретушев А.В.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Технические науки
Статья в выпуске: 4-1 (79), 2023 года.
Бесплатный доступ
В настоящее время актуальны исследования в области микробиологии, множество методов разработаны для исследования на клеточном и молекулярном уровне. В данной работе приведен метод динамической рефрактометрии для исследования внутриклеточных процессов биологических объектов. В лаборатории когерентной фазовой микроскопии МИРЭА разработали метод динамической фазовой рефрактометрии. Метод применили для исследования нейронов, получили фазовое изображение, записали динамику и исследовали с помощью разработанной методики.
Микроскопия, нейрон, интерференция, фазовое изображение, профиль, динамика, рефрактометрия
Короткий адрес: https://sciup.org/170199117
IDR: 170199117 | DOI: 10.24412/2500-1000-2023-4-1-83-87
Текст научной статьи Динамическая рефрактометрия живых клеток
Современные методы оптического анализа биологических объектов, способны визуализировать объекты и процессы, происходящие в них, но основной тенденцией в настоящем времени является не достижение сверх дифракционного разрешения, а получение объективной количественной информации об этих объектах. Для этого разрабатываются различные микроскопические методы, среди которых особое место занимают интерференционные методы, способные представлять количественную информацию не инвазивным способом. Особенностью количественной информации является то, что величина оптической разности хода естественно нормирована на длину волны источника света и точность ее измерения практически не ограничена. В нашей лаборатории «Когерентной фазовой микроскопии» был создан микроскоп, работающий на принципах шаговой интерферометрии и разработан алгоритм получения фазовых и динамических изображений для получения количественных данных биообъекта.
Биообъект представляет собой неоднородный элемент (рис. 1), который располагается в кювете или на стеклянной подложке с иммерсионной жидкостью под покровным стеклом. После чего в чего в каждой точке плоскости изображения с интерференция, фазовое изображение, пропомощью фотоприёмного устройства измеряется интенсивность интерференционного поля и фаза рассеянной волны.
Фазовый микроскоп на основе многошагового метода расчета фазы - это устройство, позволяющее записывать фазовые изображения многошаговыми методами расчета фазы. Данный микроскоп позволяет автоматизировано записывать фазовые и динамические фазовые изображения 3-х, 4-х, и 5-ти (4+1) шаговыми методами расчета фазы. Расчёт и корректировка фазовых изображений производится с помощью ПК.
Экспериментальная установка (рис. 2) представляет из себя модифицированный микроинтерферометр Линника. Модификация заключается, в замене зеркала из опорного плеча интерферометра на сэндвич из кремниевого зеркала и пьезокерамики. Обкладки пьезокерамики подключены к электронному блоку управления (ЭБ), который в свою очередь по команде с компьютера (ПК) подаёт строго заданные напряжения, приводящие к движению пьезокорректора. К обзорному окну микроинтерферометра подключен приёмник, в роли которого выступает вебкамера со снятым объективом. Камера передаёт захваченное изображение (разрешением 640х480 пикселей) на компьютер через кабель USB. Связь электронного блока с ПК так же осуществляется через USB кабель. Источником излучения явля- ется Гелий-неоновый лазер «ЛГ-207а»,работающий на длине волны λ=632,8нм.
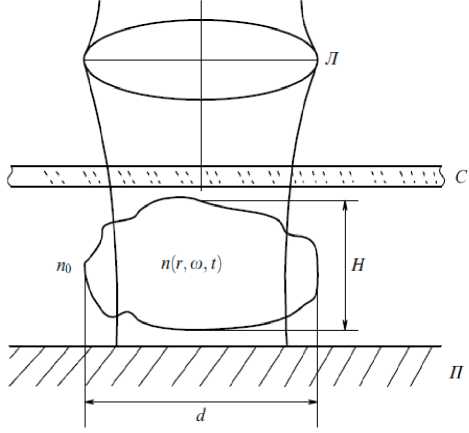
Рис. 1. Модель биообъекта. d – размер объекта, Н – толщина, n(r, ω,t) – тензор показателя преломления, Л – линза
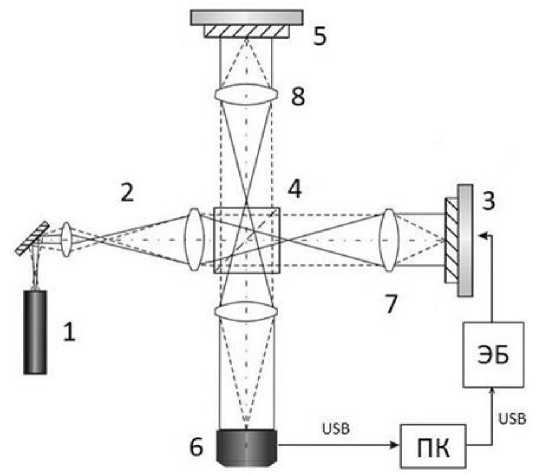
Рис. 2. Схема установки: 1 – He-Ne лазер ЛГ-207а (λ = 632,8 нм, P = 1 мВт; 2 – расширитель лазерного пучка; 3 – зеркало опорного канала интерферометра, закрепленное на пьезокерамике; 4 – светоделитель; 5 – кювета с измеряемым объектом; 6 – цифровая видеокамера; 7 – положительная линза; 8 – объектив; ЭБ – электронный блок управления пьезокерамикой; ПК – персональный компьютер.
Динамическая рефрактометрия живых клеток. Продолжая исследование биообъекта, основным и самым информативным способом получения данных является динамика внутриклеточных процес- сов. На основе метода когерентной фазовой микроскопии был разработан метод динамической фазовой рефрактивности, главным параметром которого является показатель рефрактивности Δn. Выбирает- ся участок фазового профиля и при частом и последовательном измерении показателя рефрактивности формируется трек-диаграмма, которая представляет собой двумерный массив данных h(x,y,t+mτ), где х,у – координаты пикселя в плоскости изображения фотоприемника, m =
0,1,2,3…, τ - время записи одного профиля. В результате получаем регистограмму изменений ОРХ в заданной точке профиля объекта в течении времени записи трек-диаграммы.
Был произведен расчет показателя ре-фрактивности:
d(t) (), где Δh(t) фазовая толщина объекта, равная разности уровня максимальной фазовой высоты объекта и уровня фазовой высоты среды, в которой находится объект; d(t) – поперечный размер объекта. Данные параметры получаем непосредственно из фазового профиля h(x), построенного по поперечной линии сечения объекта.
Фазовый профиль в момент времени t описывается:
h(x, t) = 2kn(t)V Rt2 — x2
Фазовая площадь S ϕ (t) поперечного сечения объекта будет равна произведению его геометрической площади S(t) на рефрактивность Δn(t) :
5^(t) = J_^ 2 An(t)VRt2 — x2dx = 2kn(t) ^R^Rt2 — x2 dx = ^n(t)S(t) (4)
Т.к. поперечное сечение нашего объекта имеет форму круга с площадью
(5),
5(t)=^d(t)2
то из выражений (2), (4) и (5) получаем систему из двух уравнений:
{
An(t) =
d(t) =
4S » (t) nd(t)2 ^h(t) ^n(t)
Решая систему уравнений (6), получаем расчётное выражение для мгновенной рефрак-тивности :
v 7 4 S V
В результате вычисления для каждого профиля трек-диаграммы значение рефрактивно-сти, формируется одномерный массив.
С помощью динамической рефрактометрии исследовали культуру нейронов. Для реализации метода электронный микроскоп Axiovert с объективом 20х. размер поля 80х60 мкм. Исследования проводились в чашках Петри с «окном» из покровного стекла. Клети выращивались на кремниевой пластине в течении двух суток.
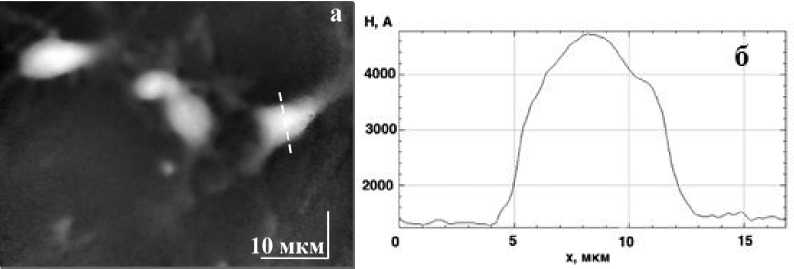
Рис. 3. (а) фазовое изображение культуры нейронов в норме., (б) поперечный фазовый профиль вдоль скан-линии на Рис.2(а).
На рисунке 3(а) представлено фазовое изображение культуры нейрона, полученное шаговым методом, после чего по сечению, указанному пунктирной линией, был взят профиль (рис. 3(б)). После добавления KCN и FCCCP отмечается уменьшение фазовой высоты области цитоплазмы и ядрышко становится более контрастным.
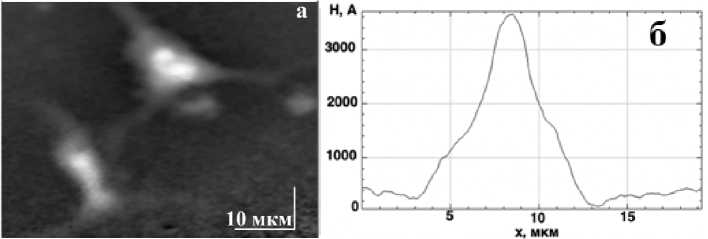
Рис. 4. (а) фазовое изображение культуры нейронов через 6 мин после добавления 1 мкл3 KCN и 1 мкл3 FCCP, (б) поперечный фазовый профиль вдоль скан-линии на Рис. 2(а).
На рисунке 4(а) показано полученное фазовое изображение после добавления KCN и FCCP. Прослеживается уменьшение фазовой высоты области цитоплазмы и ядра, становится более контрастным ядрышко, что можно заметить на профиле взятом в том же месте (рис 4(б)).
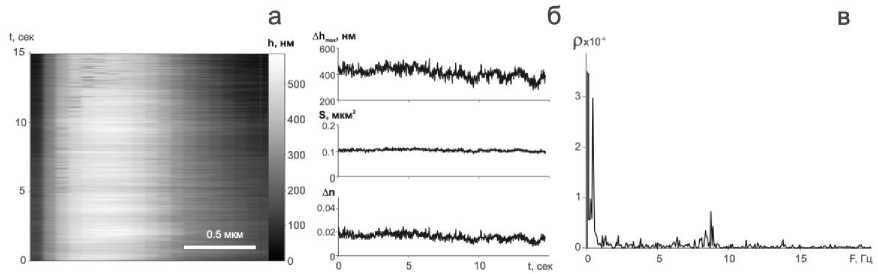
Рис. 5. а) Трек-диаграмма поперечного участка аксона; б) Изменение максимального значения ОРХ ∆h; Изменение фазовой площади аксона S; Изменение рефрактивности ∆n. в) Спектр флуктуаций ∆n.
Для тестирования алгоритма на фазовом изображении нейрона выбрали участок аксона. На этом участке построили поперечное сечение, записали трек-диаграмму в течении 15 секунд. Рассчитали изменение максимальной ОРХ, фазовой площади аксона и рефрактивности. На рисунке 5(в) представлен спектр флуктуаций, на кото- ром видны гармонические компоненты, изменения показателя преломления аксона связанные с некоторой жизнедеятельно- в нормальном состоянии.
стью аксона. Наглядно показаны частоты
Список литературы Динамическая рефрактометрия живых клеток
- Тычинский В.П. Когерентная фазовая микроскопия внутриклеточных процессов // УФН. - 2001. - Т. 171, №6. - С. 649-662.
- Simultaneous three-wavelength unwrapping using external digital holographic multiplexing module / N.A. Turko, P.J. Eravuchira, I. Barnea, N. T. Shaked // Optics letters. - 2018. - Vol. 43, №9. - P. 1943-1946.
- Quantifying myelin content in brain tissue using color Spatial Light Interference Microscopy (cSLIM) / M. Fanous, M.P. Caputo, Y. Jae Lee, L.A.Rund, C. Best-Popescu, M.E. Kandel, R.W. Johnson, T. Das, M.J. Kuchan, G. Popescu // PLOS ONE November, 2020. - 13 p.


