Динамика показателей скелетного гомеостаза у травматологических больных в условиях применения ГБО
Автор: Кузнецова Л.С., Лунева С.Н., Сысенко Ю.М., Николайчук Е.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2003 года.
Бесплатный доступ
В динамике обследованы 35 больных с переломами длинных трубчатых костей, которым был произведен закрытый чрескостный остеосинтез аппаратом Илизарова. 15 пациентам в послеоперационном периоде были проведены сеансы ГБО, 20 пациентов проходили лечение без применения баротерапии. В сыворотке крови исследовали активность щелочной (ЩФ) и кислой фосфатаз (КФ), их костных изоэнзимов (КЩФ и ТрКФ), уровни общего кальция, магния, неорганического фосфата и хлоридов. Было доказано положительное влияние применения ГБО-терапии на качество и сроки консолидации переломов.
Травма, переломы, длинные трубчатые кости, чрескостный остеосинтез, гбо, скелетный гомеостаз
Короткий адрес: https://sciup.org/142120664
IDR: 142120664
Текст научной статьи Динамика показателей скелетного гомеостаза у травматологических больных в условиях применения ГБО
Известно, что скелетная травма влияет на состояние гомеостаза, находящегося под контролем практически всех системных и местных факторов. Как любой стресс-синдром, она включает острую фазу адаптации и фазу перехода к долговременной адаптации, которые характеризуются усилием активности определенных групп факторов катаболической или анаболической направленности, что в приложении к репаративному остеогенезу соответствует резорбтивной (катаболической) и биосинтетической (анаболической) фазам костеобразования, т.е. фазам ремоделирования [1]. Глубина и продолжительность фаз адаптационного ответа зависят от объема оперативного вмешательства и адекватности лечебных мероприятий.
Основными принципами лечения травматологических больных являются восстановление анатомических взаимоотношений поврежденного сегмента и его функции с ранней активизацией больного. Оценивая характер развития фаз адаптации при помощи биохимических маркеров резорбции и новообразования, характера кальций-фосфорного обмена, важного фактора поддержания гомеостаза межклеточной жидкости и костной ткани, можно получить критерии прогнозирования течения репаративного процесса и проводить корригирующие лечебные мероприятия. При оценке изменений в костной ткани необходимо учитывать, что сдвиги метаболизма в ней отражают показатели крови, и параметры минерально-белкового – углеводного и липидного обмена отклоняются в сыворотке крови в ответ на процессы, протекающие в кости.
МАТЕРИАЛ И МЕТОДЫ
С целью изучения метаболической реакции на травму и условия реабилитации проведены динамические исследования сыворотки крови у 35 больных с переломами длинных трубчатых костей в возрасте от 50 до 70 лет, которым был произведен закрытый чрескостный остеосинтез аппаратом Илизарова. Больные были разделены на 2 группы: I группа (15 больных) в послеоперационном периоде получала сеансы ГБО, II группа (20 больных) проходила лечение без применения баротерапии.
Лечение проводилось в одноместной лечебной барокамере БЛКС 303 МК на 2-5 день после осуществления чрескостного остеосинтеза.
Выбор режима и схемы применения ГБО определялись общим состоянием больного, тяжестью повреждения кости и окружающих ее мягких тканей, наличием сопутствующих повреждений и заболеваний, переносимостью ГБО-тера-пии.
Режим на изопрессии составлял 1,4-2 ата, подбирался индивидуально, с экспозицией 40-60 мин. Количество сеансов составляло 8-10.
Забор крови производили на 3 день после произведенного чрескостного остеосинтеза, после проведения курса ГБО, что соответствовало 20-23 дню после операции, перед снятием аппарата (50-53 день) и через 1 месяц после снятия аппарата.
Лабораторный контроль за процессом заживления переломов и прогнозом их исходов включал определение щелочной (ЩФ) и кислой (КФ) фосфатаз, их костных изоэнзимов КЩФ и
РЕЗУЛЬТАТЫ
Получение травм и наложение аппарата приводили к мобилизации основных систем поддержания гомеостаза и стимуляции биосинтеза коллагена и неколлагеновых белков, являющихся основой органического матрикса, выполняющего опорную и регуляторные функции.
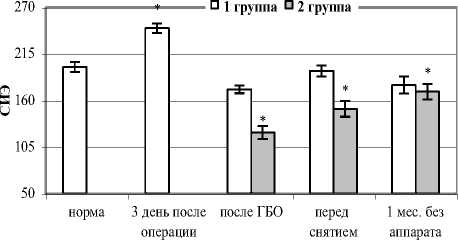
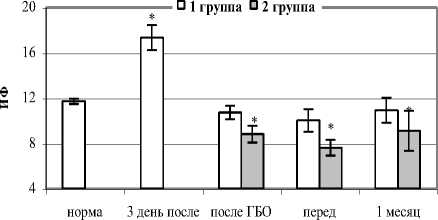
Максимальные изменения всех изучаемых параметров наблюдали на 3 сутки после остеосинтеза (таблица 1). Отмечалась гиперкальциемия, гиперфосфатемия, повышалась концентрация хлорид-ионов, соответственно достоверно увеличивался СИЭ. Возрастала активность как общей ЩФ, так и КЩФ в большей степени, чем ТрКФ, ИФ увеличивался в 1,7 раза (рис. 1, 2). В обеих группах картина была аналогичной.
На 20-23 сутки показатели скелетного гомеостаза в группах больных имели существенные различия. У пациентов I группы метаболи-
ТрЩФ – маркеров новообразования и резорбции костной ткани, уровни общего кальция (Са), магния (Mg), неорганического фосфата (Рн) и хлоридов (Cl). Активность ферментов определяли на фотометре «Stat Fax» (США), используя наборы реактивов «Витал» (Россия), изоферменты – методом ЭФ на системе «Paragon» и «Bekman» (США). Содержание электролитов определяли на анализаторе «Corning» (Великобритания).
Травматическая болезнь обусловливает широкий спектр изменений параметров внутренней среды и метаболизма, что вместе с возрастом, локализацией и тяжестью перелома приводит к значительному варьированию результатов. С целью повышения информативности и нивелирования отдельных значений были рассчитаны интегральные индексы: системный индекс электролитов [(СИЭ), отражавший процессы минерализации и деминерализации (СИЭ = (Са×Mg× Cl)/Р н ] и системный индекс фосфатаз (ИФ), отражающий соотношение объемов резорбции и костеобразования [(ИФ = КЩФ/ТрКФ)].
Биологический символ индексов заключался в характеристике костного ремоделирования, соотношении паратирин-кальцитонин зависимых фаз костеобразования [4]. Достоверность различий в малых выборках оценивали, используя непараметрические критерии Вилкоксона-Манна-Уитни [2]. Контролем служили сыворотка крови группы здоровых лиц аналогичного возраста.
ОБСУЖДЕНИЕ ческий профиль был близок к физиологической норме, низкое значение СИЭ наблюдалось за счет гипокальциемии и магниемии. Достоверные различия сохранялись для значений КЩФ и ТрКФ, однако их активность была сбалансирована, и ИФ находился в интервале нормальных значений. У пациентов II группы достоверные различия сохранялись в активности КЩФ и ТрКФ, т.е активность остеобластов уравновешивалась функциональной активностью остеокластов, ИФ был в пределах нормы, что соответствовало фазе ремоделирования. Во II группе отмечалась гипокальциемия, соответственно СИЭ оставался достоверно низким, ИФ был сдвинут в сторону остеокластической резорбции. Но тем не менее в последующем прослеживалась положительная тенденция нормализации показателей скелетного гомеостаза.
Таблица 1
Активность фосфомоноэстераз и показатели скелетного гомеостаза у травматологических больных в процессе лечения в условиях применения ГБО
|
Сроки исследования |
№ группы |
Показатели |
|||||||
|
Са ммоль/л |
Mg ммоль/л |
Cl ммоль/л |
P н, ммоль/л |
СИЭ |
КЩФ Е/л |
ТрКФ, Е/л |
ИФ |
||
|
Контрольная группа |
n=17 |
2,38±0,17 |
0,86±0,04 |
109,0±7,5 |
1,12±0,10 |
199,2±5,9 |
49,0±3,22 |
3,60±0,19 |
11,7±0,10 |
|
3-й день после остеосинтеза |
n=35 Iгр.=15 IIгр.=20 |
3,10±0,19* |
1,10±0,11* |
115,0±4,21* |
1,60±0,12* |
245,0±5,67* |
135,0±7,2* |
7,9±0,36* |
17,3±1,1* |
|
После ГБО, 20 дней после остеосинтеза |
I гр. |
2,18±0,11 |
0,80±0,02 |
110,0±3,91 |
1,16±0,12 |
172,9±4,5 |
122,7±5,11* |
11,4±0,78* |
10,7±0,60* |
|
II гр. |
2,02±0,14* |
0,68±0,01* |
108,9±5,2 |
1,30±0,12* |
122,0±7,8* |
115,0±6,2* |
13,0±0,86* |
8,8±0,74* |
|
|
Перед снятием аппарата, 50 дней после остеосинтеза |
I гр. |
2,20±0,19 |
0,80±0,02 |
108,0±6,1 |
0,94±0,10 |
194,6±6,4 |
78,0±4,91* |
7,8±0,69* |
10,0±1,0* |
|
II гр. |
2,08±0,12* |
0,70±0,04 |
110,0±7,8 |
1,07±0,09 |
149,7±9,1* |
60,0±2,02 |
7,9±0,72 |
7,60±0,70* |
|
|
1 месяц без аппарата |
I гр. |
2,26±0,19 |
0,80±0,09 |
108,0±7,1 |
1,20±0,17 |
178,0±10,2 |
62,0±3,10 |
5,7±0,27 |
10,9±1,11 |
|
II гр. |
2,10±0,18 |
0,76±0,08 |
110,0±9,2 |
1,02±0,10 |
170,0± 6,1 |
56,0±4,19 |
6,2±0,31 |
9,1±0,26* |
|
Примечание: * – различия с контролем достоверны Р ≤ 0,05
аппарата
Рис. 1. Динамика СИЭ в послеоперационном периоде
операции снятием после аппарата снятия аппарата
Рис. 2. Динамика ИФ в послеоперационном периоде
Через 1 месяц после снятия с поврежденного сегмента аппарата у пациентов I группы все параметры укладывались в значения физиологической нормы, а у пациентов II группы СИЭ и ИФ оставались достоверно ниже. Из чего следует, что изменение показателей гомеостаза было более стойким, а катаболическая фаза – продолжительнее.
Высокая активность метаболизма костной ткани обеспечивает ее возможность пластично реагировать на изменения механических напряжений, нейроэндокринной регуляции, а также метаболических сдвигов, развивающихся в организме. Это достигается за счет изменения спектра и распределения в органическом матриксе ферментов, их ингибиторов, гликопротеинов, минералов. Биохимические параметры ремоделирования невозможно отдифференцировать в зависимости от изменений обмена в разных отделах кости. Они отражают итоговые изменения резорбции или новообразования, направленные в ту или иную сторону, и отвечают на изменения в структуре кости быстрее, чем это фиксируют другие методы исследований [5].
Наиболее выраженная перестройка регуляторных механизмов происходит в первые 3 су- ток после операции. Активность ферментов, принимающих участие в ремоделировании костной ткани (КЩФ и ТрКФ) под влиянием экстремального фактора, каким является травма, сдвинута в сторону гиперкомпенсации, что является проявлением биохимической адаптации. Гомеостатические механизмы, которые вызывают изменения функции почек и костной ткани, направлены на поддержание постоянства состава крови, в частности, электролитов. Повышение КЩФ и ТрКФ в крови после остеосинтеза обусловлено вначале поступлением их из зоны перелома, из дегенерирующих остеоцитов и остеобластов, в последующем – из пролифе-рующих остеогенных клеток. Наибольшее содержание коллагена костной ткани совпадает с высокой активностью КЩФ, участвующей в образовании фибриллярных белков и ядер минерализации в костной ткани.
С возрастом наблюдается торможение новообразования костной ткани, снижение функции остеобластов в формировании очагов минерализации, снижение остеогенетических потенций [7]. Применение ГБО в послеоперационном периоде стимулировало репаративные процессы, что нашло выражение в сокращении фазы ката- болизма и более раннем наступлении фазы долговременной адаптации – анаболической. У больных I группы применение гипербарического кислорода благоприятно влияет на уровень целостного организма, стимулирует остеогене-тическую дифференциацию остеобластов, активизирует биосинтетические процессы и белково-синтетическую функцию печени [3, 6].
Процессы депонирования кальция и фосфора в костях, их абсорбция в кишечнике и экскреция с мочой сбалансированы, и восстановление их уровня в крови является свидетельством отсутствия остеопоротического синдрома и остеомаляции. Изменение магния коррелирует с динамикой калия, хлорид-ион содержится в интерстициальной жидкости, определяет рН внутренней среды и влияет на обмен электролитов.
При изучении процессов регенерации обнаружилась четкая параллель между оптимальны- ми показателями минерального обмена и стадиями репаративного процесса. Ремоделирование является одним из звеньев адаптационной перестройки костной ткани и возникает под действием различного рода факторов: в данном случае – травмы. Начальный этап адаптационной реакции – ответ на прикладываемое напряжение, следующий этап – инициация адаптационного ответа в костном матриксе химическими факторами, а конкретно – вымыванием из кристалла гидроксиаппатита Са, Мg и Рн, что сопровождалось повышением СИЭ и ИФ. Затем следует фаза физиологической регенерации, которая представлена ремоделированием и соответствует фазе долговременной адаптации. Характерными чертами являлись восстановление в сыворотке крови уровня минералов, нормализация соотношения костеобразования и резорбции.
ЗАКЛЮЧЕНИЕ
Коррективный анализ биохимических данных показал, что применение ГБО в терапевтических дозах в раннем послеоперационном периоде положительно влияет на восстановление минерального обмена и баланса между остеоге незом и резорбцией, активизирует метаболиче ские процессы и способствует заживлению пе реломов.


