Динамика влияния NPY на амплитудно временные показатели изометрического сокращения миокарда предсердий
Автор: Искаков Н.Г., Зверев А.А., Искакова Е.В., Николаев Т.И., Аникина Т.А., Зефиров Т.Л.
Статья в выпуске: 4 т.260, 2024 года.
Бесплатный доступ
Цель исследования было изучение динамики влияния нейропептида Y (NPY) на частоту и амплитудно-временные параметры изометрического сокращения предсердного миокарда крыс в раннем постнатальном онтогенезе. В представленной работе изучали влияние неселективного агониста NPY на частоту спонтанной активности и сократимость предсердного миокарда крыс на разных этапах становления симпатической иннервации. NPY у 7-суточных животных вызывает разнонаправленный эффект на частоту спонтанной активности, а у 100-суточных животных достоверно уменьшает. Основные параметры изометрического сокращения при добавлении NPY уменьшаются в сравнении с контрольными значениями.
Нейропептид y, сердце, миокард, изометрическое сокращение, частота спонтанной активности
Короткий адрес: https://sciup.org/142243211
IDR: 142243211 | УДК: 612.17 | DOI: 10.31588/2413_4201_1883_4_260_105
Текст научной статьи Динамика влияния NPY на амплитудно временные показатели изометрического сокращения миокарда предсердий
Нейропептид Y (NPY) высококонсервативный пептид, состоящий из 36 аминокислот, который был впервые выделен из гипоталамуса свиньи в 1982 году Tatemoto [15]. NPY является классическим нейромедиатором, вырабатываемым в основном симпатическими нейронами [8]. Пептид является одним из наиболее распространенных в сердце и головном мозге млекопитающих [6]. На данный момент у позвоночных животных обнаружено восемь различных Y-рецепторов (R) (Y1-Y8) [7], из которых пять (Y1R, Y2R, Y4R, Y5R и Y6R)
клонированы у млекопитающих, а четыре (Y1R, Y2R, Y4R и Y5R) доказали свою функциональность в организме человека [10].
В центральной и периферической нервной системе Y(R) кодируются разными генами и имеют различное распределение в тканях, а также внутриклеточные сигнальные пути, это доказывает о том, что они участвуют в различных физиологических процессах. Y(R) представляют собой мономерные белки сопряжённые с G-белками. После активации с рецепторами изменяется положение субъединицы G-белка в результате чего происходят различные внутриклеточные механизмы, приводящие как к ингибированию, так и к активации различных сигнальных каскадов [3]. По литературным данным известно также, что в гладкомышечных клетках кроликов Y2R и Y4R могут связываться с Gq белком и способствовать выработке инозитолтрифосфата (IP3) путем активации фосфолипазы C (PLC) [4]. Показано, что в нейронах мозга крысы Y(R) могут регулировать K+ и Ca2+ каналы, а также связанные с G-белком калиевый ток внутреннего выпрямления. Связываясь с Y (R), NPY играет различные роли в биологических процессах, а иногда даже может функционировать совершенно по-разному.
Y(R) участвуют в физиологических процессах и в заболеваниях, такие как прием пищи, ожирение, гипертония, атеросклероз, эпилепсия, метаболические нарушения, заживление переломов [2]. NPY также регулирует аппетит, половое размножение, обучение и память. Кроме того, он обладает антидепрессивными свойствами [13] и значительно ингибирует обмен костной ткани в экспериментальных моделях [5].
В кровеносной системе NPY регулирует сосудистый тонус, взаимодействуя с симпатической нервной системой. Примечательно, что NPY является признанным регулятором нескольких гормональных систем и участвует в иммунной регуляции [14].
Было показано, что NPY не влияет на инотропию полосок предсердий человека [11]. Отрицательные инотропные эффекты были продемонстрированы в кардиомиоцитах взрослых крыс, а положительные инотропные эффекты были продемонстрированы в кардиомиоцитах взрослых морских свинок [12]. Показано, что NPY и его аналоги замедляют частоту спонтанной активности и влияет разнонаправлено на сократительную функцию миокарда предсердий в онтогенезе [1]. Однако изучение динамики активации нейропептидом Y YR в возрастном аспекте изучено недостаточно.
Материал и методы исследований. В экспериментальную группу входили 7- и 100-дневные белые беспородные крысы (n=34). В ходе эксперимента из сердец крыс в условиях in vitro изготавливались полоски миокарда правого предсердия с сохраненным синусовым узлом и спонтанной активностью. Полоски были погружены в ёмкость с рабочим раствором Тироде, который был обогащен карбогеном. Механическое изометрическое сокращение полосок миокарда проводили на установке "PowerLab" с датчиком силы "MLT 050/D" ("ADInstruments"). В момент «приработки» полоскам миокарда предсердий обеспечивалось максимальное натяжение, после чего оценивался уровень контроля первоначального значения изометрического сокращения. Полученные результаты фиксировались с помощью программного обеспечения «Chart 8.0». Исследование эффекта NPY изучалось в концентрации, варьирующей от 10-8до 106М с 1 по 20 минуту регистрации, так как известен тот факт, что эндогенное содержание NPY в сердечно-сосудистой системе варьирует от микромолярных до миллимолярных концентраций [9].
Эксперимент был проведен поэтапно: регистрация первоначального показателя изометрического сокращения, аппликация NPY и промывка. Длительность отдельно взятого этапа составляла 20 минут. После оценки эффектов NPY у каждой из концентраций препарат отмывали с помощью раствора Тироде, и в дальнейшем, стабилизируя амплитудно-временные параметры изометрического сокращения, фиксировали первоначальный результат для исследования очередной концентрации. Расчеты показателей изометрического сокращения полосок миокарда производились в программе «LabChart 8.0». Оценивались: частота спонтанного сокращения (количество пиков/мин), общая длительность сокращения (момент от начала сокращения до его завершения), амплитуда сокращения (от уровня изолинии до максимального пика сокращения). В экспериментах был использован фармакологический препарат неселективного агониста NPY производства «Sigma-Aldrich», USA. Исходные показатели изометрического сокращения миокарда предсердий принимали за 100 %, тогда как эффект влияния агониста рассчитывали в процентах от первоначальных значений. Статистическая обработка данных проводилась с использованием программ Microsoft Excel и Statistica 13. Достоверность различий рассчитывали по критерию Стьюдента. Статистические данные представлены в виде среднего арифметического и стандартной ошибки среднего (М±m). Исследуемые данные считали статистически значимыми при Р˂0,05, а n-количество использованных препаратов предсердного миокарда.
Результат исследований. В наших экспериментах частота спонтанной активности у 7-дневных крысят в контроле составлял 165 пиков/мин, у 100-суточных животных средний показатель в контроле составлял 85 пиков/мин. Достоверно большие показатели частоты спонтанной активности у новорожденных животных согласуются с литературными данными развития хронотропной функции у животных.
У 7-суточных животных при аппликации NPY в концентрации 10-8М не приводила к достоверным изменениям амплитудно-временных параметров изометрического сокращения предсердного миокарда с 1 по 20 минуту регистрации (n=8). При увеличении концентрации на один порядок наблюдали развитие двухфазного эффекта. Частота спонтанной активности (ЧСА) со 2 минуты регистрации увеличивалась на 15 % (P˂0,05), затем наблюдалось уменьшение к концу эксперимента до 6 % (P˂0,05) по сравнению с контрольными значениями. Уменьшение ЧСА сопровождалось уменьшением амплитуды сокращения на 10 % (P˂0,05; n=10). При концентрации
10-6 М мы также наблюдали наличие двухфазного эффекта. Частота спонтанной активности с 1 и 2 минуты регистрации увеличивалась на 10 % и 8 % (P˂0,05). С 17 по 20 минуты регистрации частота спонтанной активности уменьшалась на 4 % (P˂0,05) (рисунок 1А). Амплитуда сокращения с 1 и по 20 минуты регистрации уменьшалась (P˂0,05). Остальные исследуемые параметры достоверно не изменялись (n=9).
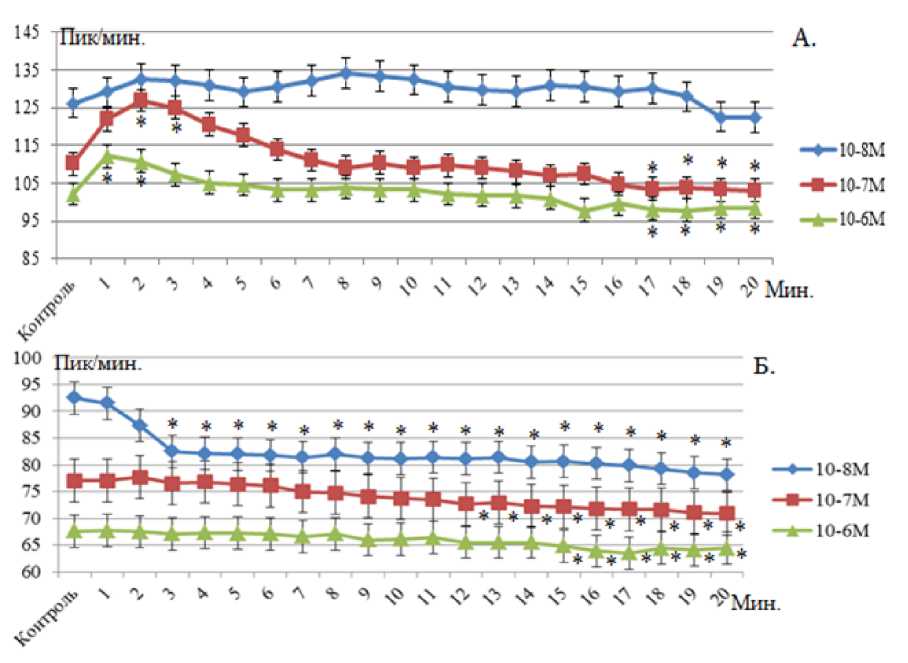
Рисунок 1 – Влияние NPY на частоту спонтанной активности с 1 по 20 минуту регистрации 7(А) - и 100 (Б) -суточных крысят
У 100-суточных животных при аппликации NPY 10-8 М ЧСА с 3 минуты регистрации уменьшалась на 10 % (P˂0,05) и к концу эксперимента уменьшилась на 15 % (P˂0,05) по сравнению с контрольным значением. Амплитуда сокращения и длительность сокращения достоверно не изменялись (n=10). В концентрации 10-7М ЧСА с 12 минуты регистрации уменьшилась на 5 % (P˂0,05). К 20 минуте регистрации ЧСА уменьшилась до 8 % (P˂0,05). Уменьшение ЧСА сопровождалось уменьшением амплитуды сокращения на 8 % (P˂0,05). К
20 минуте регистрации мы наблюдали уменьшение амплитуды сокращения на 12 % (P˂0,05; n=10). NPY в концентрации 10-6 М с 15 минуты регистрации уменьшала ЧСА на 4 % (P˂0,05). К 20 минуте регистрации ЧСА уменьшилась на 5 % (P˂0,05) по сравнению с исходным значением (рисунок 1Б). Уменьшение ЧСА сопровождалось уменьшением амплитуды сокращения на 6 % (P˂0,05) и к концу эксперимента уменьшилась на 8 % (P˂0,05; n=10) по сравнению с контрольным значением. Остальные исследуемые параметры не изменялись.
Заключение. Сердце сокращается под влиянием импульсов, возникающих в синусно-предсердном узле. ЧСА является важным физиологическим параметром не по которому оценивают работу сердца. Отклонения от нормы или наличия аритмий в работе синусного узла ведет к негативному влиянию на организм. Нейропептид Y выделяющийся из симпатических везикул совместно с АТФ и норадреналином способен регулировать работу через метаботропные рецепторы. Необходимо отметить, что пептид свои эффекты осуществляет последним, после норадреналина и АТФ. В наших экспериментах NPY оказывал эффекты у 7-суточных животных положительный на первых 3 минутах, что может быть связано с отсутствием сформированной симпатической иннервацией и NPY оказывает свои эффекты намного раньше. У 100-суточных животных при сформированной нервной регуляции NPY свои эффекты оказывает позже, что согласуется с данными.
Список литературы Динамика влияния NPY на амплитудно временные показатели изометрического сокращения миокарда предсердий
- Искаков, Н. Г. Роль NPY в изменениях параметров потенциала действия рабочих кардиомиоцитов, а также силы и частоты спонтанной активности правого предсердия взрослых крыс / Н. Г. Искаков, А. А. Зверев, Т. А. Аникина, А. С. Шалавина, Д. А. Ирдинкин, Т. Л. Зефиров // Российский кардиологический журнал. – 2021. – Т. 26. – № S5. – С. 37.
- Baldock, P. A. Hypothalamic Y2 receptors regulate bone formation / P. A. Baldock, A. Sainsbury, M. Couzens, R. F. Enriquez, G. P. Thomas, E. M. Gardiner, H. J. Herzog // Clin Invest. – 2002. – V. 109. – № 7. – P. 915-921.
- Colmers, F. Presynaptic inhibition by neuropeptide Y and baclofen in hippocampus: insensitivity to pertussis toxin treatment / F. Colmers // Brain Research. – 1989. – V. 498. – №. 1. – Р. 99-104.
- Heredia, D. P. Neuropeptide Y rapidly enhances [Ca2+] I transients and Ca2+ sparks in adult rat ventricular myocytes through Y1 receptor and Plc activation / D. P. Heredia, M. Delgado, C. Pereira, L. Perrier, R. Richard, S. Vassort // Mol. Cell. Cardiol. – 2005. – V.38. – P. 205-212.
- Diaz-delCastillo, M. Neuropeptide Y and Its Involvement in Chronic Pain / M. Diaz-delCastillo, D. P. D. Woldbye, A. M. Heegaard // Neuroscience. – 2018. – V. 387. – P. 162-169
- Dumont, Y. Neuropeptide, Y., and neuropeptide Y receptor subtypesin brain and peripheral tissues / Y. Dumont, J. C. Martel, A. Fournier, S. St-Pierre, R. Quirion, // Prog. Neurobiol. – 1992. – V. 38. – №. 2. – Р. 125-167.
- Larhammar, D. Ancient Grandeur of the Vertebrate Neuropeptide Y System Shown by the Coelacanth Latimeria chalumnae / D. Larhammar, C. A. Bergqvist // Front. Neurosci. – 2013. – V.8. – P. 7-27.
- Lundberg, J. O. The Nitrate-Nitrite-Nitric Oxide Pathway in Physiology and Therapeutics / J. O. Lundberg, E. Weitzberg, M. T. Gladwin // Nat. Rev. Drug Discov. – 2008. – V. 7. – №. 2. – P. 156-167.
- Maslyukov, P. M. NPY1 receptors are involved in rat myocardial contractility / P. M. Maslyukov, T. A. Anikina, A. A. Zverev, A. V. Krylova, K. Y. Moiseyev, T. L. Zefirov // Bulletin of experimental biology and medicine. – 2016. – V. 162. – №. 10. – P. 410-412.
- Matsumoto, S. Regulation of the phase and period of circadian rhythms restored by suprachiasmatic transplants / S. Matsumoto, J. Basil, A. E. Jetton, M. N. Lehman, E. L. Bittman // J. Biol. Rhythms. – 1996. – V. 11. – №. 2. – P. 145-162.
- Michel, M. C. XVI. International union of pharmacology recommendations for the nomenclature of neuropeptide Y peptide Yy, and pancreatic polypeptide receptors / M. C. Michel, A. Beck-Sickinger, H. Cox, H. N. Doods, H. Herzog, D. Larhammar, R. Quirion, T. Schwartz, T. Westfall // Pharmacol Rev. – 1998. – V. 50. – №. 1. – P. 143-150.
- Millar, B. C. Positive and negative contractile effects of neuropeptide-Y on ventricular cardiomyocytes / B. C. Millar, T. Weis, H. M.Piper, M. Weber, U. Borchard, B. J. Mcdermott, A Balasubramaniam // Am. J. Physiol. – 1991. – V. 6. – №. 2. – P. 1727-1733.
- Stogner, K. Neuropeptide-Y exerts antidepressant-like effects in the forced swim test in rats / K. Stogner, P. V. Holmes // Eur J Pharmacol. – 2000. – V. 387. – №. 2.(387). – P. 9-10.
- Straub, R. H. Neuropeptide Y cotransmission with norepinephrine in the sympathetic nerve-macrophage interplay / R. H. Straub, T. Schaller, L. E. Miller, S. Hörsten, D. S. Jessop, W. Falk, J. Schölmerich // J Neurochem. – 2000. – V. 75. – №. 6. – P. 2464-2471.
- Tatemoto, K. Neuropeptide Y—a novel brain peptide with structural similarities to peptide Yy and pancreatic polypeptide / K. Tatemoto, M. Carlquist, V. Mutt // Nature. – 1982. – V. 296. – P. 659-660.


