Долгосрочные эффекты новой коронавирусной инфекции COVID-19, перенесенной пациентами с хроническими коронарными синдромами, в условиях реальной клинической практики
Автор: Малинова Л. И., Толстов С. Н., Липатова Т. Е., Долотовская П. В., Фурман Н. В., Денисова Т. П.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Цель: оценить динамику гемодинамических, метаболических, гематологических параметров и маркеров сократительной способности миокарда у пациентов с хроническим коронарным синдромом, перенесших новую коронавирусную инфекцию (COVID-19), в зависимости от времени с момента ее манифестации. Материал и методы. Проведено одноцентровое обсервационное исследование пациентов с хроническими коронарными синдромами (ХКС), перенесших COVID-19 (1–10 мес., n=138). Оценены базовые клинико-лабораторные и инструментальные параметры в зависимости от давности перенесенного COVID-19. Для оценки длительности «постковидных» изменений непрерывных переменных рассчитывался индекс отклонения от нормальных значений. Результаты. Медианная длительность «постковидных» изменений изученных параметров составила 4 месяца. У пациентов с ХКС на фоне относительно постоянного количества общего белка отмечался рост уровня альбуминов на 12,3 (11,5; 25,1) % с минимальными значениями у больных, перенесших COVID-19 в течение месяца, p=0,008. Выявлено снижение, достигавшее минимума к 10‑му месяцу с момента манифестации COVID-19, уровня лейкоцитов периферической крови: с 9,0 (6,4; 10,9), *108 / л (1 мес.) до 5,5 (4,9; 6,1), *108 / л (10 мес.), p=0,001. Уменьшение частоты сердечных сокращений на 28,2 (22,1; 31,1) %, p=0,001, сопровождалось ростом фракции выброса левого желудочка с 58 (59; 64) % (1 мес.) до 69 (67; 71) % (10 мес.), p=0,027. Заключение. У больных с хроническими коронарными синдромами выявлены основные долгосрочные тренды «постковидных» изменений рутинно определяемых в реальной клинической практике метаболических, гематологических, ЭКГ параметров и характеристик сократительной способности миокарда
COVID-19, хронический коронарный синдром, постковидный синдром.
Короткий адрес: https://sciup.org/149138152
IDR: 149138152 | УДК: 616–005.6+616.24–005.6
Текст научной статьи Долгосрочные эффекты новой коронавирусной инфекции COVID-19, перенесенной пациентами с хроническими коронарными синдромами, в условиях реальной клинической практики
1 Введение. Прочно вошедшая в нашу повседневную жизнь пандемия новой коронавирусной инфекции SARS-CoV-2 актуализировала множество принципиально новых исследовательских проблем, среди которых прежде всего обращает на себя внимание состояние, именуемое в литературе как постковидный синдром (post-COVID-19 syndrome, long COVID, postacute sequelae of COVID-19, chronic COVID syndrome, long-haul COVID). Наиболее часто под постковидным синдромом (ПКС) понимается комбинация неспецифических симптомов и признаков, сохраняющихся у пациента дольше 3–4 недель от момента клинической манифестации COVID-19: слабость, одышка, кашель, гипо- или аносмия [1–3]. Кардиоваскулярные проявления ПКС включают в себя тахикардию, нарушения ритма сердца, болевой синдром и в определенном плане представляют собой клиническую дилемму: являются ли перечисленные симптомы и признаки компонентами ПКС, или же проявлениями собственно кардиальной патологии. Не меньшее затруднение в этом плане вызывают больные с уже верифицированной ишемической болезнью сердца, что у них следует подозревать: ПКС или же прогрес-сирование/обострение течения атеросклероза коронарных артерий?
Цель: оценить динамику гемодинамических, метаболических, гематологических параметров и маркеров сократительной способности миокарда у пациентов с хроническим коронарным синдромом, перенесших новую коронавирусную инфекцию
(COVID-19), в зависимости от времени с момента ее манифестации.
Материал и методы. Проводилось обсервационное исследование на базе специализированного кар-диососудистого центра. В исследование включались пациенты, имеющие в анамнезе хронический коронарный синдром [4] и подтвержденный случай COVID-19, верифицированный в соответствии с Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19), версия 11 [5]. Из исследования исключались больные с сомнительными случаями COVID-19, а также пациенты, у которых новая коронавирусная инфекция была диагностирована во время госпитализации в кардиососудистый центр.
Для анализа осуществлялся формализованный сбор анамнеза и жалоб пациента. Проводилась оценка: 1) базовых гемодинамических параметров; 2) геометрии камер сердца и параметров сократительной способности миокарда по результатам трансторакального двумерного постоянноволнового и импульсного эхокардиографического исследования; 3) результатов ЭКГ; 4) скрининговых биохимических маркеров, в том числе маркеров миокардиального повреждения. Исследование носило обсервационный характер, все назначения выполнялись лечащими врачами.
Популяция исследования после скрининга составила 138 пациентов, перенесших COVID-19 в промежутке от 1 до 10 месяцев до настоящей госпитализации, поводом к которой в подавляющем большинстве случаев было выполнение плановой коронарной реваскуляризации. Деление периода времени с момента манифестации COVID-19 до госпитализации с ша- гом в один месяц использовано для формирования подгрупп исследования. Ввиду малого количества пациентов в группах с давностью COVID-19 пять и более месяцев они были сгруппированы следующим образом: 5–6 месяцев, 7–9 месяцев и 10 месяцев с момента манифестации COVID-19.
Клиническая характеристика пациентов представлена в табл. 1. В целом это пациенты высокого и экстремально высокого кардиоваскулярного риска с высоким же индексом коморбидности. Превалирующие жалобы: боли в области сердца и повышенная утомляемость; почти в 60% случаев больных беспокоила одышка при умеренных физических нагрузках. Проводимая медикаментозная терапия отличалась высокой (57,5%) потребностью в диуретиках и широким спектром использованных антитромботических препаратов (от нефракционированного гепарина до прямых оральных антикоагулянтов).
Для оценки длительности «постковидных» изменений для непрерывных переменных рассчитывался индекс отклонения от нормальных (референсных) значений. Для статистического анализа использо-
Таблица 1
|
Параметр |
Частота (n=138) |
|
Медико-демографические параметры |
|
|
Возраст, годы |
65 (58,74) |
|
Мужской пол, % |
64,5 |
|
Клиническая характеристика |
|
|
Стенокардия напряжения, % |
87,0 |
|
Перенесенный ИМ, % |
55,8 |
|
Артериальная гипертензия, % |
94,3 |
|
Нарушения сердечного ритма: ФП, % |
40,6 |
|
Хроническая сердечная недостаточность, % |
68,2 |
|
Сахарный диабет 2-го типа, % |
24,0 |
|
Патология ЖКТ: хронический поверхностный гастрит, % |
36,3 |
|
Заболевания БЛ аппарата: ХОБЛ, % |
10,9 |
|
Гематологические заболевания: анемия хронических состояний, % |
13,1 |
|
Другие заболевания: варикозная болезнь нижних конечностей, % |
6,6 |
|
Другие заболевания: дорсопатия, % |
10,9 |
|
Клинические проявления |
|
|
Одышка (при умеренной физической нагрузке), % |
58,0 |
|
Боли в области сердца, % |
66,0 |
|
Сердцебиение, % |
30,5 |
|
Отеки (нижних конечностей, умеренные), % |
30,5 |
|
Утомляемость (умеренная), % |
49,3 |
|
Медикаментозная терапия |
|
|
Препараты ацетилсалициловой кислоты, % |
45,0 |
|
Блокаторы P2Y12 рецепторов, % |
24,0 |
|
Парентеральные антикоагулянты: НФГ/НМГ/фондапаринукс, % |
4,4/2,2/8,7 |
|
Антикоагулянты: ПОАК/варфарин, % |
30,5/6,6 |
|
БАБ, % |
72,5 |
|
БКК, % |
24 |
|
Ингибиторы АПФ или БРА, % |
74,7 |
|
АРНИ, % |
2,2 |
|
Статины, % |
72,5 |
|
БМКР, % |
45 |
|
Диуретики, % |
58 |
П р и м е ч а н и е : в разделе «клиническая характеристика» приведены патологии с максимальной частотой встречаемости в выборке; для количественных переменных данные представлены в виде Med (LQ; UQ); ИМ — инфаркт миокарда; ФП — фибрилляция предсердий; ЖКТ — желудочно-кишечный тракт; БЛ — бронхолегочный; ХОБЛ — хроническая обструктивная болезнь легких; НФГ — нефракционированный гепарин; НМГ — низкомолекулярные гепарины; ПОАК — прямые оральные антикоагулянты; БАБ — бета-адреноблокаторы; БКК — блокаторы кальциевых каналов; АПФ — ангиотензинпревращающий фермент; БРА — блокаторы рецепторов ангиотензина II, АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор; БМКР — блокаторы минералокортикоидных рецепторов.
Характеристика популяции исследования
вали пакет IBM SPSS Statistics, v. 23. Непрерывные количественные переменные описаны как медиана и интерквартильный размах (Me [LQ; UQ]). Для проверки статистических гипотез использовали критерии Манна — Уитни, Краскела — Уоллиса ANOVA и χ2 Пирсона. Альтернативная гипотеза принималась при уровне p<0,05. Все тесты были двусторонними. Оценка корреляционных связей проводилась с использованием теста Спирмена и Кендалла.
Результаты. Подгруппы пациентов, сформированные по признаку давности перенесенного COVID-19, были сопоставимы по половозрастному составу, степени тяжести перенесенного COVID-19
и основным клиническим характеристикам. Нам не удалось выявить существенных различий по частоте и степени выраженности таких клинических симптомов и признаков, как одышка, жалобы на сердцебиение, отеки, утомляемость, характеристик боли в грудной клетке. На нарушения вкуса и обоняния жаловались преимущественно пациенты, у которых давность манифестации COVID-19 не превышала трех месяцев.
Результаты скрининговых биохимических, глобальных коагуляционных и гематологических тестов представлены в табл. 2. При анализе этих данных прослеживается общая тенденция к снижению уров-
Таблица 2
Динамика биохимических, глобальных коагулологических и гематологических параметров пациентов с ХКС в зависимости от времени с момента манифестации перенесенного COVID-19
|
Параметр |
Время с момента манифестации COVID-19, мес. |
Значение p |
||||||
|
1 \(n=48) |
2 (n=28) |
3 (n=19) |
4 (n=12) |
5–6 (n=11) |
7–9 (n=11) |
10 (n=9) |
||
Биохимические скрининговые параметры
|
АЛТ Ед/л |
39 (26; 48) |
27 (23; 30) |
28 (25; 42) |
45 (26; 65) |
65 (30; 101) |
19 (16; 23) |
23 (22; 24) |
0,122 |
|
АСТ, Ед/л |
30 (18; 44) |
26 (23; 32) |
30 (25; 35) |
36 (21; 51) |
30 (23; 38) |
16 (14; 19) |
23 (20; 27) |
0,112 |
|
ЛДГ, Ед/л |
379 (314; 498) |
302 (247; 339) |
383 (304;412) |
242 (214; 270) |
323 (270; 377) |
375 (236; 515) |
370 (310; 431) |
0,075 |
|
ЩФ, Ед/л |
158 (116; 216) |
192 (107; 199) |
180 (156; 211,50) |
185 (170; 201) |
112 (102; 123) |
204 (193; 215) |
121 (110; 133) |
0,522 |
|
КФК, Ед/л |
90 (49; 121) |
78 (44; 124) |
75 (58; 130) |
60 (31; 90) |
65 (50; 80) |
61 (54; 91) |
47 (46;49) |
0,561 |
|
Общий белок, г/л |
69 (64; 79) |
73 (69; 75) |
69 (63; 76) |
85 (85; 85) |
75 (68; 82) |
75 (71; 79) |
70 (69; 72) |
0,748 |
|
Билирубин общий, мкмоль/л |
15 (13; 22) |
13 (12; 14) |
15 (13; 15) |
14 (12; 15) |
14 (12; 15) |
19 (11; 28) |
17 (14; 20) |
0,565 |
|
Билирубин кон., мкмоль/л |
2,2 (1,6; 3,5) |
1,5 (1,3; 1,8) |
1,6 (1,5; 2,0) |
1,6 (1,5; 1,8) |
1,6 (1,6; 1,7) |
2,5 (1,5; 3,5) |
3,2 (2,1; 4,4) |
0,203 |
|
Мочевина, ммоль/л |
6,6 (4,8; 8,6) |
5,6 (4,1; 7,9) |
5,9 (5,5; 6,0) |
3,9 (3,3; 4,6) |
4,2 (3,7; 4,4) |
5,7 (3,7; 7,7) |
4,6 (4,3; 5,0) |
0,398 |
|
Креатинин, мкмоль/л |
95 (83; 114) |
98 (82; 115) |
75 (75; 82) |
80 (71; 89) |
92 (61; 124) |
86 (75; 97) |
86 (79; 94) |
0,594 |
|
Глюкоза, ммоль/л |
5,7 (4,5; 7,7) |
5,0 (4,7; 5,8) |
6,0 (4,7; 7,6) |
6,2 (5,4; 7,1) |
4,6 (4,1; 5,1) |
5,3 (5,1; 5,5) |
5,0 (4,7; 5,3) |
0,736 |
|
Холестерин общий, ммоль/л |
4,9 (3,0; 5,9) |
4,3 (3,9; 4,6) |
4,7 (3,4; 5,3) |
4,5 (3,9; 5,2) |
5,2 (4,9; 5,6) |
5,6 (4,9; 6,4) |
5,0 (4,9; 5,1) |
0,749 |
|
ЛПОНП, ммоль/л |
0,68 (0,41; 0,80) |
0,81 (0,50; 1,45) |
0,60 (0,42; 0,70) |
1,51 (0,72; 2,30) |
1,13 (1,00; 1,25) |
0,48 (0,45; 0,90) |
0,40 (0,23; 0,66) |
0,220 |
|
ЛПНП, ммоль/л |
2,95 (1,50; 3,90) |
2,66 (2,39; 3,20) |
2,15 (1,05; 3,40) |
2,24 (1,00; 3,48) |
3,15 (3,00; 3,30) |
3,95 (3,50; 4,40) |
3,70 (3,50; 3,90) |
0,590 |
|
ЛПВП, ммоль/л |
1,00 (0,90; 1,20) |
1,00 (0,84; 1,10) |
1,15 (0,95; 2,15) |
1,25 (1,00; 1,50) |
0,93 (0,80; 1,05) |
1,20 (0,90; 1,50) |
0,87 (0,84; 0,90) |
0,571 |
|
ТГ, ммоль/л |
1,25 (0,92; 1,50) |
1,57 (0,90; 2,73) |
1,20 (0,87; 1,45) |
3,10 (1,60; 4,60) |
2,38 (2,00; 2,75) |
1,05 (0,99; 1,10) |
0,87 (0,51; 1,23) |
0,296 |
|
К+, ммоль/л |
4,1 (4,0; 4,4) |
3,9 (3,8; 4,0) |
3,8 (3,6; 3,9) |
3,9 (3,8; 4,0) |
3,9 (3,6; 3,9) |
3,9 (3,7; 4,0) |
3,9 (3,8; 4,0) |
0,280 |
Глобальные коагуляционные тесты
|
ПВ, сек |
15,2 (13,0; 18,1) |
14,4 (13,0; 16,7) |
14,8 (13,6; 15,5) |
12,6 (11,9; 13,4) |
12,4 (11,7; 13,1) |
14,4 (14,1; 14,8) |
14,9 (11,6; 18,3) |
0,483 |
|
АПТВ, сек |
29,6 (27,3; 33,2) |
28,0 (25,0; 30,5) |
25,3 (24,3; 26,9) |
25,7 (24,4; 27,0) |
26,0 (26,0; 26,1) |
28,3 (26,8; 29,9) |
28,2 (26,6; 29,8) |
0,257 |
|
Фибриноген, г/л |
3,6 (3,3; 4,0) |
3,7 (3,1; 3,9) |
3,6 (3,0; 4,0) |
4,0 (3,9; 4,1) |
3,0 (2,1; 3,9) |
2,8 (2,2; 3,4) |
4,6 (3,1; 6,2) |
0,600 |
Окончание табл. 2
|
Параметр |
Время с момента манифестации COVID-19, мес. |
Значение p |
||||||
|
1 \(п=48) |
2 (n=28) |
3 (n=19) |
4 (n=12) |
5–6 (n=11) |
7–9 (n=11) |
10 (n=9) |
||
|
Гематологические параметры |
||||||||
|
Гемоглобин, г/л |
130 (116; 143) |
132 (129; 146) |
127 (110; 132) |
126 (104; 149) |
140 (124; 156) |
142 (137; 148) |
120 (115; 126) |
0,717 |
|
Эритроциты, *1012/л |
4,48 (4,16; 4,74) |
4,40 (4,37; 4,60) |
4,47 (4,34; 4,66) |
5,08 (5,00; 5,16) |
4,97 (4,34; 5,60) |
4,89 (4,60; 5,17) |
4,95 (4,34; 5,61) |
0,286 |
|
Тромбоциты, *109/л |
233 (186; 320) |
207 (178; 329) |
234 (226; 262) |
192 (171; 214) |
191 (76; 306) |
218 (104; 332) |
156 (156; 156) |
0,723 |
|
Нейтрофилы сегментоядерные, % |
68 (54; 73) |
63 (56; 70) |
65 (63; 65) |
51 (42; 61) |
61 (58; 65) |
55 (50; 61) |
63 (63; 63) |
0,413 |
|
Нейтрофилы палочкоядерные, % |
2 (1; 3) |
2 (2; 3) |
1 (1; 2) |
2 (2; 2) |
2 (2; 2) |
2 (2; 3) |
2 (2; 2) |
0,129 |
|
Лимфоциты, % |
23 (16; 34) |
28 (21; 29) |
25 (24; 27) |
37 (27; 47) |
27 (26; 29) |
34 (29; 40) |
28 (24; 31) |
0,510 |
|
Моноциты, % |
7 (5; 8) |
6 (5; 10) |
8 (5; 8) |
7 (6; 8) |
7 (5; 9) |
5 (4; 6) |
6 (5; 7) |
0,840 |
|
Эозинофилы, % |
1 (1; 2) |
2 (1; 2) |
2 (2; 3) |
2 (2; 3) |
2 (2; 2) |
2 (2; 3) |
2 (2; 2) |
0,400 |
П р и м еч а н и е : АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ЛДГ — лактатдегидрогеназа; ЩФ — щелочная фосфатаза; КФК — креатинфосфокиназа; ЛПОНП — липопротеины очень низкой плотности; ЛПНП — липопротеины низкой плотности; ЛПВП — липопротеины высокой плотности; ТГ — триглицериды; ПВ — протромбиновое время; АПТВ — активированное парциальное тромбопластиновое время.
ней трансаминаз и лактатдегидрогеназы, мочевины, креатинина, не достигающая тем не менее степени статистической достоверности.
Достаточно трудные для трактовки данные получены относительно проводящей функции миокарда в сформированной выборке. Так, частоты нарушений внутрижелудочной проводимости существенно не различались в подгруппах с различной давностью манифестации COVID-19, тогда как атриовентрикулярная блокада 1-й степени чаще была у пациентов, перенесших COVID-19 менее двух месяцев тому назад:
12,5% vs 5,3% (у больных ХКС, перенесших COVID-19 более пяти месяцев, p=0,047). Тенденция к уменьшению интервала QT c 0,35 (0,32; 0,43) сек у больных, перенесших COVID-19 менее месяца, до 0,21 (0,36; 0,38) сек у пациентов, перенесших COVID-19 более пяти месяцев тому назад, выглядит клинически несущественной и статистически недостоверна.
Более «яркие» изменения в зависимости от времени с момента манифестации COVID-19 выявлены относительно количества лейкоцитов и уровня альбуминов (рисунок).
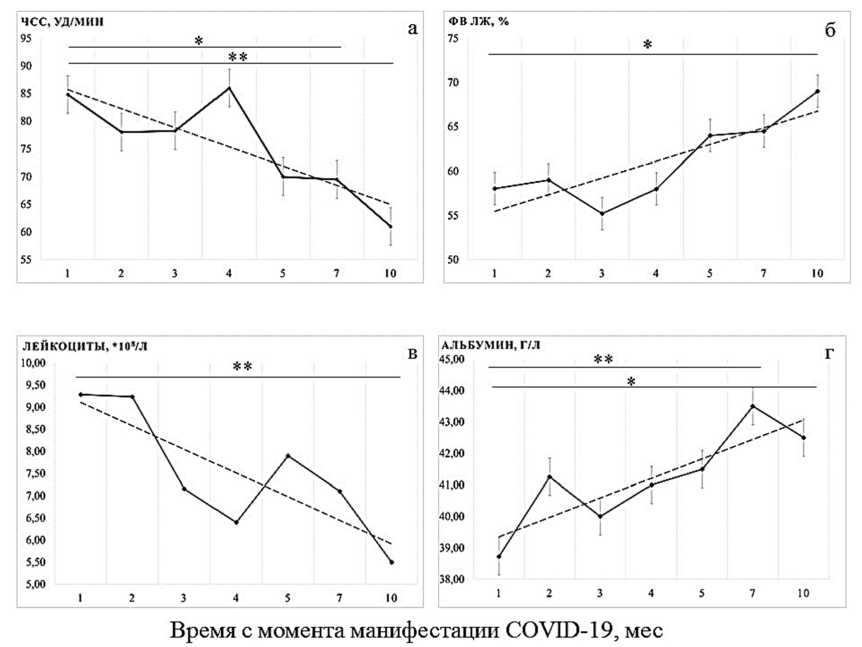
Тренды изменений частоты сердечных сокращений ( а ), фракции выброса левого желудочка ( б ), количества лейкоцитов ( в ) и уровня альбумина ( г ) в зависимости от времени с момента манифестации COVID-19: * — p<0,05; ** — p<0,01
В выборке исследования пациенты, перенесшие COVID-19 менее двух месяцев до включения в исследование, характеризовались нейтрофильным лейкоцитозом. Количество лейкоцитов в периферической крови достоверно снижалось, начиная с 5-го месяца. Долгосрочных изменений относительно количества лимфоцитов и моноцитов не выявлено.
На фоне относительно постоянного количества общего белка (см. табл. 2) у больных с ХКС, перенесших COVID-19, отмечался достоверный рост уровня альбуминов сыворотки крови (см. рисунок). Из грубодисперсных белков нами оценен уровень фибриногена, тенденция к росту его концентрации была недостоверной. Таким образом, можно говорить о возможном изменении соотношения грубо- и мелкодисперсных белков в зависимости от давности перенесенного COVID-19.
Наиболее интересным в клиническом отношении стала практически линейная обратная зависимость частоты сердечных сокращений от давности перенесенного COVID-19: R=–0,347, p=0,028 (см. рисунок). Примечательно, что все пациенты получали пульс-урежающую терапию, как правило бета-адреноблокаторы, из которых наиболее часто использовался би-сопролол. При пересчете на эффективную дозировку выяснено, что пациенты, перенесшие COVID-19 менее трех месяцев до включения в исследование, получали большую адреноблокирующую нагрузку (1,5 vs 0.8, p=0,012). Нельзя исключать, что с этим связано увеличение частоты нарушений атриовентрикулярной проводимости у больных, перенесших COVID-19 менее двух месяцев до включения в исследование. Таким образом, можно сказать, что, несмотря на проводимую пульс-урежающую терапию, ранний период после перенесенного COVID-19 характеризовался устойчивой (как правило, синусовой) тахикардией.
Не менее интересным стало выявленное повышение фракции выброса левого желудочка с «удалением» от перенесенного COVID-19, в пределах нормальных значений. Относительно сократительной способности миокарда установлена еще одна закономерность: в сформированной выборке нарушение локальной сократительной способности миокарда по типу гипокинезии наблюдалось только у больных с давностью перенесенного COVID-19 менее четырех месяцев, в отличие от акинезии, закономерно выявлявшейся у большинства больных с инфарктом миокарда в анамнезе.
Обсуждение. В настоящее время происходит быстрое накопление и совершенствование знаний о вовлеченности сердечно-сосудистой системы в патологические процессы, ассоциированные с COVID-19. Так, первоначальные результаты, базирующиеся на высокой частоте (20-30%) повышения уровня сердечных тропонинов в острый период COVID-19 у госпитализированных пациентов, ассоциированной с повышением в 2–5 раз риска летального исхода, позволили предположить прямое повреждение миокарда. Однако накопление данных патологоанатомических исследований позволило отнести большинство случаев повышения уровня тропонинов ко 2-му типу инфаркта миокарда, ассоциированному с системным воспалением [6]. Вполне логичным представлялось развитие вирусного миокардита, однако результаты аутопсий показали, что «ковидный» миокардит — достаточно редкое явление и, как правило, является ответной реакцией на системное воспаление, нежели прямое вирусное повреждение [7].
Подводя предварительный итог, в настоящий момент можно утверждать, что поражение сердечно-сосудистой системы при COVID-19 имеет смешанную природу, в основе которой лежат процессы, именуемые в литературе как иммунотромбоз [8].
Трудно, вероятно, невозможно представить мгновенное «обрывание» иммунотромбоза. Клиническая практика это подтверждает накоплением описательных данных о долгосрочных эффектах перенесенной SARS-CoV-2 инфекции. Однако пока у нас нет ни устоявшейся общепринятой терминологии, ни непротиворечивых представлений о клинике и патогенезе «длинного» ковида. Важным с практической точки зрения является вопрос объема обследования пациента кардиологического профиля с подозрением на постковидный синдром. Полученные нами результаты убедительно свидетельствуют, что данных, полученных с использованием глобальных коагуляционных и скрининговых биохимических тестов, как правило, оказывается недостаточно, чтобы выявить постковидные изменения. Клинические же проявления неспецифичны и трудны в интерпретации у пациентов, как в нашем исследовании, с хроническими коронарными синдромами.
Выявленная динамика уровня альбуминов сыворотки крови представляется достаточно важной находкой, так как сывороточные альбумины ввиду своей высокой связывающей активности играют существенную роль в фармакодинамике множества лекарственных препаратов. Это факт необходимо учитывать при выборе режимов медикаментозной терапии, в частности антитромботической.
К настоящему времени получены данные о нарушениях автономной регуляции сердечной деятельности у пациентов, перенесших COVID-19, реализуемых в виде особого фенотипа тахикардии — синдрома постковидной тахикардии (СПТ, Post-COVID-19 Tachycardia Syndrome) [9], который чаще всего описывается как постуральная ортостатическая тахикардия. Большинство работ на эту тему пока представляют собой описания клинических случаев [10, 11]. Много вопросов оставляет врачебная тактика при СПТ. Полученные нами данные убедительно свидетельствуют о потенциальной обратимости указанного феномена, в связи с чем необходима разработка строго критериального подхода к медикаментозной терапии СПТ в зависимости от общего кардиоваскулярного риска.
Выявленное увеличение ФВ ЛЖ со временем после перенесенного COVID-19 может трактоваться двояко. С одной стороны, ввиду используемого «поперечного» дизайна исследования, этот факт может свидетельствовать об относительно благоприятном прогнозе при SARS-CoV-2 инфекции у больных с исходно лучшей интегральной сократительной способностью миокарда. С другой стороны, на фоне разрешения иммунного воспаления, снижения частоты сердечных сокращений, нормализации прокоагулянтного сдвига системы гемостаза повышение ФВ ЛЖ выглядит логичным проявлением процессов реконвалесценции. В пользу последней версии свидетельствует также уменьшение частоты нарушений локальной сократимости левого желудочка по типу гипокинезии с увеличением «давности» перенесенного COVID-19.
Несмотря на лимитирующие факторы этого исследования, к которым следует отнести «поперечный» дизайн и небольшой объем выборки, нам впервые удалось оценить долгосрочные эффекты перенесенной новой коронавирусной инфекции COVID-19 у пациентов с хроническими коронарными синдромами в условиях реальной клинической практики: продолжительность выраженных «пост-ковидных» изменений у пациентов с хроническими коронарными синдромами не превышает в среднем четырех месяцев. Данный факт, на наш взгляд, представляется важным как в плане оценки процессов реконвалесценции у конкретного пациента, перенесшего COVID-19, так и в плане формирования реабилитационных стратегий этой категории пациентов.
Заключение. Суммируя полученные данные, можно заключить, что перенесенная SARS-CoV-2 инфекция у пациентов с хроническими коронарными синдромами характеризуется долгосрочными изменениями рутинно определимых в реальной клинической практике клинико-лабораторных и инструментальных параметров. Медианная длительность «постковидных» изменений метаболических, гематологических и инструментальных параметров составила 4 месяца. У пациентов с ХКС в зависимости от давности манифестации COVID-19 на фоне относительно постоянного количества общего белка отмечался достоверный рост уровня альбуминов сыворотки крови, происходило снижение частоты сердечных сокращений, увеличение фракции выброса левого желудочка и снижение уровня лейкоцитов крови.
Список литературы Долгосрочные эффекты новой коронавирусной инфекции COVID-19, перенесенной пациентами с хроническими коронарными синдромами, в условиях реальной клинической практики
- Nabavi N. Long COVID: how to define it and how to manage it. BMJ 2020; 370: m3489. DOI: 10.1136 / bmj. m3489.
- Greenhalgh T, Knight M, A’Court C, et al. Management of post-acute COVID-19 in primary care. BMJ 2020; 370: m3026. DOI: 10.1136 / bmj. m3026.
- Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome. Nat Med 2021; 27 (4): 601–15. DOI: 10.1038 / s41591‑021‑01283‑z, 2021 / 03 / 22.
- 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC) / ESC Scientific Document Group. Eur Heart J 2020; 41 (3): 407–77. DOI: 10.1093 / eurheartj / ehz425.
- Interim methodological recommendations: Prevention, diagnosis and treatment of new coronavirus infection (COVID-19): Version 11 (07.05.2021). URL: static-0.minzdrav.gov.ru. Russian (Временные методические рекомендации: Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19): Версия 11 (07.05.2021). URL: static-0.minzdrav.gov.ru).
- Linschoten M, Peters S, van Smeden M, et al. Cardiac complications in patients hospitalised with COVID-19. Eur Heart J Acute Cardiovasc Care 2020; 9 (8): 817–23. DOI: 10.1177 / 2048872620974605.
- Kawakami R, Sakamoto S, Kawai K, et al. Pathological evidence for SARS-CoV-2 as a cause of myocarditis: JACC review topic of the week. J Am Coll Cardiol 2021; 77 (3): 314–25. DOI: 10.1016 / j. jacc. 2020.11.031.
- Loo J, Spittle DA, Newnham M. COVID-19, immunothrombosis and venous thromboembolism: biological mechanisms. Thorax 2120; 76 (4): 412. DOI: org / 10.1136 / thorax jnl-2020–216243 / .
- Stahlberg M, Reistam U, Fedorowski A, et al. Post-COVID-19 Tachycardia Syndrome: A Distinct Phenotype of Post-Acute COVID-19 Syndrome [published online ahead of print]. Am J Med 2021; S0002–9343 (21) 00472–1. DOI: 10.1016 / j.amjmed. 2021.07.004.
- Kanjwal K, Jamal S, Kichloo A, Grubb BP. New-onset postural orthostatic tachycardia syndrome following coronavirus disease 2019 infection. J Innov Card Rhythm Manag 11 (2020); 4302–4. DOI: 10.19102 / icrm. 2020.111102.
- Miglis MG, Prieto T, Shaik R, et al. A case report of postural tachycardia syndrome after COVID-19. Clin Auton Res 2020; 5: 449–51. DOI: 10.1007 / s10286‑020‑00727‑9.


