Доминантные молекулярные маркеры мутации высокоолеиновости масла в семенах подсолнечника
Автор: Гучетль С.З.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 2 (182), 2020 года.
Бесплатный доступ
На сегодняшний день перспективными являются сорта и гибриды подсолнечника с высоким содержанием олеиновой кислоты. В связи с этим необходима разработка и валидация методов молекулярно-генетического выявления мутации высокоолеиновости масла в материале подсолнечника российской селекции, что способствовало бы ускорению селекционного процесса при помощи маркер-ассоциированного отбора. Материалом для исследования служили константные линии и гибриды F1 генетической коллекции ВНИИМК, отличающиеся по признаку содержания олеиновой кислоты в семенах. Геномную ДНК выделяли из семядольных листьев 5-7-днев-ных проростков подсолнечника с использованием СТАВ-буфера. Амплификацию выполняли в термоциклере S1000тм (BioRad, США). Использовали 11 INDEL, HO-specific fragment и SSR-праймеров, разработанных иностранными авторами. Экспериментальным путем были подобраны оптимальные температуры гибридизации (отжига) всех праймерных комбинаций с матрицей ДНК. Они составили от 50 до 65 °С...
Молекулярные маркеры, полимеразная цепная реакция, подсолнечник, высокоолеиновость, мутация
Короткий адрес: https://sciup.org/142223425
IDR: 142223425 | УДК: 633.854.78:575 | DOI: 10.25230/2412-608X-2020-2-182-24-32
Текст научной статьи Доминантные молекулярные маркеры мутации высокоолеиновости масла в семенах подсолнечника
Currently, sunflower varieties and hybrids with high content of oleic acid are very promising. Thus, it is necessary to develop and validate metods of molecular-genetic searching of mutation in high oleic oil of sunflower of the Russian breeding that can advance breeding process using marker-associated selection. As a material we used constant lines and F1 hybrids from the genetic collection of the V.S. Pustovoit AllRussian Research Institute of Oil Crops (VNIIMK) which are differed by a content of oleic acid on seeds. We evolved genomic DNA from cotyledons of 5–7-days sunflower seedlings using SТАB-buffer. Amplification was done in thermal cycler S1000тм (BioRad, США). We used 11 INDEL, HO-specific fragment и SSR-primers developed by foreign authors. In an experimental way, we selected optimal temperatures for hybridization (annealing) for all the primers combinations with DNA matrix. They were from 50 to 65 °С. Sizes of amplified DNA fragments generally corresponded to the same ones the authors of these markers had. Genotyping of high oleic and linoleic sunflower samples was done using seven pairs of primers. Two loci (F13/R5 и N1-1F/N1-1R) of the studied ones amplified in all genotypes independently of a presence of Ol mutation. This allows their using to exclude false negative results for mutation presence. Loci N1-2F/N2-1R, N1-3F/N2-1R, N1-3F/N2-2R,
N1-3F/N2-3R F4/R1 are dominant and indicate Ol mutation in high oleic genotypes. These markers are easy to use and require only agar gel usage. The results presented in this article can be used for marker- assistant selection of parental mutant forms in development of hybrids basing on the genotypes differed with their fatty-acid composition.
Введение. Подсолнечник является одной из важнейших масличных культур как у нас в стране, так и во всем мире. Получаемое из него растительное масло составляет основу рационального питания населения. Подсолнечное масло является наиболее употребляемым в нашей стране. Обладая большой энергетической ценностью, оно представляет собой главный источник биологически активных компонентов в рационе питания: моно- и полиненасыщенных жирных кислот, лецитинов (фосфолипидов), фитостеринов, витаминов. Стандартное подсолнечное масло богато полиненасыщенной линолевой кислотой, которая составляет около 60 % от суммы жирных кислот подсолнечного масла. Вторая наиболее распространенная – это мононенасыщенная олеиновая кислота с содержанием на уровне 30 % [1]. Потребительский спрос требует не только стандартные масла, но и растительные масла с измененными свойствами. Наиболее перспективными на сегодняшний день являются сорта и гибриды подсолнечника с высоким содержанием олеиновой кислоты. Мутация высокоолеиновости масла в семенах подсолнечника (Ol) получена впервые в мире во ВНИИМК и в 1976 г. создан высоко-олеиновый сорт подсолнечника Первенец [2]. Этот сорт стал уникальным донором данного признака в селекционных программах во всем мире. Олеиновая кислота является одной из основных жирных кислот, входящих в состав масла семян подсолнечника. Её содержание в различных сортах и гибридах подсолнечника может колебаться в широких пределах – от 10– 30 % (сорта с традиционным жирнокислотным составом) до 80–92 % (высо-коолеиновые сорта) [2; 3]. Повышенное содержание олеиновой кислоты в подсолнечном масле значительно улучшает его потребительские качества. В связи с высокой окислительной стабильностью вы- сокоолеиновое подсолнечное масло более устойчиво в процессе жарки, к воздействию высоких температур. Отсутствие транс-жирных кислот делает его более полезным для здоровья. Кроме того, такое масло имеет больший срок годности по сравнению со стандартным. В переработке высокоолеиновое масло снижает затраты на очистку, его легче транспортировать и хранить [3]. Мутантный фенотип экспрессируется только в семенах и обусловлен отсутствием активности фермента дельта-12-десатуразы. В норме данный фермент катализируют введение двойной связи в олеиновую кислоту (С18:1) с превращением её в линолевую (С18:2) [4].
С молекулярно-генетической точки зрения, увеличение содержания олеиновой кислоты обусловлено частичным дублированием аллеля FAD2-1, который вызвал подавление экспрессии гена FAD2-1 [4; 5], который кодирует фермент дельта-12-десатуразу. Таким образом, как стандартный, так и высокоолеиновый генотипы содержат последовательность FAD2-1. Однако у высокоолеиновых генотипов имеется дополнительная межгенная область (IGR), разделяющая общую последовательность FAD2-1, и укороченные интрон и экзон, которые представляют собой дублированную последовательность, обозначенную как FAD2-1D [5]. Это FAD2-1 дублирование называется Ol мутацией. G.F. Schuppert et al. разработали доминантные маркеры INDEL для обнаружения мутации Ol (наличие или отсутствие тандемных повторов FAD2-1) и идентифицировали почти 50 SNP и несколько INDEL для FAD2-1 [5]. S. Lacombe et al. и A. Bervillé et al. разработали два типа маркеров. Первый – кодоминантные маркеры SSR, расположенные в интроне предполагаемого гена FAD2-1 и тесно сцепленные с мутацией. Второй – доминантные маркеры, специфичные для мутации [6; 7]. В последние несколько лет исследования по идентификации подходящих и простых в ис- пользовании молекулярных маркеров для обнаружения высокоолеиновых генотипов увеличились из-за растущего интереса селекционных компаний к большему разнообразию генотипов подсолнечника с таким жирно-кислотным составом масла. Несколько авторов работали над разработкой методов обнаружения генов Ol с использованием известных молекулярных маркеров [8; 9; 10], но полученные результаты показали необходимость дальнейшей валидации данных методов в разных популяциях подсолнечника и на разном генетическом фоне [9; 10].
Во ВНИИМК на протяжении многих лет проводятся исследования по изучению состава жирных кислот в масле семян подсолнечника и наследования данного признака [11; 12; 13; 14]. Была разработана биологическая классификация генетической коллекции ВНИИМК по содержанию олеиновой кислоты на основе разделения на классы фенотипов образцов с определенным жирнокислотным профилем [15]. Но не были разработаны методы молекулярногенетического выявления мутации высо-коолеиновости масла в материале подсолнечника российской селекции, которые способствовали бы ускорению селекционного процесса при помощи маркер ассоциированного отбора. В связи с этим цель исследования: идентифицировать и валидировать простые в использовании молекулярные маркеры, которые будут наиболее эффективными для обнаружения мутации высокоолеиновости масла у подсолнечника.
Материалы и методы. Материалом для исследования служили константные линии генетической коллекции ВНИИМК и гибриды F 1 , отличающиеся по признаку содержания олеиновой кислоты в семенах, предоставленные сотрудниками лаборатории генетики ВНИИМК. Линии, которые несли мутацию высокоолеиново-сти масла: ВК 876, ВК 541, НА 422, ВК 680, ЛГ 26, ВК 508, ВК 195, ВК 805, RHA
345. Линии без данной мутации: ЛГ 28, 83HR4, ВК 580.
Кроме вышеприведенных линий, были проанализированы четыре гибридные комбинации первого поколения: ВК 541 × ВК 580; НА 422 × ВК 580; ЛГ 26 × ВК 580; ВК 508 × ВК 580.
Геномную ДНК выделяли из семядольных листьев 5–7-дневных этиолированных проростков подсолнечника с помощью модифицированного метода Saghai-Maroof et аl. [16] с использованием СТАВ-буфера. Для определения однородности генотипов отбирали по пять индивидуальных растений каждого образца. Растительную ткань измельчали с использованием гомогенизатора Speed Mill plus (Analytic Jena, Германия). Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5–3 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Си-бэнзим, Москва). Амплификацию выполняли в термоциклере S1000тм (BioRad, США). Условия амплификации: начальная денатурация при 96 °С в течение 2 мин; затем 30 циклов при соблюдении температурно-временного режима: отжиг при 50–65 °С (в зависимости от праймера) в течение 40 с, элонгация – 1 мин при 70 °С, денатурация при 94 °С – 30 с, финальная элонгация – 2 мин. Использовали 11 INDEL, HO-specific fragment и SSR-праймеров, разработанных зарубежными авторами [5; 6; 7] (табл. 1). Для амплификации длинных фрагментов ДНК (больше 1000 пар нуклеотидов (п. н.) использовали программу LD ПЦР, описанную Schuppert et al. [5]. Праймеры были изготовлены ООО «Синтол» (Москва, Россия).
Таблица 1
Нуклеотидные последовательности праймеров, использованных в работе г. Краснодар, ВНИИМК, 2020 г.
|
Название праймера |
Последовательность нуклеотидов праймера |
Источник |
|
F 13 |
TCA ACA GCC TCT TCC TCC TCA G |
Schuppert et al., 2006 |
|
R5 |
GTA GTT TTG GAA AGC TAG AGA CC |
- // - |
|
F4 |
GTA ACG TCT GCG CGC TTG CAG ACA TCA |
- // - |
|
R1 |
GGT TTT GCA TGA GGG ACT CGA TCG AGT G |
- // - |
|
N1-2F |
CAA ACC ACC ACC CAC TAA C |
Bervillé et al., 2009; Lacombe et al., 2009 |
|
N1-3F |
GAG AAG AGG GAG GTG TGA AG |
- // - |
|
N2-1R |
AGC GGT TAT GGT GAG GTC AG |
- // - |
|
N2-2R |
ACA AAG CCC ACA GTG TCG TC |
- // - |
|
N2-3R |
GCC ATA GCA ACA CGA TAA AG |
- // - |
|
N1-1F |
TTG GAG TTC GGT TTA TTT AT |
- // - |
|
N1-1R |
TTA GTA AAC GAG CCT GAA C |
- // - |
Электрофорез продуктов амплификации проводили в агарозном геле (2 % агароза, 1 х SB-буферы) с использованием камеры для горизонтального электрофореза (SE.2, ДНК-технология, Россия) в течение 1–1,5 ч при силе тока 58 mA и напряжении 90–100 V. Последующее окрашивание осуществляли бромистым этидием. Визуализация результатов электрофореза в ультрафиолетовом свете и их документирование обеспечивались при помощи системы цифровой документации видеоизображения BIO-PRINT (Vilber Lourmat, Франция). Размер фрагментов ДНК определяли с использованием программного обеспечения BioCapture (Vilber Lourmat, Франция) относительно маркера длины фрагментов ДНК GeneRuler 100 bp DNA Ladder Thermo Scientific (Сибэнзим, Россия).
Результаты и обсуждение. Для валидации известных молекулярных маркеров в первую очередь было необходимо определить для них оптимальные условия и температурные режимы ПЦР. Экспериментальным путем были подобраны оптимальные температуры гибридизации (отжига) всех праймерных комбинаций с матрицей ДНК и определены молекулярные массы продукта ПЦР (табл. 2). Оптимальные температуры отжига для разных пар праймеров составили от 50 до 65 °С, молекулярные массы фрагментов ДНК – от 210 до 3000 п. н.
Таблица 2
Оптимальные температурные режимы для ПЦР анализа ДНК-локусов и молекулярные массы амплифицированных фрагментов ДНК г. Краснодар, ВНИИМК, 2020 г.
|
Пара праймеров |
Молекулярная масса продукта (п. н.) |
Оптимальная t отж _ (°С) |
|
|
экспериментальная |
ожидаемая |
||
|
F13/R5 |
280 |
342 |
60 |
|
F4/R1 |
590 |
653 |
60 |
|
N1-2F/N2-1R |
3000 |
3100 |
64-58 |
|
N1-3F/N2-1R |
870 |
891 |
65 |
|
N1-3F/N2-2R |
925 |
1000 |
60 |
|
N1-3F/N2-3R |
1200 |
1400 |
60 |
|
N1-1F/N1-1R |
210 |
240 |
50 |
Все праймерные пары гибридизова-лись с ДНК. Размеры амплифицирован-ных фрагментов ДНК в основном соответствовали полученным авторами, разработавшими данные маркеры [5; 6; 7]. Генотипирование высокоолеиновых и низкоолеиновых образцов подсолнечника и их гибридов проводили с использованием семи пар праймеров: одного SSR (N1-1F/N1-1R), четырех HO PCR-specific fragment (N1-2F/N2-1R, N1-3F/N2-1R, N1-3F/N2-2R, N1-3F/N2-3R) и двух INDEL (F4/R1, F13/R5).
Согласно литературным данным, ПЦР-амплификация SSR-локуса N1-1F/N1-1R приводит к фрагментам 243/246/249 п. н., соответствующим 15/16/17 TTA-повторам соответственно. Высокоолеиновые генотипы подсолнечника имеют 16 повторов TTA, тогда как низкоолеиновые – 17 повторов TTA [7]. Полученные нами результаты ПЦР после разделения продуктов в агарозном геле выявили одну фракцию ДНК длиной 240 п. н., которая присутствовала у всех генотипов – и вы-сокоолеиновых, и линолевых (табл. 3).
Маркер F13/R5 был разработан как кодоминантный INDEL для FAD2-1 и выявлял до 8 аллелей у кондитерского и масличного подсолнечника с разным со- держанием олеиновой кислоты [5]. В нашем исследовании он показал себя как мономорфный, амплифицировал фракцию приблизительно 340 п. н. в линиях и потомствах F1 со всеми типами содержания олеинового масла в семенах подсолнечника (табл. 3, рис. 1). В связи с этим пары праймеров N1-1F/N1-1R и F13/R5 рассматриваются нами как фланкирующие контрольные бенды 240 и 340 п. н. соответственно, которые амплифициру-ются несмотря на наличие или отсутствие мутации Ol.
Таблица 3
Характеристика линий и гибридов F1 генетической коллекции ВНИИМК по наличию фрагментов ДНК, маркирующих ген Ol г. Краснодар, ВНИИМК, 2020 г.
|
Генотип |
ДНК-локус |
||||||
|
N1-3F/ N2-1R |
N1-3F/ N2-2R |
N1-3F/ N2-3R |
N1-2F/ N2-1R |
F4-R1 |
N1-1F/ N1-1R SSR |
F13/ R5 |
|
|
Высокоолеиновые |
|||||||
|
ВК 876 |
+* |
+ |
+ |
+ |
+ |
+ |
+ |
|
ВК 541 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
НА 422 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ВК 680 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ЛГ 26 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ВК 508 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ВК 195 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
RHA 345 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Низкоолеиновые |
|||||||
|
ЛГ 28 |
̶ |
̶ |
̶ |
̶ |
̶ |
+ |
+ |
|
83HR4 |
̶ |
̶ |
̶ |
̶ |
̶ |
+ |
+ |
|
ВК 580 |
̶ |
̶ |
̶ |
̶ |
̶ |
+ |
+ |
|
Гибриды F 1 |
|||||||
|
ВК 541 × ВК 580 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
НА 422 × ВК 580 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ЛГ 26 × ВК 580 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ВК 508 × ВК 580 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
* Знаком (+) обозначается наличие у образца маркерного фрагмента ДНК; (-) - отсутствие такового
Пять маркеров, использованные в этом исследовании, позволили выявить различия между высокоолеиновыми и линолевыми линиями. Маркеры F4/R1 [5], N1-2F/N2-1R, N1-3F/N2-1R, N1-3F/N2-2R, N1-3F/N2-3R [6; 7] обнаружили отличия между линиями. Однако ни один из них не показал дискриминации между гомозиготным и гетерозиготным генотипом (табл. 3).
500 пн —►
М ок 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Рисунок 1 - Электрофоретические спектры ДНК подсолнечника, амплифи-цированной с праймерной парой F13/R5: Дорожки: 1 - ВК 876; 2 - ВК 541; 3 - НА 422;
4 - ВК 680; 5 - ВК 805; 6 - 26; 7 - ВК 508;
-
8 - ВК 195; 9 - ЛГ 27; 10 - ЛГ 28; 11 - 83HR4;
12 - ВК 580; 13 - F 1 (ВК 541 х ВК 580);
14 - F 1 (НА 422 х ВК 580); 15 - F 1 (ЛГ 26 х ВК 580); 16 - F 1 (ВК 508 х ВК 580);
М - маркер молекулярной массы 100 bp, ок - отрицательный контроль
Молекулярный маркер N1-3F/N2-1R был создан для амплификации высокоолеино-вого специфического фрагмента и выявляет фракцию приблизительно 891 п. н. [6; 7]. В нашем исследовании пара праймеров амплифицировала полосу приблизительно 870 п. н. у высокоолеиновых линий и в потомствах F1, тогда как этот фрагмент отсутствовал у стандартных линолевых линий (табл. 3, рис. 2).
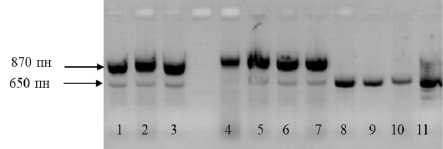
Рисунок 2 - Электрофоретические спектры ДНК подсолнечника, амплифи-цированной с аллель-специфичными праймерами по гену Ol N1-3F/N2-1R: Дорожки: 1 - ВК 876; 2 - ВК 541; 3 - НА 422; 4 - F 1 (ВК 541 х ВК 580); 5 - F 1 (НА 422 х ВК 580); 6 - F 1 (ЛГ 26 х ВК 580); 7 - F 1 (ВК 508 х ВК 580); 8 - ЛГ 27; 9 - ЛГ 28; 10 - 83HR4;
11 - ВК 580. Стрелками обозначены фрагменты ДНК 870 п. н., маркирующие мутацию высокоолеиновости масла, и 650 п. н., присутствующие у всех генотипов
Кроме того, этот праймер амплифициро-вал фракцию 650 п. н., общую между образцами, несущими и не несущими мутацию Ol (рис. 2). Степень выраженности фракции была разной у линий с разными генотипами, что не позволило использовать данную фракцию как контрольную.
Молекулярный маркер N1-3F/N2-2R также был разработан для амплификации высокоолеинового специфического фрагмента и, согласно литературным данным, амплифицирует фракцию приблизительно 1000 п. н. [6; 7]. В нашем исследовании пара праймеров амплифицировала фрагмент ДНК приблизительно 925 п. н. у вы-сокоолеиновых линий и в потомствах F 1 , тогда как этот фрагмент отсутствовал у линолевых линий (табл. 3, рис. 3). Как и у предыдущей пары праймеров, была ам-плифицирована фракция, общая между образцами, несущими и не несущими мутацию Ol (рис. 3). Размер данного фрагмента ДНК составил 500 п. н. Степень выраженности фракции была разной у линий с отличающимися по содержанию олеинового масла генотипами, что также не позволило использовать её как контрольную.
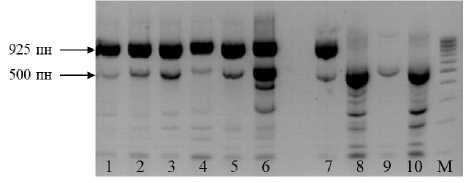
Рисунок 3 – Электрофоретические спектры ДНК подсолнечника, амплифи-цированной с аллель-специфичными праймерами по гену Ol N1-3F/N2-2R: Дорожки: 1 – ВК 876; 2 – ВК 541; 3 – НА 422; 4 – F 1 (ВК 541 × ВК 580); 5 – F 1 (НА 422 × ВК 580); 6 – F 1 (ЛГ 26 × ВК 580); 7 – F 1 (ВК 508 × ВК 580); 8 – ЛГ 27; 9 – ЛГ 28; 10 – ВК 580. М – маркер молекулярной массы 100 bp.
Стрелками обозначены фрагменты ДНК 925 п. н., маркирующие мутацию высокоолеиновости масла, и 500 п. н., присутствующие у всех Генотипов
Молекулярный маркер N1-3F/N2-3R является аллель-специфичным маркером к мутантному аллелю гена FAD2-1D. Показано, что пара праймеров, фланкирующих данный локус, амплифицирует фракцию ДНК приблизительно 1400 п. н. [6; 7]. В результате наших исследований высокоолеиновые мутанты показали специфическую полосу с длиной около 1200 п. н., которая отсутствовала в генотипах с низким содержанием олеиновой кислоты (табл. 3, рис. 4). Как и у предыдущей пары праймеров, была амплифи-цирована фракция 450 п. н., общая между всеми генотипами (рис. 4). Степень выраженности фракции была разной у линий с отличающимися по содержанию олеинового масла генотипами.
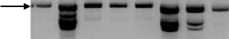
1 2 3 4 $ 6 7 8 9 10 II М
Рисунок 4 – Электрофоретические спектры ДНК подсолнечника, амплифи-цированной с аллель-специфичными праймерами по гену Ol N1-3F/N2-3R. Дорожки: 1 – ВК 876; 2 – ВК 541; 3 – НА 422; 4 – F 1 (ВК 541 × ВК 580); 5 – F 1 (НА 422 × ВК 580); 6 – F 1 (ЛГ 26 × ВК 580); 7 – F 1 (ВК 508 × ВК 580); 8 – RIL 100; 9 – ЛГ 28; 10 – ВК 580; 11 – 83HR4. М – маркер молекулярной массы 100 bp. Стрелками обозначены фрагменты ДНК 1200 п. н., маркирующие мутацию вы-сокоолеиновости масла, и 450 п. н., присутствующие у всех генотипов
Маркерный локус N1-2F/N2-1R выявляет наличие мутации Ol у подсолнечника, амплифицируя фрагмент ДНК 3100 п. н. [6; 7]. Его валидация в генетической коллекции ВНИИМК показала, что у высо-коолеиновых генотипов и гибридов, одним из родителей которых является содержащая мутацию Ol линия, амплифици-руется фрагмент, длиной около 3000 п. н., который отсутствует у линий дикого типа (табл. 3).
Также был разработан доминантный маркер INDEL для диагностики на нали- чие или отсутствие мутации Ol [5]. Показано, что пара праймеров F4/R1 ампли-фицировала фракцию 653 п. н. в мутантных линиях (высокоолеиновые линии), тогда как эта полоса отсутствовала в стандартных линиях подсолнечника [5]. В нашем исследовании F4/R1 амплифи-цировала одну фракцию ДНК примерно 590 п. н. у высокоолеиновых линий и в потомстве F1 (табл. 3, рис. 5).
1 2 3 4 5 6 7 8 9 10 11 М
Рисунок 5 – Электрофоретические спектры ДНК подсолнечника, амплифи-цированной с аллель-специфичными праймерами по гену Ol F4/R1: Дорожки: 1 – ВК 876; 2 – ВК 541;
3 – НА 422; 4 – F 1 (ВК 541 × ВК 580);
5– F 1 (НА 422 × ВК 580); 6 – F 1 (ЛГ 26 × ВК
580); 7 – F 1 (ВК 508 × ВК 580); 8 – ЛГ 28;
-
9 – ВК 580; 10 – 83HR4; 11 – ЛГ 27.
М – маркер молекулярной массы 100 bp.
Стрелкой обозначен фрагмент ДНК 590 п. н., маркирующий мутацию высокоолеиновости масла
Поскольку маркерные локусы являются доминантными, у всех гибридных растений, одним из родителей которого является линия, несущая мутацию Ol , также выявляются фрагменты ДНК, маркирующие мутацию. Статус растения – гетерозиготное или гомозиготное по гену Ol – значения не имеет.
Заключение. В результате проведенных исследований были идентифицированы и валидированы молекулярногенетические маркеры для обнаружения мутации высокоолеиновости для линий ВНИИМК с разным содержанием олеиновой кислоты в масле семян подсолнечника. Два локуса из проанализированных – F13/R5 и N1-1F/N1-1R – амплифициру-ются у всех генотипов независимо от наличия мутации Ol. Это позволяет использовать их как контрольные, для исключения ложноотрицательных результатов на наличие мутации. Локусы N1-2F/N2-1R, N1-3F/N2-1R, N1-3F/N2-2R, N1-3F/N2-3R F4/R1 являются доминантными и маркируют наличие мутации Ol у высокоолеиновых генотипов. Данные маркеры просты в использовании и требуют использования только агарозных гелей. Преимущество использования этих молекулярных маркеров заключается в том, что результаты генотипирования могут быть получены на любом этапе развития растения. Следовательно, селекционеры могут выбраковывать генотипы без мутации высокоолеиновости до цветения, экономя затраты на поддержание нежелательных генотипов. Представленные результаты могут быть использованы для маркер-сопутствующего отбора родительских мутантных форм при получении гибридов на основе генотипов, различающихся по жирно-кислотному составу.
Список литературы Доминантные молекулярные маркеры мутации высокоолеиновости масла в семенах подсолнечника
- Афанасьева В.А., Алферов С.В. Определение соотношения полиненасыщенных жирных кислот в пищевых маслах // Известия ТулГУ. Естественные науки. - 2018. - Вып. 4. - С. 76-83.
- Солдатов К.И., Воскобойник Л.К., Харченко Л.Н. Высокоолеиновый сорт подсолнечника Первенец // Бюл. НТИ по масличным культурам. - 1976. - Вып. 3. - С. 3-7.
- Vannozzi G.P. The perspectives of use of high oleic sunflower for oleochemistry and energy raws // Helia. - 2006. - V. 29 (44). - P. 1-24.
- Lacombe S., Leger S., Kaan F., Bervillé A., Sas M. Genetic, molecular and expression features of the Pervenets mutant leading to high oleic acid content of seed oil in sunflower // Oléagineux, Corps gras, Lipides - 2002. - V. 9. - P. 17-23.
- Schuppert G.F., Tang S., Slabaugh M.B. and Knapp S.J. The sunflower high-oleic mutant Ol carries variable tandem repeats of FAD2-1, a seed-specific oleoyl-phosphatidyl choline desaturase // Molecular Breeding. - 2006. - V. 17. - P. 241-256.
- Lacombe S., Souyris I., Bervillé A.J. An insertion of oleate desaturase homologous sequence silences via siRNA the functional gene leading to high oleic acid content in sunflower seed oil // Molecular Genetics and Genomics. - 2009. - V. 281. - P. 43-54.
- Bervillé A., Lacombe S., Veillet S., Granier C., Leger S., Jouve P. Method of selecting sunflower genotypes with high oleic acid content in seed oil. United States patent application US 11/587,956. - 2009.
- Singchai A., Muangsan N., Machikowa T. Evaluation of SSR markers associated with high oleic acid in sunflower // International Journal of Biological, Food, Veterinary and Agricultural Engineering. - 2013. - V. 7. - P. 631-634.
- Bilgen B.B. Characterization of sunflower inbred lines with high oleic acid content by DNA markers // In: Proc. of the 19th Intern. Sunfl. Conf., Turkey, Edirne, 2016. - P. 662-668.
- Dimitrijević A., Imerovski I., Miladinović D., Cvejić S., Jocić S., Zeremski T., Sakač Z. Oleic acid variation and marker-assisted detection of Pervenets mutation in high- and low-oleic sunflower cross // Crop Breeding and Applied Biotechnology. - 2017. - V. 17. - P. 229-235. http://dx.doi. org/.
- DOI: 10.1590/1984-70332017v17n3a36
- Демурин Я.Н., Борисенко О.М., Чебанова Ю.В. Наследование признака среднеолеиновости масла в семенах подсолнечника у гибридов второго и третьего поколений // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - № 3 (175). - С. 3-8.
- DOI: 10.25230/2412-608X-2018-3-175-3-8
- Демурин Я.Н., Борисенко О.М., Чебанова Ю.В. Осевой градиент содержания олеиновой кислоты в частях семени подсолнечника // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2014. - № 1 (157-158). - С. 7-10.
- Demurin Y., Borisenko O., Bochkarev N. Relationship of inheritance of a high palmitic mutation and plant height in sunflower // Helia. - 2010. - V. 33. - No. 53. - P. 149-154.
- Демурин Я.Н., Попов П.С., Ефименко С.Г. Гибридологический анализ признака высокоолеиновости масла семян подсолнечника // Науч.-тех. бюл. ВНИИМК. - 2001. - № 2 (125). - С. 3-20.
- Чебанова Ю.В., Демурин Я.Н., Борисенко О.М. Классификация генетической коллекции подсолнечника ВНИИМК на фенотипические классы по содержанию олеиновой кислоты // Мат-лы IV-й междунар. науч.-практич. конф. "Современное состояние, проблемы и перспективы развития аграрной науки" / Науч. ред. В.С. Паштецкий. - 2019. - С. 213-214.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R.A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics // PNAS USA. - 1984. - 81. - P. 8014-8018.


