Факторы риска и молекулярные основы этиопатогенеза остеоартроза коленного сустава (обзор литературы)
Автор: Новаков Виталий Борисович, Новакова Ольга Николаевна, Чурносов Михаил Иванович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзор литературы
Статья в выпуске: 1 т.27, 2021 года.
Бесплатный доступ
Введение. Остеоартроз - это гетерогенная группа заболеваний различной этиологии, при которых в процесс вовлекается не только суставной хрящ, но и субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы. Среди остеоартроза крупных суставов одну из самых актуальных проблем по своей медицинской, социальной и экономической значимости представляет гонартроз или остеоартроз коленного сустава. Материалы и методы. В представленном литературном обзоре проведён анализ зарубежных и отечественных научных публикаций, посвящённых молекулярным механизмам этиологии и патогенеза остеоартроза коленного сустава, основным факторам риска данного заболевания. Поиск научных публикаций за последние десять лет был выполнен в электронных базах данных PubMed, PubMedCentral, GoogleScholar, eLIBRARY на русском и английском языках по ключевым словам «остеоартроз коленного сустава», «патогенез», «этиология», «факторы риска», «knee osteoarthritis», «etiology», «pathogenesis», «risk factors». Результаты. Проведённый анализ литературных источников показал, что значимую роль в развитии заболевания имеют механизмы, в основе которых лежат нарушение метаболизма хряща, воспаление, изменение субхондральной кости, патологические процессы, происходящие в синовиальной оболочке. Остеоартроз коленного сустава является полиэтиологическим заболеванием с целым спектром как локальных (предшествующее повреждение сустава, слабость мышц, нарушение оси сустава, оперативные вмешательства на суставе, повышенная физическая активность, в том числе и спортивная физическая нагрузка, профессиональная деятельность), так и системных факторов риска (старший возраст, женский пол, высокий рост, избыточный вес и ожирение, гормональный статус, наследственная предрасположенность, минеральная плотность кости, дефицит витамина Д, этническая принадлежность), роль которых в различных этно-территориальных группах значительно варьирует. Заключение. Проведённый литературный обзор позволил раскрыть молекулярные механизмы этиопатогенеза остеоартроза коленного сустава, основные факторы риска данной патологии.
Остеоартроз коленного сустава, этиология, патогенез, факторы риска
Короткий адрес: https://sciup.org/142230144
IDR: 142230144 | УДК: 616.728.3-007.24-007.24:577.2(048.8) | DOI: 10.18019/1028-4427-2021-27-1-112-120
Текст научной статьи Факторы риска и молекулярные основы этиопатогенеза остеоартроза коленного сустава (обзор литературы)
Согласно современным представлениям, остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии, имеющих сходные биологические, морфологические и клинические проявления, при которых в патологический процесс вовлечены все структуры сустава, такие как хрящ, связки, субхондральная кость, синовиальная оболочка, периартикулярные мышцы, суставная капсула [1].
Среди остеоартроза крупных суставов одну из самых актуальных проблем по своей медицинской, социальной и экономической значимости представляет собой, несомненно, гонартроз или остеоартроз коленного сустава [2]. Согласно данным Всемирной организации здравоохранения, 9,6 % мужчин и 18,0 % женщин старше 60 лет во всем мире имеют симптоматический ОА [3]. Следует отметить, что рентгенологические признаки ОА встречаются у большинства лиц старше 65 лет. Считается, что коленные суставы чаще других поражаются остеоартрозом [4]. Среди взрослого населения России у ревматологических больных основную часть составляют пациенты с остеоартрозом (более 4 млн. на 2012–2013 гг.), причем свыше половины из них (около 2,5 млн. человек) приходится на лиц старше трудоспособного возраста [5]. Почти у 80 % больных ОА имеются некоторые ограничения в движениях, а 25 % пациентов отмечают невозможность выполнения повседневных движений [3]. Остеоартроз коленного сустава приводит к существенному снижению работо-
способности и инвалидизации людей трудоспособного возраста [2]. Следует также отметить, что пациенты с прогрессирующим ОА коленного сустава находятся в группе риска тотального эндопротезирования, являющегося, несомненно, эффективным методом лечения, но достаточно дорогостоящим [6, 7], наблюдается ежегодный прирост больных младше 55 лет, получающих эндопротезирование коленного сустава, согласно регистру эндопротезирования РНИИТО им. Р.Р. Вредена [8].
С учётом высокой распространённости, значимости в здравоохранении, медицине, экономике особый
МАТЕРИАЛЫ
Был проведён поиск научных публикаций за по следние де сять лет в электронных базах данных eLIBRARY, PubMed, PubMedCentral, GoogleScholar на английском и русском языках по ключевым словам «остеоартроз коленного сустава», «патогенез», «этиология», «фак- интерес представляет изучение механизмов возникновения и прогрессирования, факторов риска ОА коленного сустава, которые, к сожалению, в настоящее время до конца ещё непонятны, с целью дальнейшего прогнозирования течения заболевания, а также проведения профилактических и лечебных мероприятий.
Целью настоящего обзора является анализ отечественных и зарубежных научных публикаций, посвящённых вопросам этиологии и патогенеза артроза коленного сустава, а также основным факторам риска данного заболевания.
И МЕТОДЫ торы риска», «knee osteoarthritis», «etiology», «pathogenesis», «risk factors».
В случае необходимости были добавлены более ранние работы, раскрывающие важные аспекты этиологии и патогенеза остеоартроза коленного сустава, факторов риска данного заболевания.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Молекулярные механизмы этиологии и патогенеза ОА коленного сустава на протяжении многих десятилетий остаются предметом изучения для зарубежных и отечественных исследователей [9–22].
Следует отметить, что за последние годы представления об этиопатогенезе ОА коленного сустава претерпели значительные изменения. Знания о патогенезе этого заболевания прошли путь от представления как о возрастном «износе» сустава до признания вовлечения в патологический процесс всех его структур, существования иммунологических и генетических аспектов заболевания, нейрогенных механизмов формирования болевого синдрома [9–11]. В настоящее время ключевую роль в развитии остеоартроза отводят нарушениям в метаболизме хрящевой ткани, воспалительным процессам, изменениям в субхондральной кости [11–14].
T.P. Andriacchi и соавт. (2015) в своём обзоре на основе системного анализа отмечают роль биологических, механических и структурных компонентов в патогенезе ОА [15]. Авторы отмечают, что нарушение в одном из них (например, механическом) приводит к изменениям в других (например, биологическом и/или структурном), что влечёт за собой разрушение хряща и возникновение ОА [15]. В работе S. Glyn-Jones и соавт. (2015) также указывается, что ОА является многофакторным заболеванием, в патогенезе которого играют важную роль многочисленные генетические, биологические и биомеханические компоненты [13].
По данным А.И. Дядык и соавт. (2012), патогенез остеоартроза может быть представлен следующим образом [16] (рис. 1). Авторами подчёркивается важное значение в развитии заболевания деградации хряща и воспаления синовиальной оболочки. Деградация хряща приводит к синтезу хондроцитами провоспалительных цитокинов, «неполноценных» коллагенов и протеогликанов, склерозированию, появлению микропереломов и кист в субхондральной кости, формированию остеофитов, размягчению, образованию трещин, а также потере гидрофильности самой хрящевой ткани. Воспалённая синовиальная оболочка способствует усугублению нарушений функций сустава, усилению боли и прогрессированию дальнейшей деградации хряща.
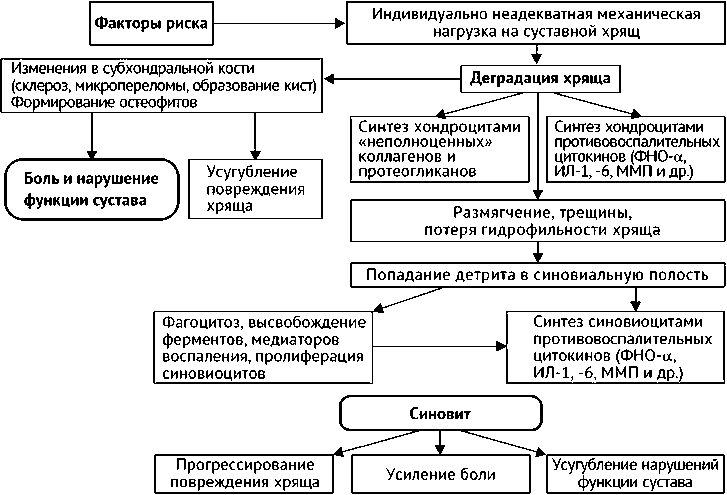
Рис. 1. Схема патогенеза остеоартроза [16]. ФНО- α – фактор некроза опухоли α , ИЛ-1 – интерлейкин 1, ММП – металлопротеиназы
Следует отметить, что воспалительный процесс затрагивает практически все структуры сустава, в результате чего формируется синовит, хондрит, остеит [11, 17–18]. Результатом длительного хронического воспалительного процесса в синовиальной оболочке являются изменения в метаболизме хондроцитов и нарушение баланса между анаболическими и катаболическими процессами с преобладанием последних [19].
Важную роль цитокинов в патогенезе ОА коленного сустава подтверждают многие исследования [16, 20–22]. Стоит отметить, что синтез цитокинов в зависимости от длительности течения и тяжести ОА может существенно меняться, что ещё раз подтверждает наличие иммунного характера воспаления при данном заболевании.
Среди цитокинов наибольшее значение имеют интерлейкин 1 β , фактор некроза опухоли α , интерлейкины 6, 15, 17 и 18, повышенные количества которых обнаружены в синовиальной оболочке и жидкости, в хрящевой ткани у больных ОА [21]. Данные цитокины приводят к повышению синтеза металлопротеиназ (MMP) в хондроцитах, снижают синтез протеогликанов, тканевого ингибитора MMP, при этом вырабатываются кислородные радикалы, оксид азот, наличие последних способствует прогрессированию катаболических процессов в хряще [22–23]. Деструктивные изменения в суставах при ОА связывают также с повышенной экспрессией изоформы синтетазы оксида азота. Данный фермент способен регулировать образование оксида азота под действием интерлейкина 1. Повышенный уровень оксида азота приводит к формированию резистентности хондроцитов к действию факторов роста, при этом подавляется синтез в хрящевом матриксе, а также индуцируется апоптоз самих хондроцитов [12].
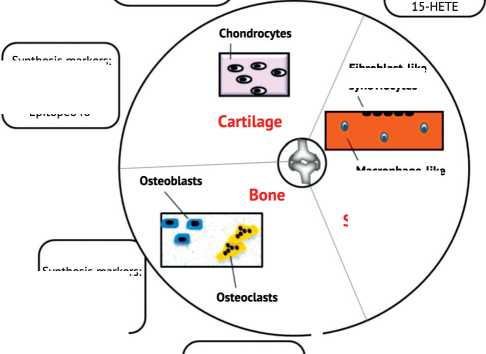
Согласно L.T. Nguyen и соавт. (2017), молекулярные основы патогенеза остеоартроза могут быть представлены в виде следующих последовательных и взаимосвязанных между собой этапов (рис. 2) [24]. Итак, первый этап характеризуется протеолитическим разрушением хряще- вого матрикса, которое возникает в результате нарушения метаболизма хондроцитов, приводящего к усилению секреции ферментов деградации, таких как коллагеназы и аггреканазы. Вторая стадия включает фибрилляцию и эрозию поверхности хряща с последующим выделением продуктов распада в синовиальную жидкость. На третьем этапе наблюдается воспаление синовиальной оболочки в результате проникновения продуктов распада в синовиальные клетки, что приводит к выработке провоспали-тельных цитокинов и протеаз, которые способствуют разрушению хрящевого матрикса [24].
По мнению G. Musumeci и соавт. (2015), основными молекулами, вовлечёнными в активацию хондроцитов при остеоартрозе, являются IL-1 β , TNF- α , RAGE, IGF-1, TGF β 1, iNOS, MMP13, лептин, ламинин, фибронектин, интегрин и коллаген, которые также участвуют в разрушении хряща в суставах или могут выступать в качестве субстратов для разрушения внеклеточного матрикса [25].
Существует и ряд других медиаторов воспаления, которые также вносят свой вклад в патогенез ОА. Хорошо известна биологическая активность простоглан-динов, лейкотриенов, протеаза-активированных рецепторов (PARs), которые играют определённую роль в повреждении тканей и их репарации, ангиогенезе, ноцицепции и нейрогенном воспалении [26].
В патогенезе ОА коленного сустава значимую роль имеет иммунный фактор. Уже на ранних этапах заболевания в крови больных ОА обнаруживают циркулирующие аутоантитела к протеингликанам [27]. Образующийся при этом комплекс антиген-антитело приводит к разрушению макрофагов в синовиальной мембране, которая способствует выделению медиаторов воспаления, последние, в свою очередь, обладают повреждающим действием на хондроциты и вызывают синовит [26]. При этом синовиальной оболочкой выделяются биологические медиаторы воспаления, способствующие деструктивным процессам в хряще, т.е. возникает замкнутый круг [17, 28].
Degradation markers: CTX-II,C2C,CIIM, HELIX-II, CoLL2-lNO2, ARGS, COMP, Pentosidine, FSTL1, Fib3-1, Fib3-2, MMP-1-3-9-13, ADAMTS-4, TIMP-1-2
^Imflammatory^ markers: IL-IRa, TNF-cl, TNF-R, IL-2-4-6-8-15-18, VEGF, PGE2,
Synthesis markers: PIMP, ОС, HA, YKL-40
Degradation markers: MidOC, CTX-I, NTX-I, ol-CTX-l, p-CTX-l, PYD, DPD
Synthesis markers: PIICP, PIIANP, C-CollO, Epitope846
Fibroblast-like synoviocytes
Macrophage-like synoviocytes
Synovium
HA, YKL-40, Glc-Gal-PYD
Рис. 2. Схема молекулярных основ патогенеза остеоартроза [24]: degradation markers – маркеры деграда-ции,p entosidine – пентозидин, imflammatory markers – маркеры воспаления, synthesis markers – маркеры синтеза, epitope 846 – эпитоп 846, chondrocytes – хондроциты, cartilage – хрящ, fibroblast-like synoviocytes – фибробластоподобные синовиоциты, macrophage-like synoviocytes – макрофагоподобные синовиоциты, synovium – синовиальная оболочка, bone – кость, osteoclasts – остеокласты, osteoblasts – остеобласты
Следует отметить, что за последние годы претерпели существенные изменения взгляды на причинноследственные аспекты в патогенезе ОА. Изначально считалось, что первично происходит поражение суставного хряща, а сужение суставной щели с сопутствующими изменениями в субхондральной кости рассматривалось как вторичный процесс [24]. На сегодняшний день изменениям в субхондральной кости отводится одна из ведущих ролей в возникновении заболевания [18, 20].
Нормальная костная структура обеспечивается благодаря наличию равновесия между формированием и резорбцией кости. В регуляции данных процессов участвуют многие гормоны, факторы роста и цитокины. Согласно современным литературным источникам [29, 30], ключевую роль в регуляции метаболизма костных клеток отводят молекулярной триаде: остео-протегерин; рецептор, активирующий фактор транскрипции NFкB; лиганд этого рецептора (ОPG/RANK/ RANKL). Одним из факторов, который регулирует функционирование данной триады, является уровень половых гормонов [20]. Известно, что недостаточное количество женских половых гормонов ведет к повышению экспрессии RANKL стромальными клетками. RANKL, связываясь с RANK, который экспрессируется на предшественниках остеокластов, стимулирует их дифференцировку и функциональную активность зрелых клеток [19]. При этом наблюдается снижение экспрессии антагониста RANK – ОPG стромальными клетками и остеобластами [29]. Данные процессы, несомненно, ведут к изменениям в субхондральной кости, замедлению костеобразования, т.е. к уменьшению пролиферации остеобластов и их функциональной активности.
О роли костного метаболизма в патогенезе гонартро-за отмечается в работе О.В. Синяченко и соавт. (2016), в которой установлено, что у больных ОА коленного сустава наблюдаются значительные изменения в крови маркеров костного метаболизма, которые проявляются дисбалансом остеоассоциированных макроэлементов (кальция, магния, фосфора) с развитием гипокальциемии, (наблюдается в 98 %), высокой активностью щелочной фосфатазы (в 47 % случаев), признаками гипер-паратиреоидизма и гиперостеокальциемией [31].
К основным этиологическим факторам развития остеоартроза коленного сустава относят микро- и макротравмы сустава, возникающие в результате ин- тенсивных физических нагрузок различного происхождения (в том числе, спорт, избыточная масса тела и т.д.) [17, 22]. В таком случае неравномерно распределённая нагрузка по поверхности суставного хряща и максимальное давление сосредоточиваются на небольшой площади, в месте наибольшего сближения суставных поверхностей, приводя к дистрофии и дегенерации хряща [12, 32]. Эти негативные процессы связывают с нарушением метаболизма хряща, который сопровождается уменьшением содержания протеогликанов и разрывом коллагеновых волокон.
Имеются сведения о важной роли эрозии хряща в медиальных отделах коленного сустава в патогенезе ОА [33, 34]. В работе S.R. Lyu и соавт. (2015) были выявлены более высокие концентрации общего белка, TNF- α , IL-1 β и MMP-3 в медиальном отделе коленного сустава у пациентов с данной патологией [33]. A. Heijink и соавт. (2012) в своём обзоре особо отмечают роль биомеханических аспектов в патогенезе ОА коленного сустава, таких как повреждение менисков, дефекты хряща и нестабильность суставов [35].
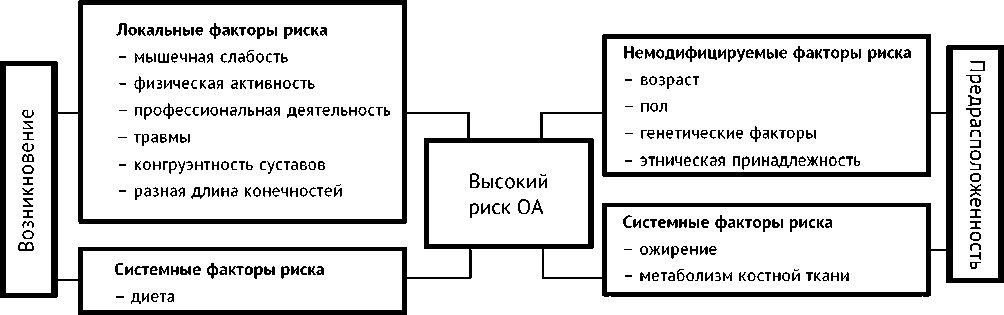
Остеоартроз коленного сустава является многофакторным заболеванием [36]. Выделяют целый ряд факторов риска развития ОА коленного сустава [22, 37, 38]. Современное понимание происхождения ОА состоит в том, что это заболевание возникает вследствие взаимодействия множества локальных и системных факторов риска [25, 38, 39]. К системным факторам риска ОА коленного сустава относятся старший возраст, женский пол, высокий рост, избыточный вес и ожирение, гормональный статус, наследственная предрасположенность, минеральная плотность кости, дефицит витамина Д, этническая принадлежность [23, 25, 39, 40]. Локальными факторами риска ОА являются предшествующее повреждение сустава, слабость мышц, нарушение оси сустава, оперативные вмешательства на суставе, повышенная физическая активность, в том числе и спортивная физическая нагрузка, профессиональная деятельность [25, 40–41].
Такие факторы риска как возраст, пол, этническая принадлежность, генетические факторы относят к немодифицируемым факторам риска данного заболевания (рис. 3) [25], а избыточный вес, сидение на корточках, езда на велосипеде входят в группу модифицируемых факторов риска ОА коленного устава [42]. G. Musumeci et al. (2015) особо подчёркивают роль локальных факторов риска в возникновении остеоартроза (рис. 3).
Наиболее распространенным фактором риска ОА в отношении опорных суставов, в том числе и коленных, является возраст [10, 22, 43]. Известно, что встречаемость ОА коленного сустава значительно увеличивается в старших возрастных группах [2, 19, 44]. Это может быть связано с тем, что в результате старения у хондроцитов наблюдается резкое снижение способности восстанавливать матрикс суставного хряща, что неизбежно приводит к дефициту межуточного вещества, или же матрикс хряща в пожилом возрасте отличается большей чувствительностью к микроповреждениям, и восстановительные механизмы клеток не в состоянии компенсировать эту увеличивающуюся чувствительность.
Важным фактором риска развития ОА коленного сустава является женский пол. Отмечается более высокая встречаемость ОА коленного сустава у женщин, чем у мужчин [19, 38]. Причём риск возникновения ОА коленного сустава у женщин в менопаузе становится выше [25], что связывают с дефицитом эстрадиола. Известно, что половые гормоны способны модифицировать метаболизм хрящевой ткани [19, 20]. Сниженный уровень эстрогенов у женщин в менопаузу обусловливает повышение уровня костного метаболизма в субхондральной кости, уменьшение мышечной силы и массы, разрушение хондроцитов. Также следует отметить, что заместительная гормонотерапия эстрогенами у женщин в постменопаузе ассоциирована с меньшим риском развития ОА коленного и тазобедренного суставов [45].
При исследовании распространённости ОА коленного сустава среди корейского населения S. Lee и со-авт. (2017) установили, что частота рентгенологического OA коленного сустава у женщин в 2,1 раза выше, чем у мужчин (43,8 % и 21,1 % соответственно) [46]. В работе S. Muraki и соавт. (2012) также выявлено, что встречаемость рентгенологического ОА коленного сустава 3 стадии и более по классификации Kellgren/ Lawrence (K/L) у японских женщин составила 13,9 %, что в 1,7 раза выше, чем у мужчин (8,4 %, OR 1,34 95 % CI 1,15–1,58) [47]. Также данной группой учёных выявлено, что боль в колене является не только важным фактором риска возникновения, но и прогрессирования ОА коленного сустава [47].
Известно, что высокая минеральная плотность кости (МПК) является повышенным фактором риска ОА, в то время как низкая минеральная плотность костного материала – протективным фактором [22, 48–49]. В современных литературных источниках отсутствуют данные, описывающие молекулярные механизмы влияния МПК на риск развития ОА [48]. В работе K.N. Linde и соавт. (2017) показано, что уровень P1NP (N-терминальный пропептид проколлагена 1 типа), являющегося маркером костного обмена, был достоверно выше у больных ОА коленного сустава с 4 стадией по классификации Kellgren/Lawrence, чем у пациентов с 3 стадией (45,9 мг/л и 41,9 мг/л соответственно, p = 0,03) [50].
Остеоартроз – это коморбидное заболевание, наиболее часто сочетающееся с сердечнососудистой патологией, ожирением, сахарным диабетом, остеопорозом и др. [51, 52]. В исследовании H.S. Kim и соавт. (2016) установлено, что распространённость ОА коленного сустава у пациентов с сахарным диабетом в 2,4 раза выше по сравнению с группой больных без диабета с учётом поправки на возраст и пол (OR 1,19 95 %
CI 1,00–1,41; p = 0,04) [53]. F. Eymard и соавт. (2015) при исследовании влияния метаболических факторов (ожирение, диабет, гипертония и дислипидемия) на скорость прогрессирования ОА коленного сустава, установили, что ширина суставной щели у больных ОА коленного сустава без сахарного диабета 2 типа была достоверно меньше, чем у пациентов с сахарным диабетом (p = 0,018) [52]. Таким образом, можно отметить, что наличие сахарного диабета 2 типа у больных ОА коленного сустава является фактором риска развития данного заболевания [25, 54]. Также в работе J. Niu и соавт. (2017) были выявлены взаимосвязи метаболического синдрома с радиографическим и симптоматическим ОА коленного сустава, но после введения поправки на индекс массы тела данные ассоциации не достигали статистически значимого уровня [55].
Ведущим фактором риска возникновения и прогрессирования ОА коленного сустава считается избыточная масса тела и ожирение [10, 40, 56–58]. В работе L. Jiang и соавт. (2012) показали, что у больных ОА коленного сустава существует прямая зависимость между ожирением и риском ОА, причем эта зависимость значительно сильнее у женщин, чем у мужчин [59]. Данной группой авторов установлено, что увеличение индекса массы тела на 5 кг/м2 повышает риск развития остеоартроза коленного сустава на 35 % (ОR 1,35 95 % Cl 1,21–1,51) [59]. Не вызывает сомнения факт того, что борьбу с лишним весом признают эффективной мерой профилактики и лечения гонартроза [60]. Некоторые исследования и метаанализы, которые посвящены изучению связи снижения массы тела и клинических исходов ОА, демонстрируют важную роль диетотерапии как основного фактора профилактики ОА коленного сустава [61–62].
S.P. Messier и соавт. (2013) в своей работе выявили, что диетотерапия в течение 18 месяцев способствовала снижению массы тела у больных ОА коленного сустава на 9,5 %, а также установили, что пациенты, находящиеся на диетическом питании и выполняющие физические упражнения, имеют достоверно более низкий уровень боли, чем пациенты, использующие только физические нагрузки [61]. Следует отметить, что избыточная масса тела и ожирение являются не только факторами риска возникновения ОА коленного сустава, но и прогрессирования заболевания [40, 62–64].
Благодаря артроскопии были получены доказательства негативной роли воспаления синовиальной оболочки в процессе прогрессирования деградации хряща при гонартрозе [65]. D.T. Felson и соавт. (2016) при исследовании 239 больных ОА коленного сустава и 731 индивидуума контрольной группы установили, что синовит является независимым фактором риска возникновения остеоартроза коленного сустава (ОR 1,1 95 % Cl 1,0-1,2, p = 0,02) [66].
В литературе приводятся сведения об участии в патогенезе ОА нарушений обмена витаминов и микроэлементов. Так, дефицит поступления витамина D в организм человека является вероятным фактором риска ОА коленного сустава [9, 67–69]. Известно, что более высокий уровень сывороточного 25(OH)D связан с меньшей потерей хряща в коленном суставе [70], а снижение поступления витамина D в организм и низкий уровень сывороточного витамина D взаимосвязаны с более высоким риском прогрессирования гонартроза [71]. Имеются данные, которые свидетельствуют о наличии расовых различий в уровнях боли у больных ОА в зависимости от уровня витамина D в организме. В исследовании T.L. Glover. и соавт. (2012) установлено, что дефицит витамина D является фактором риска интенсивной боли в коленном суставе у афроамериканцев при ОА [72].
Имеются сведения о значимой роли в патогенезе ОА коленного сустава витамина К, который является важны регулятором костной минерализации [19, 73]. Так, в исследовании D. Misra и соавт. (2013) показано, что низкая концентрация витамина К в плазме является фактором с риска развития рентгенологического ОА коленного сустава (OR 1,56; 95 % CI 1,08–2,25) [73].
Результаты исследований распространённости ОА коленного сустава в разных этнических группах весьма противоречивы. Согласно некоторым исследованиям, афроамериканцы с ОА коленного сустава имели более высокую распространенность рентгенологического ОА коленного сустава (3 и 4 стадии по классификации Kellgren-Lawrence) по сравнению с европейцами [74]. Однако в работе B.R. Deshpande и соавт. (2016) при изучении распространённости ОА коленного сустава c 2007 по 2008 г. в США было установлено, что из 13,7 млн. пациентов с данной патологией 10,4 млн. человек были белокожие, а 3,4 млн. афроамериканцы, латиноамериканцы и другие расовые/этнические меньшинства [4]. Y. Cruz-Almeida и соавт. (2014) при исследовании 267 больных ОА коленного сустава выявили, что афроамериканцы демонстрировали повышенную болевую чувствительность по сравнению с белым населением [75].
Наследственную предрасположенность выявляют чаще при генерализованном ОА. Некоторые формы семейного ОА, которые связаны с хондродисплазиями, наследуются по аутосомно-доминантному типу. При исследовании влияние генетических факторов при возникновении ОА различных локализаций на выборке из 992 монозиготных и дизиготных женщин-близнецов из реестра TwinsUK установлено, что вклад наследственных факторов в развитие ОА коленного сустава равен 37 % [76]. В работе S.G. Skousgaard и соавт., посвящённой оценке роли наследственности при развитии первичного ОА коленного сустава, приводящего к полной артропластике сустава, установлено, что наследственный компонент составил 18 %, общие экзогенные факторы и отдельные компоненты среды – 82 % [77].
Известно, что слабость мышц вносит существенный вклад в развитие и прогрессирование ОА [18, 78–79]. В работе S. Muraki было показано, что слабость четырехглавой мышцы бедра ассоциирована с болью при ОА коленного сустава [80]. В систематическом обзоре и метаанализе B.E. Oiestad и соавт. (2015) получены данные о том, что слабость мышц коленного сустава связана с повышенным риском развития ОА коленного сустава как у мужчин, так и у женщин [81].
К локальным факторам риска развития ОА коленного сустава относят также повышенную физическую активность. Следует отметить, что, с одной стороны, физическая активность способствует появлению болевого син- дрома в суставе, в то время как регулярные дозированные физические нагрузки способствуют уменьшению боли, улучшают мышечную силу и функциональную способность сустава, с другой стороны. В работе Y. Wang и соавт. было установлено, что повышенный уровень общей физической активности является фактором риска эндопротезирования коленного сустава [82]. С. Gayи соавт. (2018) при изучении уровня физической активности у 548 больных ОА коленного сустава выявили, что 42,6 % пациентов имели высокие показатели физической активности, 38,6 % – умеренные и 18,8 % – низкие [83]. Так авторами установлено, что минимальная физическая активность в данной группе пациентов взаимосвязана с индексом массы тела (p = 0,03) и женским полом (p = 0,0008) [83]. Напротив, в исследовании J. Gholami не установлено значимых ассоциаций повседневной физической активности (приседание, стояние на коленях, ходьба и перемещение грузов) с остеоартрозом коленного сустава [84].
Установлена связь профессиональных факторов и спортивной нагрузки с остеоартрозом коленного сустава. Известно, что профессиональная деятельность, связанная с выполнением повторяющихся движений, которые перегружают суставы и утомляют мышцы, повышает риск развития ОА в этих суставах [25]. В этом случае риск развития ОА удваивается по сравнению с людьми, деятельность которых не требует физической активности и повторения одних и тех же движений [85]. У лиц, профессиональная деятельность которых связана с тяжёлым физическим трудом, наблюдается более высокая частота развития ОА коленного сустава. В других источниках имеются сведения о том, что работа, выполняемая на коленях, когда сустав находится длительное время в согнутом состоянии, увеличивает риск развития ОА коленного сустава [19, 86].
Известно, что при занятии определёнными видами спорта (например, футболом, бейсболом, бегом и т.д.) увеличивается риск развития ОА коленного сустава [87]. Причинами этого могут быть усиленная физическая нагрузка на сустав, а также неправильные движения во время выполнения спортивных упражнений, приводящие к повреждениям суставного хряща, субхондральной кости, коллатеральных связок и менисков [25]. Также это часто приводит к развитию вторичного или посттравматического ОА. Напротив, систематический обзор и метаанализ K.A. Timmins и соавт. (2017) не выявили значимых ассоциаций ОА коленного сустава с таким видом спорта как бег [88]. S. Mat и соавт. (2015) сообщают, что силовые тренировки, упражнения и аэробика снижают риск развития ОА коленного сустава у пожилых людей [89].
Важную роль травматических повреждений в этио-патогенезе остеоартроза коленного сустава подтверждают многие исследователи, но однозначно признать ОА посттравматическим заболеванием нельзя [25]. В работе S. Muraki и соавт. (2012) приводятся сведения о том, что предшествующее повреждение коленного сустава является фактором риска боли в колене, но не взаимосвязано с рентгенографическим ОА коленного сустава [90].
ЗАКЛЮЧЕНИЕ
Таким образом, проведённый анализ литературных данных свидетельствует о том, что, во-первых, молекулярные механизмы этиологии и патогенеза ОА коленно- го сустава многообразны. Значимую роль в развитии ОА коленного сустава имеют механизмы, связанные с нарушением метаболизма хряща, воспалением, изменением субхондральной кости, патологическими процессами, происходящими в синовиальной оболочке. Во-вторых, остеоартроз коленного сустава является гетерогенным заболеванием с целым спектром факторов риска, как локальных (предшествующее повреждение коленного сустава, слабость мышц, нарушение оси сустава, оперативные вмешательства на суставе, повышенная физическая активность), так и системных (старший возраст, женский пол, высокий рост, избыточный вес и ожирение, наследственная предрасположенность, минеральная плотность кости, дефицит витамина Д, этническая принадлежность). Следует отметить, что данные факторы риска необходимо учитывать при проведении генетико-эпидемиологических исследований остеоартроза коленного сустава.
Список литературы Факторы риска и молекулярные основы этиопатогенеза остеоартроза коленного сустава (обзор литературы)
- Ревматология. Национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. М. : ГЭОТАР-Медиа, 2010. 714 с.
- Матвеев Р.П., Брагина С.В. Остеоартроз коленного сустава: проблемы и социальная значимость // Экология человека. 2012. № 9. С. 53-62.
- World Health Organization, Department of Chronic Diseases and Health Promotion. Chronic rheumatic conditions. Geneva: World Health Organization. URL: http://www.who.int/chp/topics/rheumatic/en/ (дата обращения: 10.01.2010).
- Number of Persons with Symptomatic Knee Osteoarthritis in the US: Impact of Race and Ethnicity, Age, Sex, and Obesity / B.R. Deshpande, J.N. Katz, D.H. Solomon, E.H. Yelin, D.J. Hunter, S.P. Messier, L.G. Suter, E. Losina // Arthritis Care Res. (Hoboken). 2016. Vol. 68, No 12. P.1743-1750. DOI: 10.1002/acr.22897
- Балабанова Р.М., Эрдес Ш.Ф. Распространенность ревматических заболеваний в России в 2012-2013 гг. // Научно-практическая ревматология. 2015. T. 53, № 2. С. 120-124.
- The cost-effectiveness of total joint arthroplasty: a systematic review of published literature / M.E. Daigle, A.M. Weinstein, J.N. Katz, E. Losina // Best Pract. Res. Clin. Rheumatol. 2012. Vol. 26, No 5. P. 649-658. DOI: 10.1016/j.berh.2012.07.013
- Estimating the burden of total knee replacement in the United States / A.M. Weinstein, B.N. Rome, W.M. Reichmann, J.E. Collins, S.A. Burbine, T.S. Thornhill, J. Wright, J.N. Katz, E. Losina // J. Bone Joint Surg. Am. 2013. Vol. 95, No 5. P.385-392. DOI: 10.2106/JBJS.L.00206
- Данные регистра эндопротезирования коленного сустава РНИИТО им. Р.Р. Вредена за 2011-2013 годы / Н.Н. Корнилов, Т.А. Куляба, А.С. Филь, Ю.В. Муравьева // Травматология и ортопедия России. 2015. № 1 (75). С. 136-151.
- Баженов А.Н. Витамин D и остеоартроз // Трансляционная медицина. 2016. Т. 3, № 1. С. 39-42.
- Knee Osteoarthritis: A Primer / M.J. Lespasio, N.S. Piuzzi, M.E. Husni, G.F. Muschler, A. Guarino, M.A. Mont // Perm. J. 2017. Vol. 21. P. 16-183. DOI:10.7812/TPP/16-183
- Geyer M., Schonfeld C. Novel Insights into the Pathogenesis of Osteoarthritis // Curr. Rheumatol. Rev. 2018. Vol.14, No 2. P. 98-107. DOI:10.217 4/1573397113666170807122312
- Шостак Н.А. Остеоартроз: актуальные вопросы диагностики и лечения // Русский медицинский журнал. Медицинское обозрение. 2014. Т. 22, № 4. С. 278-281.
- Osteoarthritis / S. Glyn-Jones, A.J. Palmer, R. Agricola, A.J. Price, T.L. Vincent, H. Weinans, A.J. Carr // Lancet. 2015. Vol. 386, No 9991. P. 376387. DOI:10.1016/S0140-6736(14)60802-3
- Genetic and Epigenetic Interactions in the Etiopathogenesis of Osteoarthritis. Selected Molecular Factors in OA Etiopathogenesis / A. Snochowska, P. Szmigielska, E. Brzezianska-Lasota, W. Tomaszewski//Ortop. Traumatol. Rehabil. 2017. Vol. 19, No 3. P. 227-237. DOI:10.5604/15093492.1240791
- A systems view of risk factors for knee osteoarthritis reveals insights into the pathogenesis of the disease // T.P. Andriacchi, J. Favre, J.C. Erhart-Hledik, C.R. Chu // Ann. Biomed. Eng. 2015. Vol. 43, No 2. P. 376-387. DOI:10.1007/s10439-014-1117-2
- Остеоартроз: вопросы патогенеза, диагностики, лечебной тактики / А.И. Дядык, И.С. Маловичко, И.И. Здиховская, Н.И. Шпилевая // Новости медицины и фармации. 2012. № 1-2 (399-400). С. 23-29.
- Лисицина Е.М., Лисицин М.П., Заремук А.М. Современный подход к патогенезу, диагностике и лечению остеоартроза коленного сустава // Эндоскопическая хирургия. 2016. Т. 22, № 6. С. 57-67. DOI:10.17116/endoskop201622657-67
- Jones G. What's new in osteoarthritis pathogenesis? // Intern. Med. J. 2016. Vol. 46, No 2. P. 229-236. DOI: 10.1111/imj.12763
- Мазуров В.И., Трофимова А.С., Трофимов Е.А. Факторы риска и некоторые аспекты патогенеза остеоартрита // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2016. Т. 8, № 2. С. 116-124.
- Зайцева Е.М., Алексеева Л.И., Насонов Е.Л. Патогенез остеоартроза и обоснование применения стронция ранелата // Научно-практическая ревматология. 2013. T. 51, № 6. С. 696-702.
- Самойлов В.В., Мироманов А.М., Самойлова С.И. Значение цитокинов в патогенезе остеоартроза // Забайкальский медицинский вестник. 2014. № 2. С. 119-125.
- Adatia A., Rainsford K.D., Kean W.F. Osteoarthritis of the knee and hip. Part I: aetiology and pathogenesis as a basis for pharmacotherapy // J. Pharm. Pharmacol. 2012. Vol. 64, No 5. P. 617-625. DOI:10.1111/j.2042-7158.2012.01458.x
- Вакуленко О.Ю., Жиляев Е.В. Остеоартроз: современные подходы к лечению // Русский медицинский журнал. 2016. Т. 24, № 22. С. 1494-1498.
- Review of Prospects of Biological Fluid Biomarkers in Osteoarthritis / L.T. Nguyen, A.R. Sharma, C. Chakraborty, B. Saibaba, M.E. Ahn, S.S. Lee // Int. J. Mol. Sci. 2017. Vol. 18, No 3. P. 601. DOI:10.3390/ijms18030601
- Osteoarthritis in the XXIst Century: risk factors and behaviours that influence disease onset and progression / G. Musumeci, F.C. Aiello, M.A. Szychlinska, M. di Rosa, P. Castrogiovanni, A. Mobasheri // Int. J. Mol. Sci. 2015. Vol. 16, No 3. P. 6093-6112. DOI:10.3390/ijms16036093
- Остеоартроз как важная проблема гериатрии / С.М. Шукурова, З.Д. Хамроева, Б.Р. Шодиев, Г.Н. Каримова // Вестник Авиценны. 2016. № 1 (66). С. 137-143.
- Patient characteristics that predict progression of knee osteoarthritis: a systematic review of prognostic studies / C.M. Chapple, H. Nicholson, G.D. Baxter, J.H. Abbott // Arthritis Care Res. (Hoboken). 2011. Vol. 63, No 8. P. 1115-1125. DOI:10.1002/acr.20492
- Swift A. Osteoarthritis 1: Physiology, risk factors and causes of pain // Nurs. Times. 2012. Vol. 108, No7. P. 12-15.
- Дубиков А.И. Остеоартроз: старая болезнь, новые подходы // Современная ревматология. 2013. Т. 7, № 2. С. 82-86.
- Роль цитокиновой системы RANKL/RANK/OPG в регуляции минерального обмена костной ткани / Д.С. Аганов, В.В. Тыренко, Е.Н. Цыган, М.М. Топорков, С.Г. Бологов // Гены и клетки. 2014. № 4. С. 50-52.
- Роль костного метаболизма в патогенезе гонартроза / О.В. Синяченко, М.В. Ермолова, И.А. Гейко, Г.С. Такташов, Т.С. Ютовец // Травма. 2016. Т.17, № 1. С. 67-70.
- An update on risk factors for cartilage loss in knee osteoarthritis assessed using MRI-based semiquantitative grading methods / H. Alizai, F.W. Roemer, D. Hayashi, M.D. Crema, D.T. Felson, A. Guermazi // Eur. Radiol. 2015. Vol. 25, No 3. P.883-893. DOI:10.1007/s00330-014-3464-7
- Role of medial abrasion phenomenon in the pathogenesis of knee osteoarthritis / S.R. Lyu, C.Y. Chiang, J.Y. Cherng, Y.C. Huang, C.H. Li, Y.J. Lin, C.M. Chang, L.K. Chau // Med. Hypotheses. 2015. Vol. 85, No 2. P. 207-211. DOI: 10.1016/j.mehy.2015.04.028.
- Focal knee lesions in knee pairs of asymptomatic and symptomatic subjects with OA risk factors - data from the Osteoarthritis Initiative / R. Chundru, T. Baum, L. Nardo, M.C. Nevitt, J. Lynch, C.E. McCulloch, T.M. Link // Eur. J. Radiol. 2013. Vol. 82, No 8. P. e367-e373. DOI: 10.1016/j. ejrad.2013.02.038
- Biomechanical considerations in the pathogenesis of osteoarthritis of the knee / A. Heijink, A.H. Gomoll, H. Madry, M. Drobnic, G. Filardo, J. Espregueira-Mendes, C.N. Van Dijk // Knee Surg. Sports Traumatol. Arthrosc. 2012. Vol. 20, No 3. P. 423-435. DOI:10.1007/s00167-011-1818-0
- Knee osteoarthritis: a review of management options / S.M. Hussain, D.W. Neilly, S. Baliga, S. Patil, R. Meek // Scott. Med. J. 2016. Vol. 61, No 1. P. 7-16. DOI: 10.1177/0036933015619588
- Risk factors for onset of osteoarthritis of the knee in older adults: a systematic review and meta-analysis / M. Blagojevic, C. Jinks, A. Jeffery, K.P. Jordan // Osteoarthritis Cartilage. 2010. Vol. 18, No 1. P. 24-33. DOI: 10.1016/j.joca.2009.08.010
- Heidari B. Knee osteoarthritis prevalence, risk factors, pathogenesis and features: Part I // Caspian J. Intern. Med. 2011. Vol. 2, No 2. Р. 205-212.
- Pereira D., Ramos E., Branco J. Osteoarthritis // Acta Med. Port. 2015. Vol. 28, No 1. P. 99-106. D0I:106. 10.20344/amp.5477
- Кашеварова Н.Г., Алексеева Л.И. Факторы риска прогрессирования остеоартроза коленных суставов // Научно-практическая ревматология. 2014. Т. 52, № 5. С. 553-561. DOI:10.14412/1995-4484-2014-553-561
- Факторы риска развития остеоартроза коленного сустава / Г. Кавалерский, С. Сметанин, А. Лычагин, А. Мойсов // Врач. 2017. № 3. С. 22-24.
- Haq S.A., Davatchi F. Osteoarthritis of the knees in the COPCORD world // Int. J. Rheum. Dis. 2011. Vol. 14, No 2. P. 122-129. DOI:10.1111/j.1756-185X.2011.01615.x
- Lifetime risk and age at diagnosis of symptomatic knee osteoarthritis in the US / E. Losina, A.M. Weinstein, W.M. Reichmann, S.A. Burbine, D.H. Solomon, M.E. Daigle, B.N. Rome, S.P. Chen, D.J. Hunter, L.G. Suter, J.M. Jordan, J.N. Katz // Arthritis Care Res. (Hoboken). 2013. Vol. 65, No 5. P. 703-711. DOI:10.1002/acr.21898
- Incidence and risk factors for clinically diagnosed knee, hip and hand osteoarthritis: influences of age, gender and osteoarthritis affecting other joints / D. Prieto-Alhambra, A. Judge, M.K. Javaid, C. Cooper, A. Diez-Perez, N.K. Arden // Ann. Rheum. Dis. 2014. Vol. 73, No 9. P. 1659-1664. DOI:10.1136/annrheumdis-2013-203355
- Поворознюк В.В., Григорьева Н.В. Остеоартроз у женщин в постменопаузе: факторы риска и связь с костной тканью // Репродуктивная эндокринология. 2012. № 6 (8). С. 64-71.
- Lee S., Kim S.J. Prevalence of knee osteoarthritis, risk factors, and quality of life: The Fifth Korean National Health and Nutrition Examination Survey // Int. J. Rheum. Dis. 2017. Vol. 20, No 7. P. 809-817. DOI:10.1111/1756-185X.12795
- Incidence and risk factors for radiographic knee osteoarthritis and knee pain in Japanese men and women: a longitudinal population-based cohort study / S. Muraki, T. Akune, H. Oka, Y. Ishimoto, K. Nagata, M. Yoshida, F. Tokimura, K. Nakamura, H. Kawaguchi, N. Yoshimura // Arthritis Rheum. 2012. Vol. 64, No 5. P. 1447-1456. DOI:10.1002/art.33508
- Bone Mineral Density and the Risk of Hip and Knee Osteoarthritis: The Johnston County Osteoarthritis Project / K.E. Barbour, L.B. Murphy, C.G. Helmick, J.M. Hootman, J.B. Renner, J.M. Jordan // Arthritis Care Res. (Hoboken). 2017. Vol. 69, No 12. P. 1863-1870. DOI:10.1002/acr.23211.
- Funck-Brentano T., Cohen-Solal M. Subchondral bone and osteoarthritis // Curr. Opin. Rheumatol. 2015. Vol. 27, No 4. P. 420-426. DOI:10.1097/ BOR.0000000000000181
- Bone Mineral Density is Lower in Patients with Severe Knee Osteoarthritis and Attrition / K.N. Linde, K.B. Puhakka, B.L. Langdahl, K. Soballe, I. Krog-Mikkelsen, F. Madsen, M. Stilling // Calcif. Tissue Int. 2017. Vol. 101, No 6. P. 593-601. DOI:10.1007/s00223-017-0315-y
- Головач И.Ю. Остеоартрит: современные фундаментальные и прикладные аспекты патогенеза заболевания // Боль. Суставы. Позвоночник. 2014. № 3 (15). C. 54-58.
- Diabetes is a risk factor for knee osteoarthritis progression / F. Eymard, C. Parsons, M.H. Edwards, F. Petit-Dop, J.Y. Reginster, O. Bruyère, P. Richette, C. Cooper, X. Chevalier // Osteoarthritis Cartilage. 2015. Vol. 23, No 6. P. 851-859. DOI: 10.1016/j.joca.2015.01.013
- Association between Knee Osteoarthritis, Cardiovascular Risk Factors, and the Framingham Risk Score in South Koreans: A Cross-Sectional Study / H.S. Kim, J.S. Shin, J. Lee, Y.J. Lee, M.R. Kim, Y.H. Bae, K.B. Park, E.J. Lee, J.H. Kim, I.H. Ha // PLoS One. 2016. Vol.11, No 10. P. e0165325. DOI: 10.1371/journal.pone.0165325
- Berenbaum F. Diabetes-induced osteoarthritis: from a new paradigm to a new phenotype // Ann. Rheum. Dis. 2011. Vol. 70, No 8. P. 1354-1356. DOI: 10.1136/ard.2010.146399
- Metabolic Syndrome, Its Components, and Knee Osteoarthritis: The Framingham Osteoarthritis Study / J. Niu, M. Clancy, P. Aliabadi, R. Vasan, D.T. Felson // Arthritis Rheumatol. 2017. Vol. 69, No 6. P. 1194-1203. DOI: 10.1002/art.40087
- Impact of obesity and knee osteoarthritis on morbidity and mortality in older Americans / E. Losina, R.P. Walensky, W.M. Reichmann, H.L. Holt, H. Gerlovin, D.H. Solomon, J.M. Jordan, D.J. Hunter, L.G. Suter, A.M. Weinstein, A.D. Paltiel, J.N. Katz // Ann. Intern. Med. 2011. Vol. 154, No 4. P. 217-226. DOI: 10.7326/0003-4819-154-4-201102150-00001
- Obesity and osteoarthritis / K. Kulkarni, T. Karssiens, V. Kumar, H. Pandit // Maturitas. 2016. Vol. 89. P. 22-28. DOI: 10.1016/j.maturitas.2016.04.006
- Systemic and Local Adipose Tissue in Knee Osteoarthritis / E. Belluzzi, H. El Hadi, M. Granzotto, M. Rossato, R. Ramonda, V. Macchi, R. De Caro, R. Vettor, M. Favero // J. Cell. Physiol. 2017. Vol. 232, No 8. P. 1971-1978. DOI:10.1002/jcp.25716
- Body mass index and susceptibility to knee osteoarthritis: a systematic review and meta-analysis / L. Jiang, W. Tian, Y. Wang, J. Rong, C. Bao, Y. Liu, Y. Zhao, C. Wang // Joint Bone Spine. 2012. Vol. 79, No 3. P. 291-297. DOI: 10.1016/j.jbspin.2011.05.015
- Current evidence on risk factors for knee osteoarthritis in older adults: a systematic review and meta-analysis / V. Silverwood, M. Blagojevic-Bucknall, C. Jinks, J.L. Jordan, J. Protheroe, K.P. Jordan // Osteoarthritis Cartilage. 2015. Vol. 23, No 4. P. 507-515. DOI: 10.1016/j.joca.2014.11.019
- Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial / S.P. Messier, S.L. Mihalko, C. Legault, G.D. Miller, B.J. Nicklas, P. De Vita, D.P. Beavers, D.J. Hunter, M.F. Lyles, F. Eckstein, J.D. Williamson, J.J. Carr, A. Guermazi, R.F. Loeser // JAMA. 2013. Vol. 310, No 12. P. 1263-1273. DOI:10.1001/jama.2013.277669
- Wluka A.E., Lombard C.B., Cicuttini F.M. Tackling obesity in knee osteoarthritis // Nat. Rev. Rheumatol. 2013. Vol. 9, No 4. P. 225-235. DOI: https: 10.1038/nrrheum.2012.224
- Risk factors for knee replacement due to primary osteoarthritis, a population based, prospective cohort study of 315,495 individuals / H. Apold, H.E. Meyer, L. Nordsletten, O. Furnes, V. Baste, G.B. Flugsrud // BMC Musculoskelet. Disord. 2014. Vol. 15. P. 217. DOI:10.1186/1471-2474-15-217
- What Are the Prognostic Factors for Radiographic Progression of Knee Osteoarthritis? A Meta-analysis / A.N. Bastick, J.N. Belo, J. Runhaar, S.M. Bierma-Zeinstra // Clin. Orthop. Relat Res. 2015. Vol. 473, No 9. P. 2969-89. DOI:10.1007/s11999-015-4349-z
- Synovitis in knee osteoarthritis: a precursor of disease? / I. Atukorala, C.K. Kwoh, A. Guermazi, F.W. Roemer, R.M. Boudreau, M.J. Hannon, D.J. Hunter // Ann. Rheum. Dis. 2016. Vol. 75, No 2. P.390-395. DOI:10.1136/annrheumdis-2014-205894
- Synovitis and the risk of knee osteoarthritis: the MOST Study / D.T. Felson, J. Niu, T. Neogi, J. Goggins, M.C. Nevitt, F. Roemer, J. Torner, C.E. Lewis, A. Guermazi; MOST Investigators Group // Osteoarthritis Cartilage. 2016. Vol. 24, No 3. P. 458-464. DOI: 10.1016/j.joca.2015.09.013
- Metabolic triggered inflammation in osteoarthritis / X. Wang, D. Hunter, J. Xu, C. Ding // Osteoarthritis Cartilage. 2015. Vol. 23, No 1. P. 22-30. DOI:10.1016/j.joca.2014.10.002
- Vitamin D deficiency associates with y-tocopherol and quadriceps weakness but not inflammatory cytokines in subjects with knee osteoarthritis / T. Barker, V.T. Henriksen, V.E. Rogers, D. Aguirre, R.H. Trawick, G. Lynn Rasmussen, N.G. Momberger // Redox. Biol. 2014. Vol. 2. P. 466-474. DOI:10.1016/j.redox.2014.01.024
- Elucidation of dietary risk factors in osteoarthritis knee - a case-control study / D. Sanghi, A. Mishra, A.C. Sharma, S. Raj, R. Mishra, R. Kumari, S.M. Natu, S. Agarwal, R.N. Srivastava // J. Am. Coll. Nutr. 2015. Vol. 34, No 1. P. 15-20. DOI:10.1080/07315724.2013.875439
- Vitamin D supplementation in the management of knee osteoarthritis: study protocol for a randomized controlled trial / Y. Cao, G. Jones, F. Cicuttini, T. Winzenberg, A. Wluka, J. Sharman, K. Nguo, C. Ding // Trials. 2012. Vol. 13. P. 131. DOI: 10.1186/1745-6215-13-131
- Vitamin D deficiency is associated with progression of knee osteoarthritis / F.F. Zhang, J.B. Driban, G.H. Lo, L.L. Price, S. Booth, C.B. Eaton, B. Lu, M. Nevitt, B. Jackson, C. Garganta, M.C. Hochberg, K. Kwoh, T.E. McAlindon // J. Nutr. 2014. Vol.144, No 12. P. 2002-2008. DOI:10.3945/ jn.114.193227
- Vitamin D, race, and experimental pain sensitivity in older adults with knee osteoarthritis / T.L. Glover, B.R. Goodin, A.L. Horgas, L.L. Kindler,
- C.D. King, K.T. Sibille, C.A. Peloquin, J.L. Riley 3rd, R. Staud, L.A. Bradley, R.B. Fillingim // Arthritis. Rheum. 2012. Vol. 64, No 12. P. 39263935. DOI: 10.1002/art.37687.
- Vitamin K deficiency is associated with incident knee osteoarthritis / D. Misra, S.L. Booth, I. Tolstykh, D.T. Felson, M.C. Nevitt, C.E. Lewis, I. Torner, T. Neogi // Am. I. Med. 2013. Vol. 126, No 3. P. 243-248. DOI: 10.1016/j.amjmed.2012.10.011
- Prevalence of knee symptoms and radiographic and symptomatic knee osteoarthritis in African Americans and Caucasians: the Johnston County Osteoarthritis Project / J.M. Jordan, C.G. Helmick, J.B. Renner, G. Luta, A.D. Dragomir, J. Woodard, F. Fang, T.A. Schwartz, L.M. Abbate, L.F. Callahan, W.D. Kalsbeek, M.C. Hochberg // J. Rheumatol. 2007. Vol. 34, No 1. P. 172-180.
- Racial and ethnic differences in older adults with knee osteoarthritis / Y. Cruz-Almeida, K.T. Sibille, B.R. Goodin, M.E. Petrov, E.J. Bartley, J.L. Riley 3rd, C.D. King, T.L. Glover, A. Sotolongo, M.S. Herbert, J.K. Schmidt, B.J. Fessler, R. Staud, D. Redden, L.A. Bradley, R.B. Fillingim // Arthritis Rheumatol. 2014. Vol. 66, No 7. P. 1800-1810. D0I:10.1002/art.38620
- The genetic influence on radiographic osteoarthritis is site specific at the hand, hip and knee / A.J. MacGregor, Q. Li, T. D. Spector, F.M. Williams // Rheumatology (Oxford). 2009. Vol. 48, No 3. P. 277-280. DOI: 10.1093/rheumatology/ken475
- Sex differences in risk and heritability estimates on primary knee osteoarthritis leading to total knee arthroplasty: a nationwide population based follow up study in Danish twins / S.G. Skousgaard, A. Skytthe, S. Möller, S. Overgaard, L.P. Brandt // Arthritis Res. Ther. 2016. Vol. 18. P. 46. DOI: 10.1186/s13075-016-0939-8.
- Restorative Effect of Vitamin D Deficiency on Knee Pain and Quadriceps Muscle Strength in Knee Osteoarthritis / B. Heidari, Y. Javadian, M. Babaei, B. Yousef-Ghahari // Acta Med. Iran. 2015. Vol. 53, No~8. P. 466-470
- Segal N., Davis M.D., Mikesky A.E. Efficacy of Blood Flow-Restricted Low-Load Resistance Training for Quadriceps Strengthening in Men at Risk of Symptomatic Knee Osteoarthritis // Geriatr. Orthop. Surg. Rehabil. 2015. Vol. 6, No 3. P. 160-167. DOI:10.1177/2151458515583088
- Quadriceps muscle strength, radiographic knee osteoarthritis and knee pain: the ROAD study / S. Muraki, T. Akune, M. Teraguchi, R. Kagotani, Y. Asai, M. Yoshida, F. Tokimura, S. Tanaka, H. Oka, H. Kawaguchi, K. Nakamura, N. Yoshimura // BMC Musculoskelet. Disord. 2015. Vol. 16, P. 305. DOI: 10.1186/s12891-015-0737-5
- Knee extensor muscle weakness is a risk factor for development of knee osteoarthritis. A systematic review and meta-analysis / B.E. 0iestad, C.B. Juhl, I. Eitzen, J.B. Thorlund // Osteoarthritis Cartilage. 2015. Vol. 23, No 2. P. 171-177. DOI: 10.1016/j.joca.2014.10.008
- Is physical activity a risk factor for primary knee or hip replacement due to osteoarthritis? A prospective cohort study / Y. Wang, J.A. Simpson, A.E. Wluka, A.J. Teichtahl, D.R. English, G.G. Giles, S. Graves, F.M. Cicuttini // J. Rheumatol. 2011. Vol. 38, No 2. P. 350-357. DOI:10.3899/ jrheum.091138
- Physical activity level and association with behavioral factors in knee osteoarthritis / C. Gay, C. Guiguet-Auclair, C. Mourgues, L. Gerbaud, E. Coudeyre // Ann. Phys. Rehabil. Med. 2019. Vol. 62, No 1. P. 14-20. DOI: 10.1016/j.rehab.2018.09.005
- Are daily physical activities risk factors for knee osteoarthritis? / J. Gholami, M.A. Mansournia, F. Davatchi, K. Mohammad, H. Hosseini, R. Majdzadeh // Int. J. Rheum. Dis. 2016. Vol. 19, No 3. P. 241-247. DOI:10.1111/1756-185X.12604
- The Intensive Diet and Exercise for Arthritis (IDEA) trial: Design and rationale / S.P. Messier, C. Legault, S. Mihalko, G.D. Miller, R.F. Loeser, P. De Vita, M. Lyles, F. Eckstein, D.J. Hunter, J.D. Williamson, B.J. Nicklas // BMC Musculoskelet. Disord. 2009. Vol. 10, P. 93. DOI:10.1186/1471-2474-10-93
- Palmer K.T. Occupational activities and osteoarthritis of the knee // Br. Med. Bull. 2012. Vol. 102. P. 147-170. DOI:10.1093/bmb/lds012
- Sport and early osteoarthritis: the role of sport in aetiology, progression and treatment of knee osteoarthritis / F. Vannini, T. Spalding, L. Andriolo, M. Berruto, M. Denti, J. Espregueira-Mendes, J. Menetrey, G.M. Peretti, R. Seil, G. Filardo // Knee Surg. Sports Traumatol. Arthrosc. 2016. Vol. 24, No 6. P. 1786-1796. DOI:10.1007/s00167-016-4090-5
- Running and Knee Osteoarthritis: A Systematic Review and Meta-analysis / K.A. Timmins, R.D. Leech, M.E. Batt, K.L. Edwards // Am. J. Sports Med. 2017. Vol. 45, No 6. P. 1447-1457. DOI:10.1177/0363546516657531
- Physical therapies for improving balance and reducing falls risk in osteoarthritis of the knee: a systematic review / S. Mat, M.P. Tan, S.B. Kamaruzzaman, C.T. Ng // Age Ageing. 2015. Vol. 44, No 1. P. 16-24. DOI:10.1093/ageing/afu112


