Фармакокинетика молекулярной конструкции для депонирования и транспортировки к клеткам- мишеням биологически активных веществ
Автор: Гамалей С.Г., Даниленко Е.Д., Батенева А.В., Лебедев Л.Р., Масычева В.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Организация здравоохранения и общественное здоровье
Статья в выпуске: 3-2 т.23, 2008 года.
Бесплатный доступ
В экспериментах на мышах с перевивной солидной карциномой Эрлиха проведено изучение фармакокинетики вирусоподобной частицы (ВПЧ), меченой [гамма-32Р]. Установлено, что препарат ВПЧ при внутривенном введении быстро элиминировался из кровеносного русла и концентрировался преимущественно в почках, селезенке и кишечнике. Препарат ВПЧ более интенсивно накапливался в ткани опухоли по сравнению с препаратом дсРНК. Процесс элиминации препарата из организма лабораторных животных осуществлялся в основном через почки и завершался к концу вторых суток после введения.
Вирусоподобная частица, дсрнк, фармакокинетика, карцинома эрлиха, мыши
Короткий адрес: https://sciup.org/14918915
IDR: 14918915 | УДК: 612.083.084+615.03
Текст научной статьи Фармакокинетика молекулярной конструкции для депонирования и транспортировки к клеткам- мишеням биологически активных веществ
Создание разнообразных вариантов молекулярных конструкций в виде наночастиц для адресной доставки терапевтических препаратов является интенсивным направлением, нацеленным на конструирование форм препаратов нового поколения. Применение таких молекулярных конструкций в виде наночастиц как средств доставки лекарственных препаратов позволяет использовать значительно меньшие количества активного вещества для получения специфического эффекта и/или получить многократно увеличенный эффект; уменьшить токсический эффект препаратов; изменить фармакокинетику и распределение веществ в клетках организма; защитить биологически активное вещество от биодеградации [1-4].
Особое значение эти исследования имеют для онкологии. Как известно, одной из проблем современной онкологии является низкая селективность накопления противоопухолевых средств тканью опухоли, что обусловливает необходимость введения препаратов в высоких дозах и, как следствие, приводит к развитию широкого спектра токсических эффектов [5]. В связи с этим, разработка средств доставки веществ, обладающих противоопухолевой активностью, чрезвычайно актуальна.
Для оценки пригодности наноконструкций как инструмента доставки фармакологического препарата важную информацию могут дать фармакокинетические исследования, поскольку они позволяют выявить тропность к органам и тканям, динамику накопления и скорость элиминации наночастицы из организма.
Ранее во ФГУН ГНЦ ВБ «Вектор» была получена молекулярная конструкция, в центре которой находится нуклеотидный материал (двуспиральные РНК), покрытый оболочкой из спермидина и поли-глюкина. Данные частицы в физиологических усло-92
виях имеют сферическую вирусоподобную форму, в связи с чем, получили название «вирусоподобная частица» (ВПЧ).
На основе этой конструкции и антигенов инфекционных агентов были получены экспериментальные образцы кандидатных вакцин против ВИЧ, туберкулеза, клещевого энцефалита, показана их высокая эффективность при иммунизации лабораторных животных [6, 7]. Успешные результаты, полученные в процессе разработки вакцин, явились основанием для исследования данной молекулярной конструкции как средства доставки терапевтических препаратов.
Как указывалось выше, особенностью этой конструкции является наличие в ее центральной части дсРНК, которая является индуктором интерферона, стимулятором неспецифической резистентности, обладает свойствами усиливать противоопухолевые, иммунотропные свойства фармакологических препаратов. Поэтому выяснение распределения и выведения дсРНК в составе наноконструкции имеет важное значение для создания средств противоопухолевого и иммуностимулирующего действия.
Целью данной работы являлась оценка фармакокинетических свойств препарата ВПЧ на мышах-опухоленосителях для заключения о пригодности наноконструкции данного типа как средства адресной доставки препаратов.
МАТЕРИАЛ И МЕТОДЫ
В исследованиях использовали препарат ВПЧ, содержащий в центральной части радиоактивно меченый препарат дсРНК. Введение радиоактивной метки [гамма-32Р] по 5'-концу дсРНК проводили с использованием полинуклеотидкиназы и [гам-ма-32Р] ATФ согласно процедуре, описанной Остерманом Л.А. [8]. Меченую дсРНК очищали двукратным переосаждением этиловым спиртом [8]. Удельная радиоактивность дсРНК, меченой фосфором, составляла 7,3*108 имп/мин/мг. Препарат вирусоподобной частицы был получен методом, описанным ранее Сизовым А.А. с соавт. [9]. В качестве препарата сравнения использовали радиоактивно меченый препарат дсРНК.
Исследования проводили на мышах-опухоле-носителях с солидной формой перевивной карциномы Эрлиха. Опухолевые клетки, полученные от мышей-доноров на 6-е сутки после трансплантации, перевивали мышам внутримышечно в дозе 105 клеток на животное в объеме 0,1 мл в правую заднюю лапу. На 6-е сутки после перевивки опухоли животные были разделены на 3 экспериментальные группы, по 24 особи в каждой. Мышам первой, опытной, группы вводили смесь немеченого и меченого препарата ВПЧ в дозе 0,01 мг дсРНК/мышь и 0,7 млн. имп/ мин/ мышь соответственно. Использованная доза препарата составляла 0,5 мг дсРНК/кг массы тела и относилась к диапазону эффективных доз дсРНК. Препарат вводили однократно внутри- венно в хвостовую вену мышей в объёме 0,1 мл на животное.
Мыши второй группы получали инъекции смеси меченой и немеченой дсРНК в той же дозе и объеме, как препарат ВПЧ.
Данные экспериментов обрабатывали методами вариационной статистики с помощью пакета программ «Statgraphics, Vers. 5.0» (Statistical Graphics Corp., USA). Статистическую значимость обнаруженных различий оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика выведения меченых препаратов ВПЧ и дсРНК из сыворотки крови мышей представлена на рис. 1. Видно, что максимальное содержание радиоактивной метки в сыворотке крови наблюдалось через 5 мин (0,08 ч) после введения. Кривая элиминации препарата ВПЧ во все сроки наблюдения не отличалась от кривой выведения дсРНК. Через 48 ч после введения препаратов в сыворотке крови оставалось 0,12% от введенного радиоактивного препарата.
Анализ показал, что значения удельной радиоактивности всех внутренних органов уже через 4 ч после введения меченого препарата ВПЧ превышали ее содержание в крови (таблица). Это свидетельствует о том, что препарат ВПЧ так же, как препарат сравнения дсРНК, быстро выводится из крови и накапливается в ткани органов.
Анализ динамики накопления радиоактивности в органах мышей контрольной группы показал, что
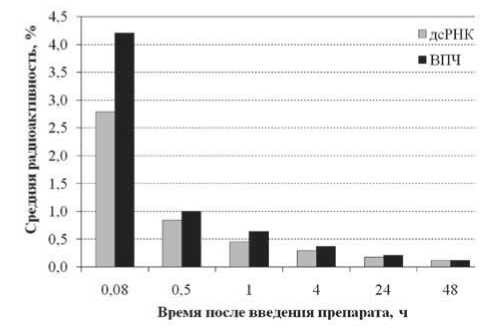
Рис. 1. Динамика изменения содержания меченой дсРНК в сыворотке крови мышей после однократного внутривенного введения беспородным мышам препаратов ВПЧ и дсРНК (в процентах от введенного)
в ранние сроки после введения препарата дсРНК (0,08 ч) значения удельной радиоактивности были наиболее высокими в почках, сыворотке крови и коже мышей (таблица). Значения показателя остальных исследуемых органов в этот срок колебались в диапазоне (9,88-18,3)*103 имп/мин/г.
Через 0,5 часа после введения дсРНК уровень радиоактивности в почках контрольных мышей снижался в 1,3 раза, через 48 часов – в 4,4 раза. В коже контрольных животных было отмечено постепенное снижение показателя к концу периода наблюдения (в 2 раза ниже, чем в начальной точке). Значение показателя в печени мышей повышалось через 0,5 ч после введения дсРНК, затем оставалось неизмен-
Таблица
Удельная радиоактивность органов и сыворотки крови мышей после введения препаратов, меченых [гамма-32Р], *103 имп/мин/г массы ткани
|
Орган/ биологическая жидкость |
Препарат |
Время после введения, ч |
|||||
|
0,08 |
0,5 |
1 |
4 |
24 |
48 |
||
|
Сыворотка крови |
ВПЧ дсРНК |
56,8±2,9 47,5±6,7 |
13,4±1,2 14,3±0,6 |
8,59±0,50 7,71±1,76 |
4,95±0,22 4,98±0,30 |
2,78±0,22 3,11±0,23 |
1,63±0,21 2,10±0,21 |
|
Печень |
ВПЧ дсРНК |
15,0±1,4 9,88±3,01 |
22,4±3,5 20,1±0,2 |
22,0±0,9 19,1±0,7 |
18,6±0,8 19,6±0,7 |
6,73±0,17 7,83±0,32 |
4,94±0,37 6,35±0,48 |
|
Почки |
ВПЧ дсРНК |
89,5±8,0 60,8±14,3 |
44,3±6,3 45,8±2,1 |
31,4±1,9 33,0±1,9 |
28,5±1,6 30,6±2,1 |
14,1±0,4 15,4±1,0 |
10,2±0,8 * 13,7±1,3 |
|
Кишечник |
ВПЧ дсРНК |
17,1±,1 15,5±3,8 |
32,8±3,2 33,2±2,7 |
37,6±3,8 34,7±4,9 |
32,8±4,0 35,6±4,3 |
27,8±2,2 31,8±0,7 |
19,7±1,4 * 27,5±3,1 |
|
Опухоль |
ВПЧ дсРНК |
16,0±1,1 * 10,3±2,2 |
11,4±1,3 12,5±2,4 |
10,2±0,3 10,3±0,2 |
15,3±1,0 14,4±0,7 |
11,5±0,8 13,1±1,7 |
11,3±1,7 9,27±0,2 |
|
Мышца |
ВПЧ дсРНК |
15,3±1,4 12,2±2,6 |
19,5±1,8 22,0±3,5 |
20,8±2,0 21,4±1,2 |
29,1±2,6 30,2±2,8 |
16,9±0,9 * 22,0±0,9 |
13,9±1,4 * 18,7±1,2 |
|
Кожа |
ВПЧ дсРНК |
35,9±4,8 23,6±4,3 |
16,7±1,2 19,3±1,5 |
14,1±0,2 15,2±0,4 |
17,8±1,5 16,1±2,0 |
13,3±1,7 15,8±1,5 |
11,5±0,8 11,5±1,3 |
|
Селезенка |
ВПЧ дсРНК |
17,6±1,3 18,3±5,6 |
35,0±1,6 * 48,8±5,7 |
38,4±2,4 33,9±1,8 |
32,8±2,6 38,5±2,4 |
26,1±1,0 * 31,1±0,3 |
13,7±1,2 * 19,2±1,8 |
Различия статистически значимы: * - по отношению к показателям мышей после введения дсРНК, р < 0,05.
ным в течение четырех часов наблюдения и снижалось лишь к концу первых суток. Уровень радиоактивности опухоли контрольных животных повышался через 4 ч после введения препарата и оставался неизменным до конца первых суток, после чего снижался до значения, которое было зарегистрировано в начальный период после введения.
В ткани селезенки и кишечника было отмечено нарастание содержания меченого препарата через 0,5 ч после введения, сохранявшееся в течение суток. Через 48 ч после введения дсРНК значение ра-диоактивости ткани селезенки снижалось до уровня, зарегистрированного в начальный период наблюдения, а значение показателя в ткани кишечника оставалось повышенным и через двое суток. Повышение показателей радиоактивности в скелетной мышце наблюдали за период от 0,5 до 4 ч после введения препарата, с последующим снижением, которое все еще было выше исходного показателя на 53%.
Через 5 мин после введения меченого препарата ВПЧ наибольшую удельную радиоактивность наблюдали в ткани почек, сыворотке крови и коже (таблица). Содержание меченого препарата в тканях печени, кишечника, мышцы, кожи и селезенки в этот срок колебалось в пределах (15-17,6)*103 имп/мин/г. Значения радиоактивности почек, печени и кожи мышей, которым вводили ВПЧ, в этот период были в 1,5 раза выше соответствующих показателей животных, получавших инъекции дсРНК.
В последующие сроки наблюдения в группе мышей, которым вводили препарат ВПЧ, наблюдали изменения радиоактивности органов, аналогичные изменениям, зарегистрированным для контрольного препарата. Через 0,5 ч после введения уровни радиоактивности почек, сыворотки и кожи снижались в 2, 4,2 и 2,2 раза соответственно по отношению к уровню, зарегистрированному через 5 мин. после введения, и продолжали уменьшаться до конца эксперимента. Однако различий между данными, полученными у двух групп животных, не обнаружено.
Через 0,5 ч после введения ВПЧ удельное содержание меченой дсРНК в тканях кишечника и селезенки возрастало в 2 раза, сохранялось в течение 4 ч и в дальнейшем снижалось. Следует отметить, что через 24 и 48 ч удельная активность меченого препарата в селезенке опытной группы была ниже, чем в контроле (Р<0,05).
Умеренно повышенное содержание меченого препарата в печени отмечалось в течение четырех часов и снижалось только через сутки после введения ВПЧ.
Незначительное увеличение уровня радиоактивности ткани мышцы наблюдали через 4 ч после введения препарата ВПЧ с последующим статистически значимым снижением показателя через 24 и 48 ч, по сравнению с показателем контрольной группы.
В ткани опухоли во все сроки наблюдали умеренное по величине накопление меченого препарата. Следует отметить, что через 5 мин после введения 94
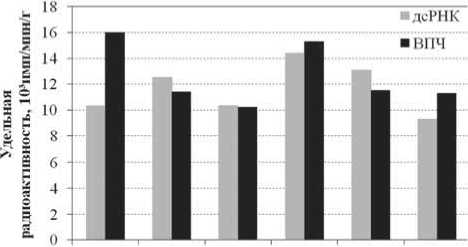
0.08 0.5 1 4 24 48
Время после введения препарата,ч
Рис. 2. Уровень удельной радиоактивности в опухоли после введения препаратов ВПЧ и дсРНК, меченых [гамма-32Р].
* – различия статистически значимы по отношению к дсРНК, р≤0,05
препарата ВПЧ уровень радиоактивности в ткани опухоли опытных животных был статистически значимо выше показателя животных, которым вводили дсРНК (рис. 2).
Расчет уровня остаточной радиоактивности в сыворотке крови и органах мышей показал, что значения показателя через 48 ч после введения в большинстве органов составляли 0,1-0,4% от введенной дозы, за исключением печени, где значения показателя были несколько выше (0,60–0,80% от величины введенной дозы). На основании этих данных можно заключить, что препарат ВПЧ, в основном, выводился из организма мышей так же, как препарат сравнения дсРНК, в течение двух суток после введения.
Таким образом, показано, что препарат ВПЧ при внутривенном введении быстро элиминировался из кровеносного русла и распределялся по периферическим органам и тканям. Наиболее высоким содержание препарата было в почках, селезенке, кишечнике. Основным путем выведения препарата ВПЧ, так же, как препарата сравнения дсРНК, являлись почки, о чем свидетельствует высокий уровень радиоактивности данного органа. Препарат ВПЧ более интенсивно накапливался в ткани опухоли по сравнению с препаратом дсРНК. Процесс элиминации препарата ВПЧ из организма лабораторных животных, в основном, завершался к концу вторых суток после введения.
Полученные результаты свидетельствуют о пригодности данной наноконструкции, включающей дсРНК, как средства доставки препаратов противоопухолевого действия.
Данная работа была выполнена при финансовой поддержке Федеральной Целевой Научно-технической Программы «Исследования и разработки по приоритетным направлениям развития научнотехнологического комплекса России на 2007-2012 годы», госконтракт №02.513.11.3372 «Конструирование нанобиочастиц – носителей терапевтических средств для доставки к клеткам-мишеням – и оценка их безопасности».
Список литературы Фармакокинетика молекулярной конструкции для депонирования и транспортировки к клеткам- мишеням биологически активных веществ
- Sahoo S.K., Labhasetwar V. Nanotech approaches to drug delivery and imaging//Drug Discov. Today. -2003. -Vol. 8, No. 24. -P. 1112-1120.
- Heffernan M.J., Murthy N. Polyketal nanoparticles: a new pH-sensitive biodegradable drug delivery vehicle.//Bioconjug Chem. -2005. -Vol. 16, № 6. -P. 1340-1342.
- Tomalia D.A., Reyna L.A., Svenson S. Dendrimers as multi-purpose nanodevices for oncology drug delivery and diagnostic imaging.//Biochem Soc. Trans. -2007. -Vol. 35, Pt 1. -P. 61-67.
- Nie S., Xing Y, Kim G.J., Simons J.W. Nanotechnology applications in cancer.//Annu Rev Biomed Eng. 2007. -Vol. 9. -P. 257-88.
- Сauwels A, Van Molle W, Janssen B, Everaerdt B, Huang P, Fiers W, Brouckaert P. Protection against TNF-induced lethal shock by soluble guanylate cyclase inhibition requires functional inducible nitric oxide synthase//Immunity. -2000. -Vol. 13, № 2. -P. 223-231.
- Karpenko L.I., Ilyichev A.A., Eroshikin A.M. et al. Combined virus-like particle-based polyepitope DNA/protein HIV-1 Vaccine. Design, immunogenicity and toxicity studies//Vaccine. -2007. -Vol. 25. -P. 4312-4323.
- Лебедев Л.Р., Гончарова Е.П., Сизов А.А., Булычев Л.Е., Одегов А.М., Рыжиков А.Б. Экспериментальный молекулярный дизайн рекомбинантных вакцин//Молекулярная биология. -2003. -Т. 37, № 3. -С. 544-549.
- Остерман Л.А. Исследование биологических макромолекул электрофокусированием, иммуноэлектрофорезом и радиоактивными методами. -М: Наука, 1983.
- Патент № 2190018 Молекулярный вектор для доставки генов в клетки-мишени (Сизов А.А., Лебедев Л.Р., Масычева В.И., Даниленко Е.Д.).


