Феномен нейтропении на фоне терапии тоцилизумабом у пациентов с ювенильным идиопатическим артритом
Автор: Каледа М.И., Никишина И.П., Шаповаленко А.Н., Костарева О.М., Федоров Е.С.
Журнал: Научно-практическая ревматология @journal-rsp
Рубрика: Педиатрическая ревматология
Статья в выпуске: 6 т.55, 2017 года.
Бесплатный доступ
Тоцилизумаб (ТЦЗ) - один из генно-инженерных биологических препаратов (ГИБП), наиболее часто используемых в лечении ювенильного идиопатического артрита (ЮИА), особенно его системного варианта. Развитие нейтропении, ассоциированное с применением ТЦЗ и обусловленное его механизмом действия, требует детального изучения. На основе анализа собственных результатов и сопоставления их с данными литературы в статье анализируются аспекты развития нейтропении на фоне терапии ТЦЗ. Цель исследования - провести анализ всех случаев нейтропении на фоне применения ТЦЗ при полиартику-лярном (пЮИА) и системном (сЮИА) вариантах заболевания. Материал и методы. В открытое проспективное исследование включены 27 пациентов с пЮИА и 83 - с сЮИА, резистентных к предшествующей стандартной терапии. Длительность лечения составила от 4 до 84 мес (медиана - 22 мес для пЮИА, 34 мес - для сЮИА). Изучались частота и сроки развития нейтропении, связь с инфекцией и сопутствующей/предшествующей терапией. Результаты и обсуждение. Продолжают лечение 22 и 62 пациента с пЮИА и сЮИА соответственно, медиана продолжительности терапии - 27,4 [9; 72] мес. У 7 пациентов с пЮИА и 21 - с сЮИА ТЦЗ был отменен: из-за серьезных неблагоприятных реакций (n=2 и n=11 соответственно), по организационным причинам (n=5 и n=7); при cЮИА у двух пациентов терапия была прекращена в связи со стойкой ремиссией, у одного - в связи с развитием вторичной неэффективности. По крайней мере один эпизод нейтропении отмечался у 63% пациентов с пЮИА и 48,2% с сЮИА, из них нейтропения 1-й степени зарегистрирована у 5 и 15 больных соответственно, 2-й степени - у 6 и 15, 3-й степени - у 4 и 10, и 4-й степени - у двух пациентов с пЮИА. При пЮИА нейтропения чаще наблюдалась в первые месяцы терапии, при сЮИА - при достижении неактивного статуса болезни. У 5 пациентов с сЮИА зафиксирована нейтропения как проявление синдрома активации макрофагов (САМ), связи с инфузиями ТЦЗ не выявлено. Нейтропения не ассоциировалась с увеличением частоты инфекций. Использование метотрексата не было достоверно связано с низким уровнем нейтрофилов, тогда как более ранний возраст ассоциировался со степенью и частотой нейтропении. Все случаи нейтропении зафиксированы у пациентов с уровнем терапевтического ответа >50% согласно критериям Американской коллегии ревматологов (ACRpedi). Полученные данные свидетельствуют о различных механизмах и сроках развития нейтропении на фоне терапии ТЦЗ при ЮИА: 1) «доброкачественная», транзиторная нейтропения - предиктор высокой эффективности терапии, развивается прежде всего в первые несколько дней после инфузии; 2) нейтропения как явление «избыточности» терапии (более резистентная) развивается чаще в неактивной фазе болезни; 3) нейтропения как компонент САМ, которая связана с другими маркерами САМ. Не выявлено связи нейтропении с повышенным риском инфекций. Пациенты, получающие терапию ТЦЗ, требуют тщательного клинико-лабораторного мониторинга, в том числе с учетом риска нейтропении, и последующей индивидуальной коррекции терапии при ее выявлении.
Тоцилизумаб, нейтропения, ювенильный идиопатический артрит, генно-инженерная биологическая терапия
Короткий адрес: https://sciup.org/14945879
IDR: 14945879 | DOI: 10.14412/1995-4484-2017-662-667
Текст научной статьи Феномен нейтропении на фоне терапии тоцилизумабом у пациентов с ювенильным идиопатическим артритом
Для ссылки: Каледа МИ, Никишина ИП, Шаповаленко АН и др. Феномен нейтропении на фоне терапии тоцилизумабом у пациентов с ювенильным идиопатическим артритом. Научно-практическая ревматология. 2017;55(6):662-667.
THE PHENOMENON OF NEUTROPENIA DURING TOCILIZUMAB THERAPY IN PATIENTS WITH JUVENILE IDIOPATHIC ARTHRITIS
Tocilizumab (TCZ) is one of the biological agents that are most commonly used in the treatment of juvenile idiopathic arthritis (JIA), especially its systemic variant. The development of neutropenia, which is associated with the use of TCZ and its mechanism of action, requires a detailed study.
Based on the analysis of their own results and comparison of the latter with the data available in the literature, the authors analyze the aspects of development of neutropenia during TCZ therapy.
Objective: to analyze all cases of neutropenia with the use of TCZ in polyarticular (pJIA) and systemic (sJIA) variants of the disease.
Subjects and methods. The open-label prospective study enrolled 27 patients with pJIA and 83 patients with sJIA, who were resistant to prior standard therapy. The treatment duration was 4 to 84 months (median, 22 months for pJIA; 34 months for sJIA). The frequency and timing of neutropenia and the relationship to infection and concomitant/pre-vious therapy were examined.
Results and discussion. 22 and 62 patients with pJIA and sJIA, respectively, continued treatment; its median duration was 27.4 [9; 72] months. 7 patients with pJIA and 21 with sJIA, discontinued TCZ due to severe adverse events (n=2 and n=11, respectively) and organizational reasons (n=5 and n=7); in sJIA, therapy was discontinued for sustained remission in two patients and for secondary inefficiency in one patient. At least one episode of neutropenia was observed in 63% of patients with pJIA and in 48.2% of those with sJIA; among them, there was grade 1 neutropenia in 5 and 15 patients, respectively; grade 2 in 6 and 15, grade 3 in 4 and 10, and grade 4 in two patients with pJIA.

Neutropenia was more frequently observed in the first months of therapy for pJIA; that was seen in patients with sJIA when the latter reached its inactive status. In 5 patients with sJIA, neutropenia was recorded as a manifestation of macrophage activation syndrome (MAS); no correlation with TCZ infusions was found. Neutropenia was not associated with an increased rate of infections. The use of methotrexate was not significantly related to the low level of neutrophils, whereas the earlier age was associated with the degree and frequency of neutropenia. All cases of neutropenia were recorded in patients with a therapeutic response rate of >50% according to the American College of Rheumatology Pediatric (ACR Pedi) criteria. The findings suggest that there are different mechanisms and periods of neutropenia during TCZ therapy for JIA: 1) benign, transient neutropenia, a predictor of the high efficiency of therapy, develops primarily in the first few days after infusion; 2) neutropenia as a phenomenon of «redundancy» of therapy (more resistant) develops more often in the inactive phase of the disease; 3) neutropenia as a component of MAS, which is associated with its other markers. No relationship was found between neutropenia and an increased risk of infections. TCZ-treated patients need careful clinical and laboratory monitoring, including consideration of a risk for neutropenia and subsequent individual treatment when this condition is identified. Keywords: tocilizumab; neutropenia; juvenile idiopathic arthritis; biological drugs.
For reference: Kaleda MI, Nikishina IP, Shapovalenko AN, et al. The phenomenon of neutropenia during tocilizumab therapy in patients with juvenile idiopathic arthritis. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2017;55(6):662-667 (In Russ.).
doi:
Одним из перспективных направлений в фармакотерапии ревматических заболеваний в начале XXI в. стала ингибиция интерлейкина 6 (ИЛ6) – цитокина, вовлеченного во многие аспекты воспаления и, тем самым, определяющего разнообразные клинические и лабораторные проявления ревматоидного артрита (РА) у взрослых и ювенильного идиопатического артрита (ЮИА) [1]. Препаратом с таким механизмом действия является тоцили-зумаб (ТЦЗ) – рекомбинантное гуманизированное моноклональное IgG1-антитело к рецептору ИЛ6, которое селективно связывается как с растворимыми, так и с мембранными рецепторами ИЛ6. ТЦЗ продемонстрировал высокую эффективность у взрослых пациентов с РА, а также при ювенильном артрите с системным дебютом (сЮИА) и при полиартикулярном варианте ЮИА как в рандомизированных клинических исследованиях, так и в клинической практике [2–6]. При изучении аспектов безопасности ТЦЗ уже на стадии доклинических исследований была выявлена повышенная частота нейтропений на фоне его применения. В связи с этим феноменом в инструкцию по применению препарата были внесены указания, не рекомендующие его использование при исходном уровне нейтрофилов <2,0•109/л, и о прекращении/при-остановке лечения ТЦЗ при снижении уровня нейтрофилов <0,5•109/л [7].
На сегодняшний день окончательно не изучен механизм развития нейтропении при применении ТЦЗ, хотя внимание многих ученых было привлечено к этому феномену. Так, L. Gibiansky и N. Frey [8] показали, что снижение уровня нейтрофилов напрямую связано с концентрацией ТЦЗ в крови и обусловлено быстрым переходом нейтрофилов из циркулирующего в маргинальный пул под влиянием ТЦЗ. После введения препарата в дозе 8 мг/кг уровень нейтрофилов восстанавливался медленнее, чем при использовании дозы 4 мг/кг. Более позднее исследование T. Suwa и соавт. [9] также продемонстрировало, что снижение количества нейтрофилов при применении ТЦЗ может быть обусловлено повышенной маргинализацией циркулирующих нейтрофилов, а не «классической» лекарственной нейтропенией, наблюдаемой при применении миелотоксических препаратов. По мнению H.L. Wright и соавт. [10], ТЦЗ может не только влиять на распределение нейтрофилов между циркулирующими и маргинальными пулами, но также увеличивать время прохождения нейтрофилов через костный мозг. Блокада ИЛ6, согласно исследованию этих авторов, одновременно вызывая переходную нейтропению, не влияет непосредственно на функции нейтрофилов, связанные с защитой хозяина. ТЦЗ-ассоциированная нейтропения не может быть объяс- нена прямой индукцией апоптоза ТЦЗ, индукцией апоптоза после истощения ИЛ6, а также повышенным фагоцитозом нейтрофилов [10]. Чаще всего она развивается непосредственно после инфузии (1–2 дня), но не носит стойкий характер, возвращаясь к нормальному уровню к 4–6-й неделе [11].
В многочисленных клинических исследованиях ТЦЗ как при РА взрослых, так и при ЮИА нейтропения регистрируется у значительной доли пациентов [12–14], поэтому данный феномен заслуживает детального изучения.
Цель исследования – провести анализ всех случаев нейтропении на фоне применения ТЦЗ при полиартику-лярном (пЮИА) и системном (сЮИА) вариантах ЮИА.
Материал и методы
В проспективное исследование были включены 110 пациентов, из них 27 пациентов с пЮИА и 83 пациента с сЮИА, резистентных к предшествующей стандартной терапии (табл. 1). Инфузии проводились в соответствии с принятыми рекомендациями по расчету дозировки и интервала между инфузиями для сЮИА и пЮИА. При динамическом наблюдении в последующем проводилась коррекция интервалов между инфузиями и дозировки в зависимости от активности заболевания, уровня и устойчивости достигнутого ответа на терапию, уровня нейтропении. Длительность наблюдения после начала терапии ТЦЗ составила от 4 до 84 мес (медиана 22 мес для пЮИА, 34 мес для сЮИА). У всех пациентов проводилось исследование клинического анализа крови с подсчетом лейкоцитов и нейтрофилов в абсолютных цифрах накануне выполнения инфузии, на 1-е, 3-и сутки после инфузии; в случае выявления нейтропении 2-й степени и ниже оценка клинического анализа крови проводилась ежедневно до достижения уровня нейтрофилов >1,5•109/л. Степень нейтропении оценивалась в соответствии с градацией, предложенной ВОЗ и используемой в рандомизированных клинических исследованиях: 1-я степень (≥1,5•109/л и <2,0•109/л), 2-я степень (≥1,0•109/л и <1,5• 109/л), 3-я степень (≥0,5•109/л и <1,0•109/л), 4-я степень (<0,5•109/л), при этом для каждого пациента фиксировалось наименьшее число нейтрофилов после инфузии.
Предшествующий опыт применения других ГИБП имели 63% пациентов с пЮИА и 24% пациентов с сЮИА, ТЦЗ назначался как ГИБП первой линии в 10/63 случаях при пЮИА/сЮИА, второй – в 6/14, третьей – 9/6, четвертой линии – 2/0 соответственно. Из пациентов с сЮИА 24 (27,3%) до начала терапии ТЦЗ перенесли синдром активации макрофагов (САМ), из них 19 – в дебюте заболевания.

По дизайну исследование было открытое проспективное, с последовательным включением пациентов.
Статистический анализ данных проводился с использованием программы Statistica 6.0 (StatSoft Inc., США). Количественные переменные описывались с помощью медианы (Me) и интерквартильного интервала [25-й; 75-й перцентили]. Сравнение значений количественных переменных выполнялось с помощью U-теста по методу Манна–Уитни (при сравнении двух независимых групп), а также с использованием критерия χ 2 (точный критерий Фишера) при сравнении качественных параметров при значении ожидаемой частоты <5. Различия считали статистически значимыми при р<0,05.
Результаты
Продолжают лечение ТЦЗ 22/62 пациента с пЮИА/ сЮИА, медиана продолжительности терапии – 27,4 [9; 72] мес. У 7 пациентов с пЮИА и 21 – с сЮИА ТЦЗ был отменен: из-за серьезных неблагоприятных реакций – у 2/11, по организационным причинам – у 5/7; при cЮИА у двух пациентов терапия была прекращена в связи со стойкой ремиссией, у одного – в связи с развитием вторичной неэффективности. Имели по крайней мере один эпизод нейтропении 1–4-й степени 63% пациентов с пЮИА и 48,2% с сЮИА, из них нейтропения 1-й степени зареги-
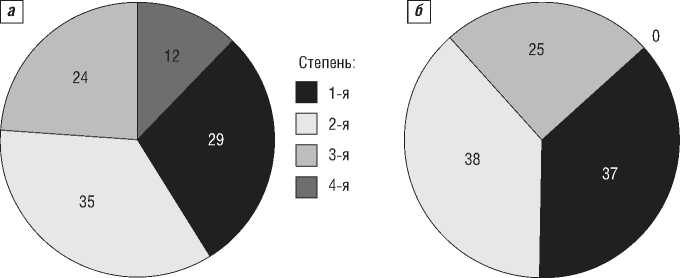
Рис. 1. Выраженность нейтропении в соответствии с градацией ВОЗ у пациентов с ЮИА на фоне терапии ТЦЗ, %: а – у больных пЮИА; б – у больных сЮИА
|
Таблица 1 Клинико-демографическая характеристика пациентов |
||
|
Показатель |
пЮИА (n=27) |
сЮИА (n=83) |
|
Мальчики/девочки |
8/19 |
35/48 |
|
Возраст начала терапии ТЦЗ, годы, |
11,1 [9,0; 14,7] |
6,25 [4,8; 11,25] |
|
Me [25-й; 75-й перцентили] |
||
|
Продолжительность болезни, годы, |
5,4 [2,0; 8,9] |
2,5 [0,8; 5,7] |
|
Me [25-й; 75-й перцентили] |
||
|
РФ+ |
4 |
0 |
|
АНФ+ |
11 |
0 |
|
Поражение глаз (увеит) |
8 |
0 |
|
Предшествующая терапия, %: |
||
|
НПВП |
100 |
65 |
|
ГК per os |
56 |
83 |
|
МТ |
93 |
86,7 |
|
ГИБП |
63 |
24 |
Примечание. РФ – ревматоидный фактор, АНФ – антинуклеарный фактор, НПВП – нестероидные противовоспалительные препараты, ГК – глюкокортикоиды, МТ – метотрексат, ГИБП – генно-инженерные биологические препараты.
стрирована у 5 больных пЮИА и 15 сЮИА, 2-й степени – у 6 и 15 соответственно, 3-й степени – у 4 и 10 и 4-й степени – у 2 пациентов с пЮИА (рис. 1).
Максимальное снижение уровня нейтрофилов в 1-й день после инфузии имели 73% пациентов. При пЮИА нейтропения чаще наблюдалась в первые месяцы терапии, тогда как при сЮИА – у большинства пациентов при достижении неактивного статуса болезни (рис. 2).
За весь период наблюдения САМ на фоне терапии ТЦЗ зафиксирован у 8 пациентов, двое из них не имели в анамнезе САМ до назначения ТЦЗ и развитие САМ было достоверно связано с превышением рекомендованного интервала между инфузиями на ранних сроках терапии, у других это были повторные эпизоды САМ. Среди пациентов с предшествующим анамнезом САМ только у 25% возникли повторные эпизоды на фоне применения ТЦЗ, которые не потребовали отмены терапии. Нейтропения как проявление САМ выявлена у 5 пациентов с сЮИА на фоне тоцилизумаба, в трех случаях уровень снижения нейтрофилов соответствовал 1-й степени нейтропении, в двух – 2-й степени, достоверная связь с инфузиями ТЦЗ не выявлена ни в одном из этих случаев, интервал от момента выполнения инфузии ТЦЗ до развития САМ составил от 5 до 21 дня, в двух случаях выявлена связь с острой респираторной инфекцией, в двух – с превышением рекомендованного интервала между инфузиями, еще в одном случае – с быстрой отменой пероральных ГК, несмотря на сохраняющиеся признаки системности заболевания в виде рецидивирующей сыпи.
При обработке результатов исследования с помощью U-теста по методу Манна–Уитни проводились сравнение частоты инфекций, зафиксированных в период нейтропении, с частотой инфекций при нормальном уровне нейтрофилов, сопоставление частоты нейтропений в зависимости от возраста (группа младшего возраста – до 6 лет, старшая возрастная группа – после 6 лет), сопутствующей терапии МТ и ГК, предшествующей терапии другими ГИБП.
Частота инфекций в течение периода, когда число нейтрофилов соответствовало норме, была сопоставима с частотой инфекций при выявлении нейтропении 1–4-й степени в диапазоне ±15 дней, без тенденции к увеличению риска развития инфекции при более тяжелой степени нейтропении. Факт использования МТ не ассоциировался с низким уровнем нейтрофилов (p=0,515), тогда как между младшим возрастом пациентов со степенью и частотой нейтропении была выявлена достоверная связь (р=0,002). Отмечено, что при комбинации ТЦЗ с пероральными ГК в подавляющем большинстве наблюдений регистрировался нормальный уровень нейтрофилов (p=0,638). У пациентов, имевших опыт применения других ГИБП, риск развития нейтропении оказался сопоставимым с таковым у ГИБП-наивных пациентов (р=0,524). Все случаи нейтропении в нашем исследовании, за исключением нейтропении в рамках САМ, были зафиксированы только у пациентов, достигших уровня терапевтического ответа более 50% согласно критериям Американ-


ской коллегии ревматологов (ACRpedi), что наглядно демонстрирует диаграмма на рис. 2.
Обсуждение
Анализ полученных в настоящем исследовании данных свидетельствует о высокой частоте нейтропении на фоне применения ТЦЗ, составившей 48,2% при сЮИА и 63% при пЮИА. При сопоставлении полученных данных с результатами других исследований следует отметить, что данные о частоте нейтропений существенно разнятся, особенно при пЮИА (табл. 2) [6, 13–17]. На наш взгляд, это может быть обусловлено как различиями в клинической картине заболевания в исследуемых группах пациентов, так и сроками выполнения контрольных обследований (в нашем исследовании на 1-й, 3-й дни после инфузии, в других исследованиях – через неделю, 15, 28 дней), а также сопутствующей терапией, в первую очередь приемом ГК. У взрослых пациентов с РА частота нейтропений по данным рандомизированных контролируемых исследований (РКИ) была существенно ниже и составила 4,7%, хотя следует отметить, что авторы фиксировали только нейтропении 3-й и 4-й степени [12], которые в нашем исследовании суммарно составили 12% при сЮИА и 22,7% при пЮИА от числа всех нейтропений.
Максимальное снижение уровня нейтрофилов у подавляющего большинства пациентов (73%) выявлялось в 1-е сутки после инфузии, что соответствует данным исследования I. Nakamura и соавт. [11] при РА у взрослых пациентов, где зафиксировано быстрое снижение нейтрофилов после инфузии в течение 1–2 дней с последующим восстановлением. Согласно полученным нами данным, у детей процесс нормализации уровня нейтрофилов происходит быстрее, с достижением, как правило, нормальных референсных значений через 5–10 дней после инфузии. К сожалению, протоколами международных РКИ при сЮИА и пЮИА [13, 14] детальное изучение динамики числа нейтрофилов после выполнения инфузии не предусматривалось.
Исследование H.L. Wright и соавт. [10] не выявило прямого влияния ТЦЗ на функцию нейтрофилов при РА у взрослых пациентов. Кроме того, in vivo терапевтическая блокада ИЛ6 при РА, индуцируя переходную нестойкую нейтропению, не влияла на функции нейтрофилов, связанные с эффективной антибактериальной защитой. Этим фактом можно объяснить отсутствие четкой связи между снижением числа нейтрофилов ниже 1,0•109/л и развитием серьезных инфекционных заболеваний на фоне терапии ТЦЗ согласно опубликованным исследованиям по применению ТЦЗ как у взрослых пациентов с РА [12], так и в РКИ при сЮИА и пЮИА [13, 14]. В нашем исследовании также не зафиксировано нарастания частоты инфекций у пациентов с нейтропенией по сравнению с частотой инфекций в тот период, когда уровень нейтрофилов соответствовал нормальным значениям.
Среди наблюдавшихся нами пациентов только двое имели нейтропению 4-й степени, развившуюся после первой инфузии. В обоих случаях это были пациенты с пЮИА, но существенно различавшиеся как по вариан- ту заболевания, так и по проводимой терапии. В первом случае нейтропения развилась у девочки 8,5 лет с высокоактивным ювенильным РА, высокоактивным полиартику-лярным вариантом, серопозитивным по РФ и антителам к циклическому цитруллинированному пептиду (АЦЦП), длительностью заболевания на момент начала терапии ТЦЗ 2 года 9 мес, которая получала МТ 15 мг/м2 поверхности тела в неделю и НПВП, не имела предшествующего опыта терапии ГК и ГИБП. В другом наблюдении максимальная степень нейтропении развилась у мальчика 9,5 лет с полиартикулярным вариантом ЮИА, АНФ-позитивным, ассоциированным с хроническим увеитом, получающим МТ в дозе 12,5 мг/м2 в неделю и ГК из расчета 0,25 мг/кг по преднизолону, с предшествующим опытом терапии двумя ГИБП (этанерцепт и адалимумаб), длительностью заболевания на момент начала терапии ТЦЗ 3 года 3 мес.
В нашем исследовании терапия МТ и младший возраст ассоциировались с повышенным риском нейтропении, тогда как применение ТЦЗ в сочетании с ГК сопровождалось нормальным уровнем нейтрофилов, что согласуется с данными исследования TENDER при сЮИА [13] и может свидетельствовать о своеобразно «протективной» функции ГК в отношении нейтропении.
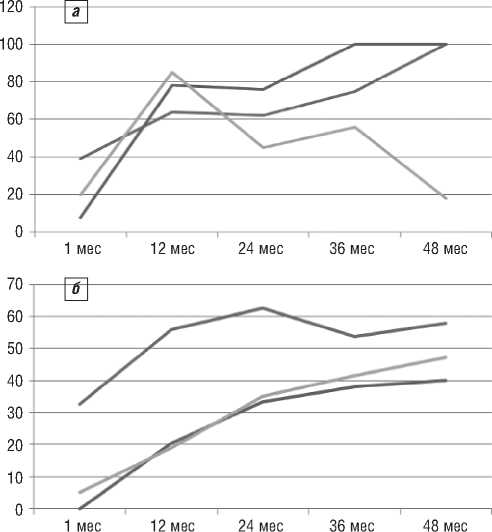
ACR50 и более Неактивная болезнь Нейтропении
Рис. 2. Соотношение терапевтической эффективности с частотой нейтропений при пЮИА (а) и сЮИА (б)
Таблица 2 Сопоставление частоты нейтропений на фоне терапии ТЦЗ при ЮИА по данным различных исследований
|
Данные |
cЮИА |
пЮИА |
|
Международные РКИ |
1) 57,1%, из них 16,9% серьезных НП [14]; |
1) 37,2% [14]; |
|
2) 19,4% [15] |
2) не зафиксировано [16] |
|
|
Данные других российских центров |
40,0% [17] |
7,5% [6] |
|
ФГБНУ НИИР им. В.А. Насоновой |
48,2% |
63% |
Представляется интересным тот факт, что при пЮИА, в отличие от сЮИА, мы чаще наблюдали транзи-торную кратковременную нейтропению на начальных этапах лечения с постепенным восстановлением нормального уровня нейтрофилов. Эти результаты согласуются с данными международного РКИ CHERISH при пЮИА, в котором нейтропения чаще регистрировалась в первые 16 нед применения ТЦЗ при последующей нормализации уровня нейтрофилов или его стабилизации на приемлемых значениях [14]. Аналогичная закономерность была выявлена M.H. Schiff и соавт. [12] при РА у взрослых, обративших внимание на медленное повышение уровня нейтрофилов по мере увеличения длительности лечения ТЦЗ. Напротив, при сЮИА, в отличие от пЮИА, как показало наше исследование, нейтропения, как правило, развивалась при длительном, часто многолетнем применении ТЦЗ у пациентов, достигших неактивного статуса болезни, и имела более стойкий характер. Возможное влияние сопутствующей ГК терапии и ее коррекции нами предполагалось, но было отвергнуто при детальном изучении.
В нашем исследовании у пациентов, имевших опыт применения других ГИБП, среди которых 70,6% при пЮИА и 65% при сЮИА ранее получали ингибиторы фактора некроза опухоли α , риск развития нейтропении оказался сопоставимым с таковым у ГИБП-наивных пациентов. Согласно данным литературы, при РА у взрослых пациентов нейтропении на фоне терапии ТЦЗ чаще развивались у пациентов с предшествующей нейтропений, в основном зафиксированной на фоне терапии этанерцептом или сульфасалазином [18].
Ранее на основании анализа применения ТЦЗ у 49 пациентов с сЮИА нами уже было отмечено, что нейтропения фиксировалась только у тех из них, которые являлись ответившими на терапию и достигали уровня терапевтического ответа >50% согласно критериям ACRpedi [19]. Настоящее исследование подтвердило полученные результаты как в отношении пациентов с сЮИА, так и при пЮИА. Эти данные согласуются с результатами других российских авторов [20], сделавших вывод из собственного исследования о том, что выраженность нейтропении у пациентов с сЮИА на фоне ТЦЗ может рассматриваться в качестве маркера биологической чувствительности к проводимой терапии.
У наблюдаемых нами пациентов при выявлении снижения уровня нейтрофилов до 2-й степени и ниже проводилась коррекция терапии как за счет изменения сроков и вводимой дозы ТЦЗ, так и путем уменьшения дозы либо отмены БПВП (МТ). Подобная терапевтическая тактика оказала положительное действие во всех случаях, что подтверждает эффективность индивидуального подбора дозы ТЦЗ, предложенного ранее при РА у взрослых [12, 18]. В ряде случаев у пациентов с предшествующей историей частых интеркуррентных инфекций нами проводились инфузии внутривенного иммуноглобулина в низких (заместительных) дозах. Применение гранулоцитарного колониестимулирующего фактора (Г-КСФ) среди наших пациентов было осуществлено только в трех случаях: у одного пациента с нейтропенией 4-й степени при пЮИА непосредственно в нашем отделении и у двух пациентов с сЮИА с нейтропенией 2-й степени в стационарах по месту жительства, что, на наш взгляд, представлялось не совсем оправданным. Согласно имеющимся представлениям о влиянии ТЦЗ на нейтрофилы, использование Г-КСФ патогенетически не вполне обосновано. Кроме того, современные рекомендации гематологов [21] предусматривают назначение Г-КСФ только при тяжелой нейтропении и агранулоцитозе как разовая процедура. Следует учитывать, что длительное использование Г-КСФ при лечении нейтропении сопряжено с повышенным риском развития острого миелобла-стного лейкоза [22].
Отдельного обсуждения требует анализ случаев развития САМ у пациентов, получающих ТЦЗ. В настоящее время отсутствует однозначная точка зрения на взаимосвязь между лечением ТЦЗ, как и другими ГИБП, и САМ. С одной стороны, при применении ТЦЗ описаны случаи развития САМ, что служит фактором, ограничивающим применение этого препарата у данной категории пациентов [3, 23]. С другой стороны, в ряде публикаций обсуждается отсутствие повышенного риска развития САМ при использовании биологических препаратов, в частности ТЦЗ [24]. Среди наших пациентов с сЮИА, получающих ТЦЗ, 26 перенесли САМ в течение всего периода болезни, из них только у двоих развитие САМ впервые зафиксировано на фоне терапии ТЦЗ, но при достоверном нарушении сроков выполнения инфузии. Ни в одном случае развитие САМ не было причиной отмены ТЦЗ. Несмотря на отсутствие достоверной взаимосвязи, о возможности развития САМ на фоне терапии не стоит забывать в клинической практике, особенно с учетом данных о том, что ТЦЗ может маскировать симптомы САМ [25].
Развитие лейко-/нейтропении среди наших пациентов только в одном случае стало основанием для отмены ТЦЗ (нейтропения 4-й степени при пЮИА, РФ- и АЦЦП-позитивном полиартрите). Возможно, с учетом нашего последующего клинического опыта применения ТЦЗ при пЮИА, отмены препарата у этой пациентки можно было бы избежать, осуществив попытку титрования дозы, коррекции интервала между инфузиями, сопутствующей терапии для получения лучшего результата в долгосрочной перспективе.
Таким образом, полученные данные свидетельствуют о различных механизмах и сроках развития нейтропении на фоне терапии ТЦЗ при ЮИА:
-
1) «доброкачественная», транзиторная нейтропения – предиктор высокой эффективности ТЦЗ, развивается прежде всего в первые несколько дней после инфузии;
-
2) нейтропения как явление «избыточности» терапии (более резистентная), которая требует коррекции дозы ТЦЗ и сопутствующей терапии и развивается чаще в неактивной фазе болезни;
-
3) нейтропения как компонент САМ, обусловленная неадекватностью проводимой терапии или «истощением» полученного терапевтического ответа, которая связана с другими маркерами САМ. Мы не выявили связи между нейтропенией и повышенным риском инфекций.
Пациенты, получающие терапию ТЦЗ, требуют тщательного клинико-лабораторного мониторинга (в том числе с учетом риска нейтропении) и последующей индивидуальной коррекции терапии при ее выявлении как за счет индивидуального титрования дозы, изменения сроков выполнения инфузий, так и за счет пересмотра сопутствующей терапии.
Прозрачность исследования
Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
Список литературы Феномен нейтропении на фоне терапии тоцилизумабом у пациентов с ювенильным идиопатическим артритом
- Schoels MM, van der Heijde D, Breedveld FC, et al. Blocking the effects of interleukin-6 in rheumatoid arthritis and other inflammatory rheumatic diseases: systematic literature review and metaanalysis informing a consensus statement. Ann Rheum Dis. 2013; 72(4): 583-9 DOI: 10.1136/annrheumdis-2012-202470
- Smolen JS, Beaulieu A, Rubbert-Roth A, et al; OPTION Investigators. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet. 2008 Mar 22; 371(9617): 987-97 DOI: 10.1016/S0140-6736(08)60453-5
- De Benedetti F, Brunner HI, Ruperto N, et al. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis. New Engl J Med. 2012; 367(25): 2385-95 DOI: 10.1056/NEJMoa1112802
- Brunner HI, Ruperto N, Zuber Z, et al. Efficacy and safety of tocilizumab in patients with polyarticular-course juvenile idiopathic arthritis: results from a phase 3, randomised, double-blind withdrawal trial. Ann Rheum Dis. 2015; 74(6): 1110-7 DOI: 10.1136/annrheumdis-2014-205351
- Каледа МИ, Никишина ИП. Эффективность и безопасность тоцилизумаба у детей с системным вариантом ювенильного артрита в клинической практике. Научно-практическая ревматология. 2015; 53(2): 204-13
- Костик ММ, Чикова ИА, Исупова ЕА и др. Применение тоцилизумаба у 40 пациентов с полиартикулярным вариантом ювенильного идиопатического артрита: результаты ретроспективного исследования. Вопросы современной педиатрии. 2017; 16(2): 148-55
- RoActemra 20 mg/ml concentrate for solution for infusion . Welwyn Garden City, UK: Roche Registration Ltd; 2014.
- Gibiansky L, Frey N. Linking interleukin-6 receptor blockade with tocilizumab and its hematological effects using a modeling approach. J Pharmacokinet Pharmacodyn. 2012 Feb; 39(1): 5-16 DOI: 10.1007/s10928-011-9227-z
- Suwa T, Hogg JC, English D, van Eeden SF. Interleukin-6 induces demargination of intravascular neutrophils and shortens their transit in marrow. Am J Physiol Heart Circ Physiol. 2000 Dec; 279(6): H2954-60.
- Wright HL, Cross AL, Edwards SW, Moots RJ. Effects of IL-6 and IL-6 blockade on neutrophil function in vitro and in vivo. Rheumatology (Oxford). 2014 Jul; 53(7): 1321-31. Epub 2014 Mar 7 DOI: 10.1093/rheumatology/keu035
- Nakamura I, Omata Y, Naito M, Ito K. Blockade of interleukin 6 signaling induces marked neutropenia in patients with rheumatoid arthritis. J Rheumatol. 2009 Feb; 36(2): 459-60 DOI: 10.3899/jrheum.080930
- Schiff MH, Kremer JM, Jahreis A, et al. Integrated safety in tocilizumab clinical trials. Arthr Res Ther. 2011; 13(5): R141 DOI: 10.1186/ar3455
- De Benedetti F, Ruperto N, Baildam E, et al. A14: Neutropenia with tocilizumab treatment is not associated with increased infection risk in patients with systemic juvenile idiopathic arthritis. Arthritis Rheum. 2014; 66: 23-24 DOI: 10.1002/art.38422
- De Benedetti F, Rubio-Perez N, Salazar CD, et al. A45: Neutropenia with tocilizumab treatment is not associated with increased infection risk in patients with polyarticular-course juvenile idiopathic arthritis. Arthritis Rheum. 2014; 66: S67-8 DOI: 10.1002/art.38461
- Yokota S, Imagawa T, Mori M, et al. Longterm safety and effectiveness of the anti-interleukin 6 receptor monoclonal antibody tocilizumab in patients with systemic juvenile idiopathic arthritis in Japan. J Rheumatol. 2014; 41(4): 759-67 DOI: 10.3899/jrheum.130690
- Imagawa T, Yokota S, Mori M, et al. Safety and efficacy of tocilizumab, polyarticular-course juvenile idiopathic arthritis. Mod Rheumatol. 2012 Feb; 22(1): 109-15 DOI: 10.1007/s10165-011-0481-0
- Валиева СИ. Новые технологии в лечении системного ювенильного идиопатического артрита. Автореф. дисс.. докт. мед. наук. Москва; 2014. 48 с.
- Shovman O, Shoenfeld Y, Langevitz P. Tocilizumab-induced neutropenia in rheumatoid arthritis patients with previous history of neutropenia: case series and review of literature. Immunol Res. 2015 Feb; 61(1-2): 164-8 DOI: 10.1007/s12026-
- Каледа МИ, Никишина ИП. Тоцилизумаб в лечении детей с системным вариантом ювенильного артрита: анализ факторов, влияющих на эффективность терапии в долгосрочном периоде. Вопросы современной педиатрии. 2015; (2): 236-46
- Kostik MM, Dubko MF, Masalova VV, et al. Successful treatment with tocilizumab every 4 weeks of a low disease activity group who achieve a drug-free remission in patients with systemic-onset juvenile idiopathic arthritis. Pediatr Rheumatol Online J. 2015; 13: 4 DOI: 10.1186/1546-0096-13-4
- Агеенкова ЭВ, редактор. Стандарты оказания специализированной помощи детям и подросткам с гематологическими и онкологическими заболеваниями. Москва: Медпрактика-М; 2009
- Rosenberg PS, Zeidler C, Bolyard AA, et al. Stable long-term risk of leukaemia in patients with severe congenital neutropenia maintained on G-CSF therapy. Brit J Haematol. 2010; 150(2): 196-9 DOI: 10.1111/j.1365-2141.2010.08216.x
- Kessler E, Vora S, Verbsky J. Risk of significant cytopenias after treatment with tocilizumab in systemic juvenile arthritis patients with a history of macrophage activation syndrome. Pediatr Rheum Online J. 2012; 10(1): 30 DOI: 10.1186/1546-0096-10-30
- Ravelli A, Schneider R, Weitzman S, et al. Macrophage activation syndrome in patients with systemic juvenile idiopathic arthritis treated with tocilizumab. Arthritis Rheum. 2014; 66 Suppl 11: 83-4 DOI: 10.1002/art.38472
- Shimizu M, Nakagishi Y, Kasai K, et al. Tocilizumab masks the clinical symptoms of systemic juvenile idiopathic arthritis-associated macrophage activation syndrome: the diagnostic significance of interleukin-18 and interleukin-6. Cytokine. 2012; 58: 287-94 DOI: 10.1016/j.cyto.2012.02.006


