Физико-химические и биокаталитические свойства протеолитического комплекса препарата «Протепсин»
Автор: Антипова Л.В., Горбунков М.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (67), 2016 года.
Бесплатный доступ
Ферментные технологии прочно вошли в практическую деятельность человека, объем мирового рынка постоянно растет и обновляется. Однако отечественное производство ферментных препаратов весьма отстает от мирового уровня, что во многом связано с недостаточной научно-технической базой для широкого распространения технологий в крупномасштабном производстве. В то же время появились российские производители ферментных препаратов из животных тканей и органов для обработки сырья животного происхождения, по прогнозам, представляющие интерес в рациональном использовании ресурсов животного происхождения. В статье приведены данные по исследованию свойств ферментного препарата «Протепсин» и оценке перспективности применения в обработке сырья животного происхождения. Ферментный препарат «Протепсин», производимый в условиях ЗАО «Завод эндокринных ферментов» (п. Ржавки, Московская область) проявляет активность при действии на белки мяса, включая белки упрочненной структуры, обладает молокосвертывающим эффектом, активен в области pH 4,0-6,0 и температуре 20-45 ºС. Белковый комплекс включает 4 фракции, 2 из которых обладают общей протеолитической активностью. Одна из них проявляет общую протеолитическую и молокосвертывающую активность. Ферменты отличаются аминокислотным набором и молекулярной массой. Методом дискового электрофореза определен молекулярно-массовый состав «Протепсина». Показаны условия инактивации препарата, гарантирующие его безопасность в технологии производства пищевых продуктов, так как активные протеолитические ферменты в процессе пищеварения могут вызывать нарушения целостности тканей и соответствующие заболевания. Таким образом, комплексно обоснованы и подобраны условия использования перспективного протеолитического препарата в технологии широкого спектра продуктов питания животного происхождения.
Ферментные технологии, сырье животного происхождения, протеолитический комплекс, молокосвертывающий эффект, идентификация ферментов
Короткий адрес: https://sciup.org/14040581
IDR: 14040581 | УДК: 637.5.04/.07 | DOI: 10.20914/2310-1202-2016-1-89-95
Текст научной статьи Физико-химические и биокаталитические свойства протеолитического комплекса препарата «Протепсин»
DOI:
For cite
Несмотря на бурное развитие биотехнологий в мире, отечественное производство ферментных препаратов остается недостаточно развитым. Вместе с тем, рынок ферментных препаратов пополнился за счет технологий переработки животных органов и тканей для получения протеаз и их применения при производстве инновационных продуктов животного происхождения, социальное и экономическое значение которых трудно переоценить. Ферментные технологии позволят увеличить выход полезной продукции с единицы перерабатываемого сырья, снизить себестоимость, улучшить качество, повысить пищевую и биологическую ценность, рационально и максимально использовать ресурсы для производства пищевого сырья и продуктов, создать гибкий ассортимент, ориентированный на социальные и физиологические группы населения с высокими потребительскими свойствами, в том числе, обогащенных биологически активными веществами, а также новые источники и формы пищи, обеспечить продовольственную безопасность страны [1-4].
Среди новинок выступает ферментный препарат «Протепсин», вырабатываемый в условиях ЗАО «Завод эндокринных ферментов» (п. Ржавки, Московская область) по ТУ 9219-005-427-89-257. По данным производителя и авторов (Антипова Л.В., Бибишев Р.А.,
Косенко И.С.) ферментный препарат «Про-тепсин» – порошок светло-серого цвета, маркируется по уровню активности: 50, 100 и 150 ед/г. Его рабочая активность проявляется в диапазоне температур 20-45 ºС при оптимуме в мясных системах 40 ºС. Полная инактивация ферментного комплекса отмечается при 70 ºС в течение 15 минут. Рекомендуемая норма при обработке мяса и мясных продуктов в диапазоне pH 4,5-6,0 составляет 0,01-0,05 % к массе сырья с учетом уровня стандартной активности, вида и состояния сырья, а также особенностей технологии применения.
Препарат апробирован и зарекомендовал себя для ускорения процессов созревания и тен-деризации мяса. Препарат – синергист внутриклеточных ферментов мышечной ткани, однако обладает более широким спектром воздействия на белки мяса.
Общий химический состав препарата, определенный традиционными методами, представлен (масс, %): влага – 10,94; белок – 87,52; жир – 0,61; зола – 0,93.
При проведении сравнительных исследований был установлен аминокислотный состав препарата в сравнении с известными аналогами (таблица 1) с использованием аминоанализатора ААА-881 (Чехия), в соответствии с инструкцией к прибору.
Т а б л и ц а 1
Аминокислотный состав ферментов кислых протеиназ
|
Аминокислоты |
Содержание аминокислот, г/100 г белка |
||
|
Микробный препарат |
Пепсин животных |
«Протепсин» |
|
|
1 |
2 |
3 |
4 |
|
Аланин |
6,8 |
- |
3,0 |
|
Аргинин |
1,1 |
1,0 |
0,87 |
|
Аспарагиновая кислота |
16,2 |
16,0 |
17,2 |
|
Цистин |
- |
1,6 |
1,3 |
|
Глютаминовая кислота |
9,7 |
11,9 |
10,2 |
|
Глицин |
6,8 |
6,4 |
5,9 |
|
Гистидин |
1,1 |
0,9 |
0,98 |
|
Изолейцин |
3,6 |
10,8 |
5,4 |
|
Лейцин |
10,2 |
10,4 |
8,8 |
|
Лизин |
0,5 |
0,9 |
1,14 |
|
Метионин |
2,0 |
1,7 |
1,4 |
|
Фенилаланин |
11,4 |
6,4 |
7,14 |
|
Пролин |
1,7 |
5,0 |
1,13 |
|
Серин |
5,0 |
12,2 |
9,9 |
|
Треонин |
10,9 |
9,6 |
8,9 |
|
Тирозин |
6,6 |
8,5 |
5,4 |
|
Валин |
14,2 |
7,1 |
5,8 |
|
Триптофан |
1,3 |
2,4 |
1,3 |
Как видно из данных таблицы 1, в состав белков-ферментов входит полный перечень протеиногенных аминокислот. Несмотря на очевидно общие черты, ферменты отличаются по содержанию отдельных аминокислот, что может быть связано как со структурными особенностями, так и со степенью чистоты исследуемых ферментов в препарате. Заметно, что приведенные в таблице ферменты на 50 и более процентов состоят из гидрофобных аминокислот, что предполагает значительную роль гидрофобных взаимодействий в стабилизации пространственной структуры. При этом в составе преобладают аспарагиновая и глютаминовая аминокислоты, сумма которых составляет 25,927,7 %, что объясняет «кислую» природу ферментов, активных в области низких значений pH. В препарате «Протепсин» содержится незначительное количество гистидина, но более выражен лизин по сравнению с аналогами. Исходя из выше изложенного можно предполагать, что ферменты наряду со структурными имеют и функциональные особенности.
Данные обстоятельства диктуют необходимость углубленного изучения компонентного состава протеолитического комплекса, физико-химических свойств и структурных особенностей входящих в него ферментов. Исследования представляют интерес еще и потому что «Протепсин» обнаруживает молокосвертывающую активность наряду с общей протеолитической, что весьма важно в оценке перспектив и расширении области применения препарата в обработке не только мясного, но и молочного сырья.
Препарат подвергали электрофоретическим исследованиям и хроматографии для определения фракционного состава белков и идентификации протеолитических фракций, в том числе обладающих молокосвертывающей активностью. Предварительно подготовленный к анализу препарат подвергали электрофоретическому разделению методом дискового электрофореза (рисунок 1) в соответствии с инструкцией к прибору.
Как видно на рисунке 1 (а), белковый комплекс препарата представлен четырьмя белковыми фракциями, отличающимися подвижностью в среде ПААГ, а следовательно молекулярной массой и величиной поверхностного заряда.
Идентификацию протеолитических фракций вели в ПААГ с использованием гемоглобина. При этом предварительно подвергнутый электрофоретическому разделению в ПААГ препарат извлекали из трубочки вместе с гелем и обрабатывали в растворе 2 % гемоглобина при pH 4,0 в течение 3-х часов при комнатной температуре. Затем гель фиксировали в растворе ТХУ и проводили окрашивание белков [5, 6]. Протеолитические фракции проявлялись в виде прозрачных полос на фоне интенсивно окрашенного гемоглобина в геле. Эксперимент доказывает наличие двух фракций, обладающих общей протеолитической активностью, так как локализованные в геле протеолитические фракции глубоко расщепляют субстрат с образованием низкомолекулярных продуктов, диффундирующих в среду красителя.
аб
Рисунок 1. Исследование протеолитического комплекса «Протепсин» методом дискового электрофореза: а) фракции белков препарата; б) идентификация протеолитических фракций
Второй способ идентификации состоял в том, что предварительно электрофоретически разделенные белковые фракции вырезали в геле в соответствии с пройденным фронтом и помещали в пробирку с дистиллированной водой (в 10 мл), проводили экстракцию в течение 3-х часов и в экстрактах определяли содержание белка, общую протеолитическую и молокосвертывающую активности. Экстракция белковых полос, вырезанных из геля, позволила идентифицировать две протеолитические фракции, названные нами протеиназа I и II соответственно, но лишь протеиназа II обладала молокосвертывающей активностью, которая определялась на обезжиренном молоке при pH 6,5 и температуре 35 ºС по времени свертывания (рисунок 2).
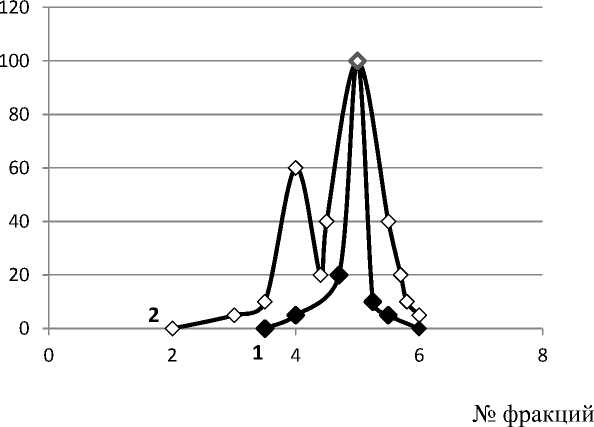
Рисунок 2. Идентификация протеолитических фракций препарата «Протепсин»: ─♦─ (1) - МСА, ─◊─ (2) – ПА
Судя по интенсивности протеолиза гемоглобина в геле, а также различию фронтов при электрофоретическом разделении фракций, протеолитические ферменты отличаются функционально, в частности, они по разному действуют на казеин молока, что указывает на отличия в субстратной специфичности.
Аналогичные результаты были получены при фракционировании белковых фракций препарата на ДЭАЭ – целлюлозе и сефадексе G – 100, последний использовался для количественного накопления ферментов и дальнейших исследований.
Основными факторами управления биохимическими процессами в пищевом сырье и продуктах выступают pH и температура, которые должны обеспечивать максимальную активность и полную инактивацию в конечном продукте. В ходе экспериментальных исследований установлено влияние этих факторов на протеолитическую активность ферментов препарата в модельном опыте: к 2 мл 2 % раствора стандартного субстрата добавляли по 2 мл растворов гомогенных фракций протеолитического комплекса с содержанием белка 600 мкг/мл. Гидролиз вели при температуре 35 ºС в течение 30 мин. Результаты определения активности в каждой пробе представлены в виде графической зависимости А=f (pH) (рисунок 3).
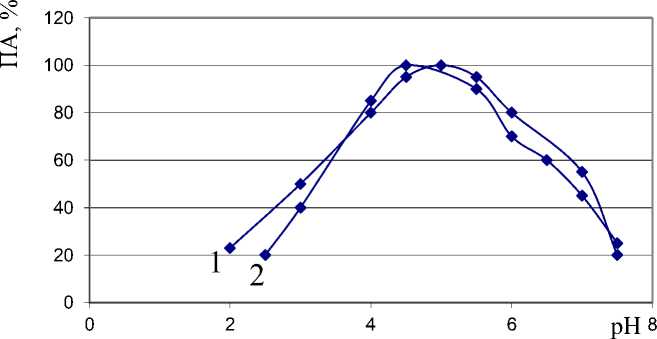
Рисунок. 3. Влияние pH на активность ферментов протеолитического комплекса препарата «Протепсин»: 1 – протеиназа II, 2 – протеиназа I
Ферменты достоверно различаются pH-оптимумами, при этом протеиназа I имеет максимальное значение активности при pH 4,0-4,5, а протеиназа II – при pH 4,5-5,0.
Аналогичные исследования проводили при воздействии температуры на реакционные смеси. Температуру поддерживали с помощью водяного термостата в диапазоне 20-70 ºС. Результаты определения ПА в каждом опыте представлены на рисунке 4.
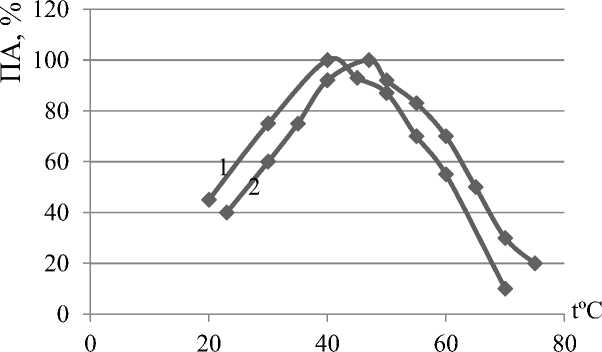
Рисунок. 4. Влияние температуры на активность протеолитических ферментов препарата «Протепсин»: 1 – протеиназа II, 2 – протеиназа I
Как видно на рисунке 4, оба фермента имеют температурный оптимум действия, характерный для ферментов животного происхождения, при этом протеиназа I наиболее активна при температуре 45 ºС, а протеиназа II – при 40 ºС.
Для ферментных препаратов, работающих в пищевых системах, весьма важна информация о пределах активности и кинетики инактивации под воздействием pH и температуры, так как активные протеолитические ферменты в процессе пищеварения могут вызывать нарушения целостности тканей и соответственные заболевания.
Инактивация ферментов под действием H+-ионов представляет собой результат предварительных ионизационных процессов, глубоко затрагивающих электростатические взаимодействия в белковой молекуле фермента. При этом в конечном счете в каждом элементарном акте инактивации принимают участие только молекула фермента и именно в ней самой происходит изменение специфической конформации, ведущее к разрушению каталитического центра.
Инактивацию можно представить как мо-номолекулярную реакцию, протекающую по схеме:
Eaк→ Eин где Ea и Eин – активная и инактивированная форма фермента соответственно; к – константа скорости перехода активной формы в инактивированную.
На примере многих ферментов микробного, растительного и животного происхождения показано, что кинетика их инактивации – реакция первого порядка. На основании расчетов энергии активации (E акт ) и энтропии ( ∆ S) сделали вывод о том, что процесс связан с глубокими изменениями нативной конформации.
Реакция первого порядка описывается уравнением 1 [7]:
к =
^^Чд — т а-х
где: a – исходная концентрация фермента, которая для мономолекулярных реакций первого порядка выражается в г-моль, в мг белка или азота, %; а – x – концентрация активного фермента в момент времени (τ).
Учитывая, что активность фермента определяется в строго стандартных условиях, уравнение 1 удобно выразить через активность фермента:
к =2^ И (2)
где: [E o ] – исходная активность (во всех опытах [E o ]=100%); [E] – активность фермента в момент времени (τ); К – константа скорости инактивации (удельная скорость инактивации), характеризующая потерю активности в течение часа (к, ч -1). Величину К находили как среднюю арифметическую величину из 5-6 повторностей.
Кислотную инактивацию ферментов препарата «Протепсин» изучали в интервале pH 2,0-7,0 в фосфатно-цитратном буфере с ионной силой 0,05. Во всех случаях использовали одну и ту же концентрацию фермента: 600 мкг/мл для ПА и 3 мкг/мл – для МСА. Среды инкубировали при температуре 30ºС и через определенные промежутки времени (20-30 минут) определяли ПА и МСА в каждой пробе.
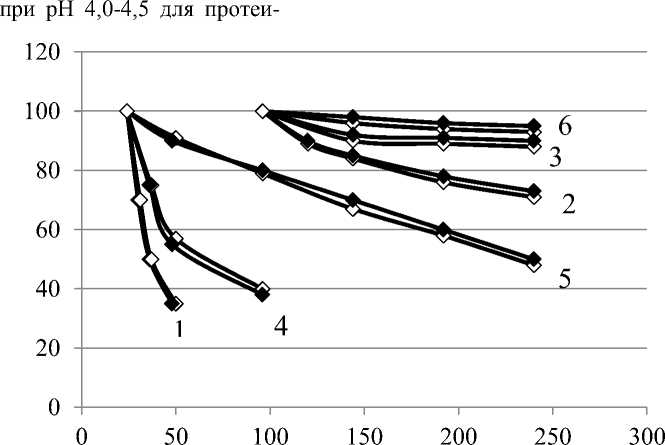
Установлено, что наибольшая стабиль- назы I и при pH 4,5-5,0 – протеиназы II. Ферменты значительно теряли активность в слабокислой и около нейтральной средах.
На примере протеиназы II (рисунок 5) видно, что инактивация по ПА и МСА практически совпадает, что говорит о том, что это один и тот же фермент.
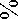
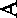
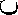

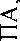
ность отмечается
τ, ч
Рисунок 5. Инактивация протеиназы II препарата «Протепсин» в зависимости от времени при температуре 30ºС: 1 –pH 7,0; 2 – pH 6,0; 3 – pH 4,0; 4 – pH 2,0; 5 – pH 3,0; 6 – pH 5,0; ─◊─ МСА, ─♦─ ПА
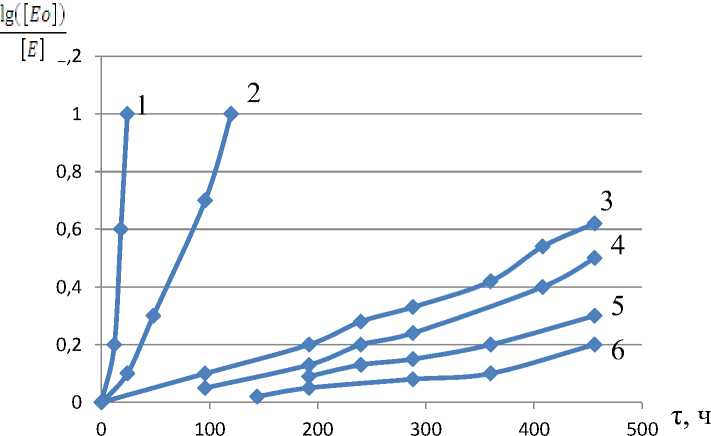
Рисунок 6. Зависимость lg [E a ]/[E] от pH протеиназы II; pH: 1 – 7,0; 2 – 6,0; 3 – 4,0; 4 – 2,0; 5 – 3,0; 6 – 5,0
На рисунке 6 видно, что зависимость lg [E a ]/[E] от pH является характерной для реакции первого порядка. Расчетные данные показывают, что область кислотной инактивации протеиназ препарата «Протепсин» максимально приближен к пепсину животных.
Термическую инактивацию протеиназы II изучали в интервале температур 30-70 ºС в зоне pH 3,0-7,0. Так как температура и концентрация H+- ионов является тесно связанными и не исключающими друг друга факторами интенсивности процесса инактивации, мы предполагали, что термическая инактивация описывается также уравнением первого порядка. Результаты опытов представлены в таблице 2, которая доказывает очевидность нашего предположения.
Т а б л и ц а 2
Термическая инактивация протеиназы II «Протепсина» при pH 5,0
|
τ, ч |
Темпе |
ратура |
||||||
|
40ºС |
50ºС |
|||||||
|
ПА |
МСА |
ПА |
МСА |
|||||
|
E |
К*103, ч-1 |
E |
К*103, ч-1 |
E |
К*103, ч-1 |
E |
К*103, ч-1 |
|
|
0 |
100 |
- |
100 |
- |
100 |
- |
100 |
- |
|
12 |
100 |
- |
100 |
- |
65,1 |
37,0 |
63,2 |
38,1 |
|
24 |
92,3 |
2,33 |
93,4 |
2,48 |
45,2 |
33,6 |
42,3 |
36,0 |
|
48 |
87,8 |
2,54 |
88,0 |
2,54 |
16,8 |
37,7 |
18,1 |
36,3 |
|
96 |
81,5 |
2,19 |
81,0 |
2,23 |
7,6 |
36,8 |
7,0 |
37,1 |
|
120 |
77,2 |
2,36 |
78,3 |
2,23 |
6,7 |
35,7 |
6,5 |
37,7 |
|
144 |
71,4 |
2,28 |
75,6 |
2,16 |
6,5 |
33,1 |
6,0 |
34,0 |
|
168 |
68,2 |
2,30 |
66,3 |
2,50 |
5,9 |
34,1 |
5,9 |
34,1 |
|
192 |
60,9 |
2,54 |
62,2 |
2,56 |
5,2 |
35,9 |
5,4 |
35,9 |
Таким образом, препарат «Протепсин» прослеживает сходность физико-химических и биокаталитических свойств входящих в него ферментов с аналогами из растений, микроорганиз- мов и животных, обеспечивает заданный диапазон активности и стабильности. Следует ожидать хорошие результаты и перспективность применения в технологии мясных и молочных продуктов.
Список литературы Физико-химические и биокаталитические свойства протеолитического комплекса препарата «Протепсин»
- Frost, Sullivan Обзор рынка биотехнологий в России и оценка перспектив его развития//РВК. 2014. 70 с.
- Пономарев В.Я. Оценка генотоксичности новых видов ферментированных мясопродуктов//Ученые записки Казанской государственной академии ветеренарной медицины им. Н.Э. Баумана. 2010. Т. 200. С. 168-172.
- Melim Miguel A.S., Martins-Meyer T.S., da Costa Figueiredo E.V., Paulo Lobo B.W., Dellamora -Ortiz G.M. Enzymes in Bakery//Current and Future Trends. 2013. №1. P. 287-321.
- Antipova L.V., Gorbunkov M.V., Storublevtsev S.A. The experience of enzyme preparation application in the processing of animal origin raw materials//Europen Journal of Natural History. 2015. №2. P. 42-43.
- Сливкин А.И. и др. Изучение физико-химических и кинетических свойств комплексного ферментного биопрепарата//Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. 2015. №2. С. 120-123.
- Лисицын А.Б. и др. Производство мясной продукции на основе биотехнологии: учеб. для вузов. М.: ВНИИМП, 2005. 369 с.
- Келепин Т.В. Основы ферментативной кинетики. М.: Мир, 1990. 350 с.


