Физиолого-биохимические характеристики клеточной культуры Saussurea orgaadayi V. Khan. and Krasnob. при воздействии мета-хлорбензгидрилмочевины
Автор: Головацкая И.Ф., Резниченко А.Е., Лаптев Н.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 3 т.56, 2021 года.
Бесплатный доступ
Мета-хлорбензгидрилмочевина (МХБМ) - индуктор монооксигеназной системы человека, ключевые ферменты которой относятся к суперсемейству цитохромов Р-450 (CYP). В настоящее время отсутствуют сведения о роли МХБМ в регуляции жизнедеятельности растений, однако показано участие CYP в превращении вторичных метаболитов, например флавоноидов (Фл), и большинства фитогормонов. Горькуша оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) - малоизученный вид растений. Ее клеточная культура, в соответствии с нашими данными, 2-кратно увеличивает суммарное количество эндогенных Фл при переходе от экспоненциального роста в стационарную фазу. В настоящем исследовании впервые показаны статистически значимые (p £ 0,05) различия в ответных ростовых реакциях каллусной культуры S. orgaadayi на действие МХБМ в разных концентрациях. Выявлено, что изменение ростового индекса по сырой и сухой массе обусловлено изменением объема и формы клеток, а также частоты встречаемости разных групп клеток. Впервые исследована динамика содержания флавоноидов, сопровождающая изменения роста культуры под влиянием МХБМ. Целью работы было определение роли мета-хлорбензгидрилмочевины в накоплении флавоноидов и изменчивости цитоморфологических характеристик (линейных размеров, объема и формы клеток, частоты встречаемости разных групп клеток, ростового индекса по сырой и сухой биомассе каллуса) каллусной культуры горькуши оргадаай. Каллусную культуру, полученную на основе семядольных эксплантов из стерильных проростков, многократно пассировали на модифицированной агаризованной питательной среде Мурасиге-Скуга (МС) с добавлением сахарозы, витаминов и регуляторов роста (0,8 мг/л 2,4-дихлорфеноксиуксусной кислоты и 0,5 мг/л 6-бензинаминопурина). Культуру выращивали в темноте при температуре 22-24 °С на среде МС с добавлением регуляторов роста и МХБМ (ООО «Синтегал», Россия) в концентрациях 0,01; 0,1; 1; 10; 100 мкМ. В контроле МХБМ не вносили. Продолжительность субкультивирования составила 30 сут, 2/3 растительного материала использовали для определения сырой и сухой биомассы с последующим выделением флавоноидов, 1/3 материала фиксировали в растворе Кларка в течение 2 сут. Для приготовления микропрепаратов каллусную культуру мацерировали в 3 н. растворе соляной кислоты при постоянном встряхивании до получения однородной суспензии клеток. Цитофотометрический анализ осуществляли с помощью световой микроскопии (видеокамера Moticam 2300, «Motic», Испания) с программным обеспечением. Определяли размеры 100 клеток для каждого варианта, оценивали их форму, вычисляли объем. Для расчета ростового индекса (РИ) определяли начальную (начало субкультивирования, М0) и конечную сырую или сухую массу каллусов (на 30-е сут субкультивирования, М30) и выражали в процентах к контролю: РИ = (М30 - М0)/М0. Количественное определение содержания суммы Фл в каллусной культуре осуществляли на основе их комплексообразования с хлоридом алюминия и последующего измерения оптической плотности окрашенных растворов (спектрофотометр UV-1650, «Shimadzu Corp.», Япония). В результате исследований установлено дозозависимое действие МХБМ на рост клеток за счет их деления (при 0,1 мкМ) и растяжения (1-100 мкМ), которое сопровождалось увеличением РИсыр и РИсух каллусной культуры соответственно в 2,1-3,5 и 1,5-2,9 раза (р сыр, отмеченное на среде с 1 мкМ МХБМ, происходило на фоне снижения суммы Фл на 83 %. Препарат МХБМ можно использовать в растительной биотехнологии в качестве модулятора роста клеток каллусных культур за счет снижения содержания ингибирующих рост метаболитов. Для активации клеточного деления наиболее предпочтительна доза 0,1 мкм МХБМ, тогда как для изменения содержания Фл, 2-кратно увеличивающих биомассу культуры, следует применять 100 мкМ МХБМ.
Saussurea orgaadayi, клеточная культура, мета-хлорбензгидрилмочевина, морфогенез, флавоноиды
Короткий адрес: https://sciup.org/142231373
IDR: 142231373 | УДК: 581.19:581.143.6 | DOI: 10.15389/agrobiology.2021.3.602rus
Текст научной статьи Физиолого-биохимические характеристики клеточной культуры Saussurea orgaadayi V. Khan. and Krasnob. при воздействии мета-хлорбензгидрилмочевины
Растения, в отличие от животных и человека, характеризуются способностью синтезировать вторичные метаболиты. Среди последних выделяют многочисленную группу флавоноидов (Фл), в которой изучено более 6900 представителей (1). Эти метаболиты синтезируются из п-кумароил-КоА последовательным воздействием различных ферментов, которые, как полагают, образуют слабо связанные с мембранами (например, с эндоплазматическим ретикулумом) упорядоченные макромолекулярные белковые комплексы — флавоноидные метаболоны (1, 2). При синтезе специфических Фл во время роста растений и в реакциях на стрессоры важную роль играет определенная локализация и продолжительность взаимодействий между специфическими белками (1, 3). Фл выполняют следующие физиологические функции: защиту от листогрызущих насекомых, патогенных микроорганизмов, ультрафиолетового излучения и света высокой интенсивности, привлечение насекомых-опылителей, ингибирование образования активных форм кислорода (АФК), участие в прорастании пыльцы, биологическую коммуникацию в ризосфере (нодуляция), повышение эффективности извлечения питательных веществ во время старения растения и его органов (3-6). Они способны к хелатированию металлов, что может служить механизмом in vivo для снижения токсичности (3). Кроме того, Фл выступают в качестве регуляторов развития, участвующих в изменении транспорта фитогормона индолил-3-уксусной кислоты (ИУК) и его метаболизма (7).
Так как Фл не синтезируются в организме животных и человека, эти соединения служат незаменимыми пищевыми компонентами. Природные Фл имеют низкую токсичность, поэтому их используют для профилактики и лечения различных патологий (8). Пищевые Фл с антиоксидантной активностью снижают частоту возникновения атеросклероза, сердечно-сосудистых заболеваний, диабета, тромбоза, воспаления при артрите, нейроде-генеративных заболеваний (болезни Альцгеймера и Паркинсона), ожирения, гиперлипидемии и гипертонии (4). Кверцетин проявляет антипроли-феративный эффект в отношении линий раковых клеток (9). Фл используют как сырье для промышленного производства фармакологических и косметических субстанций, в связи с чем возникает вопрос о контроле содержания Фл в растениях.
В качестве индукторов биосинтеза Фл рассматриваются не только негативные биотические и абиотические воздействия, но и эндогенные факторы, например гормональный баланс клеток, связанный с возрастом растения, его органов и клеточных культур (5, 10-12). Среди ферментов, участвующих в модификации Фл, выделяют цитохром-Р-450-зависимые монооксигеназы (CYP) — компоненты флавоноидных метаболонов (1, 2, 13). Индуктором цитохром-Р-450-зависимой монооксигеназной системы человека может служить мета-хлорбензгидрилмочевина (МХБМ) (14), однако сведения о роли МХБМ в регуляции жизнедеятельности растений отсутствуют.
Изучение молекулярных механизмов действия веществ в растительном организме затруднено вследствие присутствия многочисленных структурных элементов на клеточном, тканевом и органном уровнях, а также большого числа происходящих в них метаболических процессов. В связи с этим наиболее удачным модельным объектом могут служить гетеротрофные клеточные культуры, упрощенные по строению и не проявляющие фотосинтетической активности.
В настоящем исследовании впервые показаны статистически зна- чимые (p < 0,05) различия в ответных ростовых реакциях каллусной культуры горькуши оргадаай (Saussurea orgaadayi V. Khan. and Krasnob.) на действие МХБМ в разных концентрациях. Выявлено, что изменение ростового индекса по сырой и сухой массе обусловлено изменением объема и формы клеток, а также частоты встречаемости разных групп клеток. Впервые исследована динамика содержания флавоноидов, сопровождающая изменения роста культуры под влиянием МХБМ.
Целью работы было определение роли мета-хлорбензгидрилмоче-вины в накоплении флавоноидов и изменчивости цитоморфологических характеристик (линейных размеров, объема и формы клеток, частоты встречаемости разных групп клеток, ростового индекса по сырой и сухой биомассе каллуса) каллусной культуры горькуши оргадаай.
Методика. Производное мочевины — мета-хлорбензгидрилмочевина (галодиф, Galodif, CAS: 124057-07-4) было синтезировано в Томском политехническом университете (15), правообладатели препарата ООО «Синте-гал» и ООО «Наука, Техника, Медицина» (Россия). В работе использовали разведения матричного 100 мМ спиртового раствора МХБМ в концентрациях 0,01; 0,1; 1; 10; 100 мкМ.
Каллусную культуру многолетнего лекарственного растения горькуши оргадаай S. orgaadayi , полученную на основе семядольных эксплантов из стерильных проростков, многократно пассировали на модифицированной агаризованной питательной среде Мурасиге-Скуга (МС) с добавлением сахарозы, витаминов и регуляторов роста 0,8 мг/л 2,4-Д (2,4-дихлорфенок-сиуксусная кислота) и 0,5 мг/л 6-БАП (6-бензинаминопурин) (16). Культуру выращивали в темноте при температуре 22-24 ° С на среде МС с добавлением регуляторов роста и МХБМ, в контроле МХБМ не вносили.
Продолжительность субкультивирования составила 30 сут, 2/ з растительного материала использовали для определения сырой и сухой биомассы с последующим выделением флавоноидов, 1 / 3 материала фиксировали в растворе Кларка (96 % этиловый спирт:ледяная уксусная кислота в соотношении 3:1) в течение 2 сут. Затем материал отмывали от фиксатора 96 % раствором этилового спирта (3 раза по 30 мин) до исчезновения запаха уксусной кислоты и хранили в 70 % растворе этанола при 4 ° С (17). Для приготовления микропрепаратов каллусную культуру мацерировали в 3 н. растворе соляной кислоты при постоянном встряхивании до получения однородной суспензии клеток.
Цитофотометрический анализ осуществляли с помощью световой микроскопии (видеокамера Moticam 2300, «Motic», Испания) с программным обеспечением. Для каждого варианта измеряли размеры (L — длина, D — ширина) 100 клеток. По соотношению L/D оценивали форму клеток: 1,0 < L/D < 1,14 — округлые, 1,15 < L/D < 1,94 — овальные, L/D > 1,95 — вытянутые. Объем клеток вычисляли по формуле Ю.А. Цельникер (18) с учетом рассчитанного автором поправочного коэффициента (k), который зависит от L/D. При L/D > 2,5 для определения объема клеток (V, мкм3) применяли формулу цилиндра V = n (D/2)2Lk, при L/D < 2,5 — формулу эллипсоида вращения V = 4/3 n L/2(D/2)2. Для расчета ростового индекса (РИ) определяли начальную (начало субкультивирования, М е ) и конечную сырую или сухую массу каллусов (на 30-е сут субкультивирования, М 30 ) и выражали в процентах к контролю: РИ = (М 30 - М с )/М 0 .
Количественное определение содержания суммы Фл в каллусной культуре S. orgaadayi осуществляли на основе их комплексообразования с хлоридом алюминия и последующего измерения оптической плотности окрашенных растворов (спектрофотометр UV-1650, «Shimadzu Corp.», Япония) (19). Навеску сухого растительного сырья (1 г) трижды (по 60 мин) экстрагировали 70 % этиловым спиртом на кипящей водяной бане, экстракты объединяли. Аликвоту объединенного растительного экстракта выдерживали в течение 40 мин в присутствии хлористого алюминия и уксусной кислоты. Раствор сравнения, не содержащий хлористого алюминия, готовили для каждой пробы отдельно.
После взаимодействия веществ определяли оптическую плотность опытного раствора и стандартного раствора рутина при X = 415 нм. Вычисляли суммарное содержание Фл в пересчете на рутин и абсолютно сухое сырье (Х фл ):
Х фл = OD x • K x • т рут • 100 • 100 • СП рут - 1 • К рут - 1 • т х - 1 • (100 - W) - 1, где ОП х — оптическая плотность исследуемого раствора; ОП рут — оптическая плотность раствора рутина; т х — сырья масса, г; т рут — масса рутина, г; K x — коэффициент разбавления исследуемого раствора (1250); К рут — коэффициент разбавления раствора рутина (2500); W — потеря в массе при высушивании сырья, %.
При статистической обработке результатов в программе IBM SPSS Statistics («IBM Corporation», США) для Windows использовали параметрический t -критерий Стьюдента и непараметрический U-критерий Манна-Уитни для парного сравнения параметров групп. На рисунках представлены средние арифметические значения ( М) для ростовых ( n = 100) и биохимических ( n = 5) параметров с двухсторонними доверительными интервалами ( М ±1,96 SEM). Различия между значениями, отмеченные разными буквами, статистически значимы при р < 0,05.
Результаты. В проведенных экспериментах изучали зависимость морфогенеза и аккумуляции Фл у медленнорастущей каллусной культуры S. orgaadayi, полученной на основе семядолей, от концентрации МХБМ в питательной среде (рис. 1). На выбор культуры повлияли наши предварительные исследования (20), показавшие 3-кратное превышение содержания Фл (0,026±0,006 % к сухой массе) на 25-е сут в медленнорастущей культуре по сравнению с активно ростков S. orgaadayi.
растущей, полученной на основе гипокотилей про-
Б

Рис. 1. Формула мета-хлорбензгидрилмочевины (А) и каллусная культура клеток, полученная на основе семядольных эксплантов проростков горькуши оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) (Б) .
А
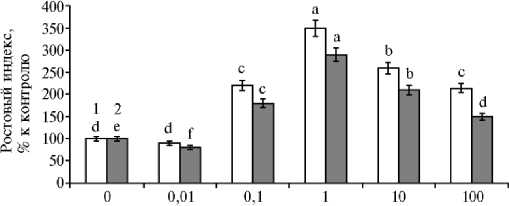
При выборе времени субкультивирования каллуса руководствовались данными о приросте сырой массы у контрольной культуры. Рост каллус- ной культуры описывался S-образной кривой с несколькими фазами ростового цикла: лаг-фазой, или периодом медленного роста, в течение первых 10 сут, логарифмической фазой с длительностью 15 сут, 5-суточной фазой замедления и, начиная с 30-х сут, стационарной фазой (данные не приведены). На 25-е сут субкультивирования РИсыр культуры в контроле составил 2,32±0,70. Эксперимент проводили до 30-х сут с целью перехода культуры в стационарную фазу роста и увеличения выхода вторичных метаболитов Фл, что согласуется с данными других авторов (12).
Добавление МХБМ в питательную среду в концентрациях 0,1100 мкМ увеличило прирост биомассы каллусной культуры. РИ сыр и РИ сух увеличивались соответственно в 2,1-3,5 и 1,5-2,9 раза (р < 0,05) относительно контроля (рис. 2). Действие 0,01 мкМ МХБМ не изменило РИ сыр , но снизило РИ сух на 20 % (р < 0,05). Наибольшие значения РИ сыр и РИ сух были отмечены при использовании 1 мкМ МХБМ. При этом в опыте каллусная культура отличалась от контрольной более светлой и рыхлой консистенцией.
Концентрация мета-хлорбензгидрилмочевины, мкМ
Рис. 2. Относительный прирост сырой (1) и сухой (2) биомассы каллусной культуры горькуши оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) в зависимости от концентрации мета-хлор-бензгидрилмочевины. Различия между значениями каждого показателя, отмеченные разными буквами, статистически значимы при р < 0,05 ( М ±1,96 SEM).
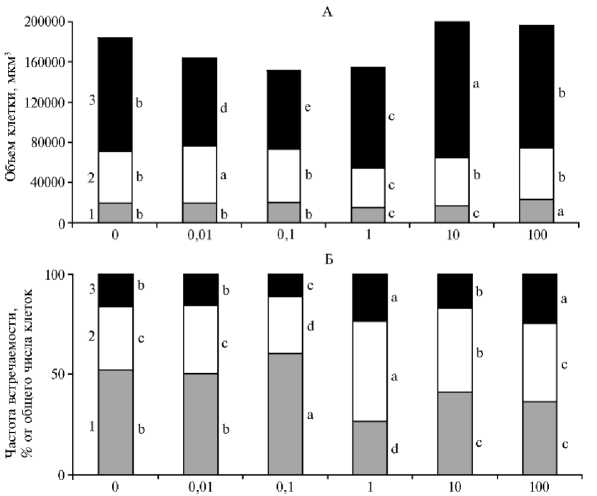
Цитологический анализ выявил морфологическую гетерогенность популяции клеток культуры S. or-gaadayi (рис. 3, 4). Мы выделили группы клеток, которые различались по форме (округлые, овальные и вытянутые) и размеру (мелкие, средние и крупные). Мелкие клетки (9,0-35,7 тыс. мкм3) мы рассматривали как ме ристематические делящиеся, средние (35,75-75,94 тыс. мкм3) — как растущие, крупные (76,0323,2 тыс. мкм3) — как завершившие рост.
Контрольная каллусная культура на 30-е сут характеризовалась боль шей частотой встречаемости мелких клеток, чем средних и крупных соответственно в 1,6 и 3,4 раза (рис. 3, Б). Средний объем мелких клеток составлял 20,2±2,3 тыс. мкм3, тогда как средних и крупных — соответственно 51,5±1,4 и 112,1±2,6 тыс. мкм3 (рис. 3, А).
Результатом действия МХБМ на каллусную культуру было изменение роста клеток. При концентрации 0,1 мкМ количество мелких меристематических клеток увеличивалось на 16 % относительно контроля, что могло свидетельствовать об усилении клеточного деления (см. рис. 3, Б). Одновременно усредненный объем клеток крупных размеров уменьшался на 31 % по сравнению с контролем (см. рис. 3, А), что указывало на торможение процессов растяжения клеток. С повышением концентрации МХБМ увеличивалась частота встречаемости клеток среднего (на 55 и 30 % соответственно при 1 и 10 мкМ) и крупного (на 50 и 57 %, р < 0,05 при 1 и 100 мкМ) размеров (см. рис. 3, Б) и увеличивался объем крупных (на 61 %, р < 0,05 при 10 мкМ) и мелких (на 18 %, р < 0,05 при 100 мкМ) клеток относительно контроля. На этом фоне уменьшалось количество мелких клеток (на 49, 20 и 30 %, р < 0,05 соответственно при 1, 10 и 100 мкМ) и их объем (на 22 и 17 %, р < 0,05 при 1 и 10 мкМ) (см. рис. 3).
Концентрация мета-хлорбензгидрилмочевины, мкМ
Рис. 3. Объем клетки (А) и частота встречаемости клеток разного размера (Б) в каллусной культуре горькуши оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) в зависимости от концентрации мета-хлорбензгидрилмочевины: 1 — мелкие, 2 — средние, 3 — крупные клетки. Различия между значениями каждого показателя, отмеченные разными буквами, статистически значимы при р < 0,05.
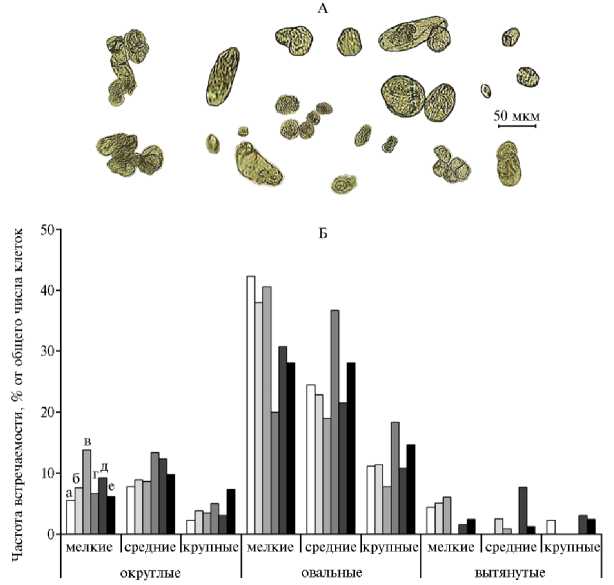
Рис. 4. Форма (А) и частота встречаемости (Б) клеток разной формы и размеров в каллусной культуре горькуши оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) в зависимости от концентрации мета-хлорбензгидрилмочевины: а — 0 (контроль); б — 0,01 мкМ; в — 0,1 мкМ; г — 1 мкМ; д — 10 мкМ; е — 100 мкМ.
Под действием МХБМ увеличивалась доля округлых клеток всех размеров (рис. 4, Б). Наибольшие изменения наблюдали в частоте встречаемости мелких клеток (повышение в 2,5 раза, р < 0,05) при концентрации 0,1 мкМ МХБМ, средних и крупных клеток (рост соответственно в 1,7 и 2,3 раза, р < 0,05) — при 1 мкМ МХБМ. Наибольшая (увеличенная в 3,3 раза, р < 0,05) частота встречаемости крупных клеток округлой формы была отмечена при 100 мкМ МХБМ.
Изменение ростовых процессов в культуре могло свидетельствовать об изменении количества эндогенных веществ, осуществляющих регуляцию роста. Среди последних называют Фл, модулирующие гомеостаз раститель ных гормонов ауксинов (7). Мы установили, что суммарное содержание
Фл у контрольной культуры в процессе субкультивирования на стационарной стадии (30-е сут) составило 0,049±0,008 % к сухой массе, что на 50 % (р < 0,05) больше, чем на 25-е сут в точке перегиба логарифмического участка кривой роста. Эти данные свидетельствуют о замедлении роста на фоне повышения содержания эндогенных Фл.
Концентрация мета-хлорбензгидрилмочевины. мкМ
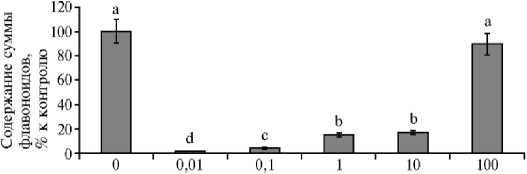
Рис. 5. Содержание суммы флавоноидов в каллусной культуре горькуши оргадаай ( Saussurea orgaadayi V. Khan. and Krasnob.) в зависимости от концентрации мета-хлорбензгидрилмочевины. Различия между значениями, отмеченные разными буквами, статистически значимы при р < 0,05 ( М ±1,96 SEM).
При действии МХБМ происходило изменение суммарного содержания Фл по сравнению с контролем (рис. 5). Впервые показано, что уменьшение (на 80-95 %) суммарного количества эндогенных Фл под действием МХБМ сопровождалось активацией ростовых процессов в раститель ных клетках S. orgaadayi in vitro. Содержание суммы Фл максимально снижалось при низких концентрациях МХБМ и сохранялось на уровне контроля при 100 мкМ МХБМ. Максимальный (в 3,5 раза) прирост биомассы, отмеченный при 1 мкМ МХБМ, происходил на фоне снижения суммы Фл на 83 %.
Таким образом, в нашем исследовании было показано влияние МХБМ на рост каллусной культуры S. orgaadayi, что, вероятно, обусловлено его действием на растяжение и деление клеток. Дозозависимые изменения в накоплении биомассы культуры (см. рис. 2) сопровождались изменением частоты встречаемости клеток разных размеров и формы (см. рис. 3, 4). Действие МХБМ в самой низкой концентрации (0,01 мкМ) снижало РИсух, что могло определяться снижением объема крупных клеток на 23 % при равном контролю соотношении ранжированных по размеру групп клеток. Наибольшие РИсыр и РИсух культуры, отмеченные при действии 1 мкМ МХБМ, сопровождались повышенной частотой встречаемости средних и крупных клеток и снижением доли мелких клеток (см. рис. 3, Б). Концентрация 0,1 мкМ МХБМ оказывала меньший эффект, чем 1 мкМ МХБМ, что проявлялось в повышении частоты встречаемости мелких клеток и, соответственно, в снижении доли средних и крупных.
Наиболее активными концентрациями МХБМ в регуляции роста каллусной культуры горькуши оргадаай были 0,1-10 мкМ, под действием которых увеличивалось число меристематических округлых мелких клеток.
Ускорение роста сопровождалось изменением вторичного метаболизма, что выразилось в снижении суммарного количества Фл на 80-95 % (р < 0,05) относительно контроля (см. рис. 5). Действие МХБМ в высокой концентрации 100 мкМ достоверно увеличивало прирост биомассы культуры, существенно не меняя содержание Фл. Дозозависимая динамика роста и содержания Фл под действием МХБМ, вероятно, может свидетельствовать об изменении функционирования ферментов, участвующих в метаболизме Фл. На модификацию Фл в клеточной культуре указывают данные других авторов (21), изучавших комплексное воздействие экзогенных факторов (кадмия и глифосата) на суммарное содержание фенольных соединений, которое возрастало на фоне снижения количества фенилпропаноидов и флавоноидов.
На рост каллусной культуры могли оказывать действие Фл с разными свойствами. Наряду с антиоксидантными свойствами катехинов и кверцетина некоторые Фл в высоких дозах могут проявлять прооксидант-ную активность и повреждать клетки (8).
Показано влияние Фл на регуляцию клеточного цикла (22). В качестве возможных механизмов называют непосредственное взаимодействие Фл (например, кверцетина) с протеинкиназами Raf и MEK, обусловливающими проведение митотических сигналов, или их связывание с рецептором AhR и образование комплекса с ARNT, стимулирующего транскрипцию ингибитора клеточного цикла CDKNB1 (22, 23).
Кроме того, возможно и опосредованное действие Фл на рост, связанное с изменением транспорта ауксинов и их метаболизма. Известно, что пространственно-временное распределение ауксинов, обусловленное механизмами полярного транспорта, играет решающую роль в их физиологических эффектах (24). На примере мутантов tt4 показано, что дефицит Фл усиливает поток ИУК (25). Считается, что флавонолы непосредственно модулируют транспорт ИУК — процесс, который снижается в сверхаккумули-рующем кемпферол мутанте tt7 , дефектном по F39H (25). Негликозилиро-ванные кемпферол и кверцетин конкурируют с ингибитором транспорта ауксина l-N-нафтилфталаминовой кислотой за высокоаффинный сайт связывания комплекса, содержащего белки PGP1, PGP2 и MDR1/PGP19, которые принадлежат к АТФ-связывающим кассетным переносчикам. В то же время Фл выступают в качестве регуляторов ИУК-оксидазы, участвующей в деградации ИУК: Фл с о-гидроксилами в ядре В (кверцетин, мирицетин, лю-теолин) ингибируют активность фермента, тогда как Фл с п-гидроксилами (апигенин, нарингенин, нарингин) стимулируют его (26). В итоге первая группа Фл стимулирует рост, а вторая — ингибирует его.
В то же время неотъемлемым этапом нормального роста и развития растений считается окисление Фл, которое связано с деятельностью растительных пероксидаз или других ферментов (27, 28). В результате окисления Фл способны проявлять прооксидантное действие, которое выражается в повреждении биологических структур и общем снижении жизнеспособности клеток организма (28).
Исследуемый нами препарат МХБМ может регулировать активность гемсодержащих ферментов семейства цитохромов P-450 (CYP), принадлежащих к группе монооксигеназ у человека. Ферменты этой группы обнаружены во всех царствах и катализируют разнообразные химические реакции (13, 25). Изменения роста клеток культуры S. orgaadayi под действием МХБМ, сопровождавшиеся изменением содержания Фл, вероятно, также можно объяснить регуляцией функционирования CYP, участвующих в метаболизме Фл (2). Показано, что CYP82D кодирует флавон-6-гидрокси-лазу и 7-деметилазу и отвечает за биосинтез Фл в сладком базилике, тогда как CYP75 регулирует экспрессию флавоноид-3‘-гидроксилазы и флаво-ноид-3‘,5‘-гидроксилазы, которые участвуют в синтезе большинства антоцианов, в красном винограде (13). CYP93G1, ближайший гомолог CYP93G2 в рисе, — это флавон-синтаза II (FNSII), которая катализирует прямое превращение флаванонов в флавоны (30).
Другими эндогенными факторами роста клеток культуры горькуши могли выступать фитогормоны, в регуляции метаболизма которых также участвуют CYP. Например, CYP79B2/B3 ответствен за превращение L-триптофана (L-Trp) в индол-3-ацетальдоксим в альтернативном L-Trp-зависи-мом пути биосинтеза ауксинов (13), цитокинин-гидроксилазы CYP735A1 и CYP735A2 катализируют биосинтез транс-зеатинов, а CYP72C1 инактивирует брассиностероиды у Arabidopsis thaliana (13, 25).
Возможны и мембранные механизмы действия МХБМ на растительные клетки по аналогии с клетками человека. Такие механизмы могут быть связаны с блокадой быстрых натриевых каналов нейронов, ограничивающей распространение электрического потенциала. В результате МХБМ за счет регулирования водно-электролитного баланса стабилизирует концентрационный градиент ионов, а также препятствует изменению мембранной проницаемости и трансмембранного потенциала клетки. Наряду с этим МХБМ усиливает процессы микросомального окисления, проявляя детоксицирующее действие в клетках.
В соответствии с полученными нами данными, высокое содержание Фл на 30-е сут субкультивирования обусловливало завершение активного роста клеток каллуса у S. orgaadayi в контрольном варианте, что согласуется с данными по увеличению аккумуляции Фл на стационарной стадии клеточной культуры (11, 12) и в завершивших рост листьях растений Lactuca sativa L. (5). Также показано (12, 29), что в процессе длительного культивирования клеток суспензионной культуры повышается окислительный статус (накопление АФК) и происходит активация антиоксидантных ферментов и вторичных метаболитов. В связи с этим следует ожидать, что действие МХБМ увеличивает биомассу культуры, вероятно, за счет снижения количества Фл и, соответственно, увеличения продолжительности ростовой активности клеток.
На основе наших результатов и данных других авторов (2, 12, 25, 2830), полученных при исследовании растений и их клеточных культур, можно предполагать влияние МХБМ на активность ферментов, регулирующих содержание Фл и фитогормонов, а также ферментативных антиоксидантов.
Итак, используемая в эксперименте медленнорастущая каллусная культура горькуши оргаадай, полученная из семядольного экспланта, продуцировала флавоноиды. Введение экзогенной мета-хлорбензгидрилмоче-вины (МХБМ) в питательную среду в концентрации от 0,01 до 10 мкМ обусловливало снижение содержания вторичных метаболитов в каллусной культуре. Уменьшение суммарного содержания флавоноидов приводило к активации ростовых процессов. Происходило накопление биомассы каллуса и повышение ростового индекса культуры с максимумом при 1 мкМ МХБМ. Дальнейшее увеличение концентрации МХБМ снижало темпы прироста биомассы. Рост биомассы культуры сопровождался изменением частоты встречаемости разных типов клеток и размеров. При действии 0,1 мкм МХБМ увеличивалось число мелких меристематических клеток, а начиная с 1 мкМ МХБМ, возрастала частота встречаемости округлых и овальных клеток среднего и крупного размера при уменьшении встречаемости мелких клеток. При этом клетки достигали наибольших размеров при концентрации 10 мкМ, а максимальное число крупных клеток отмечали при 100 мкМ МХБМ. Такая динамика указывала на увеличение скорости деления клеток при низких концентрациях и растяжения клеток — при средних и высоких концентрациях МХБМ. Полученные данные свидетельствуют о дозозависимом действии МХБМ на рост клеток через изменение содержания флавоноидов.
Список литературы Физиолого-биохимические характеристики клеточной культуры Saussurea orgaadayi V. Khan. and Krasnob. при воздействии мета-хлорбензгидрилмочевины
- Nakayama T., Takahashi S., Waki T. Formation of flavonoid metabolons: functional significance of protein-protein interactions and impact on flavonoid chemodiversity. Frontiers in Plant Science, 2019, 10: 821 (doi: 10.3389/fpls.2019.00821).
- Ayabe S., Akashi T. Cytochrome P450s in flavonoid metabolism. Phytochemistry Reviews, 2006, 5: 271-282 (doi: 10.1007/s11101-006-9007-3).
- Falcone-Ferreyra M.L., Rius S.P., Casati P. Flavonoids: biosynthesis, biological functions, and biotechnological applications. Frontiers in Plant Science, 2012, 3: 222 (doi: 10.3389/fpls.2012.00222).
- Mouradov A., Spangenberg G. Flavonoids: a metabolic network mediating plants adaptation to their real estate. Frontiers in Plant Science, 2014, 5: 620 (doi: 10.3389/fpls.2014.00620).
- Головацкая И.Ф., Бойко Е.В., Видершпан А.Н., Лаптев Н.И. Возрастные морфофизиологические и биохимические изменения у растений Lactuca sativa L. под влиянием селена и света разной интенсивности. Сельскохозяйственная биология, 2018, 53(5): 1025-1036 (doi: 10.15389/agrobiology.2018.5.1025rus).
- Kumar V., Suman U., Rubal, Yadav S.K. Flavonoid secondary metabolite: biosynthesis and role in growth and development in plants. In: Recent trends and techniques in plant metabolic engineering /S. Yadav, V. Kumar, S. Singh (eds.). Springer, Singapore, 2018: 19-45 (doi: 10.1007/978-981-13-2251-8_2).
- Kuhn B.M., Errafi S., Bucher R., Dobrev P., Geisler M., Bigler L., Zažímalová E., Ringli C. 7-rhamnosylated flavonols modulate homeostasis of the plant hormone auxin and affect plant development. The Journal of Biological Chemistry, 2016, 291(10): 5385-5395 (doi: 10.1074/jbc.M115.701565).
- Белицкий Г.А., Кирсанов К.И., Лесовая Е.А., Якубовская М.Г. Механизмы антиканцерогенного действия флавоноидов. Успехи молекулярной онкологии, 2014, 1(1): 56-68.
- Ionkova I. Optimization of flavonoid production in cell cultures of Astragalus missouriensis Nutt. (Fabaceae). Pharmacognosy Magazine, 2009, 5(18): 92-97.
- Indu S., Vijaya L., Meeta B., Jossy V., Naresh C. Production of flavonoids in callus culture of Anthocephalus indicus A. Rich. Asian Journal of Plant Sciences, 2013, 12(1): 40-45 (doi: 10.3923/ajps.2013.40.45).
- Березина Е.В., Брилкина А.А., Щурова А.В., Веселов А.П. Накопление биомассы и фенольных соединений каллусами Oxycoccus palustris Pers. и O. macrocarpus (Ait.) Pers. в присутствии разных цитокининов. Физиология растений, 2019, 66(1): 35-45 (doi: 10.1134/S0015330318050032).
- Wang J., Qian J., Yao L., Lu Y. Enhanced production of flavonoids by methyl jasmonate elicitation in cell suspension culture of Hypericum perforatum. Bioresources and Bioprocessing, 2015, 2: 5 (doi: 10.1186/s40643-014-0033-5).
- Xu J., Wang X., Guo W. The cytochrome P450 superfamily: key players in plant development and defense. Journal of Integrative Agriculture, 2015, 14(9): 1673-1686 (doi: 10.1016/s2095-3119(14)60980-1).
- Новожеева Т.П., Чурсина И.Э., Новожеева А.В., Саратиков А.С. Влияние бензонала, галонала и галодифа на систему микросомального окисления гепатоцитов в онтогенезе. Химико-фармацевтический журнал, 2004, 38(2): 7-9.
- Штрыкова В.В., Куксёнок В.Ю., Филимонов В.Д., Галанов А.И. Способ получения мета-хлорбензгидрилмочевины (галодифа) с использованием магнитных наночастиц, модифицированных сульфогруппами. А.с. 2569684 (РФ). МПК С07С 275/24, С07С 273/18. ФГАО УВО ТПУ (РФ). № 2014154126/06. Заявл. 29.12.2014. Опубл. 27.11.2015. Бюл. № 33.
- Карначук Р.А., Лихачева А.В. Питательная среда для культивирования клеточной культуры SaussureaorgaadayiV. Khan. EtKrasnov. А.с. 2428472 (РФ). МПК C12N 005/02, C12N 005/04. ГОУ ВПО ТГУ (РФ). № 2010118803.Заявл. 05.11.2010.Опубл. 09.10. 2011. Бюл. № 25.
- Барыкина Р.П., Веселова Т.Д., Девятов А.Г, Джалилова X.X., Ильина Г.М., Чубатова Н.В. Основы микротехнических исследований в ботанике. Справочное руководство. М., 2000.
- Цельникер Ю.Л. Физиологические основы теневыносливости древесных растений. М., 1978.
- Государственная фармакопея СССР: Вып. 2. Общие методы анализа. Лекарственное растительное сырье. 11-е изд. М., 1989.
- Головацкая И.Ф., Бойко Е.В., Резниченко А.Е., Плюснин И.Н. Мелатонин и селен регулируют рост и окислительный статус клеточных культур Saussurea orgaadayi in vitro, полученных от разных эксплантов. Физиология растений, 2020, 67(6): 625-635 (doi: 10.31857/S001533032005005X).
- Гончарук Е.А., Николаева Т.Н., Назаренко Л.В., Калашникова Е.А., Загоскина Н.В. Ответная реакция культивируемых in vitro клеток Linumgrandiflorum Desf. на действие кадмия и глифосата. Сельскохозяйственная биология, 2018, 53(5): 938-946 (doi: 10.15389/agrobiology.2018.5.938rus).
- Galati G., Sabzevari O., Wilson J.X., O'Brien P.J. Prooxidant activity and cellular effects of the phenoxyl radicals of dietary flavonoids and other polyphenolics. Toxicology, 2002, 177(1): 91-104 (doi: 10.1016/s0300-483x(02)00198-1).
- Brunetti C., Di Ferdinando M., Fini A., Pollastri S., Tattini M. Flavonoids as antioxidants and developmental regulators: relative significance in plants and humans. International Journal of Molecular Sciences, 2013, 14(2): 3540-3555 (doi: 10.3390/ijms14023540).
- Pařízková B., Pernisová M., Novák O. What has been seen cannot be unseen-detecting auxin in vivo. International Journal of Molecular Sciences, 2017, 18(12): 2736 (doi: 10.3390/ijms18122736).
- Sotelo-Silveira M., Cucinotta M., Chauvin A.-L., Chávez Montes R.A., Colombo L., Marsch-Martínez N., de Folter S. Cytochrome P450 CYP78A9 is involved in Arabidopsis reproductive development. Plant Physiology, 2013, 162(2): 779-799 (doi: 10.1104/pp.113.218214).
- Макаренко О.А., Левицкий А.П. Физиологические функции флавоноидов в растениях. Физиология и биохимия культурных растений, 2013, 45(2): 108-112.
- Pourcel L., Routaboul J., Cheynier V., Lepiniec L., Debeaujon I. Flavonoid oxidation in plants: from biochemical properties to physiological functions. Trends in Plant Science, 2007, 12(1): 29-36 (doi: 10.1016/j.tplants.2006.11.006).
- Червяковский Е.М., Курченко В.П., Костюк В.А. Роль флавоноидов в биологических реакциях с переносом электронов. Труды Белорусского Государственного Университета. Серия: Физиологические, биохимические и молекулярные основы функционирования биосистем, 2009, 1: 9-26.
- Kim Y.-H., Kim Y., Cho E., Kwak S., Kwon S., Bae J., Lee B., Meen B., Huh G.-H. Alterations in intracellular and extracellular activities of antioxidant enzymes during suspension culture of sweetpotato. Phytochemistry, 2004, 65(17): 2471-2476 (doi: 10.1016/j.phytochem.2004.08.001).
- Lam P.Y., Zhu F.-Y., Chan W.L., Liu H., Lo C. Cytochrome P450 93G1 is a flavone synthase II that channels flavanones to the biosynthesis of tricin o-linked conjugates in rice. Physiology, 2014, 165(3): 1315-1327 (doi: 10.1104/pp.114.239723).


