Фотоиндуцированная перезарядка примесных ионов в ультрадисперсном оксиде магния
Автор: Лютоев В.П.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Геолого-минералогические науки
Статья в выпуске: 1 (9), 2012 года.
Бесплатный доступ
Методом электронного парамагнитного резонанса (ЭПР) произведено изучение влияния естественного и искусственного оптического излучения на парамаг- нитные центры ультрадисперсных порошков оксида магния, процессов фото- и термоактивированной перезарядки примесных ионов переходных металлов группы железа. Выявленный фотостимулированный переход Mn3++ e- ?_ Mn2+ может быть положен в основу интегрирующего датчика естественных и тех- ногенных потоков УФ-излучения с ЭПР-регистрацией эффекта.
Ультрадисперсный оксид магния, аэрозоли, элементы-примеси группы железа, эпр, фотоиндуцированные парамагнитные центры
Короткий адрес: https://sciup.org/14992512
IDR: 14992512 | УДК: 549.516.11:549.746.52:[548.4:
Текст научной статьи Фотоиндуцированная перезарядка примесных ионов в ультрадисперсном оксиде магния
Порошки и аэрозоли ультрадисперсных оксидов щелочноземельных и переходных металлов аэрозольных частиц являются эффективными адсорбентами и субстратами сенсибилизации различных химических реакций в природе и технологических процессах. Они рассматриваются в качестве перспективных материалов фиксации солнечной энергии путем фотокаталитических химических реакций на их поверхности [1]. С экологической точки зрения фотокатализ на поверхности аэрозольных частиц в тропосфере может вносить существенный вклад в глобальную химию атмосферы [2]. Необходимым условием фотокаталитической реакции является фундаментальное поглощение квантов оптического излучения, сопровождающееся формированием подвижных носителей заряда, их миграцией и формированием на поверхности оксида короткоживущих высокореакционных молекулярных группировок, которые вступают в химическую реакцию с адсорбированными молекулами. Экспериментально процессы фотосорбции наиболее детально изучены для щелочноземельных оксидов, особенно оксида магния [2]. Соединение кристаллизуется в кубической структуре типа NaCl (про- странственная группа Fm3m), его природная форма известна как периклаз. Оксид магния относится к диэлектрикам с краем собственного поглощения в области вакуумного ультрафиолета с λ < 180 нм [3], поэтому он не должен реагировать на солнечное излучение (так как излучение с длинами волн короче 300 нм поглощается в верхних слоях атмосферы). Однако эффективное поглощение света в области мягкого ультрафиолета в ультрадисперсном оксиде магния может происходить на энергетических уровнях поверхностных и примесных состояний.
Ультрадисперсный оксид магния был использован нами для сорбции и диагностики методом ЭПР наноразмерных аэрозолей в приземном слое атмосферы [4]. После длительной выдержки порошков на солнечном свету с регулируемой вентиляцией воздушного потока, наряду с появлением в спектрах ЭПР сигналов осажденных примесных фаз, были отмечены изменения интенсивностей линий изоморфных примесных ионов Mn2+, Fe2+ и Cr3+ в структуре оксида магния. Цель данной работы – изучение влияния солнечного и искусственного оптического излучения на парамагнитные центры ультрадисперсных порошков оксида магния, процессов фото- и термоактивированной перезарядки примесных ионов переходных ионов.
Методы исследований
В качестве объекта исследований выбран ЧДА порошок MgO. Известно, что поверхность ультрадисперсного оксида магния после длительного контакта с воздухом покрывается адсорбированной водой, карбонатными и, возможно, нитратными соединениями [2]. На рис. 1 представлена дериватограмма порошка MgO. Общие потери веса после прокаливания до 1000 ° С составили около 40 %. Эндоэффекты при температурах ниже 600 ° С типичны для гидромагнезита Mg5(CO3)4(OH)2 - 4H2O [5] и отражают процессы дегидратации (до 350 ° С) и декарбонатизации соединения (350-600 ° С). Экзоэффект при 515 ° С соответствует кристаллизации аморфного магнезита, сформировавшегося после дегидратации. Слабый экзоэффект при 720 ° С, видимо, связан с наличием небольших количеств примеси карбоната кальция.
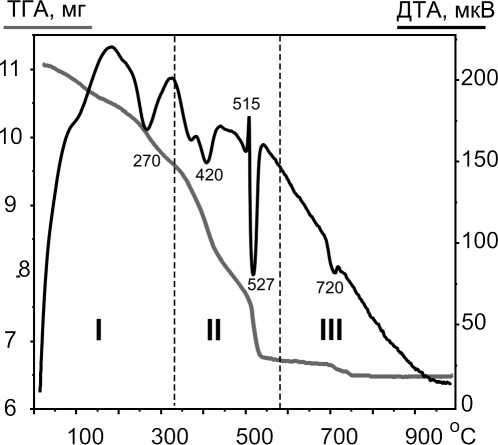
Рис. 1. Термограмма измененного ультрадисперсно-го порошка оксида магния при взаимодействии с атмосферой и ее интерпретация по данным [5]: I – Mg 5 (CO 3 ) 4 (OH) 2 ∙4H 2 O → Mg 5 (CO 3 ) 4 (OH) 2 + 4H 2 O ↑; II – Mg 5 (CO 3 ) 4 (OH) 2 → 4Mg(CO 3 ) + MgO + H 2 O↑ → 4MgO + 4(CO 2 ) ↑ + MgO;
III – (Ca 1-x Mg x )(CO 3 ) → xMgO + (1-x)CaO + (1-x)CO 2 ↑.
Присутствие кристаллического гидромагнезита в изучаемом порошке нами однозначно установлено с помощью методов ИК- и рамановской спектроскопии [6]. На рентгенограмме исходного порошка, кроме рефлексов периклаза MgO, были зарегистрированы все основные рефлексы гидромагнезита (рис. 2). После термической дегидратации и декарбонатизации поверхностных фаз порошка и последующей кристаллизации сформировавшегося аморфного оксида магния рефлексы гидромагнезита исчезают, а рефлексы оксида магния сужаются и усиливаются. При прогревании порошка выше 500 ° С гидромагнезит полностью преобразуется в оксид магния. На дифрактограмме прокаленного порошка был выявлен также слабый рефлекс кальцита. C учетом данных по потерям веса при прокаливании исходный порошок имел следующий минеральный состав (вес. %): MgO – 25, (Ca 0.45 Mg 4.55 )(CO 3 ) 4 (OH) 2 ∙4H 2 O – 75.
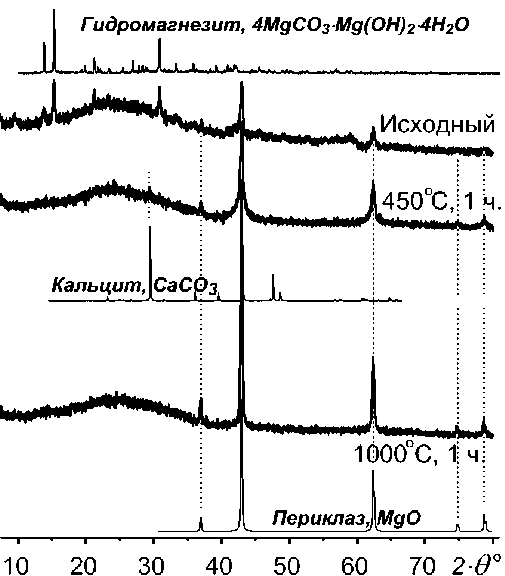
Рис. 2. Дифрактограммы порошка оксида магния (исходного и отожженного в течение часа при 450 и 1000 ° С). Для сравнения приведены расчетные ди-фрактограммы периклаза, кальцита и гидромагнезита.
Порошок, прокаленный при 1000 ° С, характеризуется узкими рентгеновскими рефлексами кристаллического периклаза MgO. Размер его зерен не превышает 100 нм, расчетная площадь поверхности около 20 м2/г. Отличительной особенностью прокаленного оксида магния является полное отсутствие в его спектрах ЭПР линий от ионов Mn2+, обычно самых интенсивных для этого соединения,; но при этом регистрируются интенсивные сигналы от изоморфных примесей ионов Cr3+ и Fe3+.
Спектры ЭПР были получены на радиоспектрометре X-диапазона RadioPAN SE/X-2547 при комнатной температуре препаратов. Навеска непрессованного порошка оксида магния в 20–40 мг помещалась в закрытые кварцевые пробирки диаметром около 5 мм. Высота насыпного столбика с веществом составляла 5–8 мм. Для выяснения влияния атмосферы на парамагнитные центры в оксиде магния одна серия предварительно прокаленных при 1000 ° С препаратов была вакуумирована (остаточное давление 0,01 мм рт. ст.) и загерметизирована в пробирках.
Оценка концентрации Mn2+ и Cr3+ производилась методом сравнения двойных интегралов соответствующих компонентов спектра ЭПР образца и аттестованной линии эталона, записанных в виде первой производной поглощения. В качестве стандарта количества спинов был использован Mn2+ : MgO (E610, аттестован третий компонент сверхтонкой структуры СТС, S эфф = 1/2, 4∙1015 спинов). Запись спектров образца и эталона производилась при одинаковых амплитудах ВЧ модуляции (0.05 мТ) и низкой СВЧ мощности в резонаторе ( < 2 мВт), обеспечивающей условия, далекие от насыщения сигналов.
Лабораторная световая экспозиция порошка оксида магния производилась вертикально падающим сфокусированным на кварцевой пробирке излучением ксеноновой лампы ДКсШ-150, прошедшим через охлаждаемый водяной фильтр (оптический путь 7 см). Освещенность в пятне составляла около 16 000 лк. Для выделения отдельных спектральных диапазонов излучения использовались светофильтры. Относительный энергетический поток рассчитывали по нормативной спектральной кривой свечения ДКсШ-150 и кривой пропускания светофильтра. Для равномерности засветки и предотвращения нагрева препарата пробирку вращали со скоростью 0,5 об/c вокруг ее оси под углом 10 ° к горизонту, охлаждая в водяной бане при комнатной температуре. Отжиг препаратов производился в трубчатой печи в кварцевой пробирке. Температурный режим задавался микропроцессорным блоком РИФ-107БР/РИФ-101 с платиновой термопарой.
Результаты и обсуждение
Гидрокарбонатизированный порошок оксида магния. В спектре ЭПР исходного порошка оксида магния присутствовала узкая ( ∆ Brr = 0.13 мТ) линия с g 0 = 1,979 (рис. 3, а). При большом усилении вокруг нее становится заметным эквидистантный квартет равноинтенсивных линий с расщеплением СТС 1,77 мТ. Данный сигнал обусловлен ионами Cr3+ (S = 3/2) с нулевым (90,5 %) и ненулевым ядерными спинами (53Cr; J = 3/2; 9,5 %) в кубической анионной позиции замещения в решетке оксида магния [7]. В спектре зарегистрирован также компонент сложной формы с g ср = 2,004, относящийся к изоморфным ионам Fe3+ в ненарушенной кубической позиции решетки оксида магния. Линии ЭПР от парамагнитных ионов в гидромагнезитовой фазе не обнаружены. Возможно, это связано с низкой симметрией решетки соединения и, соответственно, сильным ориентационным уширением сигналов ЭПР порошка, чего не происходит для ионов в позициях с кубической симметрией.
После экспозиции порошка на солнечном свету или под излучением газоразрядной лампы (рис. 3, б–г) в спектрах ЭПР появляется секстет с g =2,00 и расщеплением СТС около 8.7 мТ, связанный с ионами Mn2+ (S = 5/2, J(55Mn)= 5/2, 100 %) в неискаженных кубических анионных позициях оксида магния [7]. Ширина линий СТС составляла 0.12 мТ. Насыщение интенсивности спектра ЭПР ионов Mn2+ наступало уже после световой экспозиции 6 000–8 000 лк∙час, т. е. после 20–30 мин. облучения сфокусированным пучком света ДКсШ-150 или в течение нескольких суток рассеянной солнечной радиацией (рис. 3, в, г).
При этом интенсивность сигнала Fe3+ заметно понижается, а на его фоне появляются две одиночные асимметричные линии с g = 2,0115 и 2,0012, очевидно, обусловленные фотоиндуцированными электронно-дырочными центрами. Заметим, что фотооблучение не приводит к появлению данных линий в спектрах ЭПР прокаленного порошка оксида магния, поэтому они могут быть отнесены к фо-тоиндуцированным центрам на CO 3 2– группах гид-
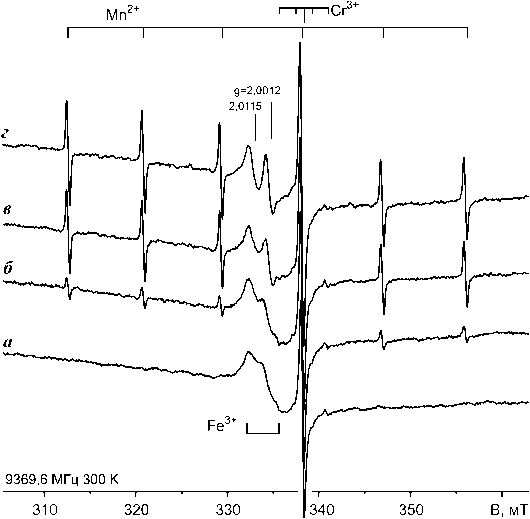
Рис. 3. Спектры ЭПР порошка MgO в закрытой кварцевой ампуле: а – неэкспонированный препарат; б и в – 1- и 12-дневная солнечная экспозиция; г – последующая 4-х часовая экспозиция под сфокусированным излучением ксеноновой лампы ДКсШ-150 с водяным фильтром (7 см). Навеска 40 мг.
ромагнезита. В структуре карбонатов такие центры характеризуются орторомбическими g-тензорами [8]. Но при их быстром хаотическом вращении в спектре ЭПР регистрируется изотропная линия с эффективным g-фактором, равным с g 0 = (g zz +g yy +g xx )/3, где g zz , g yy , g xx – главные значения g-тензора. В соответствии с известными значениями g-тензоров карбонатных центров [8] линия в спектре ЭПР гид-рокарбонатизированного оксида магния с g = 2,0115 соответствует g 0 быстро вращающихся CO 3 –-ион-радикалов, а линия с g = 2,0012 – CO 2 – -ион-радикалов.
Фотоиндуцированные изменения в спектрах ЭПР в порошке оксида магния носят частично обратимый характер. Кратковременный (20 мин.) отжиг в открытых пробирках при температуре выше 300 ° С приводит к полному исчезновению из спектров ЭПР линий электронно-дырочных центров, а повышение температуры до 450 ° С восстанавливает первоначальную интенсивность линии ионов Fe3+ и сильно снижает амплитуду линий секстета Mn2+ (рис. 4). При дальнейшем повышении температуры сигналы Mn2+ полностью исчезают из спектров ЭПР, но при этом сильно повышаются интенсивности линий ионов Fe3+ и особенно Cr3+. Ширины линий сигналов ЭПР этих примесных ионов остаются почти неизменными.
Детальная картина изменений интенсивности линий ЭПР ионов Mn2+, Cr3+ и Fe3+ в пошаговом отжиге представлена на рис. 5. Отжиг Mn2+ происходит в узком термическом интервале 400-500 ° С и сопровождается приростом интенсивности линии ЭПР ионов Fe3+. Процесс отжига Mn2+ скоррелирован с потерей веса порошка, которая в основном
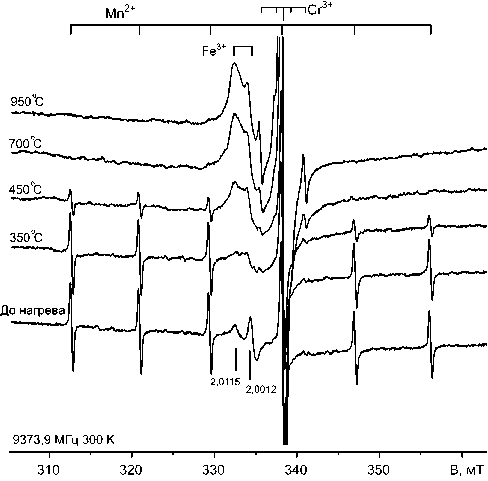
Рис. 4. Изменение спектров ЭПР гидрокарбонати-зированного порошка MgO (4 ч облучения) в ходе отжига при разных температурах в течение 20 мин.
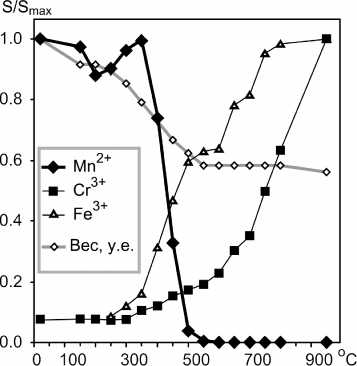
Рис. 5. Приведенные интегральные интенсивности линий ЭПР Mn 2+ , Fe 3+ , Cr 3+ и веса в прогрессирующем изохронном отжиге (20 мин.) гидрокарбо-натизированного порошка оксида магния, облученного в течение 4 ч.
происходит до 600 ° С. Быстрое наращивание интенсивности линии ионов Cr3+ происходит при температурах выше 700 ° С.
Прокаленные порошки оксида магния. Отличительной особенностью экспозиционных серий спектров ЭПР прокаленного порошка MgO при аналогичной исходному гидрокарбонатизированно-му порошку скорости накопления Mn2+ являются большая конечная фотонаведенная интенсивность линий ионов Mn2+ и отсутствие линий карбонатных радикалов (рис. 6). В порошках, прокаленных при температуре выше 450 ° С, концентрация ионов Mn2+, достигаемая при освещении образцов, в 2,5–3 раза выше получаемой в непрокаленном порошке. По нашим оценкам, около 70 % этого возрастания
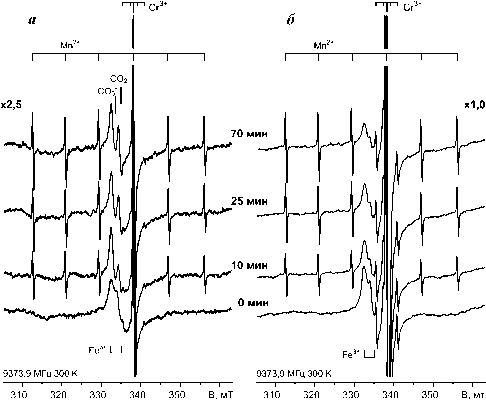
Рис. 6. Влияние на спектры ЭПР порошка оксида магния экспозиции УФ-излучения: исходного гид-рокарбонатизированного (а) и прокаленного при 1000 ° С в течение 4 ч (б). Спектры нормированы на одинаковый вес пробы до ее прокалки.
обусловлено вовлечением в фотопроцесс примесных ионов, находящихся в гидромагнезитовой фазе. Таким образом, выявляемые ЭПР фотостиму-лированные преобразования валентного состояния ионов железа и марганца происходят в оксидной фазе зерен, а приповерхностный гидромагнезит только снижает эффективность фотопроцесса.
Сравнительные экспозиционные изменения концентраций Mn2+, Fe3+ и Cr3+ в исходном порошке и продуктах его прокаливания при 450 и 1000 ° С представлены на рис. 7. Накопление Mn2+ хорошо описывается в модели экспоненциального роста с быстрым (С 1 , τ 1 ) и медленным (С 2 , τ 2 ) компонентами по уравнению:
C Mn2+ ( t ) = C 1 ∙(1 – exp(–t/ τ 1 )) + C 2 ∙(1 – exp(–t/ τ 2 )). (1)
Параметры уравнения (1), полученные при фиттинге экспериментальных зависимостей (рис. 7)
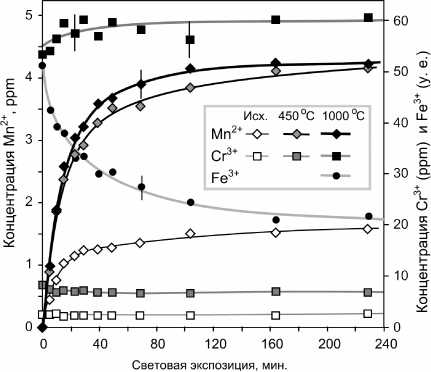
Рис. 7. Изменение концентрации примесных ионов Mn 2+ , Fe 3+ , Cr 3+ в ходе световой экспозиции исходного порошка MgO и продуктов его прокаливания в течение 4 ч (при 450 и 1000 ° С). Сплошные линии -аппроксимация экспериментальных точек по уравнениям (1) и (2).
Таблица 1
Таблица 2
Параметры фотосенсибилизированной генерации ионов Mn2+
Влияние отжига и УФ-облучения на валентное состояние примесных ионов в оксиде магния
|
Обработка порошка MgO |
С 1 , ppm |
τ 1 , мин. |
C 2 , ppm |
τ 2 , мин. |
dC/dt (t= ĩ), ppm/ мин. |
t (0,8∙C max ), мин. |
|
Исходный |
1,2±0,2 |
9,8± 0,6 |
0,50± 0,08 |
130±50 |
0,12± 0,02 |
55 |
|
450 °C, 4 ч |
2,9±0,4 |
12,3± 0,8 |
1,4±0,3 |
100±70 |
0,24± 0,05 |
50 |
|
1000 °C, 4 ч |
3,1 ±0,7 |
12,4± 2,2 |
1,2±0,6 |
60±30 |
0,25± 0,07 |
35 |
Список литературы Фотоиндуцированная перезарядка примесных ионов в ультрадисперсном оксиде магния
- Chiesa M., Paganini M.C., Giamello E. EPR of Charge Carries Stabilized at the Surface of Metal Oxides//Applied Magnetic Resonance. 2010. Vol. 37. P. 605-618.
- Андреева И.С. и др. Аэрозоли Сибири/Отв.ред. К.П. Куценогий. Новосибирск: Изд-во СО РАН, 2006. 548 с.
- Авдеев В.И., Жидомиров Г.М. Электронная структура и оптические свойства поверхностных F-центров оксида MgO. Теоретический анализ методом DFT//Журнал структурной химии. 2003. Т. 44. № 6. С. 995-1004.
- Тентюков М.П., Лютоев В.П. ЭПР-спектроскопия сухих аэрозолей//Оптика атмосферы и океана. 2008. Т. 21. № 9. С. 789-792.
- Hollingbery L. A., Hull T. R. The Thermal Decomposition of Huntite and Hydromagnesite -A Review//Thermochimica Acta. 2010. Vol. 509. P. 1-11.
- Лютоев В.П., Головатая О.С. Фоточувствительность ионов Mn3+/Mn2+ в ультрадисперсном оксиде магния//Минералогия техногенеза-2011. Миасс: ИМин УрО РАН, 2011. С. 117-132.
- Альтшуллер С.А., Козырев Б.М. Электронный парамагнитный резонанс соединений элементов промежуточных групп. М.: Наука, 1972. 672 с.
- Ikeya M. New Application of Electron Spin Resonance. Singapore: World Scientific Publishing Co. Pte. Ltd., 1993. 500 p.
- Davies J. J., Smith S. R. P. Wertz J. E. Electron Paramagnetic Resonance of tetravalent Manganese ions at tetragonal and octahedral sites in MgO//Physical Review. 1969. Vol. 178. P. 608-612.
- Wu X.-X., Fang W., Feng W.-L., Zheng W.-C. Study of EPR Parameters and Defect Structure for two tetragonal impurity centers in MgO:Cr3+ and MgO:Mn4+ crystals//Applied Magnetic Resonance. 2009. Vol. 35. P. 503-510.
- Valia Amir-Ebrahimi, Rooney J. J. A novel ESR method based on dilute solid solution of Mn3+/Mn2+ ions in MgO for detecting spillover of hydrogen from noble metals//J. Molecular Catalysis A: Chemical. 2000. Vol. 159. P. 429-432.
- Galustashvili M., Kalabegishvili T., Kurasbediani A., et al.//Applied Magnetic Resonance. 2005. Vol. 28. P. 393-399.
- Лютоев В. П., Тентюков М. П. Оценка прозрачности снега с помощью фоточувствительного датчика на основе Mn3+/Mn2+ В MgO//Минералогия техногенеза-2011. Миасс: ИМин УрО РАН, 2011. С. 133-137.


