Функциональная активность клеток из преовуляторных фолликулов кур (Gallus domesticus L.) при воздействии трийодтиронина in vitro
Автор: Лебедева И.Ю., Митяшова О.С., Смекалова А.А., Алейникова О.В., Монтвила Е.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вопросы репродукции
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Гормоны щитовидной железы оказывают множественные эффекты у позвоночных, регулируя рост, развитие и функции многих органов, в том числе входящих в репродуктивную систему. Тиреоидные гормоны также могут участвовать в регуляции раннего старения яичников и поддержании запаса овариальных фолликулов. В овариальных фолликулах птиц, включая кур, обнаружены компоненты тиреоидной системы, обеспечивающие реализацию регуляторного влияния гормонов щитовидной железы на клетки-мишени. Нами впервые проведен сравнительный анализ пролиферативной и стероидогенной активности культивируемых клеток гранулезы и теки из двух самых зрелых преовуляторных фолликулов у кур-несушек породы Hisex White разного возраста и репродуктивного статуса при воздействии трийодтиронина (Т3) - наиболее биологически активного тиреоидного гормона. Целью работы было изучение in vitro влияния Т3 на функциональную активность клеток из преовуляторных фолликулов домашней курицы (Gallus domesticus L.) в связи с процессом репродуктивного старения. В экспериментах использовали молодых кур в возрасте 27-34 нед с длинным циклом яйцекладки (n = 6) и репродуктивно постаревших птиц в возрасте 74-94 нед с коротким циклом яйцекладки (n = 6). Клетки гранулезы и теки выделяли из двух самых больших желтых фолликулов F1 и F2. Фолликулярные клетки культивировали в среде, содержащей 3 % фетальной бычьей сыворотки, в течение 48 ч (гранулеза) или 96 ч (тека) в отсутствие (контроль) или в присутствии Т3 в различных концентрациях (0,5-8,0 нг/мл). После культивирования в средах определяли концентрацию половых стероидных гормонов методом ИФА или оценивали пролиферативную активность клеток фотоколориметрически с использованием реагента ССК-8. У молодых кур Т3 в концентрации 1,0-8,0 нг/мл повышал в 1,1-1,2 раза (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Куры-несушки, трийодтиронин, преовуляторные фолликулы, клетки гранулезы, клетки теки, пролиферация, стероидогенез
Короткий адрес: https://sciup.org/142243767
IDR: 142243767 | УДК: 636.5:591.1:612.6 | DOI: 10.15389/agrobiology.2024.4.749rus
Текст научной статьи Функциональная активность клеток из преовуляторных фолликулов кур (Gallus domesticus L.) при воздействии трийодтиронина in vitro
Гормоны щитовидной железы оказывают множественные эффекты у позвоночных, регулируя рост, развитие и функции многих органов, в том числе входящих в репродуктивную систему (1-3). Как известно, любые тиреоидные патологии (как гипо-, так и гипертиреоз) приводят к нарушениям в функционировании репродуктивной системы, в первую очередь ее овариальных компонентов (4-6). У млекопитающих и человека тиреоидные гормоны влияют на эстральный/менструальный цикл, половое созревание, сексуальное поведение, овуляцию, поддержание беременности, фетальный рост и лактацию (7). Эти эффекты связаны как с непосредственным действием
∗ Работа выполнена при финансовой поддержке Российского научного фонда (проект 22-16-00149).
тиреоидных гормонов на репродуктивные органы, так и с их влиянием на биодоступность и эффекты других гормонов и факторов роста, которые необходимы для правильного функционирования женской воспроизводительной системы (8-10).
Старение представляет собой сложный и необратимый биологический процесс, который наблюдается практически у всех живых организмов и ухудшает функции всех органов, тканей и клеток (11). При этом старение яичников служит самым ранним событием, ускоряющим возрастные изменения других органов и повышающим риск различных заболеваний (12, 13). Как известно, с возрастом репродуктивный потенциал самок постепенно уменьшается, что в первую очередь обусловлено преобразованиями, происходящими в овариальных фолликулах (14). Возрастное ослабление активности яичников у млекопитающих вызвано изменением продукции гормонов, связанных с репродуктивной системой, и синтеза гормональных рецепторов, что является следствием сокращения фолликулярного резерва и снижения качества ооцитов и окружающих их соматических клеток (15, 16).
По данным некоторых исследователей, тиреоидные гормоны могут участвовать в регуляции раннего старения яичников и поддержании запаса овариальных фолликулов. При этом они воздействуют на различные канонические сигнальные пути, вовлеченные в процессы старения, включая mTOR путь (17). В свою очередь, функция щитовидной железы и ее регуляция также изменяются с возрастом (18, 19). Кроме того, старение снижает эффективность периферической сигнализации тиреоидных гормонов. Так, в печени и почках крыс наблюдали уменьшение активности дейодиназы 1-го типа и повышение экспрессии тиреоидных рецепторов (20). Тем не менее до сих пор нет ясной информации о роли этих гормонов в возрастном ухудшении овариальной функции у позвоночных.
Яичник птиц также служит мишенью для воздействия тиреоидных гормонов. В овариальных фолликулах птиц, включая кур, обнаружены элементы тиреоидной системы (ядерные и мембранные рецепторы, дейоди-назы, транспортеры), которые необходимы для реализации геномных и негеномных эффектов тиреоидных гормонов (21-23). Установлено, что сезонная секреция гонадотропин-стимулирующего гормона у птиц зависит от уровня трийодтиронина в крови (24). Показано регуляторное влияние трийодтиронина in vitro на секрецию половых стероидных гормонов фолликулами кур (22). Выявлено ингибирующее действие преовуляторной волны репродуктивных гормонов на экспрессию компонентов тиреоидной оси в яичнике индеек (23). Эти данные свидетельствуют о взаимосвязи между репродуктивной и тиреоидной системами у птиц. Кроме того, тран-скриптомный анализ показал участие генов, связанных с сигнальными путями тиреоидных гормонов, в регуляции яичной продуктивности у индеек и уток (25, 26). Вместе с тем очень мало известно о прямом воздействии тиреоидных гормонов на функциональную активность клеток репродуктивных органов птиц.
Нами впервые проведен сравнительный анализ пролиферативной и стероидогенной активности культивируемых клеток гранулезы и теки из двух самых зрелых преовуляторных фолликулов у кур-несушек разного возраста и репродуктивного статуса при воздействии трийодтиронина (Т3) — наиболее биологически активного тиреоидного гормона.
Целью настоящей работы было изучение in vitro влияния Т3 на функциональную активность клеток из преовуляторных фолликулов домашней курицы ( Gallus domesticus L.) в связи с процессом репродуктивного старения.
Методика . В экспериментах использовали две группы кур породы Hisex White (по 6 гол. в каждой): 1-я группа — молодая птица в возрасте 2734 нед с длинным циклом яйцекладки, несущая непрерывно более 6 яиц, 2-я группа — репродуктивно постаревшая птица в возрасте 74-94 нед с коротким циклом яйцекладки (от 2 до 6 яиц за цикл), которая не подвергалась естественной линьке. Кур содержали в отдельных клетках с постоянным доступом к воде в условиях режима освещения 12/12 ч свет/темнота (физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 20222023 годы). За яйцекладкой ежедневно следили с помощью видеосистемы. С целью синхронизации стероидогенной активности фолликулов у разных кур их овариэктомию проводили через 7 ч после снесения яйца. Все эксперименты с птицей (физиологический двор) выполняли в соответствии с принципами, изложенными в Хельсинской декларации (World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects, 1964-2013), и требованиями надлежащей лабораторной практики (ГОСТ 33215-2014).
Слои гранулезы и теки выделяли из двух самых больших желтых фолликулов F1 и F2 согласно методу A.B. Gilbert с соавт. (27). Гранулезные и текальные клетки изолировали из соответствующих слоев преовуляторных фолликулов согласно методике, описанной ранее (28). Предварительно из гранулезного слоя удаляли часть, прилегающую к зародышевому диску. Клетки культивировали в среде DMEM, содержащей 25 мМ HEPES, 1 г/л глюкозы, 1 мМ глутамина, 10 мл/л раствора антибиотика-антимикотика (все реагенты производства «Sigma-Aldrich», США) и 3 % фетальной бычьей сыворотки («Hyclone Laboratories», США). Концентрация клеток в исходной суспензии составляла 25½103/мл среды при жизнеспособности не менее 85 % для гранулезы и 40½103/мл среды при жизнеспособности не менее 75 % для теки (окрашивание трипановым синим). Инкубирование клеток проводили в 96-луночных планшетах в отсутствие (контроль) или в присутствии Т3 («Sigma-Aldrich», США) в концентрации 0,5; 1; 2; 4 и 8 нг/мл. Клетки гранулезы культивировали в течение 2 сут, клетки теки — в течение 4 сут (со сменой среды через 48 ч), поскольку последние в процессе выделения дольше обрабатывались коллагеназой (28), и им требовалось больше времени для восстановления всех функций. Эксперименты по культивированию клеток проводили в 6 независимых повторностях для каждой группы кур. В каждом независимом эксперименте использовали клетки, выделенные у одной курицы. Для каждой концентрации гормона использовали 2-3 ячейки с суспензией клеток. Дополнительно инкубировали среды без клеток при разных концентрациях Т3.
Пролиферативную активность фолликулярных клеток анализировали фотоколориметрическим методом, описанным ранее (28). После культивирования клеток в 96-луночных планшетах в ячейки добавляли 20 мкл реагента CCK-8 («Cloud-Clone», КНР) и инкубировали в течение 3 ч. Оптическую плотность жидкости в ячейках измеряли с помощью планшетного спектрофотометра Униплан («Пикон», Россия) при λ = 450 нм. Предварительные исследования показали, что в этих условиях оптическая плотность в ячейке прямо пропорциональна числу свежевыделенных жизнеспособных клеток. Во всех группах оптическую плотность жидкости, не содержащей клетки, вычитали из значения этого показателя в жидкости, содержащей клетки. Полученную разницу в контрольной группе принимали за 100 %. Пролиферативную активность в экспериментальных группах определяли, как отношение оптической плотности в соответствующих лунках к этому показателю в контрольной группе, выраженное в процентах.
После окончания культивирования среды освобождали от плавающих клеток центифугированием при 300 g в течение 10 мин и замораживали при - 30 ° С. Концентрацию гормонов в средах измеряли методом ИФА с использованием наборов реагентов ООО «Хема» (Россия) при помощи планшетного спектрофотометра Униплан («Пикон», Россия), как описано нами ранее (29). Все образцы исследовали в двух аналитических повторностях, при этом коэффициент вариации не превышал 18 %.
Полученные данные обрабатывали методом однофакторного или двухфакторного дисперсионного анализа с повторными измерениями (oneway или two-way repeated measures ANOVA) при помощи программы SigmaStat 4.0 («Systat Software, Inc.», США). При этом фактором повторных измерений служила концентрация Т3 в среде культивирования клеток. Данные выражали как средние значения ( M ) и стандартные ошибки средних (±SEM). Достоверность различия сравниваемых средних значений оценивали с использованием критерия Тьюки (Tukey’s test).
Результаты . У молодых кур с высокой яйценоскостью Т3 в концентрации 1,0-8,0 нг/мл повышал пролиферативную активность клеток гранулезы из фолликулов F1 в 1,1-1,2 раза (p < 0,05) по сравнению с контролем (рис. 1, А). Напротив, в случае фолликулов F2 происходило понижение этой активности в 1,2-1,3 раза (p < 0,01-0,05) при содержании тиреоидного гормона в среде 1,0-2,0 нг/мл, однако наблюдаемый ингибиторный эффект становился несущественным при повышении этого содержания до 4,0 нг/мл. Кроме того, Т3 в концентрации 0,5-1,0 нг/мл стимулировал in vitro пролиферацию клеток теки из фолликулов F2 в 1,2-1,3 раза (p < 0,01), но не влиял на эти клетки из фолликулов F1 (см. рис. 1, Б).
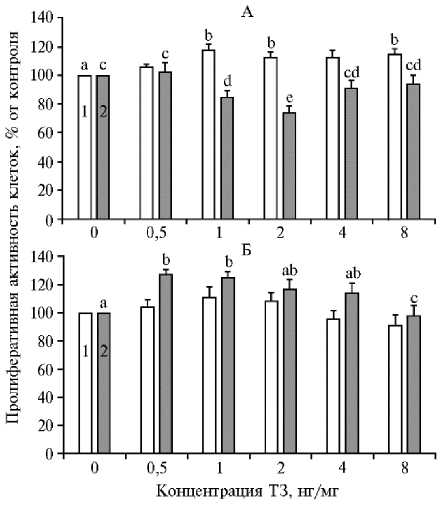
Рис. 1. Пролиферативная активность культивируемых клеток гранулезы (А) и теки (Б) из преовуляторных фолликулов F1 (1) и F2 (2) молодых кур ( Gallus domesticu s L) породы Hisex White в присутствии трийодтиронина (Т3) в разных концентрациях ( М ±SEM) . Число независимых экспериментов — 6. Различия между средними значениями, которые помечены индексами, не содержащими одинаковых букв, статистически значимы (p < 0,001-0,05).
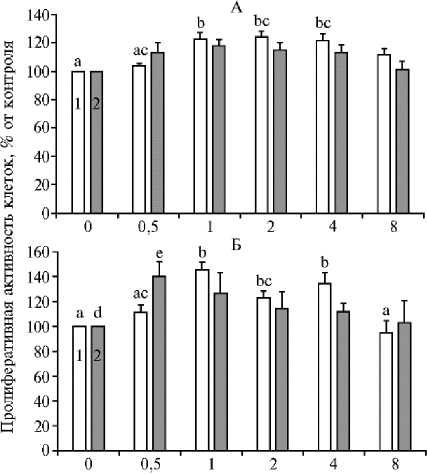
У птицы с возрастным снижением яйценоскости мы обнаружили стимулирующее влияние Т3 (1,0-4,0 нг/мл) на рост клеток гранулезы и теки из фолликулов F1 в культуре (в 1,2-1,4 раза при p < 0,0010,05) (рис. 2, А, Б). Этот гормон в низкой концентрации (0,5 нг/мл) также повышал в 1,4 раза (p < 0,05) пролифера- тивную активность текальных клеток из фолликулов F2.
При анализе влияния Т3 на продукцию половых стероидных гормонов фолликулярными клетками были учтены известные особенности стероидогенеза у кур (22, 30). После культивирования клеток гранулезы в среде определяли содержание прогестерона, а после культивирования клеток теки — содержание тестостерона и эстрадиола-17β. Полученные данные были скорректированы с учетом пролиферативной активности фолликулярных клеток при каждой концентрации Т3.
Концентрация ТЗ, нг/мт
Рис. 2. Пролиферативная активность культивируемых клеток гранулезы (А) и теки (Б) из преовуляторных фолликулов F1 (1) и F2 (2) продуктивно постаревших кур ( Gallus domesticu s L) породы Hisex White в присутствии трийодтиро-нина (Т3) в различных концентрациях ( М ±SEM) . Число независимых экспериментов — 6. Различия между средними значениями, которые помечены индексами, не содержащими одинаковых букв, статистически значимы (p < 0,001-0,05).
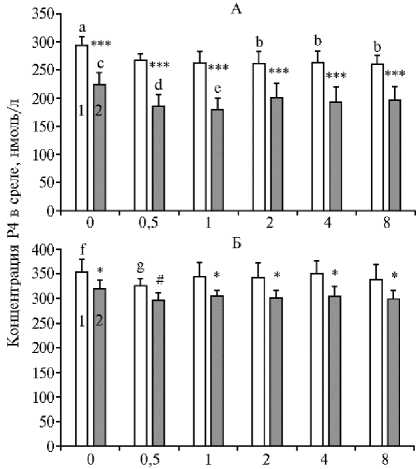
У молодых кур Т3 в 1,1-1,3 раза (p < 0,01-0,05) ингибировал продукцию прогестерона культивируемыми клетками гранулезы в случае фолликулов F1 при концентрации 2,0-8,0 нг/мл, а в случае фолликулов F2 — при концентрации 0,5-1,0 нг/мл (рис. 3, А). В то же время у репродуктивно постаревшей птицы Т3
(0,5 нг/мл) тормозил в 1,1 раза (p < 0,05) секрецию прогестерона клетками гранулезы из фолликулов F1, не изменяя эту секрецию клетками из фолликулов F2 (рис. 3, Б). При этом различия в способности фолликулов F1 и F2 секретировать прогестерон, характерные для кур (22), были более выражены чем у птиц с возрастным снижением репродуктивной у молодых птиц, функции.
Концентрация ТЗ, нт/мт
Рис. 3. Способность культивируемых клеток гранулезы из преовуляторных фолликулов F1 (1) и F2 (2) молодых (А) и репродуктивно постаревших кур (Б) ( Gallus domesticu s L) породы Hisex White секретировать прогестерон (Р4) в присутствии трийодтиронина (Т3) в различных концентрациях ( М ±SEM) . Число независимых экспериментов — 6. Различия между группами: a,bp < 0,05; c,dp < 0,05; c,ep < 0,01 (А); f,gp < 0,05 (Б). Различия между F1 и F2: #p < 0,1; *p < 0,05; ***p < 0,001.
Мы не обнаружили достоверного влияния Т3 на продукцию тестостерона и эстради-ола-17β клетками теки преовуля-торных фолликулов молодых кур (табл. 1). У репродуктивно постаревших птиц (табл. 2) тиреоидный гормон в высокой концентрации (8,0 нг/мл) подавлял секрецию тестостерона клетками теки из фолликулов F2 (в 1,9 раза, p < 0,01) и повышал продукцию эстра-диола-17β клетками теки из фолликулов F1 (в 1,8 раза, p < 0,05).
1. Способность культивируемых клеток теки из преовуляторных фолликулов молодых кур ( Gallus domesticu s L) породы Hisex White секретировать тестостерон (Т) и эстрадиол-17β (Е2) в присутствии трийодтиронина (Т3) в различных концентрациях ( n = 6, M ±SEM)
|
Концентрация T3, нг/мл |
Концентрация гормонов в среде, пмоль/л Т Е2 F1 1 F2 F1 1 F2 |
|
0 (контроль) 0,5 1,0 2,0 4,0 8,0 |
372±114 336±104 180±40 177±90 741±218 470±126 191±48 233±80 687±215 365±163 134±52 247±66 563±124 680±133 163±61 284±45 388±129 666±170 180±55 254±71 517±94 487±121 284±70 220±85 |
2. Способность культивируемых клеток теки из преовуляторных фолликулов репродуктивно постаревших кур ( Gallus domesticu s L) породы Hisex White секретировать тестостерон (Т) и эстрадиол-17β (Е2) в присутствии трийодтиро-нина (Т3) в различных концентрациях ( n = 6, M ±SEM)
|
Концентрация T3, нг/мл |
Концентрация гормонов в среде, пмоль/л |
|||
|
Т |
Е2 |
|||
|
F1 |
F2 |
F1 |
F2 |
|
|
0 (контроль) |
360±74 |
518±97a |
142±22c |
196±33 |
|
0,5 |
325±118 |
395±100 |
160±25 |
220±17 |
|
1,0 |
349±57 |
370±85 |
207±31 |
175±22 |
|
2,0 |
361±66 |
261±110 |
217±36 |
162±21 |
|
4,0 |
481±126 |
301±92 |
212±26 |
196±19 |
|
8,0 |
446±45 |
278±86b |
262±23d |
198±49 |
|
Различия между группами статистически значимы: a,b — при p < 0,01; |
c,d — при p < 0,05. |
|||
В нашем исследовании впервые выявлена способность Т3 модулировать пролиферацию клеток гранулезы и теки из преовуляторных фолликулов домашней курицы. Важно отметить, что эта способность наблюдалась главным образом при физиологической концентрации гормона, которая варьируется у кур от 0,3 до 2,6 нг/мл (31). Согласно современным представлениям, Т3 оказывает прямое ростостимулирующее влияние на неопухолевые клетки через свои мембранные рецепторы, активируя сигнальные пути, связанные с MAP киназой и Akt киназой (32). Такое влияние тиреоидного гормона на фолликулярные клетки яичника и его зависимость от степени созревания фолликулов ранее были показаны у млекопитающих (7, 33). Тем не менее некоторые авторы продемонстрировали, что Т3 может тормозить пролиферацию клеток в случае необходимости их функционального созревания, как это происходит при терминальной дифференцировке кардиомиоцитов (34).
В настоящей работе тиреоидный гормон оказывал in vitro ростостимулирующее влияние на клетки гранулезы из фолликулов F1 и клетки теки из фолликулов F2 у молодых кур, что соответствует данным, полученным у млекопитающих (7, 33). В то же время Т3 ингибировал пролиферацию гранулезных клеток из фолликулов F2, что, вероятно, обусловлено их завершающей дифференцировкой при созревании до стадии F1. Такой ингибирующий эффект гормона мог бы быть опосредован через ядерные тиреоидные рецепторы посредством активации гена (или генов), отвечающего (отвечающих) за синтез паракринного фактора, способного подавлять рост клеток (32).
Полученные нами данные также показали, что модулирующее влияние Т3 на фолликулярные клетки различается у молодых кур и у кур с возрастным снижением яйценоскости. У птиц второй группы отсутствовало ингибирующее действие тиреоидного гормона на пролиферацию клеток гранулезы из фолликулов F2 и было выявлено его стимулирующее действие 754
на пролиферацию клеток теки из фолликулов F1. Наблюдаемые изменения могли быть связаны с изменением динамики роста и дифференцировки преовуляторных фолликулов у репродуктивно постаревших кур, которая зависит от гормональной регуляции этих процессов (28).
Как известно, тиреоидные и половые стероидные гормоны тесно взаимодействуют, взаимно модулируя свои уровни в крови, а также воздействие друг друга на клетки-мишени вследствие пересечения активируемых сигнальных каскадов (10). В нашем исследовании при использовании молодых кур обнаружено ингибирование продукции прогестерона изолированными клетками гранулезы: в случае фолликулов F1 — при высокой концентрации Т3, а в случае фолликулов F2 — при его низкой концентрации. Вместе с тем другими авторами было выявлено стимулирующее влияние Т3 на секрецию прогестерона эксплантатами гранулезного слоя кур (22), что свидетельствует о значимости нативных межклеточных контактов для реализации гормонального воздействия. Репродуктивное старение также влияло на способность Т3 модулировать стероидогенную активность фолликулярных клеток, снижая чувствительность к этому гормону у клеток гранулезы и повышая ее у клеток теки.
Таким образом, полученные данные показывают, что Т3 в физиологической концентрации способен оказывать регуляторное влияние на пролиферативную и стероидогенную активность фолликулярных клеток в зависимости от их типа и степени зрелости преовуляторных фолликулов у кур-несушек. При этом чувствительность гранулезных и текальных клеток к гормону изменяется в процессе старения яичника птиц. У молодых кур Т3 (1,0-2,0 нг/мл) повышал in vitro пролиферативную активность клеток гранулезы из фолликулов F1 в 1,1-1,2 раза (p < 0,05), тогда как в случае фолликулов F2 он понижал эту активность в 1,2-1,3 раза (p < 0,01-0,05), а также в концентрации 0,5-1,0 нг/мл стимулировал пролиферацию клеток теки в 1,2-1,3 раза (p < 0,01). В этих условиях Т3 ингибировал в 1,1-1,3 раза (p < 0,01-0,05) продукцию прогестерона культивируемыми клетками гранулезы в случае фолликулов F1 при концентрации 2,0 нг/мл, а в случае фолликулов F2 — при концентрации 0,5-1,0 нг/мл. В то же время у птицы с возрастным снижением яйценоскости Т3 (1,0-2,0 нг/мл) усиливал рост в культуре клеток гранулезы и теки из фолликулов F1 (в 1,2-1,4 раза, p < 0,0010,05), а в концентрации 0,5 нг/мл повышал в 1,4 раза (p < 0,05) пролиферативную активность текальных клеток из фолликулов F2. Кроме того, Т3 (0,5 нг/мл) тормозил в 1,1 раза (p < 0,05) секрецию прогестерона клетками гранулезы из фолликулов F1, но не влиял на эту секрецию клетками из фолликулов F2. Полученные знания будут полезны для разработки общей концепции, описывающей роль тиреоидной системы в регуляции фоллику-логенеза и репродуктивного старения позвоночных, а также для оптимизации условий культивирования первичных клеток с целью создания экспериментальной модели овариального старения у кур.
Список литературы Функциональная активность клеток из преовуляторных фолликулов кур (Gallus domesticus L.) при воздействии трийодтиронина in vitro
- Mullur R., Liu Y.Y., Brent G.A. Thyroid hormone regulation of metabolism. Physiological Reviews, 2014, 94(2): 355-382 (doi: 10.1152/physrev.00030.2013).
- Mendoza A., Hollenberg A.N. New insights into thyroid hormone action. Pharmacology & Therapeutics, 2017, 173: 135-145 (doi: 10.1016/j.pharmthera.2017.02.012).
- Brown E.D.L., Obeng-Gyasi B., Hall J.E., Shekhar S. The thyroid hormone axis and female reproduction. International Journal of Molecular Sciences, 2023, 24(12): 9815 (doi: 10.3390/ijms24129815).
- Vissenberg R., Manders V.D., Mastenbroek S., Fliers E., Afink G.B., Ris-Stalpers C., Goddijn M., Bisschop P.H. Pathophysiological aspects of thyroid hormone disorders/thyroid peroxidase autoantibodies and reproduction. Human Reproduction Update, 2015, 21(3): 378-87 (doi: 10.1093/humupd/dmv004).
- Poppe K. Management of endocrine disease: Thyroid and female infertility: more questions than answers?! European Journal of Endocrinology, 2021, 184(4): 123-135 (doi: 10.1530/EJE-20-1284).
- Weetman A.P. An update on the pathogenesis of Hashimoto's thyroiditis. Journal of Endocrinological Investigation, 2021, 44(5): 883-890 (doi: 10.1007/s40618-020-01477-1).
- Silva J.F., Ocarino N.M., Serakides R. Thyroid hormones and female reproduction. Biology of Reproduction, 2018, 99(5): 907-921 (doi: 10.1093/biolre/ioy115).
- Duarte-Guterman P., Navarro-Martín L., Trudeau V.L. Mechanisms of crosstalk between endocrine systems: regulation of sex steroid hormone synthesis and action by thyroid hormones. General and Comparative Endocrinology, 2014, 203: 69-85 (doi: 10.1016/j.ygcen.2014.03.015).
- Forhead A.J., Fowden A.L. Thyroid hormones in fetal growth and prepartum maturation. Journal of Endocrinology, 2014, 221(3): 87-103 (doi: 10.1530/JOE-14-0025).
- Ren B., Zhu Y. A new perspective on thyroid hormones: crosstalk with reproductive hormones in females. International Journal of Molecular Sciences, 2022, 23(5): 2708 (doi: 10.3390/ijms23052708).
- López-Otín C., Blasco M.A., Partridge L., Serrano M., Kroemer G. Hallmarks of aging: an expanding universe. Cell, 2023, 186(2): 243-278 (doi: 10.1016/j.cell.2022.11.001).
- Zhang J., Chen Q., Du D., Wu T., Wen J., Wu M., Zhang Y., Yan W., Zhou S., Li Y., Jin Y., Luo A., Wang S. Can ovarian aging be delayed by pharmacological strategies? Aging-US: Peer-Reviewed Aging Research Journal, 2019, 11(2): 817-832 (doi: 10.18632/aging.101784).
- Tesarik J., Galán-Lázaro M., Mendoza-Tesarik R. Ovarian aging: molecular mechanisms and medical management. International Journal of Molecular Sciences, 2021, 22(3): 1371 (doi: 10.3390/ijms22031371).
- Macklon N.S., Fauser B.C. Aspects of ovarian follicle development throughout life. Hormone research, 1999, 52(4): 161-170 (doi: 10.1159/000023456).
- Tatone C., Amicarelli F., Carbone M.C., Monteleone P., Caserta D., Marci R., Artini P.G., Piomboni P., Focarelli R. Cellular and molecular aspects of ovarian follicle ageing. Human Reproduction Update, 2008, 14(2): 131-142 (doi: 10.1093/humupd/dmm048).
- Camaioni A., Ucci M.A., Campagnolo L., De Felici M., Klinger F.G. The process of ovarian aging: it is not just about oocytes and granulosa cells. Journal of Assisted Reproduction and Genetics, 2022, 39(4): 783-792 (doi: 10.1007/s10815-022-02478-0).
- Colella M., Cuomo D., Giacco A., Mallardo M., De Felice M., Ambrosino C. Thyroid hormones and functional ovarian reserve: systemic vs. peripheral dysfunctions. Journal of Clinical Medicine, 2020, 9(6): 1679 (doi: 10.3390/jcm9061679).
- da Costa V.M, Moreira D.G., Rosenthal D. Thyroid function and aging: gender-related differences. Journal of Endocrinology, 2001, 171(1): 193-198 (doi: 10.1677/joe.0.1710193).
- Jasim S., Gharib H. Thyroid and aging. Endocrine Practice, 2018, 24(4): 369-374 (doi: 10.4158/EP171796.RA).
- Silvestri E., Lombardi A., de Lange P., Schiavo L., Lanni A., Goglia F., Visser T.J., Moreno M. Age-related changes in renal and hepatic cellular mechanisms associated with variations in rat serum thyroid hormone levels. American Journal of Physiology-Endocrinology and Metabolism, 2008, 294(6): 1160-1168 (doi: 10.1152/ajpendo.00044.2008).
- McNabb F.M. The hypothalamic-pituitary-thyroid (HPT) axis in birds and its role in bird development and reproduction. Critical Reviews in Toxicology, 2007, 37(1-2): 163-193 (doi: 10.1080/10408440601123552).
- Sechman A. The role of thyroid hormones in regulation of chicken ovarian steroidogenesis. General and Comparative Endocrinology, 2013, 190: 68-75 (doi: 10.1016/j.ygcen.2013.04.012).
- Brady K., Long J.A., Liu H.C., Porter T.E. Characterization of hypothalamo-pituitary-thyroid axis gene expression in the hypothalamus, pituitary gland, and ovarian follicles of turkey hens during the preovulatory surge and in hens with low and high egg production. Poultry Science, 2021, 100(4): 100928 (doi: 10.1016/j.psj.2020.12.026).
- Guh Y.J., Tamai T.K., Yoshimura T. The underlying mechanisms of vertebrate seasonal reproduction. Proceedings of the Japan Academy, Ser. B, Physical and Biological Sciences, 2019, 95(7): 343-357 (doi: 10.2183/pjab.95.025).
- Bao X., Song Y., Li T., Zhang S., Huang L., Zhang S., Cao J., Liu X., Zhang J. Comparative transcriptome profiling of ovary tissue between black muscovy duck and white muscovy duck with high- and low-egg production. Genes (Basel), 2020, 12(1): 57 (doi: 10.3390/genes12010057).
- Brady K., Liu H.C., Hicks J.A., Long J.A., Porter T.E. Transcriptome analysis during follicle development in turkey hens with low and high egg production. Frontiers in Genetics, 2021, 12: 619196 (doi: 10.3389/fgene.2021.619196).
- Gilbert A.B., Evans A.J., Perry M.M., Davidson M.H. A method for separating the granulosa cells, the basal lamina and the theca of the preovulatory ovarian follicle of the domestic fowl (Gallus domesticus). Journal of Reproduction and Fertility, 1977, 50(1): 179-181 (doi: 10.1530/jrf.0.0500179).
- Lebedeva I.Y., Lebedev V.A., Grossmann R., Parvizi N. Age-dependent role of steroids in the regulation of growth of the hen follicular wall. Reproductive Biology and Endocrinology, 2010, 8: 15 (doi: 10.1186/1477-7827-8-15).
- Лебедева И.Ю., Смекалова А.А., Монтвила Е.К., Алейникова О.В. Влияние возраста на секреторную активность разных слоев преовуляторных фолликулов у кур-несушек. Генетика и разведение животных, 2020, 4: 28-32 (doi: 10.31043/2410-2733-2020-4-33-38).
- Rangel P.L., Gutierrez C.G. Reproduction in hens: is testosterone necessary for the ovulatory process? General and Comparative Endocrinology, 2014, 203: 250-261 (doi: 10.1016/j.ygcen.2014.03.040).
- Sahin K., Küçük O. A simple way to reduce heat stress in laying hens as judged by egg laying, body weight gain and biochemical parameters. Acta Veterinaria Hungarica, 2001, 49(4): 421-430 (doi: 10.1556/004.49.2001.4.6).
- Hammes S.R., Davis P.J. Overlapping nongenomic and genomic actions of thyroid hormone and steroids. Best Practice and Research Clinical Endocrinology and Metabolism, 2015, 29(4): 581-593 (doi: 10.1016/j.beem.2015.04.001).
- Монтвила Е.К., Митяшова О.С., Лебедева И.Ю. Влияние тиреоидных гормонов in vitro на функциональное состояние клеток гранулезы коров. Генетика и разведение животных, 2022, 4: 42-48 (doi: 10.31043/2410-2733-2022-4-42-48).
- Chattergoon N.N. Thyroid hormone signaling and consequences for cardiac development. Journal of Endocrinology, 2019, 242(1): T145-T160 (doi: 10.1530/JOE-18-0704).


