Функциональные биодеградируемые материалы на поверхности титановых имплантатов, предназначенных для протезирования зубов у собак
Автор: Красников А.В., Анников В.В., Красникова Е.С., Фомин А.А., Петрова Н.В., Морозова Д.Д.
Статья в выпуске: 4 т.224, 2015 года.
Бесплатный доступ
Авторами установлено, что для формирования биодеградируемого покрытия на поверхности титановых имплантатов, используемых для протезирования зубов у собак, можно использовать в качестве функционального вещества - полиазолидинаммоний, модифицированный гидрат-ионами галогенов в концентрации не более 0,0001 %, а в качестве биологически активного вещества - водную дисперсию субмикронных агрегатов флавоноидов в концентрации 1,25 мг/мл. Проведено исследование взаимодействия отдельно функционального и биологически активного веществ in vitro, для определения оптимальных дозировок компонентов композита, с клетками мезенхимного происхождения - фибробластами, которое позволило авторам утверждать, что при заданной концентрации веществ имплантаты являются биорезистентными и не оказывают цитотоксического эффекта. Свидетельством нетоксичности веществ явилось отсутствие повреждения клеток в культуре с возможностью адгезии фибробластов на экспериментальных образцах.
Имплантаты, дермальные фибробласты, адгезия, пролиферация, собаки, протезирование зубов, биоинтеграция
Короткий адрес: https://sciup.org/14288670
IDR: 14288670 | УДК: 619:599.742.13:616.716.85:616-77:[546.82+577.11+615.324]:615
Текст научной статьи Функциональные биодеградируемые материалы на поверхности титановых имплантатов, предназначенных для протезирования зубов у собак
Развитие ветеринарной медицины привело к пониманию важности лечения животных с заболеваниями органов ротовой полости и зубочелюстного аппарата, поскольку они оказывают непосредственное влияние на состояние пищеварительной системы и, следовательно, на гомеостаз животного в целом [1,2].
Имплантация в ткани организма любого чужеродного материала вызывает воспалительно-репаративную реакцию, которая является выражением защитнокомпенсаторной функции соединительной ткани. Воспалительный процесс в окружающей ткани ведет к пролиферации фибробластов, которые продуцируют коллагеновые волокна и другие компоненты экстрацеллюлярного матрикса. Формируется соединительнотканная капсула, изолирующая инородное тело. Исключением являются только материалы, подвергающиеся быстрой биодеградации или полной резорбции без формирования капсулы [5, 6].
Соответственно, главным условием успеха является приживление имплантируемого материала. Поэтому к нему предъявляются жесткие требования. Он не должен вызывать общей или местной негативной реакции организма, в частности, не быть токсичным, канцерогенным, аллергенным, радиоактивным и быть биоинтегрируемым [3, 7, 8].
Интенсивность и наличие воспалительного процесса зависят от степени биосовместимости имплантируемых материалов. Поэтому биоматериалы, предназначенные для медицинской и ветеринарной практики, обязательно должны проходить токсикологические и морфологические исследования в условиях, максимально приближающихся к их конкретному использованию [5, 6].
Выбор наиболее подходящего материала для эндопротезирования - весьма сложная задача, для решения которой используют исследования in vitro и in vivo .
Для практического использовании биоинтегрируемого композитного материала, включающего функциональное вещество – полиазолидинаммоний, модифицированный гидрат-ионами галогенов, а в качестве биологически активного вещества – водную дисперсию субмикронных агрегатов флавоноидов в качестве покрытия на внутрикостных имплантатах провели его апробацию in vitro с клетками мезенхимного происхождения – фибробластами. Очевидна целесообразность изучения взаимодействия отдельно функционального и биологически активного веществ на функциональные характеристики культуры фибробластов, поскольку культура этой клеточной популяции относительно доступна, особенности роста фибробластов in vitro хорошо изучены и позволяют получить достаточный для исследования на начальном этапе результат в короткие сроки.
Цель работы. Исходя из этого мы определили цели работы:
-
1. Дать оценку функциональному состоянию дермальных фибробластов, культивируемых на титановых заготовках для имплантатов с нанесённой на их поверхность полимерной плёнкой и прополисом в различных концентрациях.
-
2. Определить концентрации полимера и прополиса, способствующие формированию нетоксичного биодеградируемого покрытия и необходимой адгезивной и пролиферативной возможностям клеточной культуры.
Материалы и методы. Материалом для исследования послужили дермальные фибробласты человека, выделенные из здоровой донорской кожи, предоставленной клиниками пластической хирургии г. Саратова.
Жизнеспособность и пролиферативную активность культуры оценивали с помощью автоматического счетчика клеток в 1 мл среды.
Перед началом экспериментов изучаемые образцы титановых заготовок стерилизовали в сухожаровом шкафу («Экрос», Россия), затем помещали в 24-луночные планшеты («Costar», USA), после чего высевали клеточную культуру (концентрация составила 1*105 клеток на образец в 2-х мл среды). Для культивирования использовали питательную среду ДМЕМ («Биолот», Россия) с добавлением 10% фетальной бычьей сыворотки (Fetal Bovine Serum, HyClone UK) и смеси антибиотика-антимикотика. Планшеты помещались в СО 2 инкубатор Sanyo MCO - 18 M («Sanyo», Япония) с температурой 37°С и 5% содержанием углекислоты. Оценку состояния клеток, культивируемых на экспериментальных материалах, проводили с помощью методов световой микроскопии. За изменением формы и количеством клеток в процессе культивирования наблюдали под инвертируемым микроскопом («МИБ-Р», Россия).
В качестве субстрата для экспериментов использовали титановые заготовки с нанесенной на их поверхность полимерной плёнкой
(полиазолидинаммоний, модифицированный гидрат-ионами галогенов) и прополисом в различных концентрациях: образец №1 – контроль, образец №2 – БАВ 10мг/мл, образец №3 – БАВ 5 мг/мл, образец №4 – БАВ 2,5 мг/мл, образец №5 – БАВ 1,25 мг/мл, образец №6 – ФВ 1%, образец №7 – ФВ 0,1%, образец №8 – ФВ 0,01%, образец №9 – ФВ 0,001%, образец №10 – ФВ 0,0001%. Концентрация клеток составила 1*105 на образец.
Жизнеспособность культуры составила 94%.
Показатели адгезии и пролиферации клеточной культуры на имплантатах изучали с помощью электронного микроскопа (MIRA\\LMU, “Tescan”).
Результаты исследований. В ходе эксперимента определялись оптимальные дозировки компонентов композита, не оказывающие угнетающего влияния на фибробласты.
Проведенные исследования показали, что клетки хорошо адгезировали на образцах под номерами 1,2,3,4,5. Также вблизи представленных образцов наблюдалась высокая пролиферативная активность.
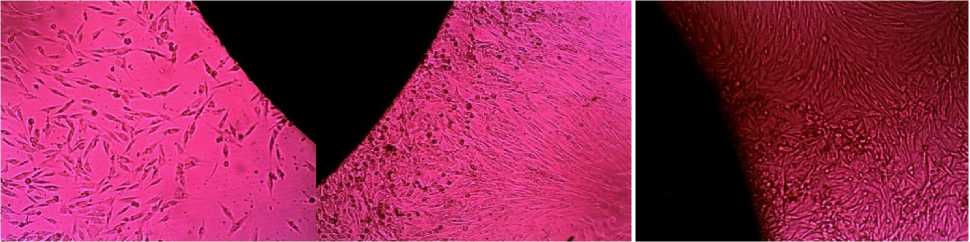
Рис. 1. Образец №1
Рис. 2. Образец №2
Рис. 3. Образец №3
Об
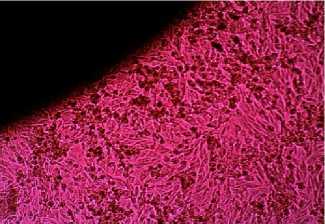
Рис. 4 Образец №4
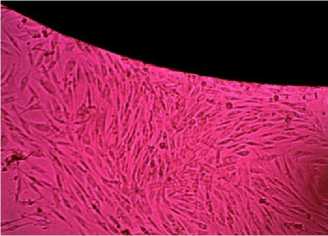
Рис. 5 Образец №5
На образцах 6 и 7 наблюдалось угнетение роста клеток, а затем и их последующая гибель.
этом свидетельствует изменение формы (округление) и отсутствие роста клеток.
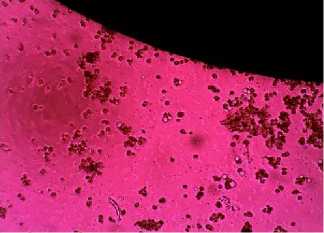
Рис. 6. Образец №6

Рис. 7. Образец №7
На образцах 8, 9, 10, где концентрация полимера последовательно уменьшалась, наблюдалось улучшение адгезивной и пролиферативной способностей клеточной культуры. О чем свидетельствует наличие вблизи образца клеток характерной формы.
Наилучшие результаты были получены на образце №10. При проведении контрольной микроскопии через 24 часа отмечали, что: культура фибробластов в хорошем состоянии, преимущественно отростки выражены,
форма клеток веретеновидная, ядра отчетливо контурируют.
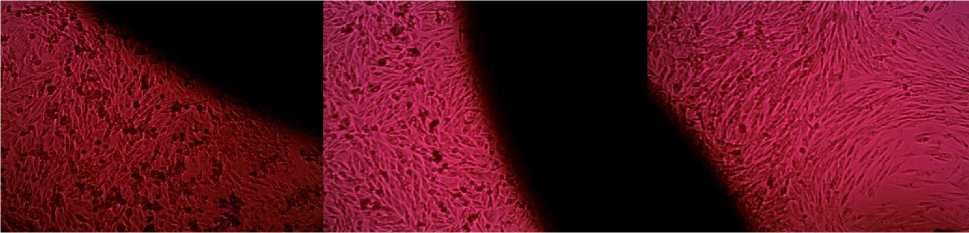
Рис. 8. Образец №8
Рис. 9. Образец №9
Рис. 10. Образец №10
В таблице 1 представлены результаты эксперимента по воздействию разных концентраций функционального и биологически активного веществ на функциональные характеристики культуры фибробластов в первые и вторые сутки эксперимента.
Таблица 1 -Оценка воздействия разных концентраций функционального и биологически активного веществ на функциональные характеристики культуры фибробластов
|
1 сутки |
2 сутки |
||||
|
№ |
Образец |
Оценка |
№ |
Образец |
Оценка |
|
1 |
Контроль |
+ |
1 |
Контроль |
+ |
|
2 |
БАВ 10 мг/мл |
+ |
2 |
БАВ 10 мг/мл |
+\- |
|
3 |
БАВ 5 мг/мл |
+ |
3 |
БАВ 10 мг/мл |
+\- |
|
4 |
БАВ 2,5 мг/мл |
+ |
4 |
БАВ 2,5 мг/мл |
+\- |
|
5 |
БАВ 1,25 мг/мл |
+ |
5 |
БАВ 1,25 мг/мл |
+ |
|
6 |
ФВ 1 % |
— |
6 |
ФВ 1 % |
— |
|
7 |
ФВ 0,1 % |
— |
7 |
ФВ 0,1 % |
— |
|
8 |
ФВ 0,01 % |
— |
8 |
ФВ 0,01 % |
+\- |
|
9 |
ФВ 0,001 % |
-\+ |
9 |
ФВ 0,001 % |
+\- |
|
10 |
ФВ 0,0001 % |
+ |
10 |
ФВ 0,0001 % |
+\- |
+ норма, ++ хорошо, - частичная гибель, -- преимущественная гибель,
Выводы. 1. Анализ функционального состояния дермальных фибробластов, культивируемых на титановых заготовках с нанесённой на их поверхность полимерной плёнкой и прополисом в различных концентрациях, показал, что для формирования биодеградируемого покрытия на поверхности имплантационных материалов необходимо использовать следующие концентрации веществ: прополиса - 1,25 мг в мл по ДВ, полимера - не более 0,0001 %. 2. Свидетельством нетоксичности биодеградируемого покрытия является отсутствие повреждения клеток в культуре с возможностью необходимой адгезии и пролиферацией на экспериментальных веществах.
Авторами установлено, что для формирования биодеградируемого покрытия на поверхности титановых имплантатов, используемых для протезирования зубов у собак, можно использовать в качестве функционального вещества – полиазолидинаммоний, модифицированный гидрат-ионами галогенов в концентрации не более 0,0001 %, а в качестве биологически активного вещества - водную дисперсию субмикронных агрегатов флавоноидов в концентрации 1,25 мг/мл. Проведено исследование взаимодействия отдельно функционального и биологически активного веществ in vitro , для определения оптимальных дозировок компонентов композита, с клетками мезенхимного происхождения – фибробластами, которое позволило авторам утверждать, что при заданной концентрации веществ имплантаты являются биорезистентными и не оказывают цитотоксического эффекта. Свидетельством нетоксичности веществ явилось отсутствие повреждения клеток в культуре с возможностью адгезии фибробластов на экспериментальных образцах.
Список литературы Функциональные биодеградируемые материалы на поверхности титановых имплантатов, предназначенных для протезирования зубов у собак
- Волков А.А. Клинико-морфологическая классификация гастритов у собак//Ветеринария Кубани. 2009. -№ 6. -С. 23-28.
- Красников А.В. Причины потери зубов у собак и проблемы ветеринарной имплантологии//Вестник ветеринарии. 2011. -№4. -С. 97-99.
- Лясников В.Н. Внутрикостные стоматологические имплантаты. -Саратов. 1997. -87 с.
- Пинаев Г.П. Методы культивирования клеток//Культивирование клеток кожи человека. -СПб.: Изд-во Политехнического университета, 2008. -С.174-188.
- Шехтер А.Б. Воспаление и регенерация//Воспаление. -М.: Медицина, 1995. -С. 200 -219.
- Шехтер А.Б. Биосовместимость/под ред. В.И. Севастьянова. -М.: ГУП «Информационный центр ВНИИ геосистем», 1999. -368 с.
- Jarcho M. Retrospective analysis of hydroxyapatite development for oral implant application//Dent. Clin. North Amer. -1992. -Vol. 36. -P. 19-26.
- Steinemann S., Perren S. Titanium alloys as metallic biomaterials/Proc. of the fifth World conference on titanium. -1984. -Vol. 2. -P. 1327-1334.


