Генерация тромбина у детей с генерализованными инфекционными заболеваниями и полиорганной недостаточностью
Автор: Папаян Людмила Петровна, Вильниц Алла Ароновна, Смирнова Ольга Анатольевна, Алексеева Ольга Григорьевна, Головина Ольга Георгиевна, Скрипченко Наталья Викторовна, Бессмельцев Станислав Семенович
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.13, 2017 года.
Бесплатный доступ
Тромбин.полиорганная недостаточность
Короткий адрес: https://sciup.org/170149984
IDR: 170149984 | УДК: 612.115,
Текст статьи Генерация тромбина у детей с генерализованными инфекционными заболеваниями и полиорганной недостаточностью
Цель исследования. Определить информативность теста генерации тромбина (ТГТ) для диагностики активации гемостаза на фоне генерализованных инфекционных заболеваний у детей.
Материалы и методы. Обследовали 6 пациентов, в возрасте от 3 до 12 лет, с сепсисом, развившимся на фоне тяжелых инфекционных заболеваний, протекающих с синдромом полиорганной недостаточности и тромбогеморрагическими нарушениями. Из них 5 человек обследованы в острой стадии заболевания и 1 (пациент № 1) повторно в период реконвалес-ценции. Все дети проходили лечение в ФГБУ ДНКЦИБ ФМБА России. Клиническая характеристика больных представлена в таблице 1.
Таблица 1.
Клиническая характеристика детей с сепсисом и ПОН
|
№ |
Фамилия, имя |
Возраст |
Диагноз |
|
1 |
Б-в А. |
12 лет |
ГФМИ*, МК, БГМ, сш, две, ОГМ, СПОН. |
|
2 |
О-ва К. |
3 года |
ГФМИ, МК, БГМ |
|
3 |
П-в П. |
3 года |
ГФГИ, БГМ, вызванный Hib |
|
4 |
П-в П. |
3 года |
ГФГИ, БГМ, вызванный Hib |
|
5 |
Н-в А. |
4 года |
ГФМИ, МК |
* Примечания: ГФМИ — генерализованная форма менингококковой инфекции;
ГФГИ — генерализованная форма гемофильной инфекции;
БГМ — бактериальный гнойный менингит;
МК — менингококцемия;
СШ — септический шок;
ОГМ — отек головного мозга;
СПОН — синдром полиорганной недостаточности;
Hib — haemophilus influenzae b типа
Исследование показателей гемостаза проводилось в ФГБУ ДНКЦИБ ФМБА России с использованием рутинных методов: международное нормализованное отношение (МНО), активированное парциальное тромбопластиновое время (АПТВ), концентрация фибриногена, тромбиновое время (ТВ), активность антитромбина, плазминогена, антиплазмина и уровень D-димеров.
Уровень генерации тромбина определяли с помощью теста генерации тромбина, современного интегрального метода, который наиболее полно отражает влияние как прокоагулянтов, так и антикоагулянтов на исследуемый процесс [5, 6.]. Эффективность системы протеина С (PC) оценивали этим же методом, измеряя уровень образования тромбина после добавления в реакционную среду рекомбинантного человеческого тромбомодулина (rh-TM). Измерения проводили в бедной тромбоцитами плазме, конечная концентрация тканевого фактора (TF) составляла 5 пМоль. С помощью программного обеспечения ThrombinoscopeR, версия 3.0.0.26, производилось построение и расчет показателей кривых генерации тромбина. Определяли эндогенный потенциал тромбина (ЕТР, нМоль*мин), который отражает общее количество образованного в процессе генерации фермента, и показатель максимальной концентрации тромбина — Peak thrombin (нМоль). Чувствительность к ТМ (в %) рассчитывали как процент падения ЕТР и Peak thrombin при добавлении в реакционную смесь rh-TM. Уменьшение этого показателя свидетельствует о снижении эффективности работы системы PC.
Результаты. Известно, что у здоровых детей до 18 лет параметры генерации тромбина ниже соответствующих значений у взрослых [7, 8]. Однако, как показали наши исследования, у детей с сепсисом в острую стадию заболевания показатели генерации тромбина превышали таковые в группе здоровых взрослых, что свидетельствовало о значимом усилении генерации тромбина у больных детей (табл. 2). Наиболее показательными были результаты определения Peak thrombin и чувствительности к ТМ. Показатель Peak thrombin в постановке с rh-TM был выше взрослой нормы у всех детей. У всех пациентов в острой стадии заболевания отмечалось резкое снижение чувствительности к rh-TM как по проценту падения ЕТР, так и по проценту падения Peak thrombin. Последнее отражает несостоятельность работы антикоагулянтной системы PC у детей с сепсисом, что связывают с дисфункцией эндотелия на фоне генерализованной инфекции.
Таблица 2.
Параметры генерации тромбина у детей в остром периоде заболевания по сравнению с нормой у здоровых взрослых лиц (Me, 95 % ДИ)
|
Параметры генерации тромбина |
Норма для взрослых |
Пациент 1, 12 лет |
Пациент 2, 3 года |
Пациент 3, 3 года |
Пациент 4, 3 года |
Пациент 5, 4 года |
|
ЕТР без rh-TM, нМоль*мин |
1756,0 (1220,6-2159,9) |
1941,5 |
2016,5 |
1722,5 |
1269,0 |
1717,0 |
|
ЕТР с rh-TM, нМоль*мин |
878,0 (538,8-1381,0) |
1846,5 |
1924,0 |
1698,0 |
1252,5 |
1627,0 |
|
Чувствительность ЕТР к rh-TM, % |
51,5 (22,9-64,4) |
5,0 |
4,0 |
2,0 |
1,0 |
5,0 |
|
Peak thrombin без rh-TM, нМоль |
293,9 (198,7-376,1) |
396,5 |
427.7 |
387,9 |
324,9 |
341,9 |
|
Peak thrombin c rh-TM, нМоль |
174,5 (113,8-310,0) |
341,9 |
416.0 |
386,1 |
325,4 |
336,7 |
|
Чувствительность Peak thrombin к rh-TM, % |
35,8 (14,8-53,1) |
2,0 |
3,0 |
0,4 |
0 |
2,0 |
Динамику изменения параметров генерации тромбина в зависимости от стадии заболевания удалось проследить лишь у одного пациента, краткая выписка из истории болезни которого представлена ниже.
Пациент Б-в А., 01.10.2003 года рождения (12 лет), поступил в ФГБУ ДНКЦИБ ФМБА России 04.03.2016 с основным диагнозом: Генерализованная менингококковая инфекция, смешанная форма (вызванная N.meningitidis с/г W135): менингококцемия, гнойный менингит.
Осложнения: септический шок в стадии децентрализации, СПОН, ДВС-синдром; церебра-стенический синдром на фоне инфекционно-гипоксической энцефалопатии, полинейропатия критического состояния; трофоневротический некроз кожи левого плеча и левой голени, с захватом голеностопного сустава.
Ребенок поступил из дома на 2 сутки заболевания с клиникой генерализованной менигокок-ковой инфекции, менингококцемии, гнойного менингита, осложненного декомпенсированным септическим шоком.
Анамнез болезни: заболел утром 03.03.2016 г. Температура тела к 15 часам дня поднялась до 400, жаловался на сильные боли в области левого колена, головную боль. С вечера 03.03 не мочился. В связи с появлением спутанного сознания к утру 04.03.2016 госпитализирован в ОРИТ ФГБУ ДНКЦИБ ФМБА России с диагнозом: генерализованная менингококковая инфекция, септический шок.
При поступлении состояние крайней тяжести, обусловленной декомпенсированным септическим шоком. Клинико-лабораторные про явления свидетельствовали о наличии у ребенка полиорганной недостаточности: церебральной (сознание спутанное 10-11 баллов по шкале ком Глазго), острой сердечно-сосудистой (АД 62/40 мм рт.ст, ЧСС-168 уд/мин; кожные покровы бледные, выраженная мраморность, дистальные отделы конечностей с цианотичным оттенком, признаки венозных стазов, гипотермия стоп, голеней до средней трети, кистей), острой почечной (анурия более 15 часов; мочевина — 13,2 ммоль/л; креатинин— 132,7 мкг/л); белково-синтетической функции печени (общий белок — 44 г/л, альбумин 29 г/л). На конечностях, лице и мошонке необильная звездчатая геморрагическая сыпь. Декомпенсированный метаболический ацидоз: уровень лактата (в венозной крови) -11,28 ммоль/л; резкое повышение уровней СРБ — 266 ед и ПКТ — более 200 пг/мл, тромбоцитопения (число тромбоцитов при поступлении 46 х 109/л).
Как видно из таблицы 3, при поступлении в стационар 04.03.2016 г. на фоне развернутой картины полиорганной недостаточности у пациента имелись нарушения, характерные для развернутой картины синдрома ДВС. Подтверждением сказанному служили снижение числа тромбоцитов, удлинение АПТВ, увеличение МНО, нормальный уровень фибриногена, не соответствующий тяжести воспалительного процесса, увеличение уровня D-димера и умеренное снижение активности антиплазмина. Отмеченное в это же время значимое снижение активности антитромбина до 24% при норме от 80% подтверждало интенсивность процесса образования тромбина.
Таблица 3.
Показатели гемостаза у пациента Б-ва, 12 лет
|
Показатели |
Пределы нормальных колебаний |
04.03 |
11.03 |
14.03 |
26.05 |
|
Тромбоциты * 109/л |
150-400 |
46 |
326 |
— |
— |
|
МНО |
0,9-1,1 |
2,57 |
1,27 |
1,36 |
1,12 |
|
АЧТВ, с. |
24,3-35 |
51,9 |
31,1 |
28,1 |
38,8 |
|
Фибриноген, г/л |
2,2-4,9 |
3,15 |
- |
7,76 |
4,27 |
|
ТВ, с. |
11-17 |
14.7 |
14.4 |
15 |
15,2 |
|
Антитромбин, % |
83-128 |
24 |
39 |
— |
— |
|
Плазминоген,% |
72,9-126 |
82 |
98 |
— |
— |
|
Анти плазмин,% |
89,3-112 |
79 |
119 |
— |
— |
|
D-димер, нг/мл |
< 500 |
8000 |
1000-2000 |
1000-2000 |
— |
Реанимационные мероприятия: перевод на ИВЛ, этиопатогенетическая терапия, продленная вено-венозная гемодиафильтрация привели к стабилизации гемодинамики к 06.03.16 г. Однако состояние ребенка оставалось крайне тяжелым за счет сохранявшихся проявлений церебральной недостаточности, белково-синтетической недостаточности печени. В местах наиболее крупных элементов менингококковой сыпи в зонах длительно сохранявшихся венозных стазов вследствие сосудистых тромбозов отмечалось формирование зон глубоких некрозов кожи и подлежащих мягких тканей (фото 1).
На фоне проводимой комплексной терапии к 10 дню от начала заболевания (11.03.16 г.) постепенное улучшение состояния — купирование проявлений церебрастенического синдрома, расширение двигательной активности, нормализация числа тромбоцитов до 326*109/л. В этот же период отмечалась некоторая коррекция показателей гемостаза: уменьшение АПТВ с 51,9 с. до 31,1 с. и МНО с 2,57 до 1,27; повышение уровня плазминогена и активности антиплазмина с 82 % до 98 % и с 79 % до 119 % соответствен- но, снижение уровня D-димера с 8000 нг/мл до 1000-2000 нг/мл. Активность антитромбина несколько повысилась, но сохранялась на критическом уровне в пределах 30%-39%. На основании полученных лабораторных данных можно было предположить ослабление интенсивности процесса тромбинообразования у наблюдаемого больного. Однако по результатам ТГТ, проведенного на 10 сутки от начала заболевания, интенсивность процесса образования тромбина была высокой: показатель максимальной концентрации тромбина (Peak thrombin) в обеих постановках ТГТ без и с тромбомодулином превышал пределы нормальных значений в контрольной группе здоровых людей, составляя 396,5 нМоль и 341,9 нМоль против 198,7 нМоль — 376 нМоль и 113,8 нМоль — 310,0 нМоль соответственно. Превышал норму и показатель ЕТР в постановке с тромбомодулином. Одновременно с этим отмечалось значительное угнетение активности антикоагулянтной системы протеина С: чувствительности ЕТР и Peak thrombin к rh-TM составили 5 % и 2 % против 22,9 %-64,4% и 15 %-53 % соответственно (табл. 4).
Таблица 4.
Параметры генерации тромбина у пациента Б-ва А., 12 лет
|
Параметры |
Норма у взрослых |
11.03.16 |
26.05.16 |
|
ЕТР без rh-TM, нМоль*мин |
1756,0 1220,6-2159,9 |
1941,5 |
1648,0 |
|
ЕТР с rh-TM, нМоль*мин |
878,0 538,8-1381,0 |
1846,5 |
1073,5 |
|
Чувствительность ЕТР к rh-TM, % |
51,5 22,9-64,4 |
5 |
35 |
|
Peak thrombin без rh-TM, нМоль |
293,9 198,7-376,1 |
396,5 |
279,3 |
|
Peak thrombin c rh-TM, нМоль |
174,5 113,8-310 |
341,9 |
210,1 |
|
Чувствительность Peak thrombin к rh-TM, % |
35,8 14,8-53,1 |
2 |
25 |
При обследовании 26.05.16, на 32 день от начала заболевания, в период реконвалесценции, общее состояние удовлетворительное, ребенок в ясном сознании, полностью ориентирован, контактен. Высшие корковые функции не нарушены. На коже небольшие по площади кожные дефекты на руках, бедрах в местах отторжения некрозов, формировавшихся на месте менин-гокковой сыпи, в области левой голени — плотная корка над раневым кожным дефектом около 8-10 см в диаметре без признаков вторичного инфицирования. При выписке количество тромбоцитов, общие коагуляционные показатели (АПТВ, МНО, тромбиновое время, концентрация фибриногена) в пределах нормы (табл. 3). Показатели генерации тромбина ЕТР и Peak thrombin в обеих постановках теста не превышали значения в группе здоровых взрослых. Нормализовалась чувствительность к тромбомодулину по проценту падения ЕТР и Peak thrombin до 35 % и 25 % соответственно.
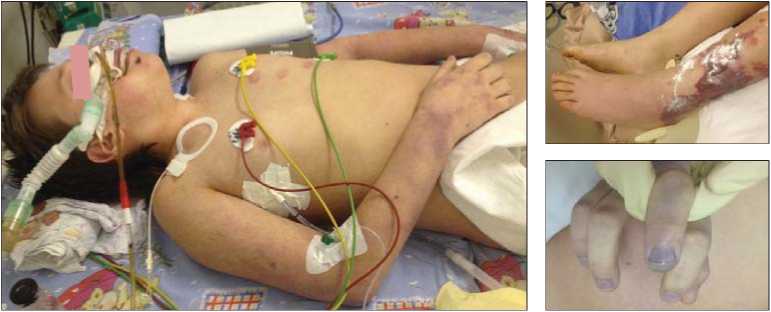
Фото 1.
Больной Б-в А. 3-и сутки от момента поступления в ОРИТ ДНК ЦИ
Выводы. Проведенное исследование позволяет предположить, что тест генерации тромбина является хорошим инструментом для диагностики гиперкоагуляции. Существенным преимуществом данного интегрального метода являет ся возможность одновременной оценки вклада в патологический процесс системы протеина С, угнетение которой является одной из причин гиперкоагуляции в связи с генерализованными инфекционными заболеваниями.


