Генетические детерминанты устойчивости хвойных древесных растений Урала к воздействию абиотических и биотических факторов
Автор: Чертов Н.В., Сбоева Я.В., Жуланов А.А. Васильева Ю.С., Наговицына В.О., Боронникова С.В.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Естественные науки
Статья в выпуске: 9 т.11, 2025 года.
Бесплатный доступ
Процессы глобального потепления и масштабное воздействие инвазивных видов, таких как уссурийский полиграф, приводят к деградации лесных экосистем и их биологического разнообразия. Целью исследований являлись выявление генетических факторов устойчивости видов хвойных растений на примере сосны обыкновенной (Pinus sylvestris L.) и гибридного комплекса елей обыкновенной и сибирской (Picea abies (L.) H. Karst.–P. obovata Ledeb.) к засухе и анализ их генетических детерминант устойчивости к воздействию патогенных организмов и фитофагов в регионе инвазии уссурийского полиграфа на Урале. Разработаны и протестированы 16 пар праймеров к локусам адаптивно- значимых генов P. sylvestris и P. abies–P. obovata, ассоциированных с засухоустойчивостью; выявлены 97 и 110 полиморфных позиций в изученных локусах видов соответственно. Установлено, что изученные виды имеют в целом средний уровень нуклеотидного разнообразия в регионе как для P. sylvestris (Hd = 0,662; π = 0,004; θW = 0,013) так и для P. abies–P. obovata (Hd = 0,761; π = 0,005; θW = 0,008). Выявлены локусы, полиморфизм которых потенциально адаптивен в отношении абиотических (устойчивость к засухе) и биотических (воздействие патогенных организмов) факторов среды, перспективные для дальнейшего изучения. Полиморфизм локусов адаптивно-значимых генов, ассоциированных с устойчивостью к засухе и воздействию патогенных организмов, рекомендуется учитывать при оценке состояния генофондов популяций видов хвойных растений в регионе исследований.
Генетический полиморфизм, адаптивно-значимые гены, засухоустойчивость, фитопатогены, уссурийский полиграф, Pinus sylvestris L., Picea abies (L.) H. Karst.–P. obovata Ledeb., Урал
Короткий адрес: https://sciup.org/14133752
IDR: 14133752 | УДК: 575.174.4:575.167:582.475.2 | DOI: 10.33619/2414-2948/118/03
Текст научной статьи Генетические детерминанты устойчивости хвойных древесных растений Урала к воздействию абиотических и биотических факторов
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 575.174.4:575.167:582.475.2
Изменение климата является глобальной проблемой современности. При интенсификации потепления и увеличении частоты засух по всему миру лесные экосистемы являются одними из наиболее чувствительных к засухе [1]. В связи с этим необходимо изучать механизмы засухоустойчивости и генетическую изменчивость популяций хвойных растений для выявления устойчивых форм деревьев, которые можно будет использовать при восстановлении лесов в условиях глобального потепления. Адаптацию растений к засухе можно проследить на анатомическом, физиологическом, биохимическом и генетическом уровнях, что свидетельствует о комплексной приспособленности растений к преодолению стресса от недостатка воды [2].
С изменениями климата на планете связано увеличение случаев инвазий ксилофильной энтомофауной, которым способствует транспортировка древесины без учета карантинных мер [3; 4]. Уссурийский полиграф Polygraphus proximus Blandford (Coleoptera, Curculionidae, Scolytinae) является дальневосточным видом и его инвазийное продвижение на запад повлекло масштабные повреждения пихтовых лесов на территории Российской Федерации [5]. К настоящему времени этот чужеродный вид найден на территории 18 субъектов РФ [6]. В Пермском крае инвайдер был обнаружен в 2022 году в городских лесах г. Перми и 5 лесничествах Пермского края, а к 2023 г. его распространение было зарегистрировано уже в 8 лесничествах [6, 7].
По данным на март 2025 г, уссурийский полиграф повредил пихтовые насаждения в 43 муниципалитетах Пермского края, затронув 23 лесных массив, а в июле 2025 г повреждения деревьев пихты сибирской ( Abies sibirica Ledeb.) отмечены еще в 4 лесничествах (1). Следствием этих процессов является деградация лесных экосистем и их биологического разнообразия. Уссурийский полиграф переносит несколько видов офиостомовых грибов, но именно Grosmannia (Ophiostoma) aoshimae Ohtaka & Masuya демонстрирует наиболее тесную связь с P. proximus и претендует на роль постоянного и специфичного ассоцианта этого вредителя [8].
Ассоцианты являются фитопатогенами, ослабляют растение хозяина и способствуют дальнейшему заселению деревьев жуками [9].
У пихты сибирской отмечена низкая устойчивость к P. proximus и к ассоциированному с ним офиостомовому грибу G. aoshimae [10, 11].
Это объясняется, в частности, тем, что у пихты сибирской группы склереид, придающих механическую прочность, располагаются во флоэме менее плотно. Это делает флоэму A. sibirica более проницаемой, как для внедрения полиграфа, так и для гиф офиостомовых грибов, а обильное смолотечение A. sibirica , возникающее в ответ на многочисленные атаки инвайдера, быстро ослабляет дерево [12, 13]. Вместе с тем, генетические детерминанты устойчивости пихты на Дальнем Востоке (в первичном ареале P. proximus ) не исследованы.
В настоящее время уссурийский полиграф во вторичном ареале поражает стволы пихты сибирской ( A. sibirica ), но возможен его перенос на виды из родов Pinus и Picea [6, 14, 15].
Так, в Томской области жуки были обнаружены единично на дереве Picea obovata Ledeb., в стволе дерева Pinus sibirica Du Tour., а также в ветвях Pinus sylvestris L. [13, 16].
Коэволюцию видов древесных растений и их вредителей («хозяин-паразит») детально изучают в Институте леса Национальной академии наук Республика Беларусь [17].
В Сибирском федеральном университете (г. Красноярск) проведено исследование геномов видов хвойных растений из родов Pinus , Picea, Abies, Larix. Кроме этого, изучают одновременно генетические детерминанты засухоустойчивости и устойчивости видов хвойных растений к воздействию фитопатогенов в лесах Сибири [18].
Одним из подходов выявления генетических детерминант устойчивости является анализ однонуклеотидных полиморфизмов (SNP – Single Nucleotide Polymorphism), который позволяет проводить исследования ассоциативного картирования в естественных популяциях хвойных растений. Обнаружение SNP в генах-кандидатах является основным направлением в геномике древесных растений в последние годы [19].
Таким образом, устойчивость к абиотическим (засуха) и биотическим (воздействие патогенных организмов) факторам необходимо изучать не только у пихты сибирской, но и у других видов хвойных растений, включая P. sylvestris и комплекс видов елей ( P. abies–P. obovata ). Данные характеристики видов хвойных растений во вторичном ареале распространения уссурийского полиграфа на Урале изучены фрагментарно, и практически не изучены генетические детерминанты данной устойчивости.
Цель исследования — выявление генетических факторов устойчивости сосны обыкновенной и комплекса видов елей P. abies–P. obovata к засухе и анализ генетических детерминант устойчивости хвойных видов растений к воздействию фитопатогенов в Уральском регионе (Северный, Средний и Южный Урал) инвазии уссурийского полиграфа.
Материал и методы исследования
Объектами исследований являлись 14 природных популяций сосны обыкновенной ( Pinus sylvestris L.) и 8 популяций комплекса елей обыкновенной и сибирской ( P. abies– P. obovata ) в пределах Среднего, Северного и Южного Урала. Одиннадцать из изученных популяций P. sylvestris располагаются на территории Пермского края: в Чердынском ( PS_Ch ), Гайнском ( PS_Gn ), Кочёвском ( PS_Kh ), Березниковском ( PS_Rm ), Кудымкарском ( PS_Ln ), Добрянском ( PS_Pl ), Сивинском ( PS_Kr ), Чусовском ( PS_Bl ), Пермском ( PS_Uk ), Кунгурском ( PS_Pr ) и Октябрьском ( PS_Sk ) лесничествах, две популяции находятся в Республике Башкортостан: в Дуванском ( PS_Mh ) и Салаватском ( PS_Sl ) лесничествах, одна популяция находится в Каслинском лесничестве ( PS_Ar ) Челябинской области. Популяции комплекса видов P. abies–P. obovata из Пермского края: Чердынское лесничество ( Po_Ch ), Красновишерское лесничество ( Po_Kr) , Гаинское лесничество( Po_Gn ), Кочёвское лесничество( Po_Kc ), Березниковское лесничество ( Po_Br ), Кудымкарское лесничество( Po_Kv) , Сивинское лесничество ( Po_Kg ) Карагайского района, Пермское лесничество( Po_Pr) (Рисунок 1).
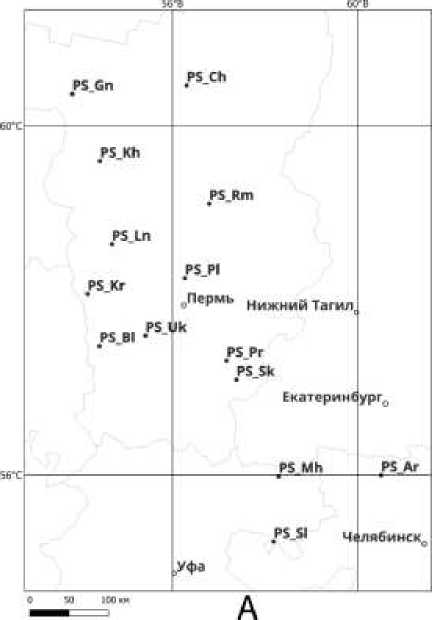
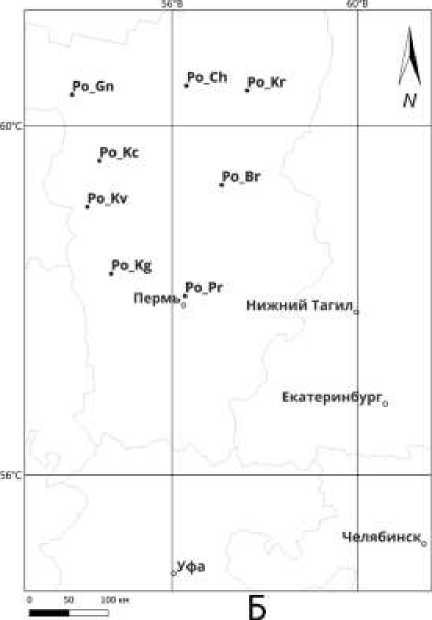
Рисунок 1. Схема расположения популяций изученных видов. Обозначения: А) выборки из популяций P. sylvestris в Чердынском ( PS_Ch ), Гайнском ( PS_Gn ), Кочёвском ( PS_Kh ), Березниковском ( PS_Rm ), Кудымкарском ( PS_Ln ), Добрянском ( PS_Pl ), Сивинском ( PS_Kr ), Чусовском ( PS_Bl ), Пермском ( PS_Uk ), Кунгурском ( PS_Pr ), Октябрьском ( PS_Sk ), Дуванском ( PS_Mh ), Салаватском ( PS_Sl ), Каслинском ( PS_Ar ) лесничествах; Б) выборки из популяций комплекса видов елей P. abies–P. obovata в Чердынском ( Po_Ch) , Красновишерском ( Po_Kr ), Гаинском ( Po_Gn ), Кочёвском ( Po_Kc ), Березниковском ( Po_Br ), Кудымкарском ( Po_Kv ), Сивинском ( Po_Kg ), Пермском лесничествах ( Po_Pr )
Расстояние между самыми удаленными популяциями P. sylvestris составило 628 км. Максимальное расстояние между популяциями P. abies–P. obovata составляло 283 км. Сбор материала и молекулярно-генетический анализ проводились с 2018 по 2025 гг. Для проведения исследований весной были собраны образцы хвои индивидуально с 28-31 дерева каждой выборки, расположенных на расстоянии не менее 100 метров друг от друга, всего у P. sylvestris образцы собраны с 434 деревьев, а у P. abies–P. obovata – с 246 деревьев. Материалом для молекулярно-генетических исследований являлась хвоя из распустившихся почек. На основании ранее проведенного молекулярно-генетического анализа из каждой изученной популяции P. sylvestris и P. abies – P. obovata , отобраны по 8 наиболее полиморфных проб ДНК, которые были использованы для определения нуклеотидных последовательностей локусов адаптивно-значимых генов этих видов.
Выделение ДНК из растительного материала проводили по методике Уго Кота-Санчес [20] с использованием СТАВ (CetylTrimethylAmmonium Bromide) и PVPP (PolyVinylPolyPyrrolidone). Разработка праймеров для определения нуклеотидных последовательностей локусов адаптивно-значимых генов, ассоциированных с устойчивостью к воздействию факторов среды, проведена в программе Primer3Plus [21] со следующими параметрами: длина содержащего SNP амплифицируемого фрагмента – 400-600 нуклеотидов, оптимальная длина праймера - 20 нуклеотидов, оптимальная температура отжига - 60°С. Отобраны пары праймеров, не образующие димеров и неспецифических продуктов амплификации.
Для проверки уникальности амплифицируемых этими праймерами последовательностей выполнен поиск гомологичных фрагментов в геномах и транскриптомах изучаемых видов. Исключены последовательности, для которых найдено больше одного фрагмента.
Для амплификации нуклеотидных последовательностей использовалась реакционная смесь объемом 10 мкл содержащая: 10х буфера для ПЦР («Евроген», Россия); 2,5 мМ MgCl2; 200 мкМ (0,2 мМ) каждого dNTP; 0,2 мкМ каждого праймера; 0,5 ед. Taq-полимеразы; 10 нг тотальной ДНК. Амплификацию проводили в термоциклере GeneAmp PCRSystem 9700 (“Applied Biosystems”, США) по программe: 5 мин – 94°C, следующие 30 циклов (94°C – 30 секунд, Т отж °C – 45 сек, 72°C – 2 мин), 72оС – 10 мин. Продукты амплификации разделяли электрофорезом в 2% агарозном геле.
Для рeакции секвенирования применяли набор BigDye® Terminator v3.1 Cycle Sequencing Kit (“Applied Biosystems”, США), в качестве праймера использована прямая последовательность из пары праймeров, с которой была поставлена ПЦР. Очистку продуктов рeакции сeквeнирования от нeвступивших в рeакцию мeчeных нуклeотидов осущeствляли с помощью набора BigDye® XTerminatorTM Purification Kit (“Applied Biosystems”, США). Капиллярный электрофорез синтeзированных послeдоватeльностeй проведен в ПЦР-лаборатории кафeдры ботаники и генетики растений ПГНИУ (Россия) на 24-капиллярном гeнeтичeском анализаторe Genetic Analyzer 3500xL (“Applied Biosystems”, США). Нуклеотидные последовательности ДНК были секвенированы в среднем у восьми деревьев из каждой популяции. Редактирование секвенированных последовательностей проводили в программе GeneScan v2.0 («Applied Biosystems», США), местоположение полиморфных позиций определяли посредством множественного выравнивания послeдоватeльностeй в компьютерной программе UGENE v1.50 [22].
Данные о секвенированных последовательностях локусов (в формате FASTA sequence) сравнивали с имеющимися последовательностями в генетической базе данных в базах данных с помощью BLAST+ [23] на сайте NCBI , а также с помощью инструментов UniProtKB . Секвенирование нуклеотидных последовательностей избранных локусов проведено в двух, а для отдельных локусов в трех повторностях.
В программе DnaSP v6.11.01 [24] были реконструированы гаплотипы, и на основе сравнения их нуклеотидных последовательностей рассчитаны следующие показатели нуклеотидного полиморфизма: число вариабельных сайтов ( S ), число гаплотипов в популяции ( h n ), общее гаплотипическое разнообразие ( Hd ) по формуле, предложенной М. Неем [25], нуклеотидное разнообразие ( π ), оценивающее среднее число парных различий между двумя последовательностями на сайт, параметр нуклеотидного разнообразия (на сайт), вычисленный исходя из числа мутаций ( θ W ) или оценка Уоттерсона [26]. Для оценки соответствия характера нуклеотидных замен гипотезе нейтральности в изученных популяциях для каждого локуса выполняли D-тест Таджимы [27], то есть проверялась степень нейтральности имеющегося полиморфизма по отношению к естественному отбору.
Результаты и обсуждение
Генетическое разнообразие и генетическая структура определены ранее в Пермском крае в популяциях P. sylvestris [28, 29] и комплекса елей P. abies – P. obovata [30, 31]. В результате биоинформационного анализа для изучения нуклеотидного полиморфизма P. sylvestris избраны три группы адаптивно-значимых генов: дегидрины, гены сигнального пути абсцизовой кислоты, гены белков теплового шока. Подобраны нуклеотидные последовательности адаптивно значимых генов сосны обыкновенной, имеющие выраженные однонуклеотидные замены (SNP), фланкированные сравнительно консервативными фрагментами. Для анализа нуклеотидного полиморфизма P. sylvestris было создано 16 пар праймеров к локусам потенциально адаптивно-значимых генов и проведена их тестовая амплификация для сосны обыкновенной [29].
Успешную специфическую амплификацию единственного фрагмента на электрофорезе показали праймеры Pinus-11 , Pinus-12 , Pinus-15, которые были отобраны для дальнейшего анализа с ДНК P. sylvestris (Таблица 1). В результате были получены продукты амплификации локусов трех генов сосны обыкновенной, обладающих схожей активностью по Gene Ontology (GO), GO:0009408 «реакция на жару». Был произведен поиск гомологов к отобранным локусам в базах данных NCBI и UniProt. Локус Pinus-11 гомологичен (60,5%) гену, контролирующему белок малого теплового шока (Small heat shock protein, A0AA38G6F5) в базе данных UniProt. В базе данных NCBI гомологов для данного локуса найдено не было. Локус Pinus-12 гомологичен (71,7%) белку малого теплового шока, домен альфа-кристалин (alpha-crystallin domain (ACD) of alpha-crystallin-type small heat shock proteins) в базе данных NCBI (ABK22047.1). Локус Pinus-15 гомологичен (93,6%) транскрипционному фактору Pinus taeda L. (MYB transcription factor) в базе данных NCBI (AC241314.1) (Таблица 1).
Таким образом, для изучения нуклеотидного полиморфизма P. sylvestris были отобраны три локуса потенциально адаптивно-значимых генов и проведено секвенирование их последовательностей.
По результатам биоинформационного анализа для изучения нуклеотидного полиморфизма комплекса видов елей P. abies–P. obovata отобраны основные семейства генов, связанных с засухоустойчивостью хвойных древесных растений, а именно гены семейства дегидринов (DHN); гены группы белков позднего эмбриогенеза (LEA); гены класса белков теплового шока (HSP); гены белков синтеза и транспорта осмопротекторных углеводов; гены синтеза пролина; гены белков защиты от оксидативного стресса; гены метаболических путей этилена и абсцизовой кислоты [31].
Таблица 1
ЛОКУСЫ ГЕНОВ, ОТОБРАННЫЕ ДЛЯ ИЗУЧЕНИЯ НУКЛЕОТИДНОГО ПОЛИМОРФИЗМА
P. sylvestris И КОМПЛЕКСА ВИДОВ P. abies – P. obovata
|
Локус |
Продукт |
Gene Ontology (GO) |
Идентификатор |
|
Pinus-11 |
Малый белок теплового шока |
GO:0009408 |
UniProt: A0AA38G6F5 |
|
Pinus-12 |
Альфа-кристаллиновый домен малого белка теплового шока |
GO:0009408 |
NCBI: ABK22047.1 |
|
Pinus-15 |
MYB-транскрипционный фактор |
GO:0009408 |
NCBI: AC241314.1 |
|
Pic01 |
3’UTR гена, гомологичного кодирующему альфа-глюканфосфорилазу |
GO:0009414 |
NCBI: BT119940 |
|
Pic02 |
Домен протеинкиназы, протеинтирозинкиназа |
GO:0009414 |
NCBI: DR048223 |
|
Pic04 |
Ингибитор Bax1, стимулирующего апоптоз |
GO:0009414 |
GE472823 |
|
Pic06 |
экзоном гена, гомологичного митохондриальному гену, кодирующему ацетилорнитин аминотрансферазу |
GO:0009414 |
NCBI: XM_058003929 |
|
Pic13 |
кодирующему рецептор-подобный серин/треонин-протеинкиназу BAM1 |
GO:0009414 |
NCBI: XP_057833279 |
|
Pic14 |
Домен BTB/POZ, MATH-содержащий домен белка 2 |
GO:0042631 |
NCBI: XM_057985325 |
Для анализа нуклеотидного разнообразия комплекса видов елей P. abies–P. obovata были разработаны 16 пар праймеров к последовательностям различных регионов избранных адаптивно-значимых генов, с которыми проведена тестовая амплификация. В результате успешную амплификацию в ПЦР единственного фрагмента на электрофорезе показали праймеры Pic01, Pic02, Pic04, Pic06, Pic13, Pic14, которые были избранны для дальнейшего анализа в геноме P. abies–P. obovata [31].
Поиск последовательностей, гомологичных полученным в ходе секвенирования избранных локусов P. abies–P. obovata в БД NCBI и UniProtKB позволил установить, что локусы Pic02, Pic06, Pic13 и Pic14 частично схожи с известными генами других видов, для локусов Pic01 и Pic04 аннотированных последовательностей не найдено. Таким образом для анализа нуклеотидного полиморфизма P. abies–P. obovata избраны адаптивно-значимые гены, участвующие в различных метаболических путях (Таблица 1).
Секвенированные нуклеотидные последовательности были выровнены между собой и в результате множественного выравнивания в сиквенсах P. sylvestris было обнаружено всего 97 полиморфных позиций. Самым консервативным по результатам множественного выравнивания являлся локус Pinus-15 , в последовательности которого обнаружено 3 полиморфные позиции. Наибольшее число полиморфных сайтов выявлено в локусе Pinus-12 – 84 замены (Таблица 2).
В последовательностях комплекса P. abies–P. obovata всего обнаружено 110 полиморфных позиций. При этом самыми консервативными оказались локусы Pic02 , Pic04 и Pic06 , в последовательностях которых обнаружено 12, 11 и 14 нуклеотидных замен соответственно. Наибольшее число полиморфных сайтов ( S ) выявлено в локусе Pic01 – 31 замена (Таблица 2).
Общее гаплотипическое разнообразие ( Hd ) для P. sylvestris по трем изученным локусам варьировало от 0,630 (локус Pinus-12 ) до 0,737 (локус Pinus-11 ) и в среднем этот показатель составил 0,662.
Наибольшее значение показателя нуклеотидного разнообразия ( π ) между двумя последовательностями ДНК P. sylvestris выявлено в локусе Pinus-12 ( π = 0,005), а наименьшее – в локусе Pinus-15 ( π = 0,003), и в среднем по трем локусам P. sylvestris этот показатель составил 0,004. Оценка Уоттерсона нуклеотидного разнообразия, рассчитанная по количеству мутаций ( θ W ) в локусах P. sylvestris , также выявила самые высокие значения в локусе Pinus-12 ( θ W = 0,032), а самые низкие в локусе Pinus-15 ( θ W = 0,002). Таким образом Pinus-15 является наиболее консервативным из изученных в геноме P. sylvestris . Для проверки гипотезы о нейтральности существующего полиморфизма использовался D -тест Таджимы ( D T ).
Таблица 2
ЧИСЛО ГАПЛОТИПОВ И ПОЛИМОРФНЫХ САЙТОВ
ДЛЯ ИЗУЧЕННЫХ ЛОКУСОВ ДВУХ ВИДОВ ХВОЙНЫХ РАСТЕНИЙ
|
Локус |
P. abies–P. obovata |
Локус |
P. sylvestris |
|||||
|
Pic01 |
h n |
62 |
Pic06 |
h n |
15 |
Pinus-11 |
h n |
19 |
|
S |
31 |
S |
14 |
S |
10 |
|||
|
Pic02 |
h n |
14 |
Pic13 |
h n |
25 |
Pinus-12 |
h n |
45 |
|
S |
12 |
S |
23 |
S |
84 |
|||
|
Pic04 |
h n |
11 |
Pic14 |
h n |
24 |
Pinus-15 |
h n |
6 |
|
S |
11 |
S |
19 |
S |
3 |
|||
Примечание: hn – число гаплотипов; S – число полиморфных сайтов на локус; Pic01 , Pic02 , Pic04 , Pic06 , Pic13 , Pic14 – изученные локусы P. abies–P. obovata; Pinus-11, Pinus-12, Pinus-15 – изученные локусы P. sylvestris
Было выявлено, что для локусов Pinus-11 и Pinus-12 значения оценочного коэффициента Уоттерсона ( θ W ) превышали индексы нуклеотидного разнообразия π , что свидетельствовало об избытке редких аллелей и согласовывалось с отрицательными значениями теста Таджимы D в популяциях P. sylvestris . Наиболее близкое к нулю значение D T (-0,890) было обнаружено в локусе Pinus-11 , поэтому можно предположить, что полиморфизм этого локуса является селективно нейтральным. Наибольшее отклонение от нейтрального значения ( D T = -2,615) было обнаружено в локусе Pinus-12. Для локуса Pinus-15 отмечено положительное отклонение значений D -критерия Таджимы ( D T =0,925), что указывает на незначительный избыток полиморфизмов с промежуточной частотой у данного вида (Таблица 3).
Общее гаплотипическое разнообразие (Hd) для изученных локусов P. abies–P. obovata варьировало от 0,516 (локус Pic06) до 0,947 (локус Pic01) и в среднем составило 0,761. Показатель нуклеотидного разнообразия (π) в популяциях комплекса елей P. abies–P. obovata, выше в локусе Pic01 (π = 0,011), а меньше – в Pic06 (π = 0,002), и в среднем по шести локусам этот показатель составил 0,005. Оценка Уоттерсона (θW) для комплекса елей выявил наибольшие значения также в локусе Pic01 (θW = 0,011), а меньшие – в локусах Pic02 (θW = 0,006), Pic04 (θW = 0,006) и Pic06 (θW = 0,006). Это свидетельствует о том, что Pic06 является самым консервативным из шести изученных локусов. Значения оценки Уоттерсона в пяти из шести изученных локусов P. abies–P. obovata превышают показатели нуклеотидного разнообразия π, что указывает на избыток аллелей с низкой частотой в данных локусах и согласуется с отрицательными значениями D-теста Таджимы (DT). А наиболее близкое к нулю значение DT (-0,406) обнаружено в локусе Pic01, поэтому можно предположить наибольшую селективную нейтральность полиморфизма данного локуса из всех изученных у комплекса P. abies–P. obovata. Наибольшее отклонение от нейтрального значения (DT = -1,931) выявлено в локусе Pic06, что указывает на потенциально высокую адаптивность полиморфизма данного локуса, и, в сумме с его консервативностью, можно предположить влияние отбора на изменчивость данного гена среди популяций комплекса елей P. abies–P. obovata на Урале (Таблица 3).
Таблица 3 ОБЩЕЕ ГАПЛОТИПИЧЕСКОЕ И НУКЛЕОТИДНОЕ РАЗНООБРАЗИЕ
И СТАТИСТИКА ТЕСТА НА НЕЙТРАЛЬНОСТЬ
ДЛЯ ИЗУЧЕННЫХ ЛОКУСОВ ДВУХ ВИДОВ ХВОЙНЫХ РАСТЕНИЙ
|
Локус |
Hd |
π |
θ W |
D T |
|
P. abies–P. obovata |
||||
|
Pic01 |
0,947 (0,013) |
0,011 (0,000) |
0,011 (0,002) |
-0,406 |
|
Pic02 |
0,701 (0,038) |
0,002 (0,000) |
0,006 (0,002) |
-1,545 |
|
Pic04 |
0,785 (0,029) |
0,005 (0,000) |
0,006 (0,002) |
-0,502 |
|
Pic06 |
0,516 (0,060) |
0,002 (0,000) |
0,006 (0,002) |
-1,931 |
|
Pic13 |
0,843 (0,021) |
0,005 (0,000) |
0,009 (0,002) |
-1,417 |
|
Pic14 |
0,772 (0,035) |
0,004 (0,000) |
0,008 (0,002) |
-1,339 |
|
Среднее |
0,761 (0,145) |
0,005 (0,003) |
0,008 (0,002) |
- |
|
P. sylvestris |
||||
|
Pinus-11 |
0,737 (0,028) |
0,004 (0,000) |
0,006 |
-0,890 |
|
Pinus-12 |
0,630 (0,040) |
0,005 (0,001) |
0,032 |
-2,615 |
|
Pinus-15 |
0,620 (0,025) |
0,003 (0,000) |
0,002 |
0,925 |
|
Среднее |
0,662 (0,010) |
0,004 (0,002) |
0,013 |
- |
Примечание: Hd – общее гаплотипическое разнообразие; π – нуклеотидное разнообразие; θ W – оценка Уоттерсона; D T – коэффициент D- теста Таджимы; в скобках указаны стандартные отклонения ( SD )
Таким образом, изучены показатели нуклеотидного полиморфизма локусов P. sylvestris и комплекса видов елей P. abies–P. obovata на Урале, потенциально адаптивных к экологическим факторам среды , в которых выявлено 97 и 110 полиморфных позиций. Изученные локусы характеризуются средним уровнем нуклеотидного разнообразия как для P. sylvestris ( Hd = 0,662; π = 0,004; θ W = 0,013) так и для P. abies–P. obovata ( Hd = 0,761; π = 0,005; θ W = 0,008) как показали ранее проведенные исследования данных локусов [29, 31], средние показатели нуклеотидного разнообразия комплекса видов елей при этом превышают таковые для сосны обыкновенной, но эта разница незначительна.
Обнаружено, что локус Pinus-15 P. sylvestris гомологичен транскрипционному фактору P. taeda (MYB transcription factor). В исследованиях группы ученных из Кореи по поиску ассоциативных генетических маркеров, связанных с периодами засухи 2000 и 2003 года, было обнаружено около 29 SNP, которые потенциально могут играть роль в устойчивости растений к абиотическим стрессам. Один из этих SNP локализован в гене белка, который взаимодействует c ABF 2 (Abscisic acid responsive elements-Binding Factor 2). Белок ABF 2 способен связываться с ABRE-binding bZIP factor мотивами, находящимися в промоторной области генов, индуцируемых абсцизовой кислотой [32].
К АБК-зависимым генам в первую очередь относят гены MYB и bZIP. Ранее отмечено, что сверхэкспрессия генов MYB увеличивает чувствительность к экзогенной абсцизовой кислоте и улучшает засухоустойчивость за счет эффективного закрытия устьиц в условиях недостатка воды. Транскрипционные факторы семейства bZIP вовлечены в большое количество АБК-зависимых регуляторных путей. Предполагается, что данные гены способствуют улучшению фотосинтетической способности в условиях стресса за счет эффективного регулирования пигментного состава [33].
Исследованный локус Pinus-15, гомологичный гену белка MYB, может быть рассмотрен как маркер устойчивости сосны обыкновенной и других видов хвойных растений к воздействию патогенов при дальнейших исследованиях. Различные типы биотических стрессов, такие как микробная атака (например, грибковая инфекция), атака вредителей, влияют на рост и урожайность растений. Растения используют ряд защитных стратегий для снижения тяжести деструктивных эффектов. Несколько факторов транскрипции играют важную роль во влиянии на внутреннюю защитную систему растений. Белки MYB являются факторами транскрипции, которые генерируют разнообразные стрессовые реакции у растений через несколько взаимосвязанных путей. Консервативный ДНК-связывающий домен (домен MYB) с одним-четырьмя несовершенными аминокислотными повторами, обнаруженный в большинстве белков MYB, считается специализированной характеристикой этого семейства. Белки MYB делятся на четыре различные категории в зависимости от числа и положения аминокислотных повторов. Эти белки MYB функционируют в различных клеточных процессах растений. Изучение регуляторных механизмов белков MYB растений может дать полезную информацию о естественной устойчивости растений к различным патогенным организмам и фитофагам [34].
Одним из механизмов адаптации к водному стрессу является индуцированный синтез специфических белков. Так, например, изменения в составе белков под воздействием стрессовых факторов установлены для приморской сосны ( P. pinaster ) [35, 36].
Для ряда белков доказана их специфичность по отношению к стрессовым факторам. Например, к таким белкам можно отнести белки теплового шока [37] и дегидрины (DHN – Dehydrins) [38, 39].
В данном исследовании изучены локусы Pinus-11 и Pinus-12 P. sylvestris, гомологичные генам, контролирующим малые белки теплового шока: малый белок теплового шока (Small heat shock protein) – Pinus-11 ; альфа-кристаллиновый домен малого белка теплового шока (alpha-crystallin domain (ACD) of alpha-crystallin-type small heat shock proteins) – Pinus-12 . При этом локус Pinus-11 имел средние показатели полиморфности, которая оказалась преимущественно селективно-нейтральной, а локус Pinus-12 напротив выступает в качестве наиболее полиморфного и проявил наибольшее отклонение от нулевого значения теста на нейтральность ( D T = -2,615) , где D T <0, что указывает на избыток полиморфизмов с низкой частотой, который может быть вызван отрицательным отбором и наиболее вероятна связь с адаптивностью гена (Таблица 3). В связи с этим, полиморфизм данного локуса может быть использован в качестве маркера устойчивости сосны обыкновенной и других видов хвойных растений к воздействию засухи.
Биоинформационный анализ изученных локусов комплекса видов елей P. abies–P. obovata показал, что самым консервативным является локус Pic06, оценки вариабельности данного локуса имели самые низкие значения (Hd = 0,516; π = 0,002; θW = 0,006). При этом полиморфизм данного локуса характеризует наибольшее отклонение от нейтрального значения (DT = -1,931) теста Таджимы (Таблица 3). Данные значения указывает на потенциально высокую адаптивность полиморфизма локуса Pic06, в сумме с консервативностью этого локуса, можно предположить влияние отбора на изменчивость данного гена и отобрать полученные SNPs в качестве кандидатов для изучения адаптивной роли полиморфизма данного гена. Локус Pic06 пересекается с экзоном гена, гомологичного митохондриальному гену, кодирующему ацетилорнитин аминотрансферазу (acetylornithine aminotransferase). Данный белок участвует в метаболизме аминокислот, что объясняет его высокую консервативность. Функционально ацетилорнитин аминотрансфераза связывает ответ на стресс и метаболизм азота и потенциально является важным элементом поддержки гомеостаза и регуляции взаимопревращений аминокислот в растительной клетке. Наиболее полиморфным по показателям нуклеотидного разнообразия (Hd = 0,947; π = 0,011; θW = 0,011) P. abies–P. obovata оказался локус Pic01 (табл. 3). Полиморфизм данного локуса имел наиболее близкое к нулю значение теста Таджимы (DT = -0,406), поэтому можно предположить наибольшую селективную нейтральность полиморфизма локуса Pic01. В то же время высокая полиморфность данного локуса дают возможность использовать его для оценки и анализа нуклеотидного разнообразия и дифференциации ели на популяционном уровне. Кроме того, локус Pic01 расположен в области 3’UTR гена, гомологичного кодирующему альфа-глюканфосфорилазу (alpha-glucan phosphorylase). Данный фермент играет центральную роль в поддержании клеточного и организменного гомеостаза глюкозы, что может играть роль в регулировании энергетического метаболизма в условиях водного дефицита. Например, обнаружено, что у L. sibirica рост замедляется во время засухи в большей степени у деревьев с более высокой индивидуальной гетерозиготностью что, вероятно, связано с перераспределением энергии и внутренних ресурсов в сторону более эффективного использования воды и энергии и оптимизации роста в засушливые годы [40].
Так же установлено, что меристематические клетки в условиях дефицита для поддержания гомеостаза и жизнеспособности вынуждены переходить на энергетически менее затратный путь развития клеточных систем – дифференциации и узкой специализации [41].
В связи с этим перспективным также оказывается изучение полиморфизма локуса Pic13 у P. abies–P. obovata, который гомологичен гену, кодирующему серин/треонин-протеинкиназу BAM1 (serine/threonine-protein kinase BAM1). Данный белок, компонент плазматической мембраны, участвует в регуляция роста и структурной организации меристемы, а также в дифференциации клеток.
Для дальнейшего изучения реакции на засуху и стресс, вызванный воздействием фитопатогенов, необходимо с использованием молекулярно-генетических и биохимических методов выявить связь морфологических и физиологических признаков с генами и или областями генома, ответственными за данные характеристики. Несмотря на наличие большого числа научных публикаций, посвященных изучению молекулярно-генетических механизмов устойчивости древесных растений к различным фитопатогенам, применительно к хвойным видам большинство исследований связано с фрагментарным изучением отдельных локусов. Кроме того, представленные результаты часто носят разрозненный или противоречивый характер, что не позволяет сформировать единую концепцию и методологические подходы для анализа наследуемых факторов резистентности по отношению к фитопатогенам у видов рода Pinus и других видов хвойных растений . Среди имеющихся работ, связанных с анализом генов, детерминирующих признаки устойчивости у хвойных растений, можно выделить исследования Ж. Лю с соавторами и Б. Мейерса с соавторами [40, 42].
Авторами на основе известных R-генов травянистых растений, относящихся к суперсемействам, детерминирующим полипептиды, содержащие функциональные нуклеотидсвязывающие (NBS) домены и С-концевые лейциннасыщенные повторы (LRR), идентифицированы их аналоги для P. monticola и P. taeda. Не менее важными маркерами, характеризующими этапы инфекционного процесса и механизмы устойчивости, являются локусы, ассоциированные с патогенетическими реакциями. В целом по результатам проведенных молекулярно-генетических исследований среди PR-генов хвойных растений в наибольшей степени охарактеризованы: локусы, кодирующие литические ферменты, такие как b-1,3 глюканазы (семейство PR-2) и хитиназы (семейства PR-3, -4, -8, -11), участвующие в деградации клеточных стенок грибных микроорганизмов; тауматинподобные белки (семейство PR-5); группа ферментов пероксидаз лигнинобразующего типа, ассоциированных с формированием клеточной стенки (семейство PR-9); рибонуклеазы (семейство PR-10); растительные дефензины (семейство PR-12) [43].
Среди регуляторных механизмов для хвойных видов описаны сигнальные системы, основанные на секреции различных растительных гормонов: жасмонатов, салицилатов, фенилпропаноидов, что, в свою очередь, делает перспективным поиск локусов, связанных с метаболизмом данных соединений [44].
Полученные в данном исследовании показатели общего гаплотипического и нуклеотидного разнообразия локусов адаптивно-значимых генов P. sylvestris и P. abies–P. obovata , ассоциированных с устойчивостью к засухе, воздействию вредителей и ассоциированных с ними фитопатогенов, рекомендуется учитывать при оценке состояния генофондов хвойных видов растений на популяционном уровне в меняющихся климатических условиях.
Заключение
Анализ литературных данных показал, что устойчивость видов хвойных растений к воздействию вредителей и неблагоприятным условиям является поликомпонентной, полисистемной и многоуровневой. Исследованы 14 природных популяций P. sylvestris и 8 популяций комплекса видов ели обыкновенной и ели сибирской (P. abies–P. obovata) в пределах Среднего, Северного и Южного Урала. Разработаны и протестированы 16 пар праймеров к локусам адаптивно-значимых генов P. sylvestris и также 16 других пар праймеров к локусам P. abies–P. obovata, ассоциированных с засухоустойчивостью; выявлены 97 и 110 полиморфных позиций в изученных локусах видов соответственно. Установлено, что изученные виды имеют в целом средний уровень нуклеотидного разнообразия в регионе как для P. sylvestris (Hd = 0,662; π = 0,004; θW = 0,013) так и для P abies–P. obovate (Hd = 0,761; π = 0,005; θW = 0,008). Средние показатели нуклеотидного разнообразия комплекса видов елей незначительно превышают таковые для сосны обыкновенной. Выявлены локусы, полиморфизм которых потенциально адаптивен в отношении абиотических (засуха) и биотических (воздействие патогенных организмов) факторов среды, перспективные для дальнейшего изучения. Анализ литературных данных показал, что устойчивость видов хвойных растений к воздействию вредителей и неблагоприятным условиям является поликомпонентной, полисистемной и многоуровневой. Помимо изучения морфологических характеристик здоровых и поврежденных деревьев первым перспективным направлением дальнейших исследований является выявление молекулярных генетических маркеров, ассоциированных с устойчивостью видов хвойных растений к абиотическим факторам (на примере засухоустойчивости) и к биотическим факторам (на примере устойчивости к инвазии уссурийского полиграфа с ассоциированными с ним офиостомовыми грибами). Вторым перспективным направлением для разработки мер борьбы с инвазивными фитопатогенами в регионе исследований является изучение таксономического состава офиостомовых грибов, ассоциантов уссурийского полиграфа. Третьим направлением возможных исследований может быть изучение гаплотипов уссурийского полиграфа [15] которые оказались более успешными для расселения и освоения конкретного региона. Анализ и учет полиморфизма локусов адаптивно-значимых генов, ассоциированных с устойчивостью к засухе и воздействию патогенных организмов вскоре станет необходимым условием для прогнозирования и разработки природоохранных и лесовосстановительных программ для смягчения потенциального негативного воздействия данных факторов среды.
Финансирование. Данное исследование проведено при частичном финансировании в рамках государственного задания № ФСНФ-2023-0004 Федерального государственного автономного образовательного учреждения высшего образования «Пермский государственный национальный исследовательский университет» в области науки и Правительства Пермского края, исследовательский проект № С-26/776 от 31 марта 2022 года.


