Генетические тромбофилии и гестационные осложнения
Автор: Момот А.П., Николаева М.Г.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 4 т.16, 2020 года.
Бесплатный доступ
В статье приведены современные представления о тромбофилиях, обусловленных, в том числе мутациями фактора V Лейден [F5L(1961) GA] и протромбина [F2G(20210) А], а также их роли в развитии не только тромботических, но и гестационных осложнений. Определена ведущая роль в этом ключе резистентности фактора Vа к активированному протеину С, активности протромбина, а также коморбидности у носительниц этих протромбогенных мутаций. Предложена тактика антикоагулянтной профилактики в целях снижения плацента-опосредованных осложнений у носителей данных мутаций
Мутация фактора v лейден f5l(1691) ga, мутация протромбина [f2g(20210) а], тромбоэмболические осложнения, плацентаопосредованные осложнения, коморбидность, апс-резистентность, активность протромбина, гепаринопрофилактика
Короткий адрес: https://sciup.org/170172550
IDR: 170172550
Текст научной статьи Генетические тромбофилии и гестационные осложнения
понимать состояние с необычной склонностью к тромбозам с дебютом в раннем возрасте у лиц с отягощенным семейным анамнезом,а также несоответствие степени тяжести тромбоза известному причинному фактору и наличие рецидивов тромбоза.При этом акценты были сделаны на врожденные виды тромбофилии, связанные с глубоким наследственным дефицитом антитромбина III,мутацией фактора V Лейден [ F5L(1961) GA ], мутацией протромбина [ F2G(20210) А ], снижением уровней протеинов C и S.Единственной приобретенной формой тромбофилии было признано носительство антифосфолипидных антител (АФА) при антифосфолипидном синдроме (АФС), ассоциированных с артериальными и венозными тромбозами, а также синдромом потери плода.
Одним из основоположников российской гематологии, профессором З. С. Баркаганом,
(в публикациях 1996–200 гг.) под тромбофилией предложено понимать не только приведенные выше причины,но и все наследственные (генетически обусловленные) и приобретенные (вторичные, симптоматические) нарушения гемостаза,для которых свойственна предрасположенность к раннему появлению и рецидивированию тромбозов, тромбоэмболий, ишемий и инфарктов органов. Особое значение в предложенной данным автором классификации придавалось состояниям с повышенной вязкостью крови,обменным заболеваниям — диабету, ожирению, аутоиммунным и инфекционно-иммунным заболеваниям — иммунным тромбоваскулитам, сепсису и т. д., а также ятрогенным,в том числе медикаментозным воздействиям [6].

Зиновий Соломонович Баркаган (1925–2006 гг.)
В международной профессиональной среде развитие учения о тромбофилии также происходило в сторону расширения списка состояний и заболеваний,которые стали включать в себя разнообразные нарушения в системе гемостаза (дисфибриногенемия, результаты ятрогенных воздействий)и некоторые соматические виды патологии (миелопролиферативный синдром, ночная пароксизмальная гемоглобинурия и др.) [7]. Интересно, что в этот список попали беременность и послеродовой период,а также синдром диссеминированного внутрисосудистого свертывания крови [8]. В результате, фактически наличие у человека врожденного или приобретенного фактора риска развития венозных тромбоэмболических осложнений
(ВТЭО), вне зависимости от времени и периода его воздействия, стали отождествлять с тром-бофилией.В итоге понятие о тромбофилии оказалось «размытым» вследствие потери границы между терминами «фактор тромбогенного риска» и «тромбофилия».
В России практикующие специалисты, в том числе гематологи и акушеры-гинекологи, в большинстве случаев ориентируются на распознавание тромбофилии по факту носительства протромбогенных аллелей, а также наличия антифосфолипидных антител (АФА) или определения эффектов «волчаночного антикоагулянта» — после проведения соответствующего генетического, иммунологического или гемостазиологического обследования. В числе критериев тромбофилии, помимо общепризнанных, зачастую неправомерно рассматривается и носительство ряда полиморфизмов генов белков (генов-кандидатов), участвующих в реакциях системы гемостаза — фибриногена, рецепторов тромбоцитов (GPIIIа и др.), а также ферментов,ответственных за метаболизм метионина.
Между тем современные представления о связи носительства протромбогенных мутаций и полиморфизмов с риском клинической реализации акушерских осложнений довольно противоречивы.Данные ряда отчетов и метаанализов свидетельствуют о наличии такой связи [9, 10]. Ассоциированная вероятность возникновения акушерских осложнений оценивается в диапазоне от 10 до 0 %. Из этого следует, что, примерно, у 0–90 % носителей протромботических мутаций имеется лишь постоянный неуправляемый фактор риска, который не реализуется клинически значимым событием. Тем не менее, мы полагаем, что такая связь объективна и обоснована,но ее необходимо оценивать в контексте присутствия у индивида не какого-либо одного фактора тромбогенного риска,а их комбинаций,об-условливающих во всех случаях «мультифак-ториальное» происхождение тромбофилии.
Отметим, что согласно данным мета-анализов (2007, 2014 г. г.), направленных на изучение шансов развития осложнений беременности в зависимости от носительства «гена-кандидата» и его зиготности,риск развития гестационных осложнений определен как значимый для дефицита антитромбина III,протеина С или протеина S,носительства мутаций фактора V Лейден и гена протромбина как в гомо-, так и гетерозиготном варианте [11,12].
Патологический генотип, как известно, не всегда приводит к клиническим проявлениям того или иного заболевания.На реализацию точечных мутаций способны влиять дополнительные факторы риска,которые,в свою очередь,могут быть разделены на управляемые и не управляемые со стороны пациента или медицинского персонала. В ряде случаев эти мутации проявляются лишь на лабораторном (субклиническом) уровне, когда меняется структура или функция кодируемого белка, при мультифакториальном воздействии патологический генотип имеет большие шансы на клиническую реализацию в виде тромботического события. Например, мутация фактора V Лейден [ F5L(1961) GA ] необязательно проявляется значительным повышением резистентности фактора Vа к активированному протеину С (APC-R), полиморфизм генов, участвующих в обмене метионина — гипергомоцистеине-мией, а редкая гомозигота гена PAI–I — увеличением активности этого ингибитора фибринолитических реакций. Можно ожидать некой вероятности этих событий, но когда и в какой мере — не поддается прогнозу. Очевидно и то, что реализация отмеченных генотипов (в виде постоянных факторов тромбогенного риска)в фенотипические проявления (лабораторные, а затем и клинические)зависит от дополнительных факторов риска,регистрируемых во время беременности,в том числе при комор-бидных состояниях [13–16].
Говоря о генетической предрасположенности к тромбообразованию и акушерским осложнениям,невозможно не отметить относительную низкую информативность определения полиморфизма генов ферментов,уча-ствующих в метаболизме метионина,которые сами по себе не имеют ни диагностической, ни прогностической ценности. Субклинически проявленным фенотипом при наличии данных полиморфизмов и,в первую очередь, цистатион-β-синтетазы, как известно, является повышение уровня гомоцистеина в сыворотке крови.
Исследование ассоциативных связей носительства генетических тромбофилий, в частности, мутации Лейден [F5L(1961) GA] и мутации гена протромбина [F2G(20210) А] сотрудниками Алтайского филиала ФГБУ «На- циональный медицинский исследовательский центр гематологии», насчитывает более 10 лет. В настоящее время создан регистр носителей генетических тромбофилий на территории Алтайского края, предпринимаются попытки его внедрения в инфраструктуру территориального Минздрава.
С учетом полученных данных, ниже представляются рекомендации, направленные на персонифицированный подход при оказании специализированной помощи пациенткам с генетическими тромбофилиями.
Мутация Лейден и осложнения гестации
В многочисленных исследованиях показа-но,что нарушение баланса между гемостатическими, антикоагулянтными и фибринолитическими реакциями способно привести к неконтролируемой глубине инвазии цитотрофобласта, формированию отслойки хориона, кровотечению и потере беременности [ 17,18 ] . Исходно повышенная генерация тромбина при носительстве мутации фактора V Лейден [ 19, 20 ] смещает равновесие в сторону гиперкоагуляции и оказывает протективное действие на этапе инвазии цитотрофобласта, предупреждая очень ранние (пре-эмбриотические) репродуктивные потери [ 21 ] . Однако повышенное тромбинообразование при этом может иметь различные варианты клинической реализации (венозный тромбоз или акушерские осложнения) во время беременности.
Ассоциация генотипа F5L(1961) GA с развитием гестационных осложнений
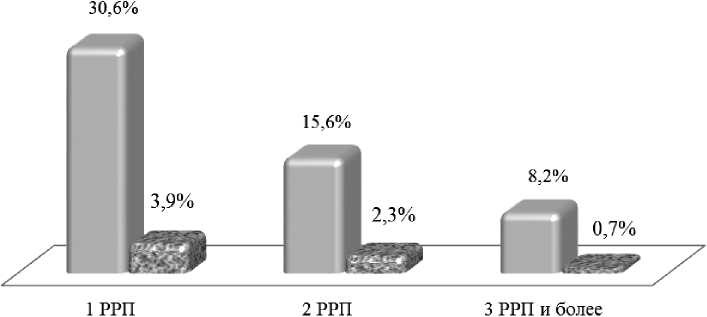
Ниже приведены результаты, полученные при анализе репродуктивной функции 00 носительниц мутации F5L(1961) GA и течения и исходов около 3000 беременностей. В нашем исследовании анализ законченных случаев беременности у пациенток носительниц генотипа F5L(1961) GA (n = 112 ) и женщин с нормальным генотипом F5L(1961) GG (n = 1622) показал, что число ранних репродуктивных потерь у пациенток носительниц мутации F5L(1961) GA в 3,9 раза больше,чем при нормальном генотипе F5L(1961) GG (33,7 % против 10,3 %; р < 0,0001). В обеих группах ранние репродуктивные потери у части пациенток носили рецидивирующий характер (рис. 1).
м Носители мутации F5L(1691)GA п=500
я Контрольная группа, генотип F5L(1691)GG п=600
Рисунок 1. Удельный вес женщин имеющих одну, две, три и более ранних репродуктивных потерь при носительстве генотипа F5L(1961) GA и при нормальном генотипе F5L(1961) GG .
У каждой третьей пациентки при носительстве мутации Лейден акушерский анамнез был осложнен одной репродуктивной потерей. Число пациенток основной группы с двумя РРП было в 2, раза больше, чем в группе контроля, а количество пациенток,имеющих три и более репродуктивных потерь, то есть страдающих привычным невынашиванием беременно-сти,в группе женщин носительниц мутации F5L(1961) GA было в 4,6 раза больше.
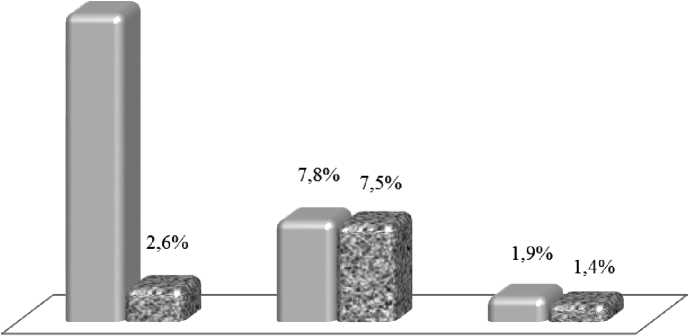
При оценке характера репродуктивных потерь в группах исследования (рис. 2) установ- лено,что удельный вес самопроизвольных выкидышей и эктопических беременностей, как исходов всех беременностей, был сопоставим (р = 0,7643 и р = 0,24, соответственно). В то же время, каждая четвертая беременность при носительстве мутации F5L(1961) GA закончилась гибелью эмбриона до 12 недель (составляя в структуре всех ранних потерь 70, %), что в 9 раз больше аналогичных исходов при нормальном генотипе F5L (1961) GG — 2,6 % (р < 0,0001).
23,8%
Нервзвивающиеся Самопроизвольные Эктопические беременности выкидыши беременности м Носители мутации F5L(1691)GA п=500
А Контрольная группа, генотип F5L(1691)GG п~600
Рисунок 2. Удельный вес клинических вариантов РРП при носительстве генотипа F5L(1961) GA и при нормальном генотипе F5L(1961) GG.
Более детальный анализ неразвивающих-ся беременностей у носительниц генотипа F5L(1961) GA показал, что в 2 ,2 % случаев беременность перестает прогрессировать в сроке –6 недель, а в 74,8 % развитие плодного яйца заканчивается в сроке 8–9 недель, что подтверждает протективное действие мутации F5L(1961) GA на этапе инвазии цитотрофобласта (3–7 недель гестации). Согласно гистологическому исследованию, у 22,1 % пациенток зарегистрирована анэмбриония, в остальных случаях — гибель эмбриона. Безусловно, учение об этиологии неразвивающейся беременности и данные гистологического исследования, свидетельствующие об отсутствии эмбриона, говорят в пользу хромосомной аномалии плодного яйца,но в нашем исследовании кариотипиро-вание абортусов не проводилось, в связи с чем, мы не можем подтвердить или опровергнуть данную гипотезу в нашей группе.
При изучении дополнительных факторов, на фоне которых возможна клиническая реализация генотипа F5L(1691) GA, нами определено, что риск ранних репродуктивных потерь увеличивается у пациенток в возрасте старше 3 лет при наличии хронического эндометрита. Проведенный многофакторный анализ показал, что переменная « F5L(1691) GA» имеет самостоятельное значение в совокупной модели рисков (OR2,2), сопоставимое по значению с переменной «возраст матери старше 3 лет» (OR2, ) и уступая при этом предиктору «хронический эндометрит» (OR3,8).
Носительство генотипа F L(1961)GA статистически значимо влияет на структуру и число ранних репродуктивных потерь. Однако значимую роль играет комбинация факторов риска развития ранних репродуктивных потерь у конкретной пациентки.
Необходимо отметить, что пенетрантность мутации фактор V Лейден в виде гестационных осложнений составила 20–2 %, остальная ко- горта женщин не имела клинической реализации носительства патологического генотипа. Это послужило основанием для изучения лабораторного фенотипа в виде APC-R у носительниц генотипа F5L(1691) GA при благоприятном и осложненном течении беременности.Прове-денный анализ показал, что медиана показателя APC-R в точках исследования при нормальном («диком») генотипе F5L(1691) GG колебалась по нормализованному отношению (НО) в диапазоне 1,0 → 0,86. В то же время, у беременных с генотипом F5L(1691) GA при благоприятном течении беременности этот показатель был значимо ниже (р < 0,0001) — НО 0, 7 → 0, 1 (рис. 3).
Математическая обработка данных позволила определить порог APC-R, специфичный для потенциальных носителей мутации гена F5L — по НО ≤ 0,6 .
Изучение ассоциации лабораторного фенотипа (APC-R) с развитием гестационных осложнений выявило следующие закономерности:
При показателе APC-R по НО > 0,5 риск развития осложнений беременности сопоставим с таковым у нормозиготных пациенток [ F5L(1961) GG ] (RR1,3; р = 0,3721) и расценивается как низкий.
Уровень APC-R по НО в сроке беременности 7–8 недель в диапазоне ≤ 0,49 сопряжен с высоким риском развития гестационных осложнений: в диапазоне 0,49 → 0,46 увеличивает риск развития задержки развития плода (ЗРП) в 2,6 раза (р < 0,0001), преэклампсии (ПЭ) в 3,3 раза (р < 0,0001); в диапазоне ≤ 0,4 риск развития ЗРП увеличивается уже в 4,7 раза (р < 0,0001), а ПЭ в 4,2 раза (р < 0,0001).
Также, была определена APC-R у 2 пациенток носительниц мутации F5L(1691) GA с гибелью эмбриона до 12 недель беременности.Во всех случаях гибель эмбриона констатирована при сроке беременности 8–9 недель. Медиана НО APC-R при сроке 7–8 недель гестации в данной группе составила 0,48 (9 %Cl:0,41–0,49) и была статистически значимо ниже, чем при дальнейшем пролонгировании беременности с благоприятным исходом (рис. 4).
Здесь и далее:
медиана — маркер; значения, соответствующие 2, и 97, процентилю — нижний и верхний вертикальные бары; ПГ — прегравидарный период; ПР — послеродовый период
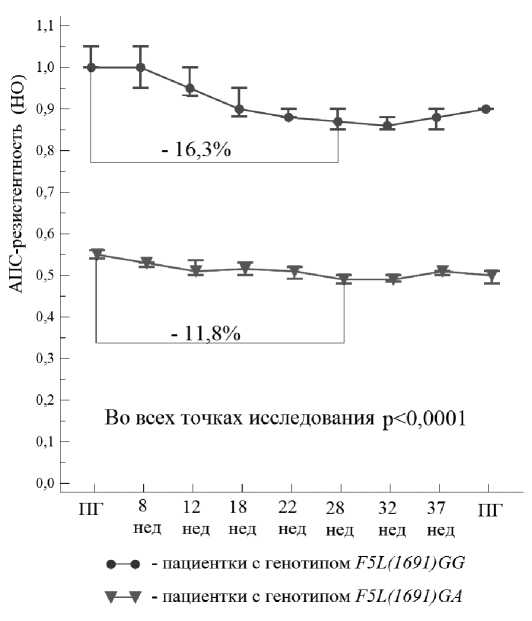
Рисунок 3. Динамика показателя НО APC-R в зависимости от генотипа при благоприятном течении беременности
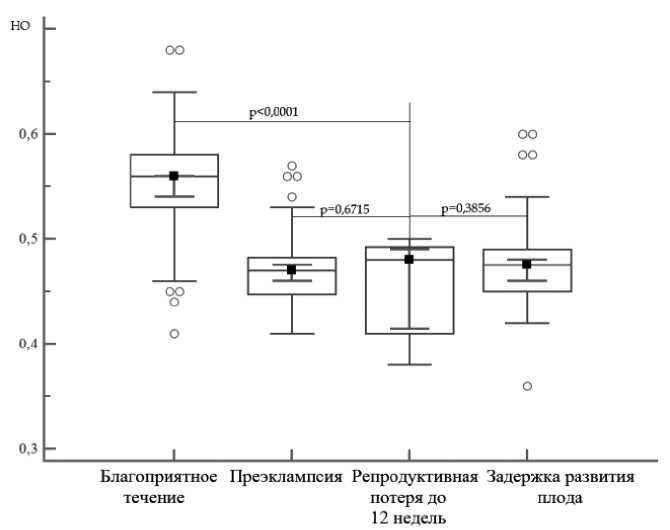
Рисунок 4. Медиана показателя НО APC-R при сроке беременности 7–8 недель у носительниц мутации F5L(1691) GA в зависимости от исхода беременности
APC-R — является объективным фенотипическим предиктором клинической реализации протромботического генотипа F L(1691)GA в виде ранних репродуктивных потерь, преэклампсии и задержки развития плода.
Фенотип (APC-R) не может рассматриваться как единственный и определяющий фактор реализации патологических процессов при носительстве генотипа F5L(1691) GA . Но его роль в сценарии развития ранних репродуктивных потерь (РРП) и больших акушерских синдромов бесспорна,что и подтверждается нашим исследованием.
Мутация гена протромбина и осложнения гестации
Ниже изложены результаты, полученные при анализе репродуктивной функции 140 пациенток с генотипом F2G20210А, проанализировано течение и исход более 3 0 беременностей. В данном случае определялась активность протромбина в сроки гестации,учитывающие волны инвазии цитотрофобласта, проведен ассоциативный анализ с осложнениями гестационного процесса.
Результаты проведенного исследования проиллюстрировали в целом наличие ассоциативной связи носительства мутации F2G(20210) А с риском развития ранних репродуктивных потерь (OR2, ), ПЭ (OR2,6), в том числе ранней и/или тяжелой (OR = 9,6) и частотой преждевременных родов (OR6,4). Выявленные риски сопоставимы с результатами части ранее представленной работы в этом направлении [22].
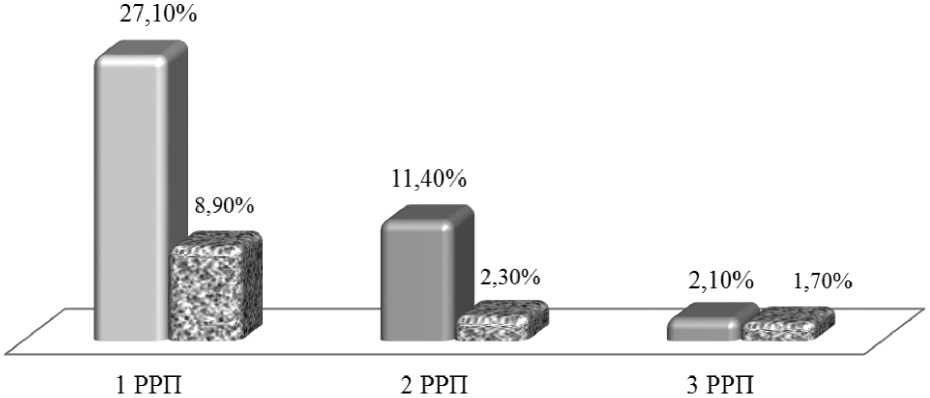
Анализ законченных случаев беременности у пациенток носительниц генотипа F2(20210) GA и женщин с нормальным генотипом F2(20210) GG показал, что ранними репродуктивными потерями закончилось 29,1 % всех запланированных беременностей у пациенток носительниц мутации F2(20210) GA, и 11,6 % (47 из 406) при нормальном генотипе (р < 0,0001).
В обеих группах ранние репродуктивные потери у части пациенток носили повторяющийся характер (рис. 5).
и Носители мутации F2(20210)GA п=140
й Контрольная группа F2(20210)GG п=150
Рисунок 5. Удельный вес женщин имеющих ранние репродуктивные потери при носительстве генотипа F2(20210) GA и при нормальном генотипе F2(20210) GG.
У каждой четвертой пациентки при носительстве мутации гена протромбина акушерский анамнез был осложнен одной репродуктивной потерей.Число пациенток основной группы с двумя РРП оказалось в ,3 раза больше, чем в группе контроля (р = 0,00 ). В то же время по числу эпизодов привычного невынашивания беременности группы исследования не отличались между собой (p = 0,3).
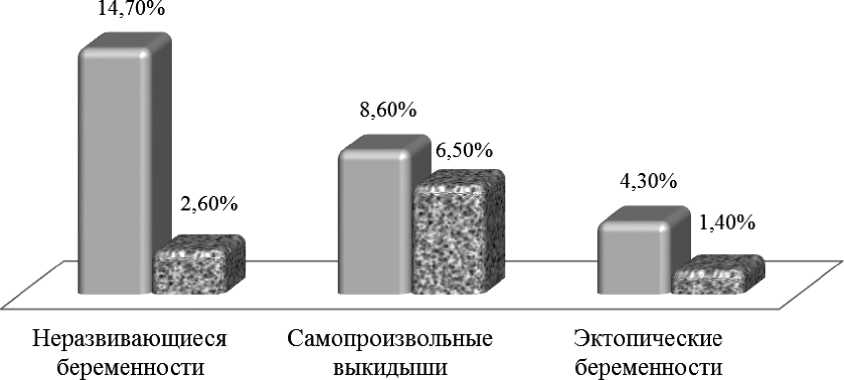
Необходимо отметить, что носительство генотипа F2G(20210) А не влияло на частоту самопроизвольных выкидышей в сроке геста- ции до 12 недель (OR1,3; p = 0,2), при этом статистически значимо увеличивая риск нераз- вивающейся беременности (OR = 6,2) (рис. 6).
и Носители мутации F2(20210)GA п=140
а Контрольная rpynnaF2(20210)GG п-150
Рисунок 6. Удельный вес клинических вариантов РРП при носительстве генотипа F2(20210) GA и при нормальном генотипе F2(20210) GG.
Все эпизоды ранних репродуктивных потерь в исследовании были обусловлены гибелью плодного яйца в сроке 8–9 недель, что согласуется с данными других авторов [23, 24].
Ассоциация фенотипа в виде сверхпороговой активности протромбина у носительниц мутации F2G(20210) А с развитием гестационных осложнений.
Установлено, что медиана показателя активности протромбина в точках исследования при физиологическом течении беременности у пациенток группы контроля [«дикий» генотип F2G(21210) G] колебалась в диапазоне от 108 % (в прегравидарном периоде) до 144 % (во время беременности) [95 % CI 130-150]. В то же время, у беременных с генотипом F2G(20210) А, вне зависимости от характера течения беременности, этот показатель был значимо выше составляя в аналогичные сроки исследования от 149 % до 181 % [95 % CI 142-195] (рис. 7).
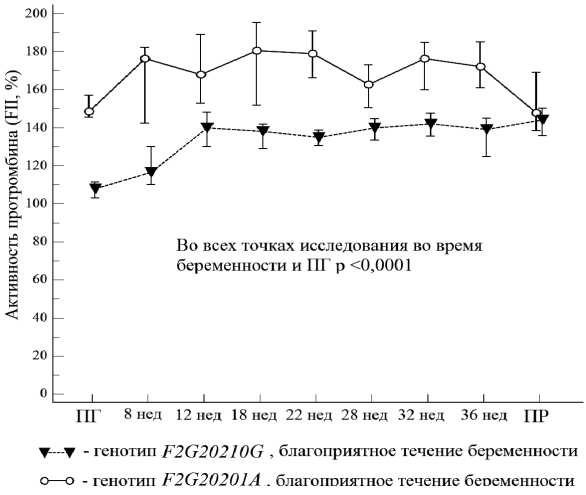
Рисунок 7 . Уровень активности протромбина в зависимости от наличия или отсутствия патологического аллеля в группах наблюдений на прегравидарном этапе в разные сроки гестации и после родов.
Активность протромбина, определенная в диапазоне от 148 % до 180 %, ассоциировалась с благоприятным течением и исходом беременности. В 8 эпизодах наблюдений ( ,7 %) беременность закончилась гибелью плодного яйца в сроке гестации 8–9 недель, при это медиана активности протромбина составила 198 % (9 % CI 191–201), что значимо больше, чем аналогичный показатель,определенный в сроке 8недель при пролонгировании беременности — 176 % (9 % CI 142–180) (р = 0,0069).
Как известно, этиопатогенез неразвиваю-щейся беременности многофакторен,и одна из его составляющих — микротромбирование сосудов плацентарного ложа [17]. Такое тром-бообразование в нашей работе может быть вызвано повышенным уровнем активности протромбина, определенного в сроке гестации 7–8 недель. Однако малое число наблюдения (n = 8) не представлялось достаточным для экстраполяции выводов.
Математическая обработка данных позволила определить порог активности протромбина, ассоциированный с риском развития гестационных осложнений для носителей мутации гена протромбина F2G(20210) А :
-
• при показателе активности протромбина < 171 % на прегравидарном этапе и > 180 % в сроке беременности 7–8недель риск развития осложнений беременности сопоставим с таковым у нормозиготных пациенток [ F2G(21210) G ] и расценивается как низкий;
-
• активность протромбина, определяемая прегравидарно > 171 % и в сроке беремен-
- ности 7–8 недель в диапазоне > 180 %, сопряжена с высоким риском развития гестационных осложнений, в том числе увеличивая риск развития ПЭ на 86 % и 84 % соответственно.
Изучение уровня и динамики активности протромбина при развитии гестационных осложнений позволяют изменить взгляд на стратификацию прогноза осложнений беременности у носительниц мутации F2(G20210) А и меняют взгляд на проведение персонифицированной гепаринопрофилактики при носительстве генотипа F2G20210А .
Рекомендации по выявлению и тактике ведения пациенток с мутациями F2(G20210) А и F5L(1691) GA на прегравидарном этапе и во время гестации.
Как правило,вопрос о необходимости проведения тестирования на генетические тромбофилии возникает при уже существующем тромботическом или акушерском отягощенном анамнезе.Перед проведением анализа женщин следует проконсультировать по поводу последствий для себя и членов семьи в случае положительного или отрицательного результата. Результаты тестирования требуют интерпретации специалиста гематолога.
По данным литературы и накопленному опыту центров, специализирующихся на тром-бофилиях,скрининг должен быть выполнен прегравидарно у группы пациентов, указанных в таблице 1 [2 , 26] (уровень убедительности — D, уровень достоверности доказательств — 3).
Показания для проведения тестирования на носительство генетических и врожденной тромбофилии
Таблица 1
|
Тромботический анамнез |
Акушерский анамнез |
|
|
Дальнейшая тактика ведения беременной будет зависеть от результатов тестирования, что можно видеть из рисунков 8 и 9.
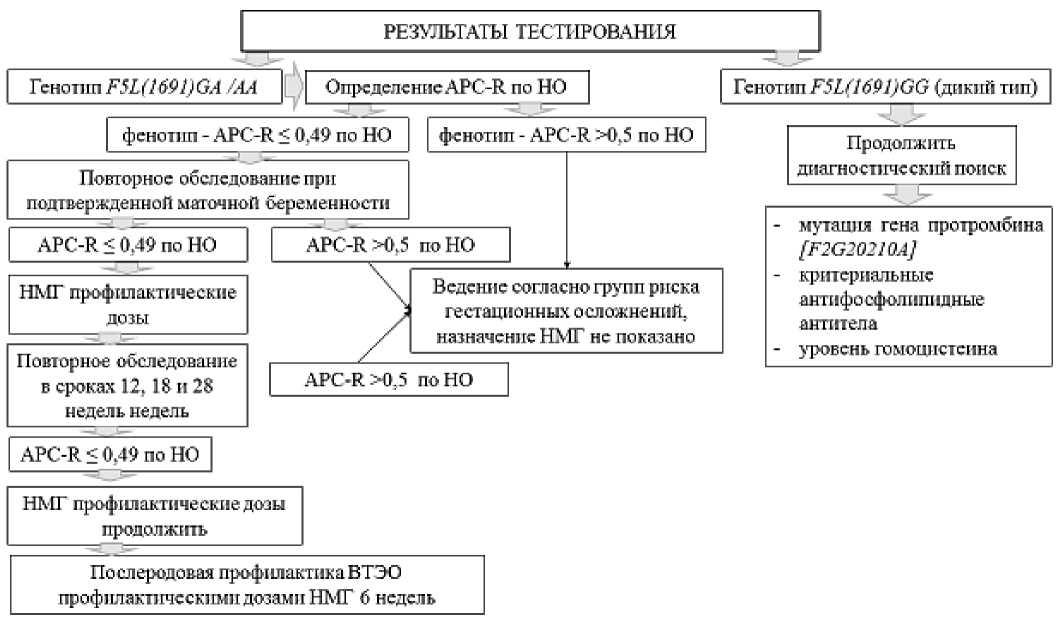
Рисунок 8. Алгоритм обследования и лекарственной терапии с учетом генотипа F5L(1691) GA и лабораторного фенотипа (APC-R) [27, 28]. Примечание: НМГ — низкомолекулярные гепарины
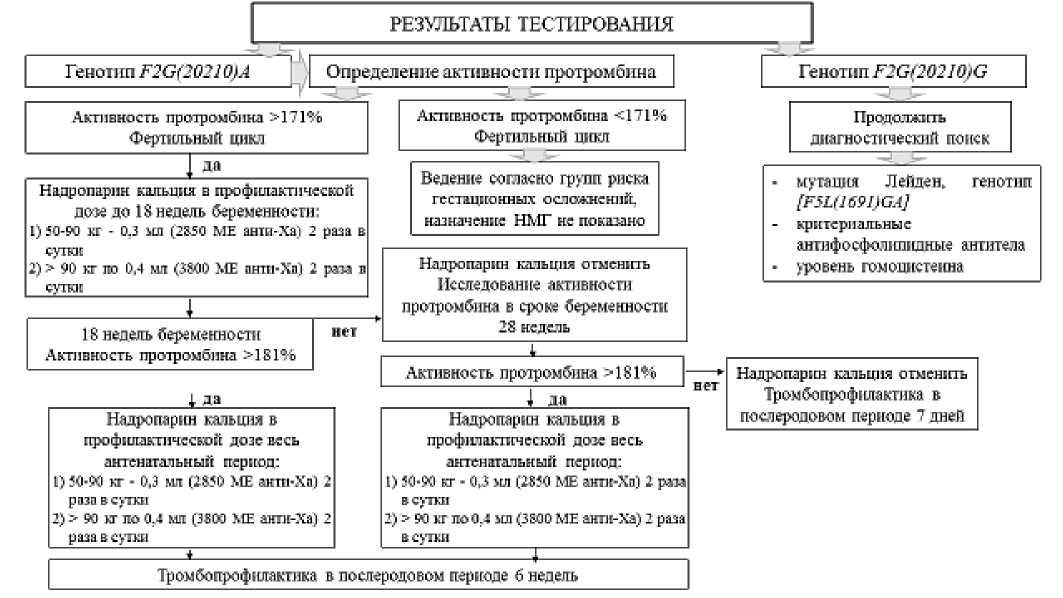
Рисунок 9. Алгоритм назначения надропарина кальция пациенткам при носительстве мутации гена F2G(20210) A с учетом активности протромбина [29, 30]
Заключение. Представленные в настоящей статье данные позволяют с высокой степенью вероятности рассматривать носительство мутации фактор V Лейден [F5L(1961) GA] и гена протромбина [F2G(20210) А] в качестве фактора риска развития гестационных осложнений, предиктором возникновения которых выступает субклинически (лабораторно) проявлен- ный фенотип в виде повышения резистентности фактора Va к активированному протеину С и сверхпороговой активности протромбина. Эти же маркеры могут служить объективной предпосылкой для инициации гепаринопрофи-лактики с целью улучшения репродуктивных исходов.
Конфликты интересов
Источник финансирования
ФГБОУ ВО «Алтайский государственный медицинский университет»
ООО фирма «Технология-Стандарт»
Вклад авторов
Концепция и дизайн: Момот А. П., Николаева М. Г.
Сбор и обработка данных: Николаева М. Г.
Представление материалов исследования: Николаева М. Г .
Подготовка рукописи: Николаева М. Г.
Окончательное одобрение рукописи: Момот А. П.
Список литературы Генетические тромбофилии и гестационные осложнения
- 1. Simone B, De Stefano V, Leoncini E. et al. Risk of venous thromboembolism associated with single and combined effects of factor V Leiden, prothrombin 20210A and methylenetethraydrofolate reductase C677T: a meta-analysis involving over 11,000 cases and 21,000 controls // Eur J Epidemiol. — 2013. — № 28. — P. 621–647.
- Stevens SM, Woller SC, Bauer KA. et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia // J Thromb Thrombolysis. — 2016. — № 41(1). — Р.154–64. doi: 10.1007/s11239–015–1316–1.
- Гамыркина Д. Р., Воробьева Н. А. Роль генетических полиморфизмов, обусловливающих состояние гиперкоагуляции, в проблеме привычного невынашивания беременности // Тромбоз, гемостаз и реология. — 2016. — Т. 1, № 65. — С. 51–56.
- Буштырева И. О., Кузнецова Н. Б., Ковалева А. В. и др. Распространенность тромбофилических полиморфизмов у женщин с привычным невынашиванием беременности в анамнезе // Акушерство, гинекология и репродукция. — 2015. — № 2. — С. 13–18. DOI: 10.17749/2070–4968.2015.9.2.013–018.
- Lino FL, Traina É, Barreto JA, et al. Thrombophilic mutations and polymorphisms, alone or in combination, and recurrent spontaneous abortion // Clin Appl Thromb Hemost. — 2015. — № 21(4). — Р.365–372. doi: 10.1177/1076029613520465.
- Руководство по гематологии: в 3 т. Под ред. А. И. Воробьева. 3-е изд. перераб и дополн. М.: Ньюдиамед: 2005. —Т.3. — 416 с. с ил.
- Thrombophilia. Prevention and treatment of venous thromboembolism. International Consensus Statement (Guidelines according to scientific evidence). IntAngiol. — 2013. — № 32(2). — Р.188–200.
- Heit JA. Thrombophilia: Clinical and Laboratory Assessment and Manajement. In: Kitchens CS, Kessler CM, Konkle BA. Editors. Consultative Hemostasis and Thrombosis. 3rd ed. Philadelphia: Saunders Elsevier. — 2013. — Р.205–239.
- Robertson L, Wu O, Langhorne P. et al. Thrombosis: Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thrombophilia in pregnancy: a systematic review // Br J Haematol. — 2006. — № 132(2). Р.171–196.
- Rodger MA, Walker MC, Smith GN. et al. Is thrombophilia associated with placenta-mediated pregnancy complications? A prospectivecohort study // J Thromb Haemost. — 2014. — № 12(4). — Р. 469–478.
- Bates SM, Greer IA, Pabinger I. et al. Venous thromboembolism, thrombophilia, antithrombotic therapy, and Pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) // Chest. — 2008. — № 133(6). — Р.844–886. DOI 10.1378/ chest.08–0761.
- Wang X, Bai T, Liu S. et al. Association between Thrombophilia Gene Polymorphisms and Preeclampsia: A Meta-Analysis // PLoS One. — 2014. — № 9(6): e100789. doi:10.1371/journal. pone.0100789. eCollection 2014.
- Карпич С. А., Шмелева В. М., Капустин С. И. и др. Оценка протромботического фенотипа у асимптомных носителей мутации G1691A в гене фактора V и/или мутации G20210A в гене протромбина с помощью теста генерации тромбина // Тромбоз, гемостаз и реология. — 2018. — Т. 3, № 75. — С. 11–16. DOI: 10.25555/THR.2018.3.0845.
- Карпич С. А., Шмелева В. М., Головина О. Г. и др. Оценка генерации тромбина у лиц с наследственной тромбофилией // Вестник гематологии. — 2018. — Т. 14, № 1. С. 44–45.
- Момот А. П. Проблема тромбофилии в клинической практике // Российский журнал детской гематологии и онкологии. — 2015. — № 1. — С. 36–48.
- Чечулова А. В., Капустин С. И., Карпич С. А. и др. Риск венозных тромбоэмболических осложнений у беременных женщин на фоне наследственной тромбофилии // Акушерство и гинекология СанктПетербурга. — 2018. — № 2. — С. 21–22. 17. Милованов А. П., Кузнецова Н. Б., Буштырева И. О. Морфология, характерные сочетания полиморфных генов гемостаза и особенности патогенеза ретрохориальной гематомы при неразвивающейся беременности // Архив патологии. — 2016. — Т. 5, № 78. — С. 3–8. http://dx. doi. org/10.17116/ patol20167853–8.
- Pijnenborg R., Vercruysse L., Hanssens M. The uterine spiral arteries in human pregnancy: facts and controversies // Placenta. — 2006. — № 27. — Р.939–958. https://doi. org/10.1016/j. placenta.2005.12.006.
- Kojima T., Takagi A., Murata M., Takagi Y. Antithrombin resistance: a new mechanism of inherited thrombophilia // Rinsho Ketsueki. — 2015. — Vol. 56, № 6. — Р.632–638. https://doi. org/10.11406/rinketsu.56.632.
- Segers O., Simioni P., Tormene D., Castoldi E. Influence of single nucleotide polymorphisms on thrombin generation in factor V Leiden heterozygotes // Thromb Haemost. — 2014. — Vol. 111, № 3. — Р. 438–446. https://doi. org/ 10.1160/TH13–05–0360.
- Kaandorp S. P., van Mens T. E., Middeldorp S. et al. Time to conception and time to live birth in women with unexplained recurrent miscarriage // Hum Reprod. — 2014. — Vol. 29, № 6. — Р. 1146–1152. https://doi. org/10.1093/humrep/deu052.
- Royal College of Obstetricians and Gynaecologists // Green-top Guideline. — 2015. — No. 37b. Thromboembolic disease in pregnancy and the puerperium: acute management. https://www. rcog. org. uk/en/guidelinesresearch-services/guidelines/gtg37b.
- Радзинский В. Е. Неразвивающаяся беременность. Методические рекомендации МАРС (Междисциплинарной ассоциации специалистов репродуктивной медицины) / [авт.-сост. В. Е. Радзинский и др.]. — М.: Редакция журнала StatusPraesens. — 2015. —48 с.
- Gao H, Tao FB. Prothrombin G20210A mutation is associated with recurrent pregnancy loss: a systematic review and meta-analysis update // Thromb Res. — 2015. — № 135(2). Р. 339–346. http://dx. doi. org/10.1016/j. thromres.2014.12.001.
- Baglin T, Bauer K, Douketis J. et al. Duration of anticoagulant therapy after a first episode of an unprovoked pulmonary embolus or deep vein thrombosis: guidance from the SSC of the ISTH // J Thromb Haemost. — 2012. — № 10. — Р.698–702.
- Nicolaides AN, Fareed J, Kakkar AK. et al. Prevention and treatment of venous thromboembolism-International Consensus Statement // Int Angiol. — 2013. — № 32(2). —Р.111–260.
- Николаева М. Г., Сердюк Г. В., Момот А. П. и др. Способ профилактики преэклампсии у беременных с мутацией фактора V Лейден 1691 G/A. Патент на изобретение RU2666251 C1, 06.09.2018.
- Николаева М. Г., Момот А. П., Момот К. А. и др. Гепаринопрофилактика гестационных осложнений у носительниц мутации V фактора, генотип GA Акушерство, гинекология и репродукция. 2018; 12 (2): https://doi. org/10.17749/2313–7347.2018.12.2.
- Николаева М. Г., Момот А. П., Ясафова Н. Н. и др. Способ профилактики преэклампсии у носительниц мутации F2G20210A при сверхпороговом повышении активности протромбина. Патент на изобретение RU2712444 C1, 29.01.2020.
- Momot A. P., Nikolaeva M. G., Yasafova N. N. et al. Clinical and laboratory manifestations of the prothrombin gene mutation in women of reproductive age. Journal of Blood Medicine, 2019:10, 255–263; https://doi. org/10.2147/JBM. S212759


