Геноидентификация вируса лейкоза крупного рогатого скота, циркулирующего в Алексеевском районе Республики Татарстан
Автор: Шаева А.Ю., Галиуллин А.К., Дуенина В.В.
Статья в выпуске: 1 т.261, 2025 года.
Бесплатный доступ
Данная статья содержит информацию о геноидентификации вируса лейкоза крупного рогатого скота, циркулирующего в Алексеевском районе Республики Татарстан, методом ПЦР-ПДРФ-анализа. Было происследовано 1 0 проб крови коров. Результаты показали, что 9 изолятов провирусной ДНК ВЛКРС относятся к 4 генотипу, а 1 изолят - к 8 генотипу возбудителя.
Лейкоз крупного рогатого скота, вирус лейкоза крупного рогатого скота (влкрс), генотип, env-ген, полимеразная цепная реакция (пцр), пцр-пдрф
Короткий адрес: https://sciup.org/142244559
IDR: 142244559 | УДК: 619:57.065:578.828 | DOI: 10.31588/2413_4201_1883_1_261_255
Текст научной статьи Геноидентификация вируса лейкоза крупного рогатого скота, циркулирующего в Алексеевском районе Республики Татарстан
Из множества болезней животных, наиболее сложной и до конца нерешенной проблемой является лейкоз крупного рогатого скота. Это заболевание занимает первое место по распространенности среди инфекционных болезней животных и приносит огромный экономический ущерб. Лейкоз КРС – хроническое инфекционное заболевание, характеризующееся прогрессивным увеличением в крови лейкоцитов с последующим развитием лейкозной опухоли [5].
За последние два десятилетия было проведено множество исследований по изучению филогении и генетической изменчивости изолятов вируса лейкоза крупного рогатого скота из разных географических регионов мира. Почти все эти исследования были основаны главным образом на частичном или полном анализе env-гена возбудителя, включая последовательность, кодирующую gp51. Это объясняется тем, что гликопротеид gp51 играет важную и незаменимую роль в инфекционности ВЛКРС [6].
Современная классификация вируса лейкоза крупного рогатого скота включает
13 генотипов, идентифицировать филогенетического секвенированных последовательностей которые можно с помощью анализа нуклеотидных локусов env-гена
ВЛКРС, а также с помощью обновленной
ПЦР-ПДРФ стратегии генотипирования [1, 2].
Многочисленные исследования показали, что последовательности env-гена, представляющие географически разные изоляты, имеют между собой высокую гомологию, однако зафиксировано наличие мелкомасштабных точечных мутаций. Показано, что некоторые из этих мутаций связаны с инфекционностью, репликацией и патогенезом ВЛКРС и могут изменять серологический статус инфицированного крупного рогатого скота [7].
Ситуация в Российской Федерации по лейкозу КРС остаётся эндемичной, она плохо поддается как пространственному, так и временному анализу и контролю. Так, в первом квартале 2023 года на территории нашей страны было зарегистрировано 311 неблагополучных по лейкозу КРС пунктов, во втором квартале – 958 неблагополучных пунктов, в третьем квартале – 315 неблагополучных пунктов.
В Республике Татарстан в последние годы наметилась положительная тенденция по благополучию хозяйств. Тем не менее, высокий уровень инфицированности лейкозом остается во многих районах республики [4]. По данным Федеральной службы по ветеринарному и фитосанитарному надзору, Татарстан входит в число регионов, в которых в 2023
году были зарегистрированы новые очаги [8]. В 2023 году инфекция ВЛКРС была зарегистрирована в большинстве районов Республики Татарстан и имела неодинаковое распространение (рисунок 1). В Алексеевском районе заражённость лейкозом за 2023 год составила 1,7 %, тогда как 10 лет назад (в 2014 году) инфицированность поголовья достигала 21,6 % [3]. Это говорит об эффективности проводимых мероприятий по ликвидации лейкоза КРС. Однако проблема своевременного выявления и элиминации положительно реагирующих животных по-прежнему остаётся актуальной.
Цель данного исследования – геноидентификация вируса лейкоза крупного рогатого скота, циркулирующего в Алексеевском районе РТ, методом ПЦР-ПДРФ-анализа.
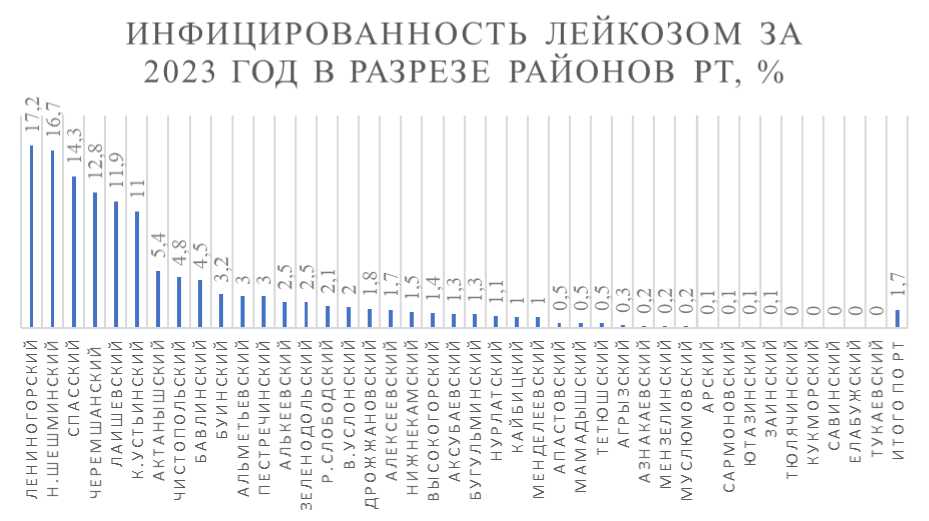
Рисунок 1 – Инфицированность ВЛКРС за 2023 год в разрезе районов Республики Татарстан
Материал и методы исследований. Для исследования было взято 10 проб крови от коров голштинской породы, принадлежащих неблагополучному по лейкозу хозяйству Алексеевского района. Ранее при плановом серологическом исследовании всего поголовья хозяйства эти 10 коров оказались положительными на лейкоз (РИД+).
Венозная кровь у коров для исследований отбиралась в утреннее время до приема корма, для этого использовалась вакуум-содержащая система фирмы «Vacuette».
Экстракция тотальной ДНК из цельной крови крупного рогатого скота проводилась с применением набора «ДНК-сорб-В», согласно инструкции производителя («ЦНИИ Эпидемиологии» Роспотребнадзора МЗ РФ).
При постановке ПЦР с выделенными образцами провирусной ДНК ВЛКРС применялась модификация «nested» ПЦР с использованием комплекта внешних (env5032 + env5608) и внутренних (env5099 + env5521) праймеров, приводящих к амплификации фрагмента env-гена возбудителя длиной 444 п.н.
Амплификацию локусов провирусной ДНК ВЛКРС проводили в термоциклере «Терцик» («ДНК-технология», Россия).
Полученные ПЦР-продукты обрабатывались при температуре 37 °С эндонуклеазами рестрикции AsuHPI, SspI, BstX2I, PvuII и HaeIII [1]. Детекцию результатов ПЦР-ПДРФ-анализа проводили методом горизонтального электрофореза в 2,5 % агарозном геле в TBE-буфере с добавлением бромистого этидия. Размеры полученных фрагментов ДНК оценивали по подвижности в сравнении со стандартными ДНК маркерами.
Результат исследований. В результате «nested»-ПЦР с провирусной ДНК, выделенной из 10 образцов крови крупного рогатого скота, были получены продукты размером 444 п.н.
Эндонуклеазы рестрикции AsuHPI, SspI, BstX2I, PvuII и HaeIII разделили ампликоны на соответствующие фрагменты, представленные в таблице 1.
Таблица 1 – ПДРФ-фрагменты env-гена изолятов ВЛКРС
|
№ пробы |
ПДРФ-фрагменты, п.н. |
||||
|
SspI |
AsuHPI |
PvuII |
BstX2I |
HaeIII |
|
|
4 |
399/45 |
224/220 |
444 |
316/128 |
225/94/87/32/6 |
|
1, 2, 3, 5, 6, 7, 8, 9, 10 |
399/45 |
224/220 |
280/164 |
444 |
198/94/87/32/27/6 |
Как показано на рисунке 2, продукты амплификации одной из проб (№ 4) провирусной ДНК расщепляются ферментом SspI на 2 фрагмента – 399 и 45 пар нуклеотидов (п.н.), рестриктазой AsuHPI – на фрагменты 224 и 220 п.н. PvuII не делит ПЦР-продукт на фрагменты (444 п.н.). Фермент BstX2I расщепляет
1 2 3
амплифицированный участок env-гена на фрагменты 316 и 128 п.н., а HaeIII - на 225, 94, 87, 32 и 6 п.н.
Полученная картина рестрикции характерна для 86 комбинации ПДРФ-профиля, относящейся к 8 генотипу ВЛКРС.
4 5 6
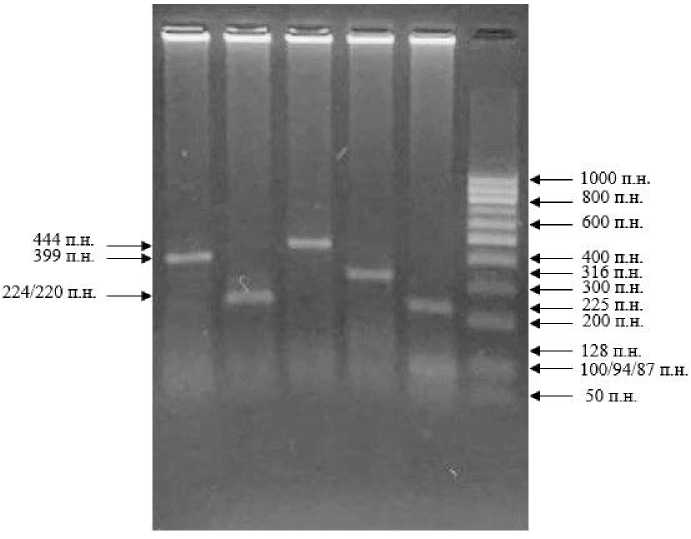
Рисунок 2 – Электрофореграмма ПЦР-ПДРФ-профиля 8 генотипа ВЛКРС 1) фрагменты с SspI; 2) с AsuHPI; 3) с PvuII; 4) с BstX2I; 5) с HaeIII;
6) ДНК-маркер (СибЭнзим, Россия)
Ферментативное расщепление других девяти (№ 1, 2, 3, 5, 6, 7, 8, 9, 10)
амплификатов эндонуклеазой SspI привело к получению фрагментов 399 и 45 п.н., ферментом AsuHPI – фрагментов 224 и 220 п.н., рестриктазой PvuII – фрагментов 280 и 164 п.н. Эндонуклеаза BstX2I в данном локусе env-гена ПДРФ-фрагментов не образовала из-за отсутствия соответствующих сайтов рестрикций. Фермент HaeIII разрезал ампликоны на 198, 94, 87, 32, 27 и 6 п.н.
Данный результат соответствует нескольким ПДРФ-комбинациям – 28, 29, 30, 31, 32, 33 или 34-й. Все они относятся к 4 генотипу вируса лейкоза крупного рогатого скота. Электрофореграмма полученных ПЦР-ПДРФ-фрагментов представлена на рисунке 3.
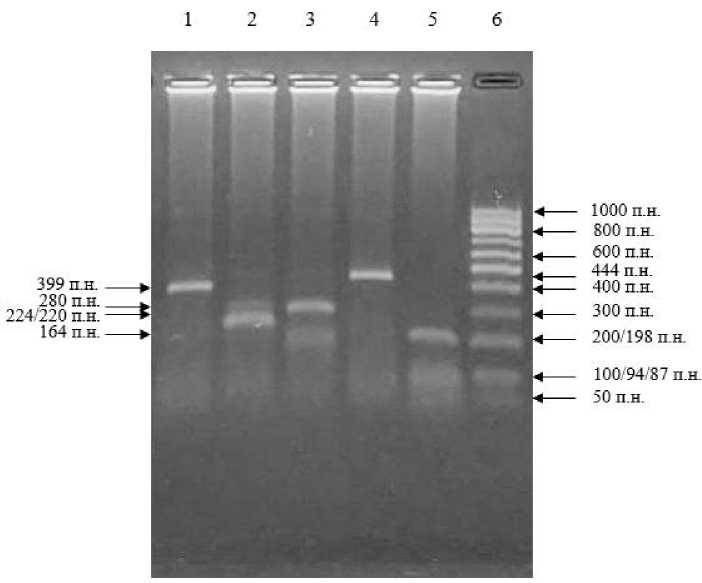
Рисунок 3 – Электрофореграмма ПЦР-ПДРФ-профиля 4 генотипа ВЛКРС Обозначения: 1) фрагменты с SspI; 2) с AsuHPI; 3) с PvuII; 4) с BstX2I; 5) с HaeIII;
6) ДНК-маркер (СибЭнзим, Россия)
Согласно современной усовершенствованной стратегии ПЦР-ПДРФ-генотипирования, для полного анализа, наряду с вышеперечисленными 5ю эндонуклеазами рестрикции, необходимо использовать ещё 2 фермента – DdeI и HpyCH4III. Это связано с тем, что с расширением знаний о генетическом многообразии ВЛКРС, вместе с ранее описанными комбинациями ПДРФ-профилей, регистрируются и новые комбинации. Возникают случаи, когда схожие комбинации ПЦР-ПДРФ профилей по 5 рестриктазам относятся к разным генотипам. В этом случае дифференцировать их можно лишь путём применения 2-х дополнительных эндонуклеаз [2].
В нашем случае при исследовании 9-и образцов мы получили ПДРФ-профили, которые могут быть отнесены сразу к 7-и комбинациям. Но поскольку все эти комбинации соответствуют одному и тому же генотипу вируса (4-му), нет необходимости в применении ещё 2-х эндонуклеаз рестрикции (DdeI и HpyCH4III) для генотипической идентификации возбудителя.
Полученные нами результаты эндонуклеазного расщепления пробы № 4 соответствуют лишь одной комбинации – 86. Данная комбинация относится к 8 генотипу, что также делает нецелесообразным использование дополнительных рестриктаз.
Заключение. Проведённые исследования показали, что 9 изолятов провирусной ДНК ВЛКРС, выделенных в Алексеевском районе РТ, относятся к 4 генотипу, а 1 изолят – к 8 генотипу возбудителя (комбинация 86). Это соответствует полученным ранее сведениям, согласно которым в Республике Татарстан циркулируют представители 1, 4, 7 и 8 генотипов ВЛКРС [3,4].
Полученные результаты подтверждают состоятельность усовершенствованного метода генотипирования возбудителя лейкоза крупного рогатого скота на основе ПЦР-ПДРФ-анализа. Следует отметить, что в большинстве случаев для идентификации генотипа вируса достаточно 5 эндонуклеаз рестрикции (SspI, AsuHPI, PvuII, BstX2I, и HaeIII). Лишь в отдельных случаях возникает необходимость в применении 2х дополнительных рестриктаз - DdeI и HpyCH4III.
Список литературы Геноидентификация вируса лейкоза крупного рогатого скота, циркулирующего в Алексеевском районе Республики Татарстан
- Вафин, Р.Р. Стратегия ПЦР-ПДРФ-генотипирования BLV и её соответствие филогенетической классификации / Р.Р. Вафин, Х.Х. Гильманов, П.Н. Шастин, В.А. Савинов, С.В. Лопунов, А.М. Гулюкин // Ветеринария и кормление. - 2023. - № 2. -С. 15-19. EDN: UZZVDS
- Вафин, Р.Р. Усовершенствованная стратегия ПЦР-ПДРФ-генотипирования BLV и её согласованность с филогенетической классификацией / Р.Р. Вафин, Х.Х. Гильманов, П.Н. Шастин, В.А. Савинов, С.В. Лопунов, А.М. Гулюкин // Ветеринария и кормление. - 2023. - № 3. -С.14-19. EDN: UTBKYM
- Геноидентификация вируса бычьего лейкоза: монография / Н.З. Хазипов, Р.Р. Вафин, А.Ю. Шаева [и др.]. -Казань: Инфра-М, 2017. - 163 с. - 500 экз. - Текст: непосредственный. ISBN: 978-5-16-012313-4 EDN: DNERYZ
- Шаева, А.Ю. Генотипизация изолятов вируса бычьего лейкоза, выделенных в Лаишевском районе Республики Татарстан / А.Ю. Шаева, Д.А. Зубринкин, О.В. Олудина // Ученые записки казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2023. - Т. 255. - № 3. - С. 376-379. EDN: DQQYIX
- King, A.M.Q. Virus Taxonomy: classification and nomenclature of viruses. Ninth Report of the ICTV / A.M.Q. King, J. Adams, E.B. Carstens, E.J. Lefkowitz // Amsterdam: Elsevier. Academic Press. -2012. - P. 1-1344. - Текст: непосредственный.
- Pluta, A.Computational analysis of envelope glycoproteins from diverse geographical isolates of bovine leukemia virus identifies highly conserved peptide motifs / A. Pluta, L.M. Albritton, M. Rola-Luszczak, et al. // Retrovirology. - 2018. - V. 15. DOI: 10.1186/s12977-017-0383-0 EDN: YEBBVR
- Polat, M. Epidemiology and genetic diversity of bovine leukemia virus / M. Polat, S. Takeshima, Y. Aida // Virology Journal. - 2017. - Р. 14. - Текст: непосредственный. EDN: YKKQGE
- Аналитический ежеквартальный, с нарастающим итогом отчет по эпидситуации в стране: Россельхознадзор: официальный сайт. - Москва. - URL: https://fsvps.gov.ru/jepizooticheskaja-situacij a/rossij a/analiticheskij -ezhekvartalnyj -s-narastajushhim-itogom-otchet-po-jepidsituacii-v-strane-po-dannym-departamenta-veterinarii-msh/(дата обращения: 15.05.2024). - Текст: электронный.


