Гетерогенные катализаторы на основе гамма оксида алюминия с иммобилизованной ксиланазой для гидролитического разложения ксилана
Автор: Тамбасова Дарья Павловна, Любякина Полина Николаевна, Антонов Денис Олегович, Ковалева Елена Германовна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 1 т.9, 2021 года.
Бесплатный доступ
В данной работе были получены гетерогенные катализаторы на основе порошкового γ-оксида алюминия с иммобилизованным ферментом ксиланазой и проведено исследование их каталитической активности возможности их многократного использования. Целью работы являлось создание эффективной гетерогенной каталитической системы на основе γ-оксида алюминия с иммобилизованным ферментом для разложения природного полисахарида ксилана с максимальным выходом целевого продукта. В ходе работы проводилась иммобилизация ксиланазы на γ-Al2O3 двумя способами, а именно, физической адсорбцией и ковалентным связыванием с использованием глутарового альдегида как сшивающего агента. Реакции ферментативного гидролиза ксилана, исследование каталитической активности и операционной стабильности иммобилизованного фермента в 4-х циклах проводились на полученных системах. Образец оксида алюминия синтезирован золь-гель методом с температурой обжига 550 °С в течение 4 часов, что соответствует γфазе оксида алюминия. Заряд поверхности полученного образца был охарактеризован методом ЭПР pH-чувствительных нитроксильных радикалов. Установлено, что по сдвигам кривых ЭПР титрования поверхность γ-Al2O3 имеет положительный заряд, что подразумевает наличие центров Льюиса на поверхности. Было установлено, что каталитическая активность ксиланазы, иммобилизованной на поверхности γ-Al2O3 методом ковалентного присоединения через глутаровый альдегид выше, чем при иммобилизации посредством физической адсорбции в 1,83 раза и составляет 12,23U/мг. Найдено, что, ферментативная активность ковалентно иммобилизованной ксиланазы при первых двух циклах достаточно высока, на третьем цикле она снижается до 37,5 % и выходит на плато. При иммобилизации фермента физической адсорбцией активность продолжает снижаться до 23 % в 4-м цикле. Разложение ксилана гетерогенными каталитическими системами на основе γ-Al2O3 и иммобилизованного на нем различными способами фермента ксиланазы, и проведение сравнительного анализа полученных данных, позволяет сделать вывод о перспективности дальнейшего использования полученных систем, например, в птицеводстве в силу эффективности применения иммобилизованной ксиланазы в высвобождении редуцирующих сахаров.
Гетерогенный катализ, полисахариды, гидролиз, ксилан, иммобилизованные ферменты, ксиланаза, оксид алюминия, нитроксильные радикалы, электронный парамагнитный резонанс
Короткий адрес: https://sciup.org/147234335
IDR: 147234335 | УДК: 544.478-03, | DOI: 10.14529/food210107
Текст научной статьи Гетерогенные катализаторы на основе гамма оксида алюминия с иммобилизованной ксиланазой для гидролитического разложения ксилана
Одной из актуальных задач инженерной энзимологии является биодеградация природных полимеров, одним из которых является ксилан [1–5]. По распространенности в природе ксилан занимает второе место после целлюлозы, содержится в различном растительном сырье, где является антинутриентом, препятствуя усвоению питательных веществ. Кроме того, во многих технологических процессах в пищевой, целлюлозно-бумажной, текстильной промышленности он является нежелательной примесью. Ранее были проведены исследования гидролитического разложения ксилана как химическим, так и ферментативным методом [6–8]. Ферментатив- ный гидролиз является наиболее перспективным, так как наименьшим образом повреждает структуру волокон ксилана, широко применяется в пищевой промышленности, является более экологичным и безотходным.
Гидролитический фермент ксиланаза [9, 10] является специфическим для разложения ксилана и обеспечивает полное ферментативное разложение ксилана, включая в себя расщепление боковых цепей. Иммобилизация ксиланазы обеспечивает значительные преимущества – возможность непрерывной переработки и повторного использования фермента [11, 12]. Такие ферменты являются предпочтительными в промышленном масштабе, так как с их помощью можно уменьшить себестоимость процесса переработки.
Перспективным методом иммобилизации ферментов является их адсорбция на мезопо-ристых γ-оксидах алюминия, обладающих необходимыми для закрепления фермента поверхностными свойствами. Повысить эффективность иммобилизации ферментов можно с помощью его ковалентного связывания с поверхностью носителя с помощью бифункционального реагента глутарового альдегида [13]. Также модификация поверхности γ-оксида алюминия силансодержащими органическими соединениями может положительно повлиять на степень и прочность иммобилизации фермента.
Целью исследования являлось создание эффективной гетерогенной каталитической системы на основе γ -оксида алюминия с иммобилизованным ферментом для разложения природного полисахарида ксилана с максимальным выходом целевого продукта с возможностью ее (системы) многократного использования.
Объекты и методы исследования
Для проведения гидролитической реакции использовался очищенный ксилан из древесины березы (молекулярная масса 30000 U/g) China. CAS Регистрационный номер: 9014-63-5 EINECS:232-760-6.
Для каталитического разложения ксилана использовалась эндо-1.4-β-ксиланаза, изолированная из микромицета Trichoderma viride. CAS Регистрационный номер: 9025-57-4 EINECS:232-760-6 (молекулярная масса 6000 U/mg) China.
В качестве носителя для иммобилизации фермента использовался порошкообразный мезопористый γ-оксид алюминия, представляющий собой белый порошок рыхлого строения с зернистой структурой с большой удельной поверхностью 204 м2/г. Средний диаметр пор γ-Al 2 O 3 равен 2,60 мкм. Диаметр частиц преобладающей фракции – 0,41 мкм. Температура отжига – 550 °С.
γ-Al 2 O 3 удобен в применении, так как при проведении экспериментов и съемках на ЭПР-спектрометре для определения электропо-верхностных свойств образцов легко отделяется от раствора, его можно отделять от фильтровальной бумаги, что уменьшает потери при повторном использовании.
Образец γ-Al2O3 синтезирован химическим осаждением, используя 0,5М раствор 9- ти водного нитрата алюминия, после приготовления раствор выдерживают при температуре 70 °С в течение суток. Выделение продукта Al(OH)3 в виде гелеобразного осадка проводилось его осаждением из раствора Al(NO3)3 по реакции 1 с использованием 25 % NH4OH [14, 15]:
Al(NO3)3+3NH4OH =
= Al(OH) 3+3NH4NO 3. (1)
Водный раствор аммиака добавлялся маленькими порциями и рН получившейся суспензии контролировался с помощью рН-метра. Наиболее устойчивая суспензия формировалась при рН 8–9. Затем осадок фильтровался и промывался дистиллированной водой. Сушка образца проводилась в течение 3-х дней при 60 °С. Затем получившийся продукт подвергался термообработке при температуре 550 °С в течение 4-х часов.
Для определения ксиланазной активности были использованы следующие реактивы: кислота уксусная ледяная, натрий уксуснокислый 3-водный, калий-натрий виннокислый 4-водный, натрия гидроокись, кислота 3,5-динитросалициловая (ДНС) кристаллическая с содержанием основного вещества 98 %. Все реактивы были марки ХЧ или ЧДА.
Для приготовления 1,0 % раствора 3,5-динитросалициловой кислоты (ДНС-реактива) предварительно готовится раствор NaOH с массовой долей 10,7 %. Навеска NaOH 16,05 г растворяется в 150 мл дистиллированной воды, и раствор охлаждается до комнатной температуры. В стакан объемом 2 л добавляются 10 г 3,5-динитросалициловой кислоты, добавляются 400 мл дистиллированной воды и полученная смесь перемешивается в течение 25– 30 мин. Далее при постоянном перемешивании добавляются 150 мл раствора NaOH. При этом цвет жидкости изменяется от светложелтого до ярко-желтого.
Стакан с полученной жидкостью ставится в водяную баню с температурой (47 ± 1) °С и далее 300 г виннокислого калия-натрия добавляются аккуратно, маленькими количествами. Перемешивание проводится до полного растворения.
Охлажденный до комнатной температуры раствор переносится в мерную литровую колбу, и объем жидкости доводится до метки дистиллированной водой. Полученный раствор должен иметь ярко-желтый окрас (без красного оттенка). Реактив хранится в темной бутыли не более 6 месяцев [16].
Заряд поверхности полученного оксида алюминия был охарактеризован методом ЭПР pH-чувствительных нитроксильных радикалов (НР) как спиновых pH-зондов [17, 18]. Для регистрации спектров ЭПР образцы готовились следующим образом. Навеска γ-Al 2 O 3 массой 0,20 г была добавлена в водный раствор НР R имидазолинового типа: 4-диметиламино-5,5-диметил-2-(4-(хлорметил) фенил)-2-этил-2,5-дегидро-1H-имидозол-1-оксил гидрохлорид семигидрата с ионной силой 0,1М, созданной с помощью NaCl, и выдерживалась в этом растворе в течение суток. Для построения кривых титрования НР (зависимостей константы сверхтонкого расщепления, а, Гс (pH-чувствительного параметра спектров ЭПР НР) от pH внешнего раствора (pH) как в растворе, так и в фазе исследуемых материалов варьировали pH раствора НР с помощью 0,1M HCl и 0,1M NaOH, который контролировался с помощью pH-метра Mettler-Toledo Five plus с точностью 0,01 единиц. Образцы отделялись от раствора, промокались фильтровальной бумагой и небольшое количество помещалось в ампулы для регистрации ЭПР-спектров на ЭПР-спектрометре Bruker Elexsys CW E-500 в трехсантиметровом диапазоне длин волн при комнатной температуре. Использовались запаянные с одной стороны кварцевые тонкостенные ампулы, которые помещались в резонатор ЭПР-спектрометра. Для съемки спектров были подобраны оптимальные условия СВЧ мощности и амплитуды модуляции магнитного поля.
Определение ксиланазной активности проводилось согласно ГОСТ 3148-2012 «Препараты ферментные. Методы определения ферментативной активности ксиланазы» [16] с некоторыми допустимыми модификациями. ферментативной активности ксиланазы. Метод, использованный нами, основан на определении редуцирующих сахаров, полученных при ферментативном гидролизе ксилана раствором гидролитического фермента, который при реакции с 3,5-динитросалициловой кислотой дает окрашенное комплексное соединение. Полученные продукты определяются фотометрически при длине волны 540 нм. Количество образовавшихся редуцирующих сахаров определяют по градуировочному графику, построенному для ксилозы-целевого продукта реакции. Единицей ферментативной активности фермента (1 ед. КсА) является такое количество фермента, которое при дейст- вии на субстрат за 1 минуту в стандартных условиях образует 1 мкмоль редуцирующих сахаров (в пересчете на ксилозу).
Для приготовления раствора субстрата ксилана с массовой долей 1 % бралась навеска ксилана 0,125 г, которая вносилась в колбу объемом 25 мл, далее добавлялись 6,25 мл фосфатного буфера (pH = 7,0) вместо ацетатного буфера (pH = 4,7). Подобный выбор был обусловлен подбором оптимальных условий для использования фермента ксиланазы. Содержимое перемешивалось на водяной бане 10 минут с температурой 60–70 °С. Далее колба охлаждалась и добавлялся буферный раствор до 12,5 г (по массе). Приготовление субстрата проводилось в день проведения эксперимента.
Для приготовления рабочего раствора ксиланазы навеска фермента массой 0,002 г помещалась в стеклянный бюкс вместимостью 10 мл. Затем добавлялись 5 мл воды, и содержимое перемешивалось на магнитной мешалке в течение 15 мин. После добавлялись 5 мл дистиллированной воды. Полученный раствор центрифугировался при частоте оборотов 6000 мин–1 в течение 25 мин. Оптическая плотность полученного раствора измерялась на фотоколориметре при 540 нм относительно дистиллированной воды. Раствор готовится в день проведения эксперимента.
Определение активности ксиланазы проводилось следующим способом. В три стеклянные пробирки: две опытные и контрольную добавлялся 1 мл раствора субстрата кси-лана, далее пробирки закрывались пробками и помещались в водяную баню с температурой (50 ± 1) °С на 5 мин. В опытные пробирки добавлялось по 1 мл раствора фермента, подогретого при температуре 50 °С. Содержимое пробирок перемешивалось.
Все пробирки помещались в водяную баню с температурой (50 ± 1) °С на 10 мин. В контрольную пробирку добавлялся 1 мл раствора ксиланазы. Во все пробирки добавлялись 3 мл реактива ДНС, и содержимое перемешивалось.
Параллельно готовилась контрольная проба на реактивы: в чистую пробирку добавляют 1 мл ацетатного буфера, 1 мл дистиллированной воды и 3 мл реактива ДНС. Все пробирки (опытные, контрольную, пробу на реактивы) кипятились на водяной бане в течение 5 мин. Далее пробирки охлаждались под струей воды до комнатной температуры.
После этого проводилось измерение оптических плотностей окрасившихся растворов на фотоэлектроколориметре КФК-3-01 при 540 нм, в кварцевых кюветах с толщиной поглощающего свет слоя 10 мм, против приготовленной контрольной пробы на реактивы.
Каталитическая активность фермента ксиланазы КсА, U/мг определялась по фор- муле:
КсА= (С ^ Ск) , (2)
× где С 0 – молярная концентрация ксилозы в анализируемой пробе в соответствии с градировочным графиком, мкмоль/мл; Ск – молярная концентрация ксилозы в контрольной пробе в соответствии с градуировочным графиком, мкмоль/мл; t – продолжительность гидролиза, мин; с – массовая концентрация ферментного препарата в 1 мл рабочего раствора анализируемого образца, г/мл, рассчитывалась по формуле:
т с= , ,
где т – масса навески ферментного препара- та, г; V – объем разведения навески при приготовлении основного раствора, мл; Р – разведение основного ферментного препарата для приготовления рабочего раствора.
Иммобилизация ксиланазы на γ-Al2O3 поводилась следующим методом: фермент кси-ланаза иммобилизировалась на γ-Al2O3 как методом физической адсорбции, так и кова- лентным связыванием при помощи сшивающего агента – глутарового альдегида [19–22].
В два стеклянных бюкса вместимостью 10 мл помещались две навески массой 0,2 г γ-Al2O3. В первый бюкс добавлялись 2 мл 4 % глутарового альдегида. После этого смесь перемешивалась и выдерживалась в течение 1 часа при комнатной температуре. Затем микропипеткой отбиралась надосадочная жидкость над γ-Al2O3. Образец трижды промывался 2 мл дистиллированной воды с целью отделения непрореагировавшего глутарового альдегида, при этом надосадочная жидкость каждый раз отбиралась в отдельный бюкс. В оба бюкса с γ-Al2O3 добавлялись 2 мл раствора фермента ксиланазы и содержимое выдерживалось при комнатной температуре в течение 1,5 часов. По истечении времени микропипеткой отбиралась надосадочная жидкость. Полученный после ковалентной иммобилизации γ-Al2O3 три раза промывался 2 мл дистиллированной воды. Отобранные надосадоч- ные жидкости центрифугировались при 6000 мин–1 в течение 10 мин. Оптическая плотность
(D) определялась с помощью фотоэлектроколориметра при длине волны 540 нм против дистиллированной воды.
Выход иммобилизации определялся по формуле:
Y = (КсА порошка ) × 100% .
(КсА в растворе)
Эффективность иммобилизации определялась по формуле:
=
КсА в растворе × 100%.
(КсА в порошке )
-
КсА в надосадочной жидкости
×
Гидролитическое разложение ксилана гетерогенными системами с иммобилизованной ксиланазой проводилось по ниже разработан- ному методу.
В бюксы с иммобилизованной ксиланазой (с применением глутарового альдегида и без) вносились по 1 мл субстрата ксилана, предварительно подогретого до 50 °С. Бюксы ставились в термостат при 50 °С на 10 мин. Затем из каждого бюкса микропипеткой отбирался 1 мл надосадочной жидкости и помещался в пробирку. Далее в пробирку добавлялись 1 мл дистиллированной воды, 3 мл ДНС реактива и содержимое ставилось в кипящую водяную баню на 5 минут, засекая время с точностью до секунды.
Параллельно подготавливалась проба на реактивы: в чистую пробирку вносились 1 мл фосфатного буфера, 1 мл дистиллированной воды, 3 мл ДНС реактива. Полученная смесь также помещалась в кипящую водяную баню на 5 мин. По истечении времени пробирки охлаждали под проточной водой до комнатной температуры. Оптические плотности растворов (D) определялись при длине волны 540 нм в кварцевых кюветах с толщиной поглощающего светового слоя 10 мм против контрольной пробы на реактивы с помощью фотоколориметра КФК-3-01.
Для того, чтобы оценить собственную ка- талитическую активность порошкового γ-оксида алюминия, была проведена гидролитическая реакция разложения ксилана по методике, описанной выше, без применения раствора фермента. В два бюкса помещались 0,2 г γ-оксида алюминия. В один из них добавлялся 2 мл глутарового альдегида и выдерживался в течение 1 часа. Затем образец промывался 3 раза 2 мл воды от остатков не прореагировавшего глутарового альдегида. Далее проводилась реакция гидролиза ксилана и определялись оптические плотности растворов с помощью фотоколориметра КФК-3-01 при 540 нм.
Для оценки стабильности ксиланазы, иммобилизованной на γ-Al2O3 для ее многократного применения, проведено 4 цикла реакций гидролитического разложения ксилана, где повторно использовалась гетерогенная каталитическая система – порошковый γ-Al2O3 с иммобилизованной ксиланазой.
Реакции проводились для ксиланазы, иммобилизованной как физической адсорбцией, так и ковалентным связыванием. Реакции проводились по методике, описанной ранее. После каждого цикла образец промывался 3 мл дистиллированной воды с целью вымывания остатков редуцированных сахаров предыдущего цикла.
Относительная активность ксиланазы рассчитывалась по формуле:
=КсА ∙100 %, (6)
КсА где КсА – каталитическая активность фермента в n-м цикле; КсА – каталитическая активность фермента в 1 цикле.
Результаты и их обсуждение
Для того, чтобы оценить эффективность как физической адсорбции специфического фермента ксиланазы на поверхность γ-Al2O3, так и ковалентного его присоединения к оксидной поверхности, было проведено исследование электроповерхностных свойств, а именно заряда поверхности, этого оксида методом ЭПР pH-чувствительных нитроксиль-ных радикалов (НР) [23].
В основе метода лежит определение pH-чувствительных параметров из спектров ЭПР НР в растворе и вблизи поверхности оксида при разных pH внешнего раствора НР, контактирующего с навеской оксида, построение зависимостей pH-чувствительного параметра спектров ЭПР НР (кривых ЭПР титрования) от pH внешнего раствора, и определение сдвигов кривой титрования вблизи поверхности относительно таковой для свободного водного раствора НР.
В случае ЭПР спектра НР вблизи поверхности γ-Al 2 O 3 , приведенного на рис. 1, pH-чувствительным параметром был выбран параметр а , характеризующий константу сверхтонкого расщепления aN , определяемый как расстояние между первой и второй компонентами триплета тонких линий.
Нами установлено ранее в [24], что сдвиг кривой НР в порах γ-оксида алюминия влево (рис. 2) указывает на концентрирование вбли-
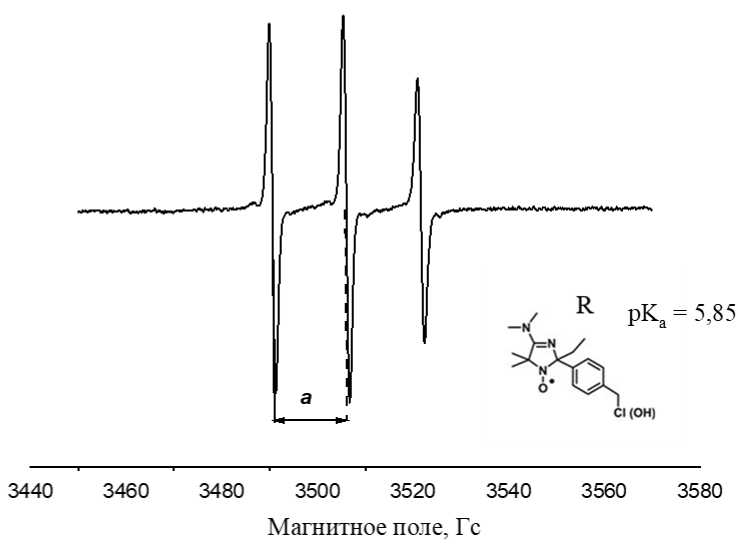
Рис. 1. Типичный спектр НР вблизи поверхности γ-Al 2 O 3 , где R – НР, использованный в качестве зонда, а – pH- чувствительный параметр спектров ЭПР, pK a – антилогарифм константы ионизации НР
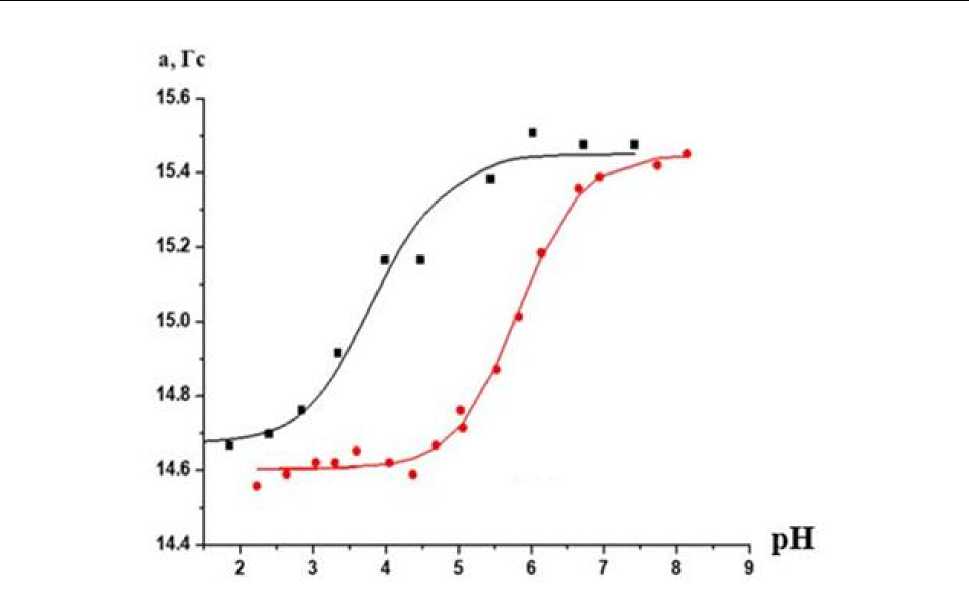
Рис. 2. Кривые титрования НР в во внешнем водном растворе с ионной силой I = 0,1 ( • ) и вблизи поверхности Y-AhO 3№
зи поверхности и связывание самой поверхностью ионов H+ из раствора. Это делает pH локальное (pHloc) выше рН внешнего раствора (pH) и, одновременно, обеспечивает положительный заряд поверхности γ-Al 2 O 3 по крайней мере в диапазоне рН, в котором чувствителен НР.
Как видно из сдвига кривой титрования (см. рис. 2), поверхность оксида обладает положительным зарядом, что говорит о наличии на поверхности центров Льюиса, они обеспечивают возможность ковалентного пришивания фермента при использовании глутарового альдегида, как сшивающего агента.
Выше в разделе «Объекты и методы исследования» нами был изложен метод определения активности гидролитического фермента ксиланазы.
Концентрация получившейся в ходе реакции ксилозы определялась по градуировочному графику зависимости оптической плотности (D) раствора, от концентрации ксилозы. Из формул (2) и (3) была определена активность используемой нами неиммобилизован-ной ксиланазы, которая составила 3,16 U/мг, что указывает на высокую активность фермента в разложении ксилана.
Как отмечено выше, ксиланаза была иммобилизована на порошках γ-Al 2 O 3 как посредством физической адсорбции, так и путем ковалентного связывания посредством глутарового альдегида.
Глутаровый альдегид, который использовался в качестве сшивающего агента, являясь по химической природе жестким основанием Льюиса за счет наличия полярной связи C=O, с одной стороны, образует ковалентную связь с кислотными льюисовскими центрами на поверхности оксида алюминия, а с другой – реагирует со свободными аминогруппами белков, таким образом сшивая молекулы.
Формулы (2) и (3) были также использованы для определения суммарной каталитической активности гетерогенных каталитических систем, состоящей из активности иммобилизованного фермента с использованием сшивающего агента и физической адсорбцией, и активности носителя, которые были равны 12,23 U/мг и 6,68 U/мг, соответственно Таким образом, ковалентная иммобилизация фермента на поверхности γ-Al2O3 приводила к каталитической активности гетерогенной системы в 1,83 раза большей, чем в случае адсорбционной иммобилизации ксиланазы.
Большая активность гетерогенной системы с ковалентно иммобилизованной ксилана-зой обусловлена большими выходом (Y % = 60) и эффективностью иммобилизации (E % = 90,1) по сравнению со случаем физической адсорбции (Y % = 55,5 и E % = 86,2, соответственно), хотя эффективность иммобилизации фермента в обоих случаях иммобилизации была довольно высокой, позволяя сделать вывод, что все иммобилизованные молекулы фермента проявляли каталитическую активность.
В ходе экспериментов было установлено, что каталитическая суммарная активность гетерогенной каталитической системы выше, чем при гомогенной реакции. Процесс можно проводить непрерывно, в проточных колонках, регулируя скорость реакции. При многократном использовании гетерогенной каталитической системы значительно снижается себестоимость продукта, реакцию можно остановить в любой момент и получать продукты, не загрязненные ферментом.
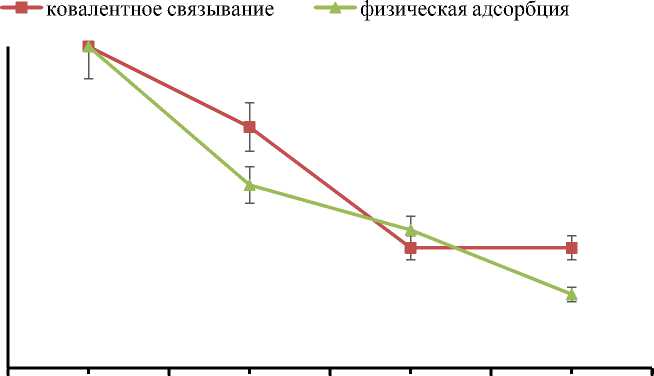
С целью подтвердить возможность многократного использования наших гетерогенных каталитических систем была исследована операционная стабильность иммобилизованного фермента в четырех последовательных циклах каталитической реакции гидролиза ксилана (рис. 3).
Данное количество циклов является оп- тимальным и обеспечивает достоверность полученных данных, при этом уменьшается расход реактивов. Из рис. 3 видно, что ковалентно иммобилизованная ксиланаза проявляет большую операционную стабильность при многократном использовании, чем в случае физической адсорбции фермента на поверхность носителя.
Было установлено, что ферментативная активность ковалентно иммобилизованной ксиланазы при первых двух циклах достаточно высока, на третьем цикле она снижается до 37,5 % и выходит на плато. При иммобилизации фермента физической адсорбцией активность продолжает снижаться до 23 % в 4-м цикле.
Разложение ксилана гетерогенными каталитическими системами на основе оксида алюминия и иммобилизованного на нем различными способами фермента ксиланазы, и проведение сравнительного анализа полученных данных позволяет сделать вывод о перспективности дальнейшего использования полученных систем.
Дальнейшее изучение каталитической активности фермента иммобилизованной кси-ланазы в реакции гидролитического разложения ксилана и подбор оптимальных условий для иммобилизации позволит увеличить число циклов использования ксиланазы для увеличения выхода восстанавливающих сахаров, of 50
3 4
Цикл
Рис. 3. Операционная стабильность ксиланазы, иммобилизованной на порошковом γ-Al 2 O 3 . R – относительная активность ксиланазы в %, вычисленная по формуле (6)
в т. ч. целевого продукта ксилозы. Иммобилизованная ксиланаза имеет потенциал для применения в кормовой промышленности, поскольку эффективна в высвобождении восстанавливающих сахаров, и может быть использована в птицеводстве.
Статья подготовлена при финансовой поддержке гранта РФФИ по научному проекту № 18-29-12129 мк.
Список литературы Гетерогенные катализаторы на основе гамма оксида алюминия с иммобилизованной ксиланазой для гидролитического разложения ксилана
- Bajpai P. Xylanolytic Enzymes / P. Bajpai. - Academic press, 2014. - 121 p.
- Laine C. [et al.] Extraction of xylan from wood pulp and brewer's spent grain // Industrial Crops and Products. - 2015. (70). - P. 231-237.
- Sousa S. [et al.] Surface properties of xylan and xylan derivatives measured by inverse gas chromatography // Colloids and Surfaces A: Physicochemical and Engineering Aspects. -2016. - (506). - P. 600-606.
- Ramawat K. G., Merillon J. M. Polysaccharides: Bioactivity and biotechnology / K. G. Ramawat, J. M. Merillon, 2015. 1-2241 p.
- Li H. [et al.] The hydrolytic efficiency and synergistic action of recombinant xylan-degrading enzymes on xylan isolated from sugarcane bagasse // Carbohydrate Polymers. - 2017. - (175). - P. 199-206.
- Soleimani M., Tabil L. G., Panigrahi S. A kinetic study of xylose recovery from a hemicellu-lose-rich biomass for xylitol fermentative production // Chemical Engineering Communications. -2019. - № 2 (206). - P. 193-206.
- Болотова К. С. Применение ферментных технологий для повышения экологической безопасности целлюлозно-бумажного производства / К.С. Болотова, Е. В. Новожилов // Химия растительного сырья. - 2015. - № 3. -С. 5-23.
- Саловарова В.П. Эколого-биотехноло-гические основы конверсии растительных субстратов: учеб. пособие /Ю.П. Козлов. - 2-е изд., перераб. и доп. -М. : Издательский дом «Энергия», 2006. - 544 с.
- Carvalho E.A. [et al.] Thermoresistant xylanases from Trichoderma stromaticum: Application in bread making and manufacturing xylo-oligosaccharides // Food Chemistry. - 2017. -(221). - P. 1499-1506.
- Thomas L. [et al.] Industrial Enzymes: Xylanases // Current Developments in Biotechnology and Bioengineering: Production, Isolation and Purification of Industrial Products. - 2016. - P. 127-148.
- Krajewska B. Application of chitin- and chitosan-based materials for enzyme immobilizations: A review // Enzyme and Microbial Technology. - 2004. - № 2-3 (35). - P. 126-139.
- Arya S.K., Srivastava S.K. Kinetics of immobilized cyclodextrin gluconotransferase produced by Bacillus macerans ATCC 8244 // Enzyme and Microbial Technology. - 2006. - № 3 (39). - P. 507-510.
- Nagar S. [et al.] Immobilization of xylanase on glutaraldehyde activated aluminum oxide pellets for increasing digestibility of poultry feed // Process Biochemistry. - 2012. - № 9 (47). - P. 1402-1410.
- Тихонов В. Н. Аналитическая химия алюминия. - М: Наука, 1971. - 266 с.
- Пантелеев И.Б. Получение и свойства алюмооксидного прекурсора / И.Б. Пантелеев, А.А. Циренников, Н.А. Андреева // Известия СПбГТИ(ТУ). - 2017. - № 40. - С. 8-12.
- ГОСТ 31488-2012 Препараты ферментные. Методы определения ферментативной активности ксиланазы. - М: Стан-дартинформ, 2012. - C. 2-10.
- Kovaleva E.G. [et al.] Interfacial Electrostatic Properties of Hydrated Mesoporous and Nanostructured Alumina Powders by Spin Labeling EPR // Cell Biochemistry and Biophysics. - 2017. - № 2 (75). - P. 159-170.
- Akratopulu K. C., Vordonis L., Lycourghiotis A. Effect of temperature on the point of zero charge and surface dissociation constants of aqueous suspensions of y-Al2O3 // Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases. - 1986. - № 12 (82). - P. 3697-3708.
- Fadouloglou V.E., Kokkinidis M., Glykos N.M. Determination of protein oligomerization state: Two approaches based on glutaraldehyde crosslinking // Analytical Biochemistry. - 2008. -№ 2 (373). - P. 404-406.
- Xiao H.Y. [et al.] Immobilization of laccase on amine-terminated magnetic nano-composite by glutaraldehyde crosslinking method // Transactions of Nonferrous Metals Society of China (English Edition). - 2006. - (16). -P. 414-418.
- Lopez-Gallego F. [et al.] Enzyme stabilization by glutaraldehyde crosslinking of adsorbed proteins on aminated supports // Journal of Biotechnology. - 2005. - № 1 (119). - P. 70-75.
- Lee H. R. [et al.] Preparation of glutaraldehyde-treated lipase-inorganic hybrid nanoflowers and their catalytic performance as immobilized enzymes // Enzyme and Microbial Technology. - 2017. - (105). - P. 24-29.
- Khramtsov V.V. and Volodarsky L.B. Biological Magnetic Resonance. - New York: Kluwer Academic Publishers, 2002. - P. 109180.
- Молочников Л.С. Метод спинового зонда в исследовании кислотности неорганических материалов / Л.С. Молочников, Е.Г. Ковалева, Е.Л. Головкина и др. // Коллоидный журнал. - 2007. - № 6. - С. 821-828.


