Гистологическое исследование печени и 12-пёрстной кишки лабора торных мышей при использовании пробиотика Bacillus coagulanc
Автор: Проворова Н.А., Салмина Е.С., Дежаткин И.М., Феоктистова Н.А., Ахметова В.В., Пульчеровская Л.П.
Статья в выпуске: 1 т.253, 2023 года.
Бесплатный доступ
Целью работы явилось гистологическое исследование и морфологическая оценка состояния печени и 12-пёрстной кишки у лабораторных мышей на фоне добавления в их рацион пробиотического препарата Bacillus coagulans. Научные исследования проводились на кафедре морфологии, физиологии и патологии животных в Ульяновском ГАУ. Объектами научного исследования были белые мыши, сформированные в 4 группы, в каждой по 20 мышей. Применение пробиотического препарата Bacillus coagulans в дозировке 0,6 мл 107 КОЕ оптимизирует структурную организацию печени, предотвращает жировую дистрофию гепатоцитов и фиброзную дегенерацию стромы органа, а также стабилизирует десквамативные процессы в 12-ти перстной кишке, что можно видеть на микроскопическом уровне у животных третьей опытной группы. Наши наблюдения являются морфологическим обоснованием необходимости применения пробиотического препарата животным.
Пробиотик, мыши, печень, тонкий кишечник, гистологическое исследование
Короткий адрес: https://sciup.org/142237401
IDR: 142237401 | УДК: 636.2. | DOI: 10.31588/2413_4201_1883_1_253_220
Текст научной статьи Гистологическое исследование печени и 12-пёрстной кишки лабора торных мышей при использовании пробиотика Bacillus coagulanc
Согласно распоряжению Правительства Российской федерации (от 30.03.2019, № 604-р) «Об утверждении плана мероприятий на 2019-2024 гг. по реализации Стратегии предупреждения распространения антимикробной резистентности в РФ на период до 2030 г» взамен кормовых антибиотиков для животных и птиц стали использовать пробиотики и пребиотики, фитобиотики, эфирные масла и биопрепараты. Усилился научный поиск в области разработки и биотехнологии новых отечественных пробиотических композиций и препаратов [2, 5, 7, 9]. Микробиота кишечника как мобильная система, способна быстро перестраиваться под влиянием внешних факторов. Микробиота кишечника непосредственно вовлечена в систему питания и обмена веществ у животных и человека. Поэтому изменения, связанные с нарушением и неполноценным питанием, в том числе отсутствие и нехватка корма, смена рациона, а также связанные с реакцией организма на внешние стресс-раздражители различной этиологии, также влияют на систему пищеварения и микробиоценоз кишечника [3, 4, 8]. В последнее время интерес учёных вызывает изучение спорообразующей лактобактерии Bacillus coagulans, она достаточно хорошо поддаётся необходимым технологическим процессам, а в организме может долго не разрушаться под влиянием желудочного сока и желчи. Попадая в тонкий кишечник животного, её споры могут прорастать в вегетирующие бактерии и оказывать свои пробиотические эффекты. При этом эффективно вытесняют патогенную микрофлору из кишечника, улучшая процесс пищеварения и переваривания корма [6, 13, 14]. Важное значение, в научных исследованиях, имеет использование патоморфологического метода диагностики, направленного на изучение морфологических критериев состояния и изменений, происходящих в органах и тканях, при помощи микроскопа [1, 10, 11, 12].
Материал и методы исследований. Целью настоящего исследования стало гистологическое исследование и морфологическая оценка состояния печени и 12-пёрстной кишки у лабораторных мышей на фоне добавления в их рацион пробиотического препарата Bacillus coagulans. Научные исследования проводились на кафедре морфологии, физиологии и патологии животных в Ульяновском ГАУ. Объектами научного исследования стали б/п белые мыши, сформированные в 4 группы, в каждой по 20 мышей. Животные содержались в одинаковых условиях в стандартных клетках при 12-часовом световом режиме, имели свободный доступ к пище и воде. Пробиотик вводили энтерально 1 раз в день каждому животному на голодный желудок в течение 30 дней (скармливали кусочки хлеба пропитанные пробиотиком В. Сoagulans согласно схеме (Таблица 1).
Таблица 1 – Схема опыта на лабораторных мышах
|
Группа |
Количество животных |
Количество исследуемого препарата |
|
1 – группа (контроль) |
20 |
0,5 мл дистиллированной воды |
|
2 – группа (опыт) |
20 |
0,5 мл 107 КОЕ пробиотика |
|
3 – группа (опыт) |
20 |
0,6 мл 107 КОЕ пробиотика |
|
4 – группа (опыт) |
20 |
0,7 мл 107 КОЕ пробиотика |
В конце опыта проводили убой по 10 животных из группы для взятия образцов органов и тканей. Материалом для гистологического исследования послужили образцы печени и слизистой оболочки тонкого кишечника (12-перстной кишки) лабораторных мышей. Взятие данного материала проводили в утренние часы (11 часов), фиксировали в 10 % растворе нейтрального формалина, обезвоживали и изготавливали гистологические срезы толщиной 5-7 мкм на замораживающем микротоме; полученные срезы окрашивались классическими методами гистологии.
Результат исследований. У всех животных опытных групп при макроскопическом исследовании было обнаружено незначительное увеличение размеров печени. Было установлено, что печень имела дряблую консистенцию, тургор её паренхимы был снижен. Поверхность печени была гладкой и имела различные оттенки желтого цвета (от желто-беловатого до охряно-желтого). У мышей 4 группы (опыт, с применением максимальной дозировки пробиотического препарата, до 0,7 мл 107 КОЕ) такая окраска была диффузной и распространялась на всю поверхность печени. В тоже время, у животных 2 и 3 групп (опыт) её окраска чередовалась с участками, имевшими нормальный цвет (красно-бурый). Следовательно, на основании гистологического исследования выявлена высокая зависимость структуры печени мышей от их кормления.
При анализе гистопрепаратов тканей печени мышей 2-й и 4-й групп, было установлено нарушение общей структуры паренхимы их печени. Гепатоциты характеризовались выраженной мембраной и были среднего и большого размера. Ядра гепатоцитов были округлые и находились в центре клетки, редко - на периферии, что объясняется смещением их большими липидными каплями. Ядерная мембрана была целостна и четко выражена. В ходе исследований выявлены области с признаками жировой дистрофии гепатоцитов-многочисленные мелкие липидные капли образовывали крупные и находились в паренхиме печени лабораторных мышей. Цитоплазма также характеризовалась многочисленными жировыми включениями. Ядрышки сохраняли округлую форму, имели средний и мелкий размер, в синусоидах встречались макрофаги.
В печени мышей 4-й группы выявлены отрицательные изменения: гибель гепатоцитов; замещение пустот крупными жировыми каплями;
гипертрофия гепатоцитов со снижением ядерно-цитоплазматического соотношения; накопление в цитоплазме липидных включений; снижение количества двуядерных гепатоцитов и ядрышек в ядрах; уменьшение относительной площади сети синусоидов. Это свидетельствует о развитии жирового гепатоза в печени мышей 4-й группы при скармливании высокой дозировки изучаемого биопрепарата В. Сoagulans, большая часть её клеток подверглась жировой дистрофии.
Дальнейшие исследования позволили установить, что в печени подопытных животных 3-й группы общее число одноядерных гепатоцитов на единицу площади было меньшим по сравнению с контролем. Количество двуядерных гепатоцитов снижалось у животных 1-й и 3-й группы. Наличие крупных жировых капель в печени мышей 2-й и 4-й групп преобладало по сравнению с другими группами. А сеть синусоидов, в тканях печени животных 2-й и 4-й групп имела выраженные нарушения кровообращения и лимфотока. Отмечено уменьшение относительной площади синусоидов, что указывает на ухудшение кровенаполнения паренхимы печени и снижении выполнения трофической функции соединительной ткани в ней.
В ходе микроскопического изучения гистопрепаратов печени животных 1-й группы было установлено клубочковотрабекулярное строение, при этом отмечены суженные просветы синусоидных капилляров. Клетки печени этих лабораторных мышей были увеличенными и характеризовались признаками зернистой и жировой дистрофии. Это хорошо просматривалось по слабой зернистости цитоплазмы, небольшим вакуолям, при этом под капсулой вакуолизация цитоплазмы гепатоцитов была более выраженой (Фото 1, А).
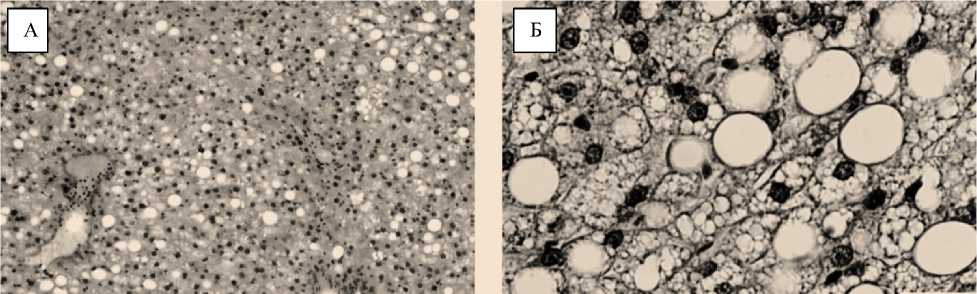
Фото 1 – Микрокартина печени животных 1-й (контрольная) и 2-й (опытная) групп (А— контрольная, х200, Б — опытная, х800). Окраска гематоксилин-эозином
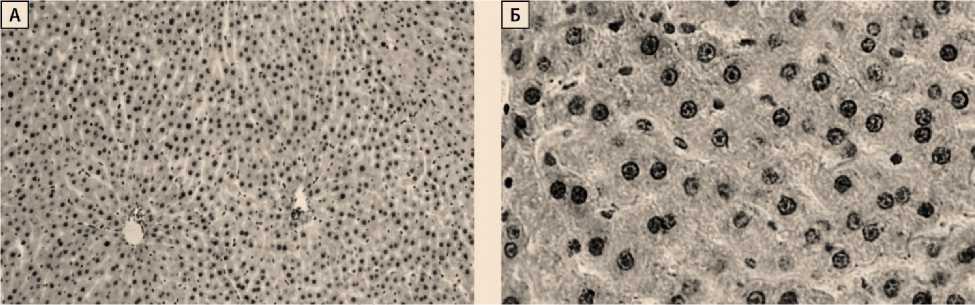
Фото 2 – Микрокартина печени животных 3-й группы (опытная) (А – х200, Б – х800). Окраска гематоксилин-эозином
На срезах печени животных 2-й группы, с применением дозировки пробиотика до 0,5 мл 107 КОЕ, выявлено наличие небольшого просвета в кровеносных сосудах, которые умеренно заполнены клетками крови, характеризуя усиление кровообращения. В виде прямых пучков видны пластинки, клетки печени содержат одно ядро, а двуядерные клетки встречаются редко. В крупных светлых ядрах гепатоцитов гетерохроматин идёт по периферии, в виде тонкой полосы по внутреннему краю оболочки ядра.
Ядрышко находится в центре ядра, имеет небольшой размер и еле выраженную ретикулярную структуру. Достаточно чётко виды ядра гепатоцитов, которые имели округлую и овальную форму (фото 1, Б).
По сравнению с аналогами лучшей оказалась микрокартина печени у животных 3-й группы, получавших пробиотический препарат в дозе до 0,6 мл 107 КОЕ. Результаты гистологического изучения их печени показали, что при относительном снижении объема её паренхимы все тканевые структуры были хорошо развиты. Не обнаружено признаков атрофии и дистрофических изменений, не выявлено нарушений крово- и лимфообращения. При окраске гематоксилином-эозином цитоплазма отличалась мелкозернистой структурой без нейтральных жиров. Объем гепатоцитов, их ядер, ядерно-плазматическое отношение было большим по сравнению гистообразцами в других группах. В гепатоцитах печени мышей 3-й группы совершенно отсутствовали капли нейтральных жиров, а в цитоплазме не было зернистости (Фото 2).
В печени животных 4-й группы (с дозой препарата, до 0,7 мл 107 КОЕ) установлены наихудшие изменения по сравнению с аналогами: ячеистая структура, гепатоциты выглядели опустошенными, ядра их, как бы, плавали посредине цитоплазмы и были сморщенными; опустошенность цитоплазмы заполнялась жировыми включениями, здесь же были диффузные очаги экстрамедуллярного кроветворения; границы печеночных долек едва просматривались; микроциркуляторное русло нарушалось; центральные вены заполнялись форменными элементами крови; строма печени была фиброзно изменена; стенки сосудов утолщены. Установлены признаки мукоидного и фибриноидного набухания соединительной ткани. Вероятно, такие изменения происходили вследствие застойных явлений в кровеносной системе мышей 4 группы. Выявлены не выраженные и обратимые альтеративные изменения, которые связаны с развитием липофанероза и распад клеточных белково-липидных комплексов, клеточных мембран (Фото 3).
Анализ гистопрепаратов 12-ти пёрстной кишки лабораторных мышей 1-й (контроль) и 3-й (опыт) групп показал, что происходила пролиферация лимфоидных клеток в собственной пластинке слизистой оболочки (Фото 4).
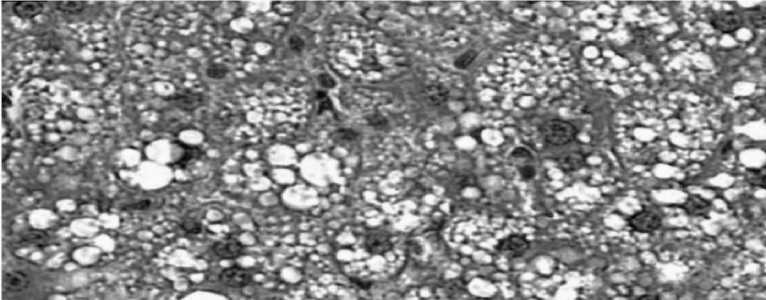
Фото 3 - Микрокартина печени крыс 4-й (опытной) группы. Окраска гематоксилином и эозином, х 800
Энтероциты боковых поверхностей и оснований ворсинок отличались своей высотой. За базальной мембраной эпителиального пласта были выявлены скопления лимфоидных клеток. Крипты имели характерное строение, у основания которых было обилие бокаловидных клеток. При электронной микроскопии энтероциты имели высокие микроворсинки, в цитоплазме была развита эндоплазматическая сеть, полиморфные митохондрии располагались группами. В срезах двенадцатиперстной кишки у крыс 2-й и 4-й групп в слизистой оболочке имелась тенденция к десквамации эпителиоцитов с боковых поверхностей ворсинки, в слизистой оболочке тонкой кишки выявлялись мигрирующие клетки. Из мигрантов чаще всего выявлялись лимфоциты и эозинофилы. В срезах выявлялся невысокий однослойный цилиндрический эпителий. При микроскопическом исследовании выявлены в энтероцитах округлые электронно-светлые митохондрии. Экзокриноциты крипт содержали небольшое количество секреторных гранул в апикальной части клетки, ядра были слабо дифференцированы. Нередко встречались дистрофические во всей толще слизистой оболочки, а в подслизистом слое наблюдали расширение кровеносных капилляров и гиперемию (Фото 5).
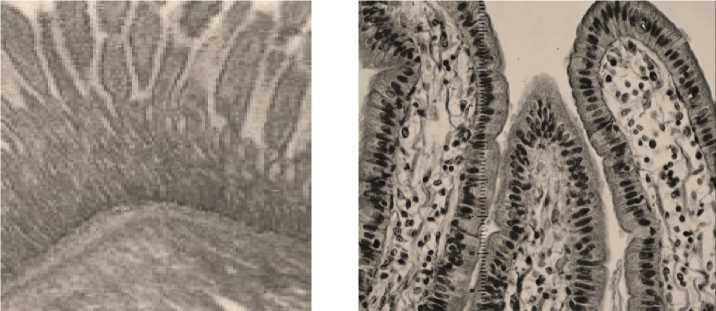
Фото 4 – Структурная организация слизистой оболочки 12-перстной кишки у крыс 1-й (контрольная) и 3-й (опытная) групп (микрокартина): скопление лимфоидных клеток на базальной мембране эпителиального пласта; увеличение высоты микроворсинок энтероцитов; увеличение количества полиморфных митохондрий, х 200, х 800, окраска гематоксилином и эозином
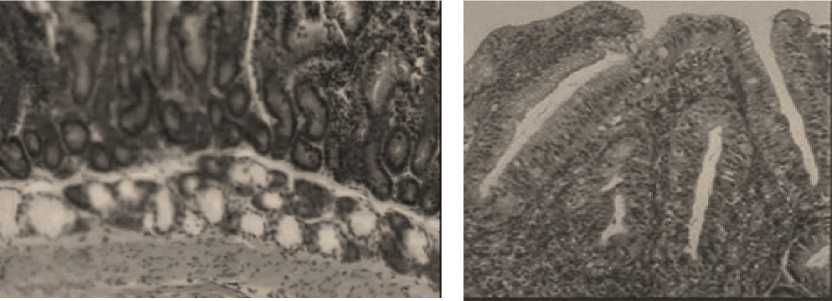
Фото 5 – Структурная организация клеток слизистой оболочки 12-ти перстной кишки у животных 2-й и 4-й групп (опытные): эозинофилия в собственном слое слизистой оболочки; дистрофия энтероцитов с низкими микроворсинками; дистрофические энтероциты в криптах слизистой оболочки; расширение микроциркуляторного русла
Заключение. Следовательно, на фоне развития липофанероза и усиления декомпозиции ультраструктур печени, мы видим фиброзные изменения её стромы и гемодинамики. Поступление в организм мышей с кормом пробиотического препарата Bacillus coagulans в дозировке 0,6 мл 107 КОЕ способствует улучшению структурной организации, а также снижению вероятности развития процессов жировой дистрофии гепатоцитов и фиброзной дегенерации стромы их печени. Использование биопрепарата в указанной дозировке стабилизирует десквамативные процессы и в 12-ти перстной кишке, что подтверждают микроскопические исследования структуры слизистой оболочки тонкого кишечника у животных 3-й опытной группы. Считаем, что выявленные наблюдения являются морфологическим обоснованием к использованию пробиотического препарата Bacillus coagulans в дозировке 0,6 мл 107 КОЕ для лабораторных животных.
Список литературы Гистологическое исследование печени и 12-пёрстной кишки лабора торных мышей при использовании пробиотика Bacillus coagulanc
- Воротникова, И. А. Изучение влияния добавок цеолита и наноцеолита на организм и динамику массы крыс / И. А. Воротникова, С. В. Дежаткина, Н. А. Любин, Н. В. Шаронина, Е. В. Панкратова // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2020. – Т. 244. – № 4. – С. 57-60.
- Дежаткина, С. В. Влияние препарата «Aminobiol» на молочную продуктивность коров / С. В. Дежаткина, А.
- З. Мухитов, Н. В. Шаронина // Вестник Ульяновской государственной сельскохозяйственной академии. – 2019. – № 2(46). – С.179-183.
- Дежаткина, С.В. Влияние соевой окары на морфо-биохимический статус организма кур-несушек / С. В. Дежаткина, Н. В. Шаронина, М. Е. Дежаткин //Материалы конференции: Аграрная наука и образование на современном этапе развития: опыт, проблемы и пути их решения. – 2016. – С. 119-125.
- Дежаткина, С. В. Получение органической продукции в молочном скотоводстве путём скармливания натуральных кремнийсодержащих добавок / С. В. Дежаткина, Ш. Р. Зялалов, А. З. Мухитов, М. Е. Дежаткин, Н. В. Шаронина // Аграрная наука. – 2021. – № 2. – С. 45-49.
- Дежаткина, С. В. Использование природных высокоструктурированных кремний содержащих добавок для получения органической продукции животноводства / С. В. Дежаткина, В. А. Исайчев, М. Е. Дежаткин, Л. П. Пульчеровская [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2021. № 247(3). – С. 58-64.
- Дежаткина, С. В. Использование кремнийсодержащей добавки в молочном скотоводстве с целью производства органической продукции / С. В. Дежаткина, Н. В. Шаронина, Т. М. Ахметов // Национальная научно-практическая конференция с Международным участием: Кремний и жизнь. Кремнистые породы в сельском хозяйстве. –Ульяновск. – 2021. – С. 161-167.
- Зялалов, Ш. Р. Влияние аминокислотного комплекса «ВИТААМИН» на биохимические показатели крови мышей / Ш. Р. Зялалов, М. А. Ильинская, Н. В. Шаронина, С. В. Дежаткина, А. З. Мухитов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2021. – Т. 246. – № 2. – С. 88-93.
- Зялалов, Ш. Р. Влияние аминокислотного комплекса «ВИТААМИН» на гематологические показатели лабораторных животных при изучении хронической токсичности / Ш. Р. Зялалов, А. З. Мухитов // Материалы X Международной научно-практической конференции. – 2020. – С. 283-286.
- Ильинская, М. А. Влияние дельтаметрина (Дельцид) на репродуктивную способность лабораторных мышей / М. А. Ильинская, Д. Ю. Акимов // Лабораторные животные для научных исследований. – 2020. – № 4. – С. 38-48.
- Ильинская, М. А. К вопросу о методике изучения воспроизводительных способностей мышей при использовании кремнийсодержащих добавок / М. А. Ильинская, С. В. Дежаткина // Кремний и жизнь. Кремнистые породы в сельском хозяйстве. Материалы Национальной научно-практической конференции с Международным участием. – Ульяновск. – 2021. – С. 183-189.
- Макарова, М. Н. Зоотехнические особенности воспроизводства мышей линии BALB/c / М. Н. Макарова, М. А. Ильинская // Лабораторные животные для научных исследований. – 2020. – № 1. – https://doi.org/10.29296/2618723X-2020-01-04.
- Никитина, И. А. К вопросу о постановке опыта на лабораторных животных / И. А. Никитина, С. В. Дежаткина //Аграрная наука и образование на современном этапе развития: опыт, проблемы и пути их решения. Материалы VIII международной научно-практической конференции. – 2017. – С. 159-161.
- Романова, Ю. А. Повышение качества молока путём скармливания активированных кремнийсодержащих добавок / Ю. А. Романова, И. М. Дежаткин, С. В. Дежаткина, В. В. Ахметова // Материалы Международной научно-практической конференции обучающихся, аспирантов и молодых ученых: Проблемы и пути развития ветеринарной и зоотехнической наук. – Саратов. – 2021. – С. 762-768.
- Zhukov, R. B. Red cattle breeds feeding rations with selenium-enriched components from yeast and chilorella / R. B. Zhukov, O. N. Eremenko, G. V. Ospichuk, A. N. Simonov [et al.] // International Transaction Journal of Engineering, Management and Applied Sciences and Technologies. – 2021. – V. 1(11). – https://doi.org/10.14456/ITJEMAST.2021.222.


