Характеристика BRCA-ассоциированного эпителиального рака яичников в российской популяции
Автор: Новикова Е.И., Кудинова Е.А., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.23, 2023 года.
Бесплатный доступ
Наличие клинически значимых вариантов в генах BRCA1 и BRCA2 у больных раком яичников во многом определяет выбор тактики лечения и профилактических мероприятий. Целью работы было исследовать особенности BRCA-ассоциированного эпителиального рака яичников в российской популяции. В исследование вошли 298 пациентов с диагнозом эпителиальный рак яичников. На первом этапе проведено исследование образцов крови всех пациентов на наличие восьми наиболее распространенных патогенных вариантов в генах BRCA1 и BRCA2 методом ПЦР в реальном времени. Далее 93 больным эпителиальным раком яичников, у которых на первом этапе не были выявлены повреждения в генах BRCA1 и BRCA2 , проводилось исследование всей кодирующей части данных генов методомсеквенирования нового поколения (NGS). В результате у 16% пациентов выявлены наиболее распространенные в российской популяции наследственные варианты в генах BRCA1 и BRCA2 , среди которых преобладал вариант 5382insC в гене BRCA1 . Методом NGS у 16% больных эпителиальным раком яичников были обнаружены 13 клинически значимыхвариантов в генах BRCA1 и BRCA2 . Таким образом, эпителиальный рак яичников вроссийской популяции характеризуется достаточно высокой частотой и широким спектром герминальных патогенных вариантов в генах BRCA1 и BRCA2 , поэтому использование только «стандартных» диагностических панелей может привести к получению ложноотрицательных результатов. Использование высокопроизводительногосеквенирования позволяет повысить эффективность диагностики клинически значимых вариантов в генах BRCA1 и BRCA2 у больных эпителиальным РЯ как минимум в 2 раза. Клинико-морфологические особенности BRCA -ассоциированного эпителиального рака яичников свидетельствуют о необходимости проведения молекулярно-генетическоготестирования всем пациентам с данным диагнозом, в первую очередь у пациенток с серозной карциномой высокой степени злокачественности.
Патогенные варианты в генах brca1 и brca2, секвенирование «нового поколения» (ngs), наследственный рак яичников
Короткий адрес: https://sciup.org/149145016
IDR: 149145016
Текст научной статьи Характеристика BRCA-ассоциированного эпителиального рака яичников в российской популяции
Рак яичников (РЯ) занимает первое место по смертности среди гинекологических злокачественных заболеваний. В России ежегодно злокачественные опухоли яичников выявляются более чем у 13 000 женщин, а умирают от этого заболевания около 8 000 женщин. У большинства пациенток заболевание выявляется на поздних стадиях, при которых общая пятилетняя выживаемость не превышает 30-40% [1]. В связи с этим проблема ранней диагностики этого рака является актуальной.
Основную роль в развитии РЯ отводят гормональному и генетическому факторам. В связи с генетическим фактором выделяют спорадический (ненаследственный рак), на долю которого приходится 75-85% всех случаев РЯ, и наследственный рак, составляющий 15-25% всех случаев заболевания и характеризующийся наличием клинически значимого генетического варианта в генах, участвующих в процессах репарации, регуляции клеточного цикла, апоптоза, то есть отвечающих за поддержание стабильности генома [2].
Прежде всего, к таким генам относятся гены BRCA1 и BRCA2: 65-85% всех случаев наследственного рака связаны с повреждением этих генов. У женщин с патогенными изменениями в гене BRCA1 вероятность развития заболевания в течение жизни выше на 58%, а у женщин с повреждениями в гене BRCA2 - на 29% [3]. Наследственный BRCA-ассоциированный РЯ характеризуется клиническими особенностями течения заболевания. Для него характерен более молодой возраст манифестации заболевания по сравнению со спорадическим раком. В основном BRCA-позитивный РЯ характеризуется серозным гистологическим типом с высокой степенью злокачественности. Серозная карцинома высокой степени злокачественности составляет 70-75% всех эпителиальных злокачественных опухолей яичников [4-6]. Наличие клинически значимых вариантов в генах BRCA1 и BRCA2 во многом определяет выбор тактики лечения и профилактических мероприятий [7].
В настоящее время в России в большинстве лабораторий молекулярно-генетическая диагностика для выявления наследственных форм РЯ заключается в определении нескольких патогенных вариантов в генах BRCA1 и BRCA2 , которые наиболее характерны для нашей популяции, с использованием «стандартных» диагностических панелей [8]. Однако ряд проведенных исследований указывает на наличие других клинически значимых вариантов в данных генах, которые также встречаются в нашей популяции и увеличивают онкологический риск, поэтому должны быть учтены при назначении лечения и проведении профилактических мероприятий [9].
Целью работы было исследовать особенности BRCA -ассоциированного эпителиального рака яичников в российской популяции.
Материалы и методы
В обследованную группу вошли 298 пациентов с диагнозом эпителиальный РЯ в возрасте от 19 до 81 года, которые проходили обследование и лечение в Российском научном центре рентгенорадиологии с 2010 по 2022 г. (табл. 1). Все они подписали добровольное информированное согласие на проведение молекулярно-генетического исследования. Также всем пациентам было проведено гистологическое исследование тканей опухоли. Средний возраст манифестации заболевания составил 53 года. У 37% пациентов заболевание развилось в возрасте до 50 лет. Онкологически отягощенный семейный анамнез имели 16% обследованных. Наличие или отсутствие онкологически отягощенного семейного анамнеза оценивалось по следующим критериям. Считалось, что пациент имеет онкологически отягощенный семейный анамнез, если: 1) у него имелся хотя бы один кровный родственник первой, второй или третьей степени родства с диагнозом: рак молочной железы (РМЖ), установленном в возрасте до 50 лет или диагноз РЯ, РМЖ у мужчин, рак поджелудочной железы или метастатический рак предстательной железы, установленный в любом возрасте; 2) пациент имел хотя бы двух родственников первой, второй или третьей степени родства с диагнозом РМЖ, установленном в любом возрасте. У 21% пациентов были выявлены первично-множественные злокачественные новообразования (ПМЗН) (РЯ и РМЖ или рак эндометрия (РЭ) или колоректальный рак (КР)). У большей части больных РЯ (82%) заболевание было диагностировано на поздней стадии (3-4 стадии заболевания).
Табл. 1. Клиническая характеристика обследованной группы больных РЯ
|
Характеристика |
Больные раком яичников (n=298) |
|
1. Возраст |
|
|
Средний возраст манифестации заболевания, лет |
53 (19-81) |
|
до 50 лет, чел. (%) |
110 (37) |
|
51 год и старше, чел. (%) |
188 (63) |
|
2.Семейный онкологический анамнез |
|
|
Отягощен, чел. (%) |
48 (16) |
|
Не отягощен, чел. (%) |
250 (84) |
|
3. Диагноз |
|
|
Первично-множественные злокачественные новообразования (рак яичников + рак молочной железы, рак яичников + рак эндометрия, рак яичников + колоректальный рак), чел. (%) |
64 (21) |
|
Рак яичников, чел. (%) |
234 (79) |
|
4. Гистологический тип опухоли |
|
|
Серозная карцинома высокой степени злокачественности, чел. (%) |
238 (80) |
|
Серозная карцинома низкой степени злокачественности, чел. (%) |
12 (4) |
|
Эндометриоидная карцинома, чел. (%) |
18 (6) |
|
Муцинозная карцинома, чел. (%) |
9 (3) |
|
Светлоклеточная карцинома, чел. (%) |
21 (7) |
|
5. Стадия |
|
|
1-2, чел. (%) |
54 (18) |
|
3-4, чел. (%) |
244 (82) |
Что касается гистологического типа опухоли, у 80% пациентов была диагностирована серозная карцинома высокой степени злокачественности, у 7% пациентов - светлоклеточная карцинома, у 6% пациентов - эндометриоидная карцинома, у 4% пациентов - серозная карцинома низкой степени злокачественности, у 3% пациентов - муцинозная карцинома (табл. 1).
На первом этапе обследования всем пациентам проводилось ДНК-тестирование на наличие распространенных в российской популяции наследственных патогенных вариантов в генах BRCA1/2 методом ПЦР в реальном времени.
Для выделения ДНК использовали наборы «М-Сорб» («Синтол», Россия). Постановку ПЦР в реальном времени проводили с использованием панели реагентов «ОнкоГенетика BRCA» («ДНК-Технология», Россия), которая содержит специфические праймеры для определения 7 вариантов в гене BRCA1 (185delAG, 4153delA, 5382insC, 3819delGTAAA, 3875delGTCT, 300T>G, 2080delA) и 1 варианта в гене BRCA2 (6174delT).
При отсутствии у пациентов этих патогенных вариантов проводилось исследование методом секвенирования нового поколения (NGS) , которое позволяло исследовать всю кодирующую часть и регионы сплайсинга генов BRCA1/2 . Данным методом были обследованы 93 больных эпителиальным РЯ.
Геномную ДНК для исследования выделяли из периферической крови с использованием реактивов «QIAamp DNA Blood Mini Kit» (Qiagen; Германия) по протоколу производителя. Рабочая концентрация ДНК составляла не менее 10 нг/мкл. Подготовку библиотек для секвенирования проводили по протоколу фирмы-производителя с использованием методики селективного захвата участков ДНК, кодирующих регионы исследуемых генов, с помощью панели «TruSight Cancer» (Illumina; США) и набора реагентов «TruSight Rapid Capture» (Illumina; США).
Секвенирование подготовленных библиотек проводили на приборе «MiSeq» (Illumina; США) с использованием наборов реагентов «MiSeq Reagent Kits v2» (Illumina; США) методом парно-концевого чтения (2 × 151 пар оснований). Среднее покрытие исследуемых таргетных участков ДНК составило не менее 100×.
Выравнивание прочитанных последовательностей относительно референсной последовательности генома человека (hg19), а также фильтрация их по качеству, проводилось в автоматическом режиме с помощью программы Local Run Manager (Illumina, США).
Для анализа (аннотации) генетических изменений использовалась программа Variant Studio 3.0 (Illumina, США). Для визуализации геномных данных: оценки глубины прочтения и выявления возможных ложноположительных результатов использовалась программа Integrative Genomics Viewer (IGV) (Broad Institute, USA). Для оценки популяционных частот аннотированных генетических вариантов использовались данные базы gnomAD ExomesVersion: 2.1.1 (Genome aggregation database). Клиническую значимость выявленных генетических нарушений оценивали на основании критериев оценки «патогенности»
генетических вариантов, предложенной Американским колледжем медицинской генетики (ACMG) [10], с использованием баз данных «dbSNP» («The Single Nucleotide Polymorphism database»), «ClinVar» («Clinical Variation»), «HGMD» («Human Gene Mutation Database»), клинически сертифицированной платформы VarSome, а также данных публикаций. Генетические варианты, не имеющие клинического значения, а также имеющие неизвестное клиническое значение, в данной работе не рассматривали.
Для верификации выявленных изменений нуклеотидной последовательности использовали метод секвенирования по Сэнгеру. Анализ проводили на автоматическом капиллярном секвенаторе «ABI PRISM 3100» (Applied Biosystems; США).
Результаты
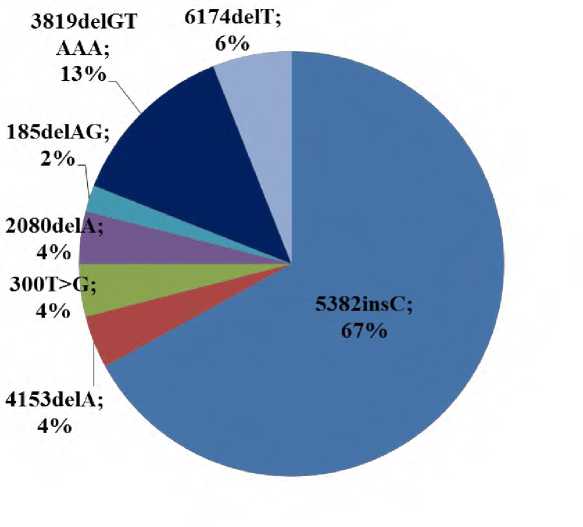
В результате проведенного исследования у 48 из 298 (16%) больных эпителиальным РЯ выявлены наиболее распространенные в российской популяции наследственные варианты в генах BRCA1 и BRCA2 , определяемые с помощью «стандартных» диагностических панелей (табл. 2). В спектре выявленных изменений преобладал вариант 5382insC в гене BRCA1 . Его частота в группе обследованных составила 10,7%. Доля данного варианта среди выявленных изменений составила 67% (рис. 1). Частота остальных генетических вариантов была, по крайней мере, на порядок ниже.
Табл. 2. Частота встречаемости наиболее распространенных в популяции патогенных генетических вариантов в генах BRCA1 и BRCA2 у больных эпителиальным РЯ
|
Ген |
Название мутации (номенклатура BIC) |
Число пациентов с мутацией в обследованной группе, чел. |
Частота % |
мутации, |
|
BRCA1 |
5382insC |
32 |
10,7 |
|
|
BRCA1 |
4153delA |
2 |
0,7 |
|
|
BRCA1 |
300T>G |
2 |
0,7 |
|
|
BRCA1 |
2080delA |
2 |
0,7 |
|
|
BRCA1 |
185delAG |
1 |
0,3 |
|
|
BRCA1 |
3819delGTAAA |
6 |
2,0 |
|
|
BRCA1 |
3875delGTCT |
- |
- |
|
|
BRCA2 |
6174delT |
3 |
1,0 |
|
|
Всего |
48 |
16,1 |
2080deL4 4%
300TXR;
4% .
6174delT;
6%
ISSdelAG: 2%. ,
3819delGT
AAA;
13%
5382insC;
67%
4153delA;
4%
Рис. 1. Доля каждого из наиболее распространенных в популяции патогенных генетических вариантов в генах BRCA1 и BRCA2 у больных эпителиальным РЯ в спектре выявленных изменений
Анализ всей кодирующей области, а также регионов сплайсинга генов BRCA1 и BRCA2 методом высокопроизводительного секвенирования позволил выявить у 15 из 93 (16%) пациентов 13 патогенных вариантов: 6 - в гене BRCA1 и 7 - в гене BRCA2 . Варианты в гене BRCA1 представлены тремя нонсенс- мутациями, двумя делециями со сдвигом рамки считывания и одним нарушением в сайте сплайсинга. В гене BRCA2 патогенные варианты представляли собой шесть вариантов со сдвигом рамки считывания и одну нонсенс-мутацию (табл. 3).
Табл. 3. Характеристика и частота редких патогенных вариантов нуклеотидной последовательности в генах BRCA1 и BRCA2 в группе больных эпителиальным РЯ
|
Ген |
Название генетического варианта (номенклатура HGVS) |
Идентификационный номер (dbSNP) |
Характеристика варианта |
Число больных, чел. |
|
BRCA1 |
c.4165_4166delAG (p.Ser1389Terfs) |
rs80357572 |
делеция со сдвигом рамки считывания |
1 |
|
BRCA1 |
c.2158G>T (p.Glu720Ter) |
rs80356875 |
нонсенс-мутация |
1 |
|
BRCA1 |
c.5152+1G>T |
rs80358094 |
мутация в сайте сплайсинга |
1 |
|
BRCA1 |
c.1510delC (p.Arg504Valfs) |
rs80357908 |
делеция со сдвигом рамки считывания |
3 |
|
BRCA1 |
c.5314C>T (p.Arg1772Ter) |
rs80357123 |
нонсенс-мутация |
1 |
|
BRCA1 |
c.3964A>T (p.Lys1322Ter) |
rs80357343 |
нонсенс-мутация |
1 |
|
BRCA2 |
c.5718_5719delCT (p.Leu1908Argfs) |
rs80359530 |
делеция со сдвигом рамки считывания |
1 |
|
BRCA2 |
c.8208_8209insAG (p.Leu2737Serfs*2) |
rs483353122 |
инсерция со сдвигом рамки считывания |
1 |
|
BRCA2 |
c.3880_3883delTTAC (p.Leu1294LysfsTer6) |
- |
делеция со сдвигом рамки считывания |
1 |
|
BRCA2 |
c.5237_5238insT (p.Asn1747Ter) |
rs80359499 |
инсерция со сдвигом рамки считывания |
1 |
|
BRCA2 |
c.5855delT (p.Leu1952TrpfsTer11) |
- |
делеция со сдвигом рамки считывания |
1 |
|
BRCA2 |
c.1796_1800delCTTAT (p.Ser599Ter) |
rs276174813 |
делеция со сдвигом рамки считывания |
1 |
BRCA2 c.3881T>A rs80358632 нонсенс-мутация 1 (p.Leu1294Ter)
Все варианты были выявлены по одному, кроме генетического варианта с.1510delC в гене BRCA1 , обнаруженного у трех пациентов.
Частота встречаемости клинически значимых генетических вариантов, выявленных методом высокопроизводительного секвенирования, сопоставима с частотой «стандартных» патогенных вариантов в генах BRCA1 и BRCA2 (статистически значимые различия не обнаружены, p >0,05), за исключением изменения нуклеотидной последовательности 5382insC в гене BRCA1 . Таким образом, метод NGS позволил дополнительно к 16% больных РЯ, имеющих распространенные в популяции патогенные варианты в генах BRCA1/2 , выявить 16% пациентов с патогенными вариантами в других регионах данных генов.
Сравнение групп пациентов с выявленными повреждениями в генах BRCA1 и BRCA2 показало, что в группе пациентов с выявленными патогенными вариантами как в гене BRCA1 , так и в гене BRCA2 средний возраст манифестации заболевания оказался ниже, чем в общей группе. Однако в группе пациентов - носителей повреждений в гене BRCA1 он был ниже (47 лет), чем в группе пациентов с изменением нуклеотидной последовательности в гене BRCA2 (52 года). При этом заболевание развилось в возрасте до 50 лет у 64% пациентов с выявленными патогенными вариантами в гене BRCA1 и только у 30% больных с повреждением в гене BRCA2 . 75% пациентов-носителей патогенных вариантов в гене BRCA1 и 70% пациентов с повреждением в гене BRCA2 имели онкологически отягощенный семейный анамнез. Примерно у половины пациентов с выявленными патогенными вариантами как в гене BRCA1 , так и в гене BRCA2 диагностировали ПМЗН. Таким образом, клиническими признаками наследственного рака, которые включают: молодой возраст манифестации заболевания, наличие онкологически отягощенного семейного анамнеза и наличие ПМЗН, характеризовались 89% пациентов с выявленными патогенными вариантами в гене BRCA1 и 70% пациентов – носителей повреждений в гене BRCA2 (табл.4).
Преобладающим гистологическим типом опухоли у носителей патогенных вариантов в генах BRCA1/2 являлась серозная карцинома высокой степени злокачественности. Все пациенты, кроме одного, имели данный гистологический тип опухоли. Серозная карцинома низкой степени злокачественности была выявлена у пациента с патогенным вариантом 5382insC в гене BRCA1 . У всех больных РЯ – носителей повреждений в генах BRCA1/2 , кроме одного пациента с патогенным вариантом c.3881T>A в гене BRCA2 , заболевание было диагностировано на поздней стадии (3-4) (табл. 4).
Табл. 4. Сравнение BRCA1 - и BRCA2 -ассоциированного РЯ по основным клиникоморфологическим характеристикам
|
Характеристика |
Больные раком яичников с патогенным вариантом в гене BRCA1 (n=53) |
Больные раком яичников с патогенным вариантом в гене BRCA2 (n=10) |
|
Возраст |
||
|
Средний возраст манифестации заболевания, лет |
47 (29-64) |
52 (39-60) |
|
до 50 лет, чел. (%) |
34 (64) |
3 (30) |
|
51 год и старше, чел. (%) |
19 (36) |
7 (70) |
|
Семейный онкологический анамнез |
||
|
Отягощен, чел. (%) |
40 (75) |
7 (70) |
|
Не отягощен, чел. (%) |
13 (25) |
3 (30) |
|
Диагноз |
||
|
Первично-множественные злокачественные новообразования (рак яичников + рак молочной железы, рак яичников + рак эндометрия, рак яичников + колоректальный рак), чел. (%) |
27 (51) |
5 (50) |
|
Рак яичников, чел. (%) |
26 (49) |
5 (50) |
|
Гистологический тип опухоли |
||
|
Серозная карцинома высокой степени злокачественности, чел. (%) |
52 (98) |
10 (100) |
|
Серозная карцинома низкой степени злокачественности, чел. (%) |
1 (2) |
0 (0) |
|
Эндометриоидная карцинома, чел. (%) |
0 (0) |
0 (0) |
|
Муцинозная карцинома, чел. (%) |
0 (0) |
0 (0) |
|
Светлоклеточная карцинома, чел. (%) |
0 (0) |
0 (0) |
|
Стадия |
||
|
1-2, чел. (%) |
0 (0) |
1 (10) |
|
3-4, чел. (%) |
53 (100) |
9 (90) |
|
Наличие клинических признаков наследственного заболевания |
||
|
С клиническими признаками заболевания, чел. (%) |
47 (89) |
7 (70) |
|
Без клинических признаков заболевания, чел. (%) |
6 (11) |
3 (30) |
Обсуждение
Результаты проведенного исследования показали, что эпителиальный РЯ в российской популяции характеризуется достаточно высокой частотой и широким спектром герминальных патогенных вариантов в генах BRCA1 и BRCA2. Однако генетический вариант 5382insC в гене BRCA1 встречается в нашей популяции на порядок чаще, чем все остальные выявленные повреждения в данных генах, что подтверждает предположение о его славянском происхождении [2,8].
Среди патогенных вариантов, выявленных методом высокопроизводительного секвенирования, наиболее часто встречалось изменение нуклеотидной последовательности с.1510delC в гене BRCA1 . Данный генетический вариант описан в литературе, в том числе в отечественных публикациях. Он ранее был выявлен в российской популяции как у больных РМЖ, характеризующихся клиническими признаками наследственного заболевания, так и у пациентов с серозным РЯ высокой степени злокачественности [11,12].
Все остальные выявленные генетические варианты также описаны в научных публикациях и внесены в зарубежные базы данных, кроме двух делеций со сдвигом рамки считывания (c.3880_3883delTTAC, c.5855delT), выявленных впервые.
Сопоставимость частот патогенных вариантов в генах BRCA1 и BRCA1 , входящих в «стандартные» диагностические панели, за исключением изменения нуклеотидной последовательности 5382insC в гене BRCA1, и клинически значимых генетических вариантов, выявленных методом NGS, свидетельствует о целесообразности оптимизации алгоритма молекулярно-генетического обследования больных эпителиальным РЯ в российской популяции. На первом этапе обследования достаточно протестировать пациентов только на наличие варианта 5382insC в гене BRCA1 методом ПЦР в реальном времени. При отсутствии данного патогенного варианта необходимо проанализировать всю кодирующую часть генов BRCA1 и BRCA2 методом высокопроизводительного секвенирования.
Группа больных BRCA2 -ассоциированным РЯ характеризовалась более высоким средним возрастом манифестации заболевания (52 года), по сравнению с группой больных РЯ с повреждениями в гене BRCA1 (47 лет), что согласуется с данными литературы [13].
Отсутствие клинических признаков наследственного заболевания у 11% пациентов -носителей патогенных вариантов в гене BRCA1 и у 30% больных РЯ с клинически значимыми вариантами в гене BRCA2 подтверждает необходимость проведения молекулярногенетического обследования для выявления повреждений в данных генах всем больным эпителиальным РЯ.
Анализ результатов настоящего исследования показал, что большинство BRCA -ассоциированных опухолей яичников являются серозными карциномами высокой степени злокачественности, диагностированными преимущественно на поздних стадиях, что подтверждается результатами ранее проведенных исследований [6,14].
Выводы
Таким образом, эпителиальный РЯ в российской популяции характеризуется достаточно высокой частотой и широким спектром герминальных патогенных вариантов в генах BRCA1 и BRCA2 , поэтому использование только «стандартных» диагностических панелей может привести к получению ложноотрицательных результатов. Использование метода высокопроизводительного секвенирования позволяет повысить эффективность диагностики герминальных патогенных вариантов в генах BRCA1 и BRCA2 у больных эпителиальным РЯ по крайней мере в 2 раза. Клинико-морфологические особенности BRCA -ассоциированного эпителиального РЯ свидетельствуют о необходимости проведения молекулярно-генетического тестирования всем пациентам с данным диагнозом, в первую очередь с серозной карциномой высокой степени злокачественности.
Вклад авторов. Е. И. Новикова: сбор клинического материала, проведение молекулярногенетических исследований, анализ и статистическая обработка результатов, подготовка и написание текста статьи; Е. А. Кудинова: анализ литературы, анализ результатов исследования; В. К. Боженко: анализ результатов, редактирование текста статьи. Все авторы прочитали и согласились с версией рукописи.
Финансирование. Собственные средства ФГБУ «РНЦРР» Минздрава России.
Соблюдение прав пациентов и правил биоэтики. Исследование одобрено этическим комитетом РНЦРР (протокол № 3 от 27 марта 2020 г.) Все пациенты, включенные в исследование, подписали добровольное информированное согласие на его проведение.
Список литературы Характеристика BRCA-ассоциированного эпителиального рака яичников в российской популяции
- Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.). Состояние онкологической помощи населению России в 2022 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. 239 с.
- Имянитов Е.Н. Наследственный рак молочной железы. Практическая онкология. 2010; 11(4):258-266.
- Chen J, Bae E, Zhang L, Hughes K, Parmigiani G, Braun D, Rebbeck TR. Penetrance of Breast and Ovarian Cancer in Women Who Carry a BRCA1/2 Mutation and Do Not Use Risk-Reducing Salpingo-Oophorectomy: An Updated Meta-Analysis. JNCI Cancer Spectr. 2020 Apr 23;4(4):pkaa029. doi: 10.1093/jncics/pkaa029.
- Arts-de Jong M, de Bock GH, van Asperen CJ, Mourits MJ, de Hullu JA, Kets CM. Germline BRCA1/2 mutation testing is indicated in every patient with epithelial ovarian cancer: A systematic review. Eur J Cancer. 2016 Jul;61:137-145. doi: 10.1016/j.ejca.2016.03.009.
- Schrader KA, Hurlburt J, Kalloger SE, Hansford S, Young S, Huntsman DG, Gilks CB, McAlpine JN. Germline BRCA1 and BRCA2 mutations in ovarian cancer: utility of a histology-based referral strategy. Obstet Gynecol. 2012 Aug;120(2 Pt 1):235-240. doi: 10.1097/AOG.0b013e31825f3576.
- Witjes VM, van Bommel MHD, Ligtenberg MJL, Vos JR, Mourits MJE, Ausems MGEM, et al. Probability of detecting germline BRCA1/2 pathogenic variants in histological subtypes of ovarian carcinoma. A meta-analysis. Gynecol Oncol. 2022 Jan;164(1):221-230. doi: 10.1016/j.ygyno.2021.10.072.
- Daly MB, Pilarski R, Berry M, Buys SS, Farmer M, Friedman S, et al. NCCN Guidelines Insights: Genetic/Familial High-Risk Assessment: Breast and Ovarian, Version 2.2017. J Natl Compr Canc Netw. 2017 Jan;15(1):9-20. doi: 10.6004/jnccn.2017.0003.
- Батенева Е. И. Новая диагностическая панель для выявления наследственной предрасположенности к развитию рака молочной железы и рака яичников. Дис. … канд. мед. наук. М. 2015. 125 с.
- Новикова Е. И., Снигирева Г. П., Солодкий В. А. Редкие мутации в генах BRCA1 и BRCA2 у российских больных раком молочной железы. Медицинская генетика. 2017; 16 (9):25-30.
- Richards S, Aziz N, Bale S, Bick D, Das S, Gastier-Foster J, et al; ACMG Laboratory Quality Assurance Committee. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015 May;17(5):405-424. doi: 10.1038/gim.2015.30.
- Novikova E.I., Kudinova E.A., Bozhenko V.K., Solodkiy V.A. Characteristics of brca- associated breast cancer in the population of the Russian federation. Bulletin of Russian State Medical University. 2021;1:24-29. doi:10.24075/brsmu.2021.006.
- Журман В.Н. Влияние молекулярно-генетических характеристик на прогноз впервые выявленного серозного рака яичников high-grade iii-iv стадии в зависимости от вариантов лечения. Поволжский онкологический вестник. 2022; 13 (4):17-24. doi:10.32000/2078-1466-2022-4-17-24.
- Bolton KL, Chenevix-Trench G, Goh C, Sadetzki S, Ramus SJ, Karlan BY, et al.; EMBRACE; kConFab Investigators; Cancer Genome Atlas Research Network. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA. 2012 Jan 25;307(4):382-390. doi: 10.1001/jama.2012.20.
- Mavaddat N, Barrowdale D, Andrulis IL, Domchek SM, Eccles D, Nevanlinna H, et al.; Consortium of Investigators of Modifiers of BRCA1/2. Pathology of breast and ovarian cancers among BRCA1 and BRCA2 mutation carriers: results from the Consortium of Investigators of Modifiers of BRCA1/2 (CIMBA). Cancer Epidemiol Biomarkers Prev. 2012 Jan;21(1):134-147. doi: 10.1158/1055-9965.EPI-11-0775.


