Характеристика гуморального и клеточного звена иммунной системы, показателей апоптоза лимфоцитов у пациенток с бесплодием, имеющих высокие уровни сывороточных антиспермальных антител
Автор: Униговская М.В., Теплова С.Н., Медведев Б.И., Иванов Е.А.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 19 (195), 2010 года.
Бесплатный доступ
Обследовано 108 пациенток с бееплодием, из них 74 с высоким уровнем антиспермальных антител в крови, 34 - с низким. Контрольную группу составили 23 здоровых женщины. У пациенток с высоким уровнем антиспермальных антител (АСАТ) выявлено повышение содержания IgA, IgM, IgG в сыворотке, а также рост абсолютного числа CD25+, HLA-DR+, CD4+ лимфоцитов, что может свидетельствовать о поликлональной активации гуморального и клеточного иммунитета. Для этой группы в сравнении с группой 2 характерен более высокий уровень sFas в сыворотке при отсутствии отличий по другим показателям апоптоза.
Антиспермальные антитела, бесплодие, cd маркеры лимфоцитов, апоптоз лимфоцитов
Короткий адрес: https://sciup.org/147152686
IDR: 147152686 | УДК: 618.177-097
Текст краткого сообщения Характеристика гуморального и клеточного звена иммунной системы, показателей апоптоза лимфоцитов у пациенток с бесплодием, имеющих высокие уровни сывороточных антиспермальных антител
Актуальность. Общая частота бесплодного брака колеблется от 10 до 20 %, частота женского бесплодия составляет 47,5-53,5 % [4]. Одной из форм иммунологического бесплодия являются состояния, характеризующиеся наличием высоких уровней антиспермальных антител в сыворотке крови пациентов. Данная форма женского бесплодия встречается у 9-36 % нефертильных пар [6]. Антиспермальные антитела, взаимодействуя в жидкостях женского репродуктивного тракта со сперматозоидами, вызывают нарушение их подвижности, а также блокируют мембранные молекулы, необходимые для взаимодействия с яйцеклеткой [2]. Возможно также участие антиспермальных антител в запуске иммунологических механизмов, повреждающих оболочку сперматозоидов.
Современные авторы выделяют ряд факторов, способствующих повышенной выработке антиспермальных антител. К ним относят хронические воспалительные заболевания половых органов, инфекции, передающиеся половым путем, генитальный эндометриоз, отягощенный аллергологический анамнез [1]. Вместе с тем нет ясного представления о механизмах реализации влияния этих факторов на развитие антиспермального иммунитета. Придается большое значение нарушению процессов иммунологической толерантности - «неотвечаемости» на некоторые антигены, что сопровождается активацией клонов лимфоцитов, продуцирующих антиспермальные антитела. В норме элиминацию подобных клонов лимфоцитов, возможно, осуществляют процессы апоптоза. В то же время существует явный дефицит работ, посвященных оценке состояния гуморального и клеточного звена иммунной системы, а также программированной ги бели лимфоцитов у пациенток с повышенными уровнями антиспермальных антител.
Целью исследования является оценка гуморального иммунитета, популяционного и субпопуляционного состава лимфоцитов, процессов апоптоза у пациенток с бесплодием, сочетающимся с высокими уровнями антиспермальных антител.
Материалы и методы. Обследовано 108 пациенток с бесплодием (первичным или вторичным). Контрольную группу составили 23 соматически здоровых женщин фертильного возраста, не имеющих патологии репродуктивной системы. Пациентки с бесплодием были разделены на 2 группы: с высоким уровнем антиспермальных антител (> 65,00 Е/мл) - 74 женщины и с низким уровнем (0-35,00 Е/мл) - 34 женщины. Критерием исключения были промежуточные уровни антиспермальных антител (от 36,00 до 65,00 Е/мл) в сыворотке крови пациенток.
У пациенток, составляющих 1-ю группу, первичное бесплодие регистрировалось в 51,4 % случаев (38 женщин), вторичное бесплодие в 48,6 % (36 женщин). Во 2-й группе пациенток с первичным бесплодием было 19 (55,9 %), а имеющих вторичное бесплодие - 15 (44,1 %). Следовательно, соотношение первичного и вторичного бесплодия в обследуемых группах практически не отличалось.
По социальному составу пациентки всех трех групп были сопоставимы. Они не имели достоверных отличий по возрасту. Медиана возраста в первой группе составила 28 лет (квартили 26-32), во второй 29 лет (квартили 27-33), в группе контроля -также 29 лет (квартили 26-31).
Для обнаружения антиспермальных антител в сыворотке крови использовали иммуноферментный
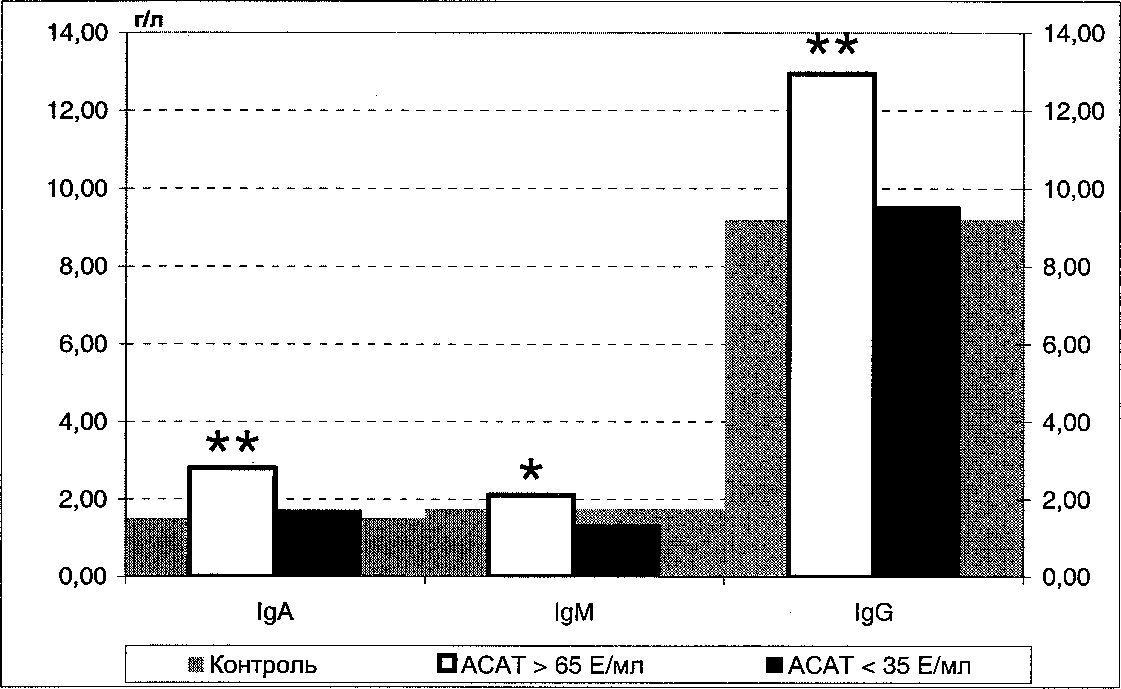
Медианы уровней IgA, IgM, IgG в сыворотке крови пациенток с бесплодием на фоне высокого и низкого содержания антиспермальных антител в сопоставлении с группой контроля: * - достоверное отличие от группы [АСАТ < 35 Е/мл]; **-достоверное отличие от группы [АСАТ < 35 Е/мл] и от группы контроля
метод (тест-система Sperm-antibody-elisa, Bioserv, Германия). Сывороточные уровни иммуноглобулинов IgA, IgM, IgG определяли иммунофермент-ным методом с помощью тест-системы «Иммуноскрин - G, М, А - ИФА - БЕСТ», производства ЗАО «Вектор-Бест» (г. Новосибирск).
Популяционный спектр лимфоцитов оценивали путем CD-типирования непрямым иммуноф-люоресцентным методом с использованием мышиных моноклональных антител к соответствующим антигенам человека, а также меченых ФИТЦ Fab-фрагментов кроличьих антител против иммуноглобулинов мыши (НПО «Препарат», Н. Новгород). Определяли общее число лейкоцитов периферической крови, процент и абсолютное число лимфоцитов, Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-цитотоксических (CDS4), В-лимфоцитов (CD224), NK-клеток (CD16+), а также лимфоцитов с маркерами активации CD25, CD71, HLA-DR и готовности к апоптозу - CD95.
Апоптоз лимфоцитов периферической крови изучали морфологически путем подсчета лимфоцитов с фрагментацией ядра при люминесцентной микроскопии мононуклеаров, окрашенных суправитальным ядерным красителем Hoechst 33342 (Boehringer Mannheim).
Иммуноферментным методом с помощью тест-систем Bender Medsystems (Austria) определяли в сыворотке крови уровень растворимых рецепторов, регулирующих апоптоз клеток: ингибитора апоптоза sFas (растворимого CD95ZFas/Apo-l) и проапоптогенного фактора sFasL (растворимого Fas-лиганда).
Статистическая обработка результатов Данные были обработаны с использованием пакета программ Statistica 6.0. Результаты представлены в виде медианы (Me) и квартилей - нижнего и верхнего (QL-QU). Достоверность отличий сопоставляемых групп оценивали с помощью непараметрического критерия Манна-Уитни, позволяющего работать с данными независимо от вида их распределения (значимыми считали отличия при р < 0,05). Корреляционный анализ проводили по Спирмену.
Результаты исследования и их обсуждение. Увеличение уровня антиспермальных антител в сыворотке крови пациенток с бесплодием может отражать как проявление специфического иммунного ответа против спермальных антигенов, так и общее изменение антителопродукции вследствие нарушения функции гуморального звена иммунной системы. Для общей оценки гуморального иммунного ответа мы провели сопоставление уровней сывороточных иммуноглобулинов классов А, М, G у обследованных женщин (см. рисунок).
Как следует из рисунка, у женщин с бесплодием, имеющих высокие уровни антиспермальных антител, достоверно увеличено содержание всех анализируемых классов иммуноглобулинов в сыворотке крови, что может свидетельствовать о поликлональной активации В-лимфоцитов.
Были обнаружены отличия в популяционном составе лимфоцитов (табл. 1).
Как следует из табл. 1, у пациенток с бесплодием, сочетающимся с гиперпродукцией антиспермальных антител, в сопоставлении с пациентками,
Униговская М.В., Теплова С.Н., Медведев Б.И., Иванов Е.А.
Характеристика гуморального и клеточного звена иммунной системы, показателей апоптоза...
имеющими низкие их уровни, увеличено абсолютное число лимфоцитов периферической крови и число CD4+клеток (Т-хелперов). Кроме того, у них наблюдается увеличение абсолютного числа лимфоцитов с маркерами ранней и поздней активации -CD25 и HLA-DR, что в целом свидетельствует об активации клеточного звена иммунитета.
Апоптоз лимфоцитов - один из важных меха низмов поддержания иммунного гомеостаза. Как следует из табл. 2, наиболее выраженные изменения программированной гибели лимфоцитов выявлены у пациенток 1-й группы, которая достоверно отличалась от контрольной группы здоровых женщин более высокой численностью клеток с готовностью к апоптозу (CD954), повышенным числом лимфоцитов с морфологическими призна-
Таблица1
Характеристика популяционного спектра лимфоцитов обследуемых пациенток
|
Показатели |
Группа 1 |
Группа 2 |
Группа 3 |
Достоверность отличий между группами (р) согласно тесту Манна-Уитни |
||
|
Высокий уровень АСАТ+ бесплодие |
Низкий уровень АСАТ+ бесплодие |
Здоровые (контроль) |
||||
|
Me QL-QU |
Me QL-QU |
Me QL-QU |
1-2 |
1-3 |
2-3 |
|
|
АСАТ |
79,42 70,70-96,00 |
10,14 6,90-20,25 |
- |
< 0,001 |
- |
- |
|
Лейкоциты |
5,45 4,50-6,40 |
5,00 4,20-5,80 |
4,80 3,80-5,80 |
0,086 |
0,028 |
0,361 |
|
Лимфоциты, х109/л |
1,55 1,17-2,08 |
1,41 1,05-1,56 |
1,54 0,91-2,18 |
0,037 |
0,406 |
0,402 |
|
CD3, х109/л |
1,08 0,84-1,47 |
0,94 0,73-1,14 |
0,97 0,62-1,43 |
0,235 |
0,297 |
1,000 |
|
CD4, х109/л |
0,65 0,49-0,85 |
0,53 0,39-0,65 |
0,55 0,35-0,84 |
0,046 |
0,235 |
0,641 |
|
CD8, х109/л |
0,40 0,32-0,54 |
0,35 0,29-0,41 |
0,35 0,21-0,53 |
0,109 |
0,183 |
0,776 |
|
CD22, х109/л |
0,37 0,27-0,52 |
0,31 0,26-0,38 |
0,27 0,19-0,43 |
0,163 |
0,056 |
0,649 |
|
CD 16, х109/л |
0,31 0,21-0,41 |
0,25 0,22-0,31 |
0,23 0,17-0,36 |
0,124 |
0,094 |
0,562 |
|
CD25, х109/л |
0,18 0,15-0,28 |
0,16 0,13-0,22 |
0,15 0,09-0,24 |
0,015 |
0,027 |
0,478 |
|
СП71,х109/л |
0,21 0,15-0,33 |
0,20 0,17-0,29 |
0,18 0,12-0,29 |
0,971 |
0,261 |
0,366 |
|
HLA-DR, х109/л |
0,33 0,21-0,49 |
0,25 0,21-0,34 |
0,29 0,19-0,43 |
0,028 |
0,275 |
0,406 |
Таблица 2
Данные показателей, характеризующие процессы апоптоза
При сопоставлении показателей апоптоза в группах пациенток с высокими и низкими уровнями антиспермальных антител единственным достоверным отличием является более высокое содержание сывороточного sFas в 1-й группе (см. табл. 2).
Таким образом, у пациенток с бесплодием с повышенными уровнями антиспермальных антител в сравнении с пациентками, страдающими бесплодием с низкими уровнями этих антител, выявлен рост количества лимфоцитов в крови, признаки их поликлональной активации, увеличение содержания sFas в сыворотке.
Выводы
-
1. У пациенток с высокими уровнями антиспермальных антител наблюдается усиление общей антителопродукции, что может отражать активацию гуморального иммунного ответа.
-
2. Наибольшие изменения популяционного состава лимфоцитов характерны для группы пациенток с повышенным уровнем антиспермальных антител. Установлено увеличение абсолютного
-
3. При бесплодии у пациенток с высокими уровнями антиспермальных антител в сопоставлении с пациентками, имеющими низкие уровни этих антител, отмечается более высокое содержание sFas в сыворотке, при отсутствии отличий по другим показателям апоптоза.
числа лимфоцитов с маркерами ранней и поздней активации (CD25, HLA-DR), количества CD4 лимфоцитов.
Список литературы Характеристика гуморального и клеточного звена иммунной системы, показателей апоптоза лимфоцитов у пациенток с бесплодием, имеющих высокие уровни сывороточных антиспермальных антител
- Кулаков, В.И. Бесплодный брак/В.И. Кулаков. -М.: ГЭОТАР-Медиа, 2005. -616 с.
- Основы клинической иммунологии: пер. с англ./Э. Чепелъ, М. Хейни, С. Мисбах, Н. Сновден. -5-е изд. -М.: ГЭОТАР-Медиа, 2008. -416 с.
- Теплова, С.И. Первичные иммунодефицитные состояния/С.Н. Теплова, А.Ю. Пищальников. -Екатеринбург: УрО РАН, 2005. -232 с.
- Узлова, Т.В. Этиология, иммунологические аспекты патогенеза, диагностика и лечение трубно-перитонеального бесплодия/Т.В. Узлова. -Челябинск, 2000. -С. 12.
- Mouawad, R. Plasma Fas ligand, an inducer of apoptosis, and plasma soluble Fas, an inhibitor of apoptosis, in advanced melanoma/R. Mouawad, D. Khayat, С. Soubrane//Melanoma Res. -2000. -V. 10 (5). -P. 461^67.
- Rajesh, K. Naz. Modalities for treatment of antisperm antibody mediated infertility: novel perspectives/K. Naz Rajesh//American Journal of Reproductive Immunology. -2004. -P. 390-397.


