Характеристика RF-линий подсолнечника коллекции ВНИИМК с помощью микросателлитных маркеров ДНК
Автор: Гучетль С.З., Логинова Е.Д., Рябовол И.В., Головатская А.В., Савиченко Д.Л., Волошко А.А., Борисенко О.М., Савченко В.Д., Фролов С.С., Горбаченко О.Ф., Пихтярева А.А.
Рубрика: Селекция, семеноводство и биотехнология сельскохозяйственных растений
Статья в выпуске: 1 (197), 2024 года.
Бесплатный доступ
Подсолнечник - одна из наиболее рентабельных масличных культур. Задача селекции подсолнечника - создание новых высокоурожайных гибридов. Для ее решения важное значение имеет генетическое разнообразие исходного селекционного материала. Оценить это разнообразие можно с использованием молекулярно-генетических маркеров, в частности микросателлитов. Цель данной работы заключалась в генотипировании коллекции Rf-линий, анализе ее генетического разнообразия с помощью микросателлитных маркеров. Анализ для 54 Rf-линий коллекции ФГБНУ ФНЦ ВНИИМК выполнен с помощью 12 SSR-маркеров. По этим маркерам были составлены генетические паспорта для всех изучаемых линий и определены основные показатели информативности SSR-локусов. Коллекция характеризовалась большим генетическим разнообразием, в сумме были получены (Nа) 55 аллелей, в среднем 4,58 аллеля на локус. Эффективное число аллелей (Ne) в среднем 2,48. Индекс полиморфного информационного содержания (PIC) составил 0,51. Уровень гетерогенности линий был достаточно низким (5,5 %), что говорит об их хорошей генетической выровненности. По результатам анализа коллекция была разделена на два кластера на уровне объединения 15,8. Минимальная генетическая дистанция между линиями составила 0. Первый кластер cформировали 11 линий. Большая часть линий (43 шт.) образовали второй кластер. Уникальность коллекции составила 91 %.
Генетическое разнообразие, генотипирование, подсолнечник, helianthus annuus, маркер, ssr, линии-восстановители фертильности
Короткий адрес: https://sciup.org/142241296
IDR: 142241296 | УДК: 631.523:633.854.78 | DOI: 10.25230/2412-608X-2024-1-197-17-23
Текст научной статьи Характеристика RF-линий подсолнечника коллекции ВНИИМК с помощью микросателлитных маркеров ДНК
Введение. Поскольку селекция гибридов подсолнечника представляет собой динамично развивающуюся отрасль сельского хозяйства, для эффективной реализации селекционных программ необходимо создавать новый исходный материал, отличающийся генетическим разнообразием. Надежным инструментом в изучении и поддержании разнообразия выступает анализ ДНК. В последние годы все большую популярность приобретают методы анализа однонуклеотидного полиморфизма (SNP). С их помощью как у подсолнечника, так и у других сельскохозяйственных культур изучаются уровни разнообразия и популяционной структуры зародышевой плазмы [1; 2; 3]. Вместе с тем не теряют своей актуальности и мик-росателлитные (SSR) маркеры, быстрый прогресс в использовании которых отмечен с начала 2000-х годов. Они характеризуются богатым аллельным разнообразием и высокой степенью гетерозиготности, вследствие чего активно используются как для создания генетических паспортов сельскохозяйственных культур, так и для мониторинга аллелофонда коллекций ис-18
ходного материала для селекции [4; 5; 6; 7]. Так, L.S. Zhang с соавторами разработали систему из 78 SSR-маркеров подсолнечника и с ее помощью определили генетическое разнообразие 124 инбред-ных линий, включая 67 материнских (стерильных) и 57 линий-востановителей фертильности [5]. И.А. Шилов с соавторами на основе семи микросателлитных локусов (ORS815, ORS394, HA140, HA432, ORS546, ORS1144, ORS78) разработал мультиплексную систему генетической идентификации линий и гибридов подсолнечника, идентифицировал девять гибридов и их родительских форм, установил их однородность по всем локусам [8]. В ФГБНУ ФНЦ ВНИИМК разработана система микросателлитных маркеров для генотипирования подсолнечника, и с ее помощью проводится идентификация, паспортизация и оценка генетической чистоты линий и гибридов [6; 9]. Целью данной работы является генотипирование коллекции Rf-линий, анализ ее генетического разнообразия с помощью микроса-теллитных маркеров.
Mатериалы и методы. Анализ генетического разнообразия выполнен для 54 Rf-линий коллекции ФГБНУ ФНЦ ВНИИМК, включающей наиболее ценные селекционные формы (табл. 1).
Таблица 1
54 Rf-линии подсолнечника ФГБНУ ФНЦ ВНИИМК, использованные в работе
|
Название линии |
Происхождение |
|
ВК585, ВК303, ВК551, ВК529-1, ВК548, ВК549-1, ВК595-1, ВК595, ВК525, ВК989, ВК930, ВК944, МоР, Л 08 006, ВК301, ВК304, И613033, КЗ619, ВК195, ВК305, ВК23-ими, ВК21-сур, ВК21-клп, СОНО-1, СО НО-2, СОНО-3,ЭОЛ-1, ЭОЛ-2, ЭОЛ- 3, ЭОЛ-4, ЭОЛ-5, ЭОЛ-6, ЭОЛ-7, ЭОЛ-8, ЭОЛ-9, ЭОЛ-10, ЭОЛ-11, ЭОЛ-12, ЭОЛ-13, ЭОЛ-14 |
Центральная экспериментальная база (ЦЭБ ВНИИМК) ФГБНУ ФНЦ ВНИИМК |
|
ЭД114, ЭД155, ВД541, ЭД193, ЭД788 |
Донская опытная станция имени Л.А. Жданова (ДОС ВНИИМК) – филиал ФГБНУ ФНЦ ВНИИМК |
|
ВА337, ВА384, ВА389, ВА568, ВА737, ВА820, ВА325, ВА317 |
Армавирская опытная станция (АОС ВНИИМК) – филиал ФГБНУ ФНЦ ВНИИМК |
ДНК была выделена из смеси сухих зародышей пяти семян каждой линии с помощью набора МагноПрайм® ФИТО (НекстБио, РФ) на автоматической станции Auto-pure 96 (Allsheng, КНР). Концентрацию и качество полученной ДНК определяли с помощью микроспектрофотометра Nano-300 (Allsheng, КНР).
Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН8,8; 16,6 мM сульфата аммония; 2,5 мM MgCl 2 ; 0,01%-ный Tween 20; по 0,2 мM каждого dNTP; по 10 пМ каждого праймера; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Син-тол, РФ). Амплификацию выполняли в термоциклере MiniAmp™ plus (Thermo Scientific, США) при следующих температурно-временных режимах: начальная денатурация при 96 °С в течение 2 мин, затем 30 циклов при температурновременном режиме: денатурация при 94 °С – 30 сек, отжиг при 60 °С – 40 сек, элонгация при 70 °С – 1 мин, финальная элонгация при 70° С – 2 мин. Все образцы были генотипированы с использованием 12 опубликованных геномных SSR-маркеров [10; 11; 12] .
Разделение продуктов амплификации SSR-локусов, полученных с использованием пары праймеров, один из которых был флуоресцентно мечен (FAM, R6G, TAMRA или ROX), осуществляли методом капиллярного электрофореза в денатурирующих условиях на генетическом анализаторе «Нанофор-05» (ИАП РАН, РФ). Размер фрагментов определяли относительно размерного стандарта СД-600 с помощью GeneMarker software version 3.0.1. (State College, PA). Индекс полиморфного информационного содержания (PIC) и эффективное число аллелей (Ne) вычисляли с помощью программного обеспечения Gene-Calc [13].
Для оценки генетических взаимосвязей применялся иерархический кластерный анализ с помощью функции hclust() стандартного программного пакета stats для языка программирования R версии 4.3.2 (R Core Team, 2023) по методу ward.D2 [14].
Результаты и обсуждение. Для генотипирования и определения генетического разнообразия линий по результатам наших предыдущих исследований были отобраны 12 микросателлитных маркеров, часть из которых разработана в лаборатории молекулярно-генетических исследований ВНИИМК. Критерием отбора маркеров служил высокий или средний дискриминационный потенциал (PIC ˃ 0,3), кодоминантное наследование и специфичность к целевому локусу [6; 12]. По этим маркерам были составлены генетические паспорта для всех изучаемых 54 линий. По результатам генотипирования были определены основные показатели информативности SSR-локусов (табл. 2).
Таблица 2
Основные показатели информативности 12 SSR-локусов у 54 Rf-линий ФГБНУ ФНЦ ВНИИМК
|
SSR-локус |
Na |
Ne |
PIC |
|
Размах варьирования признака |
2–10 |
1,25–5,78 |
0,20–0,83 |
|
Среднее |
4,58 |
2,48 |
0,51 |
#Du@eчанue: Na – число аллелей на локус, Ne – эффективное число аллелей, PIC – индекс полиморфного информационного содержания
Для коллекции образцов в сумме были получены 55 аллелей. Количество аллелей на локус составило от 2 до 11, в среднем 4,58 аллелей на локус. Эффективное число аллелей варьировало от 1,25 до 5,78 при среднем значении 2,48. PIC – от 0,20 до 0,83, в среднем – 0,51. Эти показатели характеризуют изученную коллекцию как отличающуюся большим разнообразием. Для коллекций, отличающихся общим происхождением или объединенных общим признаков, этот показатель обычно не превышает 0,4 [6; 15].
Поскольку для анализа брали не отдельные растения, а смесь генотипов, у трех образцов были выявлены от одного до двух локусов в гетерозиготном состоя- нии, что свидетельствует о недостаточной выровненности линий по используемым маркерам или же загрязненности чужеродным генетическим материалом (рис. 1).
А
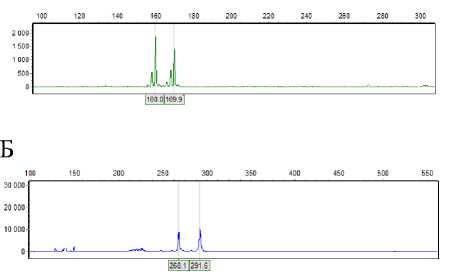
$ucGнок 1 – ДНК-профили линии ВД 541 по SSR-маркерам HA 514 (А) и CHR682 (Б), полученные методом фрагментного анализа (ориг.)
Следует отметить, что уровень гетерогенности линий, наблюдаемый в настоящем исследовании, достаточно низкий (5,5 %), следовательно, инбредные линии все же генетически выровнены. Для определения генетических взаимоотношений между изучаемыми линиями подсолнечника выполнен кластерный анализ с построением диаграммы c помощью метода ward.D2 [14] (рис. 2).
По результатам анализа коллекция была разделена на два кластера на уровне объединения 15,8. Минимальная генетическая дистанция между линиями составила 0. Первый кластер cформировали 11 линий. Большая часть линий (43 шт.) образовали второй кластер. В первый кластер вошли селекционные линии ЦЭБ ВНИИМК и образцы ЭОЛ-1, ЭОЛ-2, ЭОЛ-7, ЭОЛ-9, ЭОЛ-11, ЭОЛ-13. Большим разнообразием отличался второй кластер, включающий Rf-линии как ЦЭБ, так и АОС и ДОС ВНИИМК. Ранее при оценке генетического разнообразия селекционных линий подсолнечника ВНИИМК с помощью микросателлитных локусов было установлено, что для линий
ЦЭБ, ДОС и АОС ВНИИМК была характерна группировка отцовских линий в отдельные кластеры или субкластеры, которые демонстрируют, соответственно, большую степень сходства [6]. ЦМС- и Rf-линии различного происхождения (США, Индия) с использованием 39 SSR-праймеров в исследованиях K. T. Ramya с соавторами также сгруппированы в отдельные кластеры [15]. В наших исследованиях отцовские линии демонстрируют генетическую близость и формируют, преимущественно, один кластер. Это, вероятно, связано со сходством по признакам, которые характерны для линий-восстановителей фертильности.
+асть линий обладала идентичными генотипами по аллельному состоянию микросателлитных локусов. Всего таких групп было две (табл. 3).
Таблица 3
Распреде;ение и7Cченных ;иний в 7рCппы с идентичными 7енотипами по 12 микросате;;итным маркерам
|
Номер группы |
Линии с идентичными генотипами |
|
I |
ВА325, ВК21-сур, ВК21-клп |
|
II |
ВК304, ЭОЛ-1 |
Сходство образцов внутри каждой группы вполне закономерно, поскольку ВА325, ВК21-сур, ВК21-клп являются линиями-аналогами, а линии ВК304, ЭОЛ-1 имеют общее происхождение. Для идентификации таких близкородственных линий необходимо использовать либо большее число маркеров, либо маркеры к целевым генам, по которым велась селекция каждого аналога. Вместе с тем некоторые линии, которые также являлись близкородственными ( например, ВК595-1 и ВК595), были дифференцированы друг от друга, что говорит о достаточной дискриминационной силе системы маркеров. Уникальность изученной коллекции Rf-линий составила 91 %.
Заключение. Таким образом, в результате проведенных исследований у коллекции из 54 Rf-линий подсолнечника селекции ВНИИМК был установлен
ЭОЛ-13
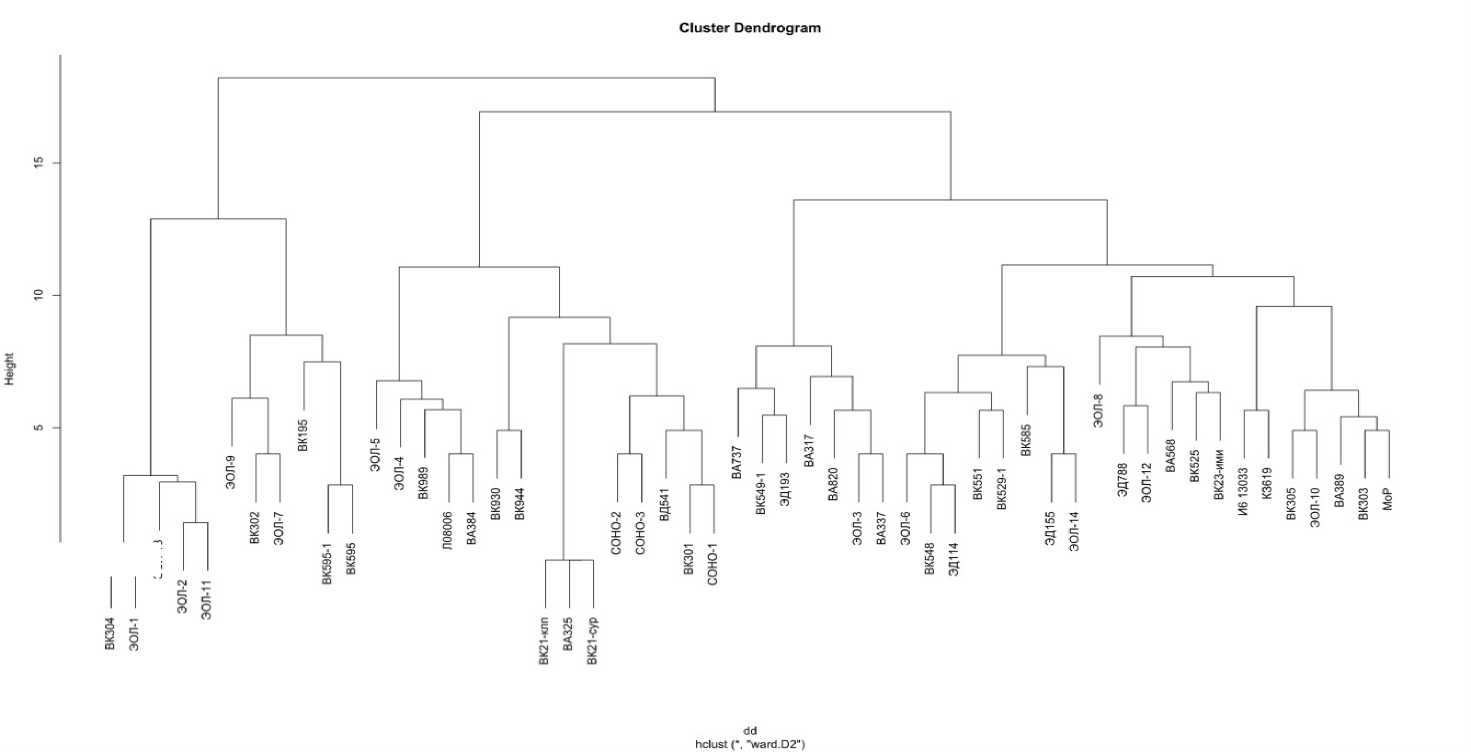
Рисунок 2 – Диаграмма генетических расстояний между 54 линиями подсолнечника коллекции ВНИИМК по результатам анализа
полиморфизма 12 SSR-локусов
достаточно высокий уровень генетического разнообразия по 12 микросателлитным маркерам, уникальность 91 %. При построении дендрограммы генетических расстояний большинство линий формировало один кластер, что может быть следствием наличия признаков, объединяющих линии-восстановители фертильности.
Список литературы Характеристика RF-линий подсолнечника коллекции ВНИИМК с помощью микросателлитных маркеров ДНК
- Filippi C.V., Merino G.A., Montecchia J.F., Aguirre N.C., Rivarola M., Naamati G., Fass M.I., Álvarez D., Di Rienzo J., Heinz R.A., Contreras Moreira B., Lia V.V., Paniego N.B. Genetic diversity, population structure and linkage disequilibrium assessment among international sunflower breeding collections // Genes. - 2020. - 11 (3). - 283. DOI: 10.3390/genes11030283 EDN: FUBKHR
- Goryunova S.V., Goryunov D.V., Chernova A.I., Martynova E.U., Boldyrev S.V., Ayupova A.F., Mazin P.V., Gurchenko E.A., Pavlova A.S., Petrova D.A., Dmitriev A.E., Chebanova Y.V., Gorlova L.A., Demurin Y.N., Garkusha S.V., Mukhina Z.M., Savenko E.G. Genetic and phenotypic diversity of the sunflower collection of the Pustovoit All-Russia Research Institute of Oil Crops (VNIIMK) // Helia. - 2019. - 42 (70). - Р. 45-60. DOI: 10.1515/helia-2018-0021 EDN: IVIRDU
- Velimirović A., Jovović Z., Perović D., Lehnert H., Mikić S., Mandić D., Pržulj N., Mangini G., Finetti-Sialer M.M. SNP diversity and genetic structure of "Rogosija", an old Western Balkan durum wheat collection // Plants. - 2023. - 12 (5). - 1157. DOI: 10.3390/plants12051157 EDN: XSKEQT
- Duca M., Port A., Cucereavî A., Șestacova T. SSR markers assessment in estimation of genetic polymorphism in sunflower // International Journal of Advanced Research in Biological Sciences. - 2015. - 2 (1). - Р. 70-77.
- Zhang L.S., Clerc V. Le, Li S., Zhang D. Establishment of an effective set of simple sequence repeat markers for sunflower variety identification and diversity assessment // Canadian Journal of Botany. - 2005. - V. 83. - P. 66-72. DOI: 10.1139/B04-155


