Химическая и ферментативная деструкция хондроитина сульфата из северного ската
Автор: Кучина Ю. А., Коновалова И. Н., Новиков В. Ю., Долгопятова Н. В., Кузнецов В. Я.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 3 т.24, 2021 года.
Бесплатный доступ
Благодаря биосовместимости с тканями человека и животных, низкой токсичности, биодеградируемости хондроитина сульфат (ХС) представляет большой интерес для медицины. Поскольку ХС используется как фармацевтический препарат, то величина его молекулярной массы и растворимость определяют возможности его применения. Приведены результаты изучения химической и ферментативной деструкции макромолекул ХС и ее влияние на молекулярную массу, растворимость и степень кристалличности полисахарида. ХС получали из хрящевой ткани северного ската (Amblyraja hyperborea). На стадии ферментолиза хрящевой ткани использовали ферменты панкреатин, гепатопанкреатин и протосубтилин. Идентификацию полученных образцов ХС выполняли методом ИК-спектроскопии. Ферментативную деструкцию гликозидных связей в макромолекулах ХС проводили 1%-м раствором фермента гепатопанкреатина, химическую деструкцию – перекисью водорода и хлороводородной кислотой. Содержание ХС в образцах определяли методом Дише. Химический состав образцов ХС оценивали стандартными методами. Среднемассовую молекулярную массу (ММ) определяли с помощью высокоэффективной жидкостной хроматографии и нефелометрическим методом; степень кристалличности (СК) – графической обработкой дифрактограмм, полученных рентгенофазовым анализом образцов ХС. Установлено, что под действием гепатопанкреатина и перекиси водорода происходит глубокая деструкция хондроитина сульфата, до образования низкомолекулярных и олигомерных фрагментов. В условиях кислотной деструкции в 0,5 н HCl в течение 20 мин ММ хондроитина сульфата снижается на 10 % по сравнению с исходной. Кислотная деструкция вызывает значительное уменьшение СК образцов ХС. Для не деструктированных в кислоте образцов ХС растворимость в дистиллированной воде увеличивается с уменьшением ММ и СК. Растворимость ХС после кислотной деструкции в диапазоне рН = 5–9 единиц составляет 99,0 ± 0,5 %. Высокая растворимость, по всей видимости, объясняется значительным содержанием в образцах аморфной фазы.
Хондроитина сульфат, северный скат, деструкция, ферменты, молекулярная масса, степень кристалличности, растворимость, chondroitin sulfate, Arctic skate, destruction, enzymes, molecular weight, crystallinity degree, solubility
Короткий адрес: https://sciup.org/142227608
IDR: 142227608 | УДК: 664.959(043.3) | DOI: 10.21443/1560-9278-2021-24-3-267-276
Текст статьи Химическая и ферментативная деструкция хондроитина сульфата из северного ската
*Мурманский государственный технический университет, г. Мурманск, Россия; e-mail: , ORCID:
e-mail: , ORCID:
Из многообразия природных полимеров о собого внимания заслу ж ивают хонд р оитина сул ь фаты, уникальные свойства которых выз ы вают интерес большого числа спе ц иалистов р а зличных от р аслей промышленности.
Природный полисахарид хо н дроитина с ульфат (ХС) представляет собой с ульфатиров а нный гликозамин о гликан, макромолекулы ко т орого состоя т из чередую щ ихся моном е рных звенье в сульфатированного N-ацетил-D-галактозамина и D-глюк у роновой ки с лоты (рис. 1) ( Hardingham, 1981 ).
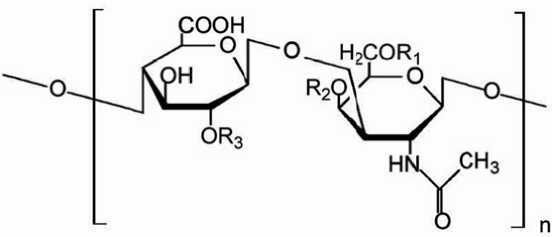
Рис. 1. М ономерное з вено хондроитина сульф а та Fig. 1. Monomeric unit of chondroitin sulfate
Благодаря биосовместимости с тканями чело в ека и живот н ых, низкой т о ксичности, б иодеградиру е мости этот полиме р представляет большой и н терес для ме д ицины. Хондроитина сул ь фаты облад аю т противоя д ными, ранозаживл я ющими, иммуностимул и рующими, о бщеукрепляющими, пр о тивомикро б ными свойс т вами. Хондроити н сульфат входит в соста в многих лек а рственных п репаратов, п рименяемы х при заболеваниях суставов ( Б у йлова, 2010 ). Такое широ к ое примене н ие ХС в жизнедеятельно с ти человека т ребует дета л ьного изучения его свойств.
Современные технологии получения хон д роитина сульфата пред п олагают ис п ользование сырья из различных источников, однако в п р омышленн ых масштабах его получаю т главным о б разом из хр я щевой ткани круп н ого рогатого скота, свиней, птицы ( Li et al., 20 1 6 ) и акульи х хрящей ( S a lmon..., 2003а, б ). С увеличением потребления в пищ у ранее неи с пользованных объектов рыбного пр о мысла, так и х как северный скат, возросло количество рыбных отх о дов, содер ж ащих хрящевую ткань. В хрящевых т канях хондроитина сульфат присутствует в виде комп л екса полис а харид-белок, т. е. проте о гликана, гд е цепи полисахарида ковалентно связаны с б елковым яд р ом ( Слуцкий, 1969 ).
Технологии производства ХС представля ю т собой мно г остадийные процессы г и дролиза хря щ евых тканей с последующей очисткой. Осно в ными стади я ми получени я хондроити н а сульфата я в ляются: под г отовка сырья, гидролиз, выделение хондро и тина сульф а та из раствора, очистка п репарата и с ушка. Техн о логии производст в а постоянно совершенс т вуются, пр е длагаются новые виды с ырья и спо с обы переработки. Известно, что условия получения влияют на кач е ство, чистоту и биологическую акт и вность преп а ратов ХС. Возможные загрязняющие примеси препара т а включают белок от ис х одной ткан и , воду, связ а нную хондроитина сульфатом, органичес к ие раствор и тели, испо л ьзуемые в н екоторых п р оцессах очистки, органическ и е молекулы, попадающи е в препарат в ходе процесса очистки.
При м енение высокомолекуля р ных полиса х аридов огр а ничено их в ысокой мол е кулярной м ассой, высокой кажущейся вязкостью, п л охой раств о римостью в воде, а т акже слож н ыми струк т урами и конформ а циями. Низкомолекуля р ные полиса х ариды привлекают все большее в н имание, ос о бенно из-за их би о логической активности. Гликозамин о гликаны, в частности х о ндроитина с ульфат, об л адают антиоксида н тной активностью, с пособность ю ингибир о вать перекисное ок и сление л и пидов и нейропр о текторными свойствам и , связанны м и с их ан т иоксидантн ы м и проти в овоспалите л ьным действиями. Высокомолекулярный и низкомоле ку лярный хондроитина су л ьфат облад а ют различн о й или даже проти в оположной биологическ о й активнос т ью ( McAlin d on et al., 200 0 ). Поскольк у ХС используется как фарма ц евтический препарат, т о величина е го молекул я рной масс ы определяе т возможнос т и его использования. Хондроитина сульфат по литерату р ным данным имеет молек у лярную мас с у от 50 до 1 0 0 кДа. Большинство фармацевтических пр е паратов со д ержат ХС с меньшей м олекулярно й массой ≈ 17 кДа. Низкомоле к улярный хондроитина с у льфат по да н ным иссле д ований обл а дает более в ысокой ско р остью усвоения, чем высокомолекулярны й . Чем мень ш е молекулярная масса, тем лучше р астворимос т ь ХС и, следовательно, более широкий с пектр лекар с твенных форм, например, можно п олучать таблетки, использовать растворы ХС для инъе к ций1 ( Adebo w ale et al., 2 0 00 ).
Применение низкомолекулярного хондроитина сульфата в качестве функционального пищевого ингредиента и пищевой добавки также является перспективным ( Шокина и др., 2014; Щетинский и др., 2014 ).
В данной работе изучена химическая и ферментативная деструкция макромолекул хондроитина сульфата, полученного из хрящевой ткани северного ската, и ее влияние на физико-химические свойства полисахарида: молекулярную массу, растворимость и степень кристалличности.
Материалы и методы
Основные стадии получения хондроитина сульфата включают: обезжиривание сырья, щелочной и ферментативный гидролиз, выделение хондроитина сульфата из раствора, дополнительную очистку препарата, сушку ( Lauder et al., 2000; Sugahara et al., 2003; 2007 ). За основу технологии выделения хондроитина сульфата был взят способ, приведенный в работах ( Salmon..., 2003а, б ) и усовершенствованный в работах ( Порцель и др., 2015; Kuchina, 2017 ).
В качестве сырья при получении ХС использовали хрящевую ткань северного ската ( Amblyraja hyperborea ). Ферментативный гидролиз хрящевой ткани северного ската проводили под действием протеолитических ферментов – панкреатина, гепатопанкреатина (ферментный препарат, выделенный из гепатопанкреаса камчатского краба) и протосубтилина ГЗх – ферментный препарат микробного происхождения.
Измельченное сырье смешивали с 0,2 М раствором гидроксида натрия в массовом соотношении 1 : 2 и термостатировали при температуре 50 ± 1 ° С в течение трех часов при постоянном перемешивании. Такие условия щелочного гидролиза позволяют провести растворение щелочерастворимых веществ и предотвратить разрушение хондроитина сульфата. После реакционную смесь нейтрализовали до рН = 7,0 ± 0,1 ледяной уксусной кислотой, нерастворившийся осадок отделяли фильтрованием, фильтрат направляли на ферментативный гидролиз. Ферментативный гидролиз проводили при температуре 50 ± 1 ° С в течение 6 часов при постоянном перемешивании. Концентрация ферментного препарата составляла 6 г на 1 кг сырья. Твердый осадок, полученный после ферментолиза, отделяли с помощью фильтрации.
Полученный после щелочной и ферментативной обработки сырья гидролизат хрящевой ткани содержит продукты расщепления белков , соли, высокомолекулярные полисахариды. Гидролизат фильтровали, фильтрат направляли на осаждение ХС. В качестве осадителя использовали 96%-й этиловый спирт, соотношение гидролизат : осадитель = 1 : 2. Время осаждения составляло не менее 48 часов. Для отделения ХС взвесь центрифугировали, осадок промывали этанолом и сушили в лиофильной сушилке при температуре минус 53 ° С и остаточном давлении 9,3 Па.
Ферментативную деструкцию гликозидных связей в ХС проводили 1%-м раствором фермента гепатопанкреатина. Для этого 1 г хондроитина сульфата растворяли в воде, при температуре 50 ± 2 °С и постоянном перемешивании с использованием магнитной мешалки. К раствору ХС добавляли 1 мл раствора фермента и проводили деструкцию в течение 30 минут при постоянной температуре. Далее для дезактивации фермента смесь кипятили, затем охлаждали. ХС осаждали избытком этанола.
Химическую деструкцию гликозидных связей в ХС проводили под действием перекиси водорода и хлороводородной кислоты. Концентрация раствора перекиси водорода составляла 1,5 %, концентрация хлороводородной кислоты была 0,1 и 0,5 н. Раствор перекиси или кислоты нагревали до 50 ± 2 °С, затем добавляли 1 г хондроитина сульфата. Деструкцию проводили в течение 20 и 30 минут при постоянном перемешивании. После кислотной деструкции смесь нейтрализовали 1 н NaOH до pH ≈ 7.
После проведения процесса деструкции хондроитин сульфат осаждали избытком спирта и отстаивали 22–24 часа для осаждения.
Идентификацию полученных образцов хондроитина сульфата проводили методом ИК-спектроскопии ( Silverstein et al., 2005 ).
ИК-Фурье спектры были получены с использованием ИК-Фурье-спектрометра IRTracer-100 (Shimadzu, Япония); в диапазоне частот от 4 000 до 800 см–1 и разрешении 2 см–1 (количество сканирований – 50). Образец для исследования представлял собой смесь хондроитина сульфата и KBr в массовом соотношении 1 : 100. Смесь растворяли в дистиллированной воде, затем сушили в лиофильной сушилке в течение 6–8 часов ( Rabek, 1983 ). Для удаления остатков влаги смесь дополнительно выдерживали в сушильном шкафу при 55 ± 5 °С в течение 6 часов. Таблетки готовили из навески 250 мг смеси (диаметр таблетки составлял 13 мм), прессовали под давлением 650 кгс/см2 в течение 1 мин при комнатной температуре. Спектры FTIR снимали сразу после прессования.
Химический состав образцов ХС определяли стандартными методами2. Содержание влаги определяли после термостатирования в сушильном шкафу при 105 ± 5 °С до постоянной массы; содержание общего азота определяли методом Кьельдаля; минеральные вещества определяли методом сжигания в муфельной печи при 550 ± 10 °С.
Содержание ХС в образцах определяли методом Дише, который основан на цветной реакции уроновых кислот с карбазолом ( Dische, 1947; Jo et al., 2005 ).
Рентгенофазовый анализ образцов хондроитина сульфатов проводили на дифрактометре LabXXRD-6000 (Shimadzu Corp., Япония). Излучение рентгеновской трубки – Cu-Кα, использовался графитовый монохроматор, λ – длина волны монохроматического рентгеновского излучения 1.54178 Å. Получали дифрактограммы, с помощью которых определяли степень кристалличности. Степень кристалличности ( х кр) определяли по отношению интегральной интенсивности сигнала кристаллических областей на дифрактограмме к общему интегральному сигналу ( Новиков и др., 2012 ).
Для вычисления сигнала, обусловленного наличием кристаллических областей в образцах, графически определили общую площадь под кривой дифракционной картины S общ и площадь аморфной составляющей S аморф . Площади на дифрактограмме, соответствующие аморфной и кристаллической фазам, определяли с помощью компьютерной программы lpSquare.
Степень кристалличности х кр (%) рассчитывали по формуле
Х кр
общ аморф
S кр
х 100,
где S общ - общая площадь под кривой дифракционной картины в диапазоне 2 9 от 6 до 36 ° ; S аморф - площадь аморфной составляющей дифракционной картины; S кр – площадь кристаллической составляющей дифракционной картины.
Среднемассовую молекулярную массу хондроитина сульфата определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) ( Новиков и др., 2012 ) и нефелометрическим методом ( Mathews et al., 1958 ).
При определении ММ методом ВЭЖХ регистрацию пиков выполняли на хромато-масс-спектрометре LCMS-QP8000 (Shimadzu, Япония) со спектрофотометрическим детектором (модель SPD – 10 AV VP ) при λ = 205 нм. Хроматографическое разделение проводили на колонке Tosoh TSKgel Alpha-4000 при 25 °С в изократическом режиме, скорость потока 0,8 мл/мин, элюент – водный раствор NaCl с концентрацией 0,15 моль/л, объем пробы 10 мкл. Для калибровки колонки использовали образцы с известной молекулярной массой, коэффициент корреляции составил 0,98.
Растворимость образцов ХС определяли при различных значениях рН. ХС смешивали с растворителем в массовом соотношении 1 : 100 и оставляли для набухания при постоянном перемешивании в течение 2 часов. Затем растворы выдерживали при температуре 20–25 °С в течение 22 часов. Не растворившуюся часть отфильтровывали с помощью фильтра Шотта, взвешенного до постоянной массы. Растворимость оценивали в процентах от исходной массы образца.
Результаты и обсуждение
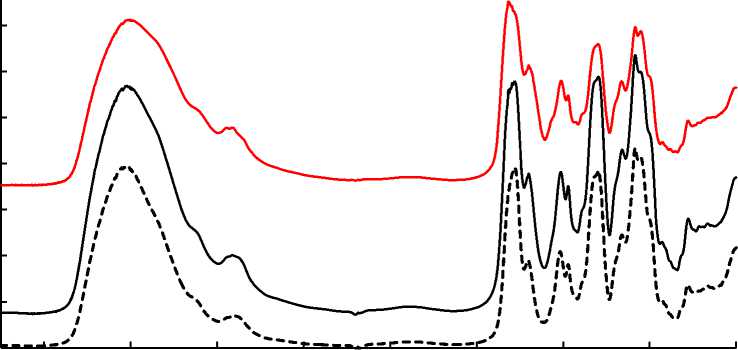
Идентификацию полученных образцов хондритина сульфата проводили методом ИК-спектроскопии (рис. 2). В качестве образцов сравнения (рис. 2, кривые 1, 2) использовали стандартные препараты хондроитина сульфата фирмы Sigma-Aldrich. По литературным данным хондроитина сульфат, полученный из морских гидробионтов, должен иметь полосы поглощения на волновых числах 1 550, 1 350–1 300 и 1 160–1 120 см–1 ( Garnjanagoonchorn et al., 2007 ).
На рис. 2 (кривая 3) приведен спектр образцов ХС, полученных с использованием на стадии ферментолиза фермента протосубтилин. Для образцов ХС, полученных с использованием панкреатина и гепатопанкреатина, ИК-спектры были аналогичны. Для сравнения на рис. 2 (кривые 1, 2) приведены спектры хондроитина сульфата из морских гидробионтов, Европейский Фармстандарт (Sigma) – кривая 1 и хондроитина сульфата из хрящей акулы, Американский стандарт (Sigma) – кривая 2.
Анализ ИК-спектров показал, что полученные образцы хондроитина сульфата имеют пики поглощения на характерных для данного полисахарида волновых числах. Наличие пиков на этих волновых числах свидетельствует о том, что спектры полученных препаратов соответствуют спектрам хондроитина сульфата.
Из литературных данных известно, что об источнике получения ХС можно судить по специфическим полосам поглощения ( Garnjanagoonchorn et al., 2007 ). Поглощение на волновом числе 850 см–1 (хондроитин-4-сульфат) свидетельствует о том, что ХС получен из ткани млекопитающих. Поглощение в диапазоне волновых чисел 825–820 см–1 (хондроитин-6-сульфат) характерно для хондроитина сульфатов из хрящевой ткани рыб.
ИК-спектры всех полученных нами образцов имеют полосу поглощения на частоте 822 см– 1 , характерную для хондроитина сульфата из хрящевой ткани рыб.
А
3800 3400 3000 2600 2200 1800 1400 1000 600 ν, сm–1
Рис. 2. Спектры поглощения: 1 – хондроитин сульфат из морских гидробионтов, Европейский Фармстандарт (Sigma); 2 – хондроитин сульфат из хрящей акулы, Американский стандарт (Sigma);
3 – ХС из хрящевой ткани северного ската
Fig. 2. Absorption spectra: 1 – chondroitin sulfate from marine organisms, European Pharmstandard (Sigma); 2 – chondroitin sulfate from shark cartilage, American standard (Sigma); 3 – CS from the cartilaginous tissue of Arctic skate
Химический состав полученных образцов хондроитина сульфата приведен в табл. 1.
Таблица 1. Химический состав образцов хондроитина сульфата Table 1. Chemical composition of chondroitin sulfate samples
|
Влага, % |
Содержание ХС, % (метод Дише) |
Общий азот, % |
Зольность, % |
|
7,6 ± 0,1 |
82,5 ± 0,5 |
3,9 ± 0,1 |
16,4 ± 0,3 |
На рис. 3 приведены результаты влияния вида ферментного препарата на среднемассовую молекулярную массу хондроитина сульфата.
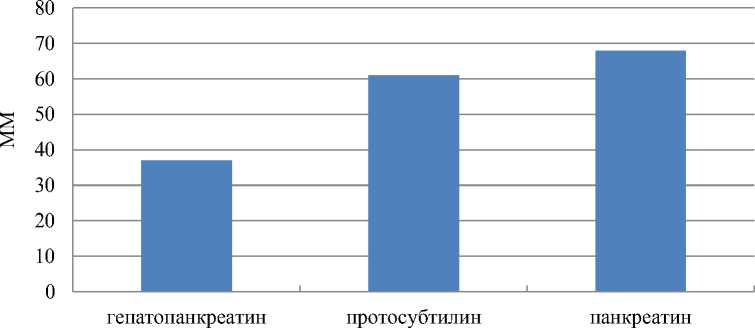
Рис. 3. Молекулярная масса образцов хондроитина сульфата, полученных с использованием различных ферментов на стадии ферментолиза хрящевой ткани Fig. 3. Molecular weight of chondroitin sulfate samples obtained using various enzymes at the stage of cartilage tissue enzymolysis
Из данных, приведенных на рис. 3, следует, что среднемассовая молекулярная масса хондроитина сульфатов, полученных из хрящевой ткани северного ската, не превышает 70 кДа, что соответствует литературным данным3 ( Adebowale et al., 2000 ).
Хондроитина сульфат, осажденный из гидролизата (получен под действием гепатопанкреатина), характеризуется более низкой среднемассовой молекулярной массой (ММ ср = 37 ± 3 кДа). По всей видимости, гепатопанкреатин вызывает деструкцию гликозидных связей в хондроитина сульфате уже на стадии ферментолиза хрящевой ткани.
С целью уменьшения молекулярной массы полисахарида были изучены условия деструкции гликозидных связей в макромолекулах хондроитина сульфата ферментом гепатопанкреатином, перекисью водорода и соляной кислотой.
В результате деструкции ХС под действием перекиси водорода и гепатопанкреатина в условиях эксперимента образовались устойчивые дисперсии, из которых выделить ХС осаждением не удалось. Вероятно, в этих условиях протекает глубокая деструкция ХС до образования низкомолекулярных фрагментов или олигомеров.
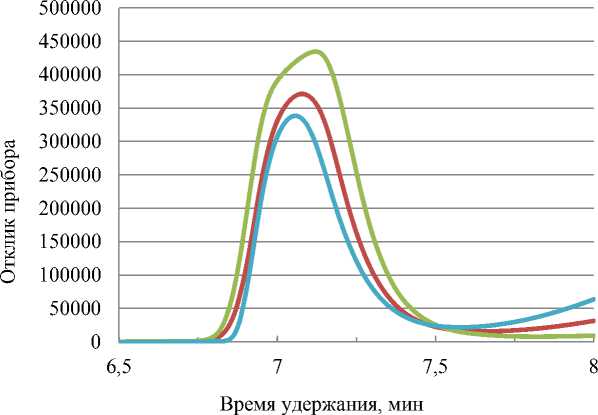
Молекулярная масса и молекулярно-массовое распределение образцов ХС после кислотной деструкции приведены на рис. 4 и в табл. 2.
: ХС 0,1н HCl 20 мин
ХС 0,5н HCl 20 мин ХС
Рис. 4. Молекулярно-массовое распределение образцов хондроитина сульфата:
1 – ХС, гидролизованный в 0,1 н HCl в течение 20 мин; 2 – ХС, гидролизованный в 0,5 н HCl в течение 20 мин; 3 – негидролизованный ХС
Fig. 4. Molecular weight distribution of chondroitin sulfate samples:
1 – CS hydrolyzed in 0.1 N HCl for 20 min; 2 – CS hydrolyzed in 0.5 N HCl for 20 min;
3 – non-hydrolyzed CS
Таблица 2. Условия деструкции и среднемассовая молекулярная масса хондроитина сульфата (ММ, кДа), фермент протосубтилин
Table 2. Conditions of destruction and weight-average molecular weight of chondroitin sulfate (MW, kDa), enzyme protosubtilin
|
Условия деструкции |
ММ, кДа |
|
Хондроитина сульфат |
61 ± 3 |
|
Хондроитина сульфат, гидролизованный в 0,1 н HCl в течение 20 мин |
59 ± 3 |
|
Хондроитина сульфат, гидролизованный в 0,5 н HCl в течение 20 мин |
54 ± 3 |
В условиях эксперимента кислотная деструкция ХС в 0,1 н HCl в течение 20 мин не приводит к уменьшению молекулярной массы. При увеличении концентрации хлороводородной кислоты до 0,5 н молекулярная масса ХС снижается на 10 % по сравнению с ММ негидролизованного образца. По всей видимости, в условиях кислотной деструкции хондроитина сульфата происходит постепенное отщепление от концов макромолекул мономерных или олигомерных фрагментов.
Результаты рентгенофазового анализа свидетельствуют о том, что полученные образцы ХС содержат как кристаллическую, так и аморфную фазы (рис. 5, табл. 3). Дифрактограмма (кривая зависимости интенсивности дифракционной картины от угла отражения – рентгенодифракционный спектр) образца, содержащего аморфную фазу имеет характерный вид – это пики с широкой линией (галло) с угловой шириной 2ϴ = 10–20°. Возникают такие отражения за счет существования ближнего порядка в расположении атомов аморфной фазы ( Васильев и др., 1986; Кузнецова, 2005 ).
Полученные нами дифрактограммы образцов ХС содержат пики, имеющие в основании широкую линию (галло) с угловой шириной 2ϴ = 15–30°, что свидетельствует о значительном содержании в образцах аморфной фазы.
На рис. 5 в качестве примера приведена дифрактограмма ХС, полученного с использованием на стадии ферментолиза протосубтилина.
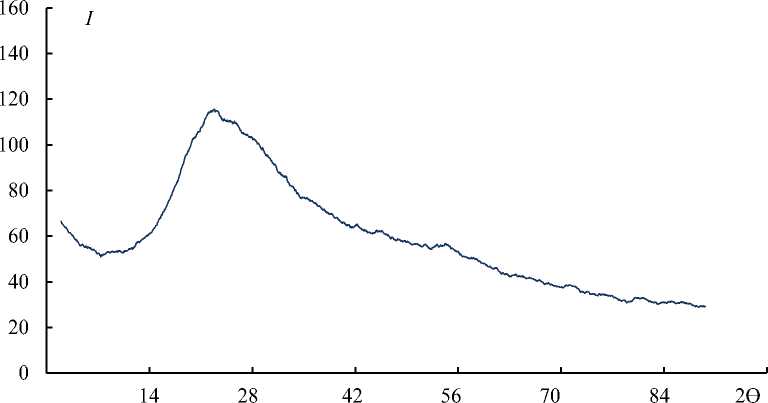
Рис. 5. Дифрактограмма ХС, полученного с использованием протосубтилина на стадии ферментолиза Fig. 5. Diffraction pattern of CS obtained using protosubtilin at the stage of enzymatic lysis
Из данных, приведенных в табл. 3, следует, что наиболее аморфным является образец, полученный с использованием на стадии ферментолиза гепатопанкреатина. Степень кристалличности этого образца составляет 34 ± 2 %.
Кислотная деструкция вызывает значительную аморфизацию образцов. Так, степень кристалличности образца ХС после деструкции гликозидных связей хондроитина сульфата в 0,1 н HCl составляет 41 ± 2 %, после деструкции в 0,5 н HCl – 21 ± 2 %. Эти образцы характеризуются более низкой ММ по сравнению с исходными (табл. 3). По всей видимости, молекулярная масса хондроитина сульфата может оказывать влияние на степень кристалличности.
Результаты изучения влияния молекулярной массы и степени кристалличности на растворимость в дистиллированной воде образцов хондроитина сульфата, полученных с использованием на стадии ферментолиза различных ферментов, приведены в табл. 3.
Таблица 3. Влияние ММ и СК на растворимость ХС в дистиллированной воде Table 3. Influence of MW and CD on the CS solubility in distilled water
|
Ферментный препарат |
ММ, кДа |
СК, % |
Растворимость, % |
|
панкреатин |
68 ± 3 |
42 ± 2 |
72 ± 2 |
|
протосубтилин |
61 ± 3 |
59,6 ± 2 |
75 ± 2 |
|
гепатопанкреатин |
37 ± 3 |
34 ± 2 |
80 ± 2 |
Из данных, приведенных в табл. 3, следует, что для не деструктированных в кислоте образцов ХС растворимость в дистиллированной воде увеличивается с уменьшением ММ и СК.
Увеличение рН раствора способствует ионизации кислотных групп ХС, поэтому растворимость образцов увеличивается в 0,1 н NaOH (рН = 11,9) и в 0,1 н NaHCO3 (рН = 8,1), составляет 90–98 ± 1 % и не зависит от ММ и СК полисахарида.
Растворимость образцов ХС после кислотной деструкции в диапазоне рН = 5–9 единиц составляет 99,0 ± 0,5 %. Такая высокая растворимость, по всей видимости, объясняется значительным содержанием в образцах аморфной фазы.
Заключение
Получены образцы хондроитина сульфата, имеющие пики поглощения на характерных для данного полисахарида волновых числах.
Фермент гепатопанкреатин вызывает деструкцию гликозидных связей в хондроитина сульфате на стадии ферментолиза хрящевой ткани. В результате деструкции ХС под действием перекиси водорода и гепатопанкреатина в условиях эксперимента протекает разрушение гликозидных связей в макромолекулах ХС до образования низкомолекулярных фрагментов или олигомеров.
Кислотная деструкция ХС в 0,5 н HCl в течение 20 мин приводит к уменьшению молекулярной массы на 10 % по сравнению с ММ негидролизованного образца.
Дифрактограммы образцов ХС содержат пики, имеющие в основании широкую линию (галло) с угловой шириной 2ϴ = 15–30°, что свидетельствует о значительном содержании в ХС аморфной фазы. Кислотная деструкция вызывает значительную аморфизацию образцов: степень кристалличности образца ХС после обработки в 0,1 н HCl составляет 41 ± 2 %, после обработки в 0,5 н HCl – 21 ± 2 %.
Для не деструктированных в кислоте образцов ХС растворимость в дистиллированной воде увеличивается с уменьшением ММ и СК. Растворимость ХС после кислотной деструкции в диапазоне рН = 5–9 единиц составляет 99,0 ± 0,5 %. Такая высокая растворимость, по всей видимости, объясняется значительным содержанием в образцах аморфной фазы.


