Холестерин не повышает криозащитную эффективность среды на основе растительных фосфолипидов, используемой для замораживания спермы быка
Автор: Шишова Н.В., Комбарова Н.А., Тараховский Ю.С., Давыдова Г.А., Заломова Л.В., Серая О.Ю., Абилов А.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Криопротекторы
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
В настоящее время для криоконсервации семени сельскохозяйственных животных актуальной задачей остается разработка сред на основе растительных фосфолипидов, не содержащих компонентов животного происхождения. Однако в комплексе растительных липидов, в отличие от желточных, отсутствует холестерин, который играет важную роль в обеспечении криорезистентности. Известно, что обогащение клеточных мембран холестерином усиливает толерантность сперматозоидов быка к охлаждению и замораживанию (E. Mocé с соавт., 2010; E. Mocé с соавт., 2014; M.H. Fayyaz с соавт., 2016). Можно предположить, что включение холестерина в состав безжелточных сред на основе растительных лецитинов способно повысить их криозащитную эффективность. Нами впервые одновременно оценено влияние холестерина на свойства липосом или липидных частиц на основе смеси соевых фосфолипидов и на их криозащитное действие при добавлении в растворы для криоконсервации спермы быка. Цель исследования - определить, как введение холестерина в комплекс растительных липидов повлияет на физические характристики и криопротекторную функцию липидной суспензии. Для этого мы изучили динамический размер липосом и липидных частиц из обработанной ультразвуком смеси холестерина с соевым лецитином (диапазон массовой доли холестерина - 0; 8; 18; 33 и 50 %) и определили выживаемость сперматозоидов быка при замораживании и оттаивании в среде, содержащей такие липидные смеси. О жизнеспособности половых клеток судили по доле сперматозоидов с прямолинейно-поступательным движением (при скорости более 25 мкм/с) сразу после оттаивания и через 5 ч инкубации при 38 °С. Для приготовления суспензии использовали коммерческий лецитин марки LeciPRO 90 («Unitechem Co., Ltd», КНР) и очищенный холестерин, полученный из ланолина («Sigma-Aldrich Co.», США), для озвучивания - ультразвуковой дезинтегратор УЗДН-2Т («НПП Академприбор», Россия; 22 кГц, 60 Вт/см2, 5 мин). Показано, что введение холестерина в состав липосом из коммерческого соевого лецитина LeciPRO 90 в концентрации 18 и 33 % по массе липидов увеличивало размер липосом после ультразвукового дробления. Такие смеси формировали монодисперсную суспензию со средним размером частиц соответственно 66±6 нм и 62±11 нм. Введение холестерина в концентрации 50 % приводило к полному изменению состояния липидной суспензии с образованием сложных структур из фосфолипидно-холестериновых ламелл и кристаллов монгидрата холестерина. В концентрации 8 % холестерин не повышал криозащитную эффективность лецитина, а при 18-50 % она снижалась. При увеличении концентрации холестерина в липидной смеси до 50 % (» 66 моль%) отмечалось некоторое повышение подвижности сперматозоидов относительно минимального значения в варианте с 33 % холестерина. Наиболее вероятная причина негативного воздействия холестерина на криозащитную эффективность липидной суспензии - ухудшение взаимодействия липосом с цитоплазматической мембраной сперматозоида за счет уплотнения упаковки фосфолипидов в липидном бислое.
Крупный рогатый скот, сперматозоиды, криоконсервация, холестерин, фосфолипиды, липосомы
Короткий адрес: https://sciup.org/142214029
IDR: 142214029 | УДК: 636.2:591.463.1:57.086.13 | DOI: 10.15389/agrobiology.2017.2.306rus
Текст научной статьи Холестерин не повышает криозащитную эффективность среды на основе растительных фосфолипидов, используемой для замораживания спермы быка
При воспроизводстве и селекции сельскохозяйственных животных широко используется криоконсервированная сперма элитных производителей. Традиционно для замораживания семени быка в России применяли среды, содержащие яичный желток, который обладает высокой криозащит-ной эффективностью. К нежелательным обстоятельствам относится непостоянство состава желтка, высокая вероятность контаминации опасными патогенами, быстрая потеря протективных свойств при хранении, сложность стерилизации и др. В связи с этим в последнее время большое внимание уделяется разработке криозащитных сред, не содержащих яичного желтка или других компонентов животного происхождения (1).
Известно, что криопротективная функция желтка обусловлена присутствием фосфолипидов легкой липопротеиновой фракции (2, 3). Заменой этому компоненту в криозащитных средах могут служить фосфолипиды 306
растительного происхождения, например соевый лецитин (4, 5). Однако, помимо фосфолипидов, яичный желток содержит ряд других веществ, способных влиять на устойчивость биологических объектов к охлаждению и замораживанию. В частности, в состав легкой липопротеиновой фракции входит холестерин, полностью отсутствующий в растительных липидах.
Холестерин — важный компонент цитоплазматических мембран и оказывает большое влияние на устойчивость клеток к охлаждению и замораживанию. Сравнивая криорезистентность сперматозоидов у разных видов животных, уже давно заметили, что при высоком соотношении холестерина и липидов в мембранах спермии устойчивее к холодовому шоку, чем при низком содержание холестерина. Такая закономерность описана у млекопитающих (6-8), птиц (9) и рыб (10). Позже была разработана технология искусственного обогащения плазматических мембран клеток холестерином с использованием циклического олигосахарида циклодекстрина (11). Многочисленные эксперименты с применением этого метода подтверждают, что обогащение клеточных мембран холестерином усиливает толерантность сперматозоидов быка к охлаждению и замораживанию (1215). Следовательно, можно предположить, что включение холестерина в состав безжелточных сред на основе растительных лецитинов способно повысить их криозащитную эффективность.
Соевый лецитин вводят в криозащитные среды в виде липосом, строение и размер которых зависят от способа приготовления и состава сырья. Поскольку холестерин оказывает сильное воздействие на структуру и свойства липидного бислоя, он будет существенно изменять и свойства липосом, и их взаимодействие с цитоплазматическими мембранами (16-18). Влияние холестерина на свойства бислойной мембраны, в свою очередь, зависит от фосфолипидного состава липосом. Поэтому для получения достоверных данных о криозащитной роли холестерина в составе липосом из растительных фосфолипидов необходимо не только изучить их воздействие на сперматозоиды, но и отслеживать изменения в самих липосомах.
При совершенствовании безжелточных сред для криоконсервации необходимо детальнее понимать, как холестерин влияет на криозащитные функции липосом сложного состава, но имеющихся на этот счет данных недостаточно. Мы впервые одновременно оценили влияние холестерина в разных концентрациях (0; 8; 18; 33 и 50 %) на физико-химические свойства липосом и липидных частиц на основе соевых фосфолипидов, а также на протективный эффект полученных липидных суспензий при криоконсервации спермы быка. Выявлено, что холестерин не повышал, а в концентрации 18-50 % даже снижал криозащитную эффективность лецитина.
Целью работы было изучение размерных характеристик и криопротекторных свойств суспензий из смеси соевых фосфолипидов и холестерина с разным содержанием последнего.
Методика. Для приготовления суспензии использовали коммерческий лецитин марки LeciPRO 90 («Unitechem Co., Ltd», КНР) и очищенный холестерин, полученный из ланолина («Sigma-Aldrich Co.», США). Липосомы готовили с массовой долей холестерина 0; 8; 18; 33 и 50 %. Для этого липиды в указанном соотношении растворяли в химически чистом хлороформе. Далее с помощью роторного испарителя удаляли хлороформ в течение 4-5 ч до образования тонкой пленки фосфолипидов на внутренней стенке стеклянной колбы, после чего в колбу вносили раствор сахарозы (сахароза 242 мМ, HEPES 10 мМ) в таком количестве, чтобы на 1 мл воды приходилось 15 мкг лецитина. Липиды в среде диспергировали при посто- янном встряхивании на лабораторном шейкере (type 358S, «ELPIN PLUS s.c.», Польша) в течение 2 ч при комнатной температуре. Полученную суспензию для предотвращения окисления лецитина продували азотом, затем охлаждали на ледяной бане до 4 °С и в течение 5 мин обрабатывали на ультразвуковом дезинтеграторе УЗДН-2Т («НПП Академприбор», Россия; 22 кГц, 60 Вт/см2), используя погруженный зонд с диаметром торца 2 мм.
Средний гидродинамический диаметр липосом или липидных частиц в суспензии и их распределение по размерам оценивали с использованием метода динамического светорассеяния на анализаторе размеров субмикронных частиц N5 Submicron Particle Size Analyzer («Beckman Coulter, Inc.», США) через 24 ч после приготовления суспензии.
Частицы просматривали под микроскопом Axio Scope FL («Carl Zeiss», Германия) при увеличении ½400 с контрастированием методом темного поля.
При криоконсервации семени быка и оценке защитной эффективности лецитинов использовали выбракованные эякуляты (ОАО «Головной центр по воспроизводству сельскохозяйственных животных»), в которых доля спермиев с прямолинейным поступательным движением составляла не менее 70 %. В качестве криопротектора использовали лактозо-глице-риновый разбавитель (лактоза 242 мМ, HEPES 10 мМ, глицерин 55 мМ). К нему добавляли анализируемые фосфолипидные или фосфолипидно-холестериновые суспензии до конечной концентрации лецитина 3 мг/мл. В контрольные образцы вместо суспензии вносили 20 % яичного желтка. Семя разбавляли криозащитной средой в два этапа (в зависимости от количества в эякуляте) и после 4 ч эквилибрации при 4 ° С замораживали в открытых гранулах на пластинах твердой двуокиси углерода (сухом льду) по стандартной методике (19). Гранулы размораживали на водяной бане при 39-40 ° С в специальном растворе, содержащем NaCl 130 мМ, KCl 4 мМ, CaCl 2 1 мМ, MgCl 2 0,5 мМ, фруктозу 14 мМ, HEPES 10 мМ («Merck KGaA», Германия); бычий сывороточный альбумин — 0,1 % (ООО НПП «ПанЭко», Россия).
Криозащитную эффективность лецитина и смеси холестерина с лецитином определяли по выживаемости сперматозоидов в процессе криоконсервации. О жизнеспособности половых клеток судили по подвижности сразу после оттаивания и через 5 ч инкубации при 38 ° С. Подвижность определяли на спермоанализаторе SFA-500 (ООО НПФ «БИОЛА», Россия) как долю сперматозоидов с прямолинейно-поступательным движением при скорости более 25 мкм/с. Контролем служила стандартная лактозо-глицеро-желточная среда.
Статистическую обработку данных выполняли в программе SigmaPlot 12.5 («Systat Software Inc.», США). Статистически значимыми считали различия при Р < 0,05. Экспериментальные данные (за исключением величины разброса размеров частиц в образцах) представлены как средние ( Я ) с указанием стандартной ошибки (±SE). Для характеристики разброса размеров частиц внутри образцов после ультразвуковой обработки показана дисперсия размеров частиц (SD).
Результаты . Размерные характеристики суспензии лецитина, полученной методом ультразвукового дробления. Дробление ультразвуком широко используется для приготовления наноразмерных липосом. В отличие от липосом, полученных методом экструзии (продавливание суспензии через поликарбонатную мембрану с порами определенного размера), у частиц при ультразвуковом дроблении размер существенно зависит от липидного состава и свойств липидного бислоя (табл. 1). 308
1. Средний размер фосфолипидных и фосфоли- После ультразвуко- пидно-холестериновых частиц после ультра- вого дробления в суспензии звукового дробления (n = 4) формировались липосомы,
|
Содержание холестерина, % |
Средний размер частиц, нм (X±SE) |
Разброс частиц (SD) внутри образца, нм |
|
0 |
41±7 |
51 |
|
8 |
43±13 |
42 |
|
18 |
66±6 |
56 |
|
33 |
62±11 |
46 |
|
50 |
3476±532 |
2978 |
П р и м е ч а н и е. При определении среднего размера учитывается разброс между средними значениями для частиц в разных образцах.
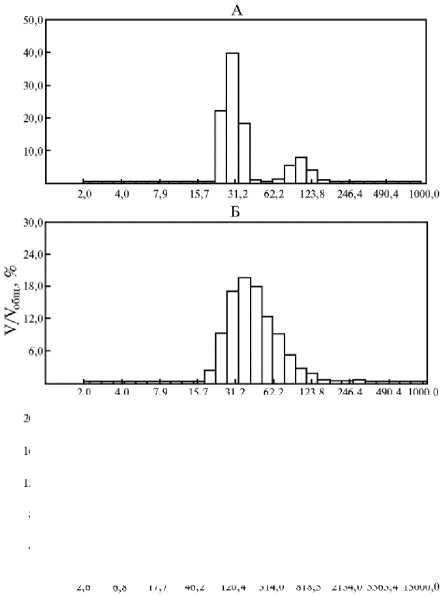
распределение которых по размерам зависело от количественного соотношения лецитина и холестерина. На рисунке 1, А представлена типичная гистограмма распределения частиц в озвученной суспензии лецитина LeciPRO 90. Обработка ультразвуком приводила к образованию полидисперсной суспензии с двух-, реже трехмодальным распределением. В препаратах всегда присутствовал кластер со средними размерами липосом порядка 30 нм и кластер более крупных частиц — около 100 нм. В некоторых образцах до 1,5 % составляли липосомы с диаметром от 300 до 1000 нм.
Гидродинамический диаметр частиц, нм
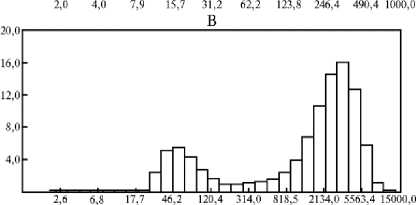
Рис. 1. Гистограмма распределения липидных частиц, образованных из смеси холестерина и лецитина LeciPRO 90 после обработки ультразвуком, по размеру: А — липосомы без холестерина, Б — липосомы с массовым содержанием холестерина 18 %, В — липосомы с массовым содержанием холестерина 50 %; V/Vобщ. — отношение суммарного объема частиц указанного размера к общему объему частиц в суспензии. Ультразвуковой дезинтегратор УЗДН-2Т («НПП Академприбор», Россия; 22 кГц, 60 Вт/см2, 5 мин).
Увеличение длительности обработки ультразвуком (с 5 до 20 мин) не оказывало существенного влияния на средний размер липосом и их распределение по размерам. Лецитин марки LeciPRO 90 представляет собой сложную смесь полярных липидов сои и других жирорастворимых примесей, характерных для растительного сырья, например каротинов. Наиболее массовые компоненты коммерческих со- евых лецитинов аналогичного класса — фосфотидилхолин, фосфотидилэтаноламин и фосфотидили-нозитол (20). Липосомы из таких сложных смесей при ультразвуковом дроблении достаточно часто демонстрируют сложное полидисперсное распределение по размерам (21), что соответствует полученным нами результатам. Введение в состав липосом из Le-ciPRO 90 холестерина в низкой концентрации (8 %) не имело существенного влияния на размерные характеристики озвученной суспензии. Средний диаметр частиц не изменялся (см. табл. 1), а тип их распределения по размерам был аналоги- чен тому, который наблюдался в случае чистого LeciPRO 90 (данные не приведены).
Возрастание массовой доли холестерина в смеси с лецитином до 18 и 33 % приводило к увеличению среднего размера частиц и изменению характера их распределения. После ультразвуковой обработки такие смеси формировали монодисперсную суспензию со средним размером частиц соответственно 66±6 нм и 62±11 нм (см. табл. 1, рис. 1, В).
Массовая доля холестерина 50 % для исследуемой суспензии соответствует приблизительно 66 моль% холестерина — предельному количеству этого стерола, которое может удерживать липидный бислой, сформированный из фосфотидилхолина. При более высоком соотношении холе-стерин:лецитин формируется система из высокохолестериновых фосфолипидных ламелл и кристаллов моногидрата холестерина (22, 23). Предельно удерживаемое бислоем количество холестерина зависит от состава фосфолипидов (22). Для лецитина LeciPRO 90 эта величина неизвестна. Из представленных данных (см. табл. 1, рис. 1, В) следует, что характер суспензии из смеси холестерина и LeciPRO 90, содержащей 50 % холестерина ( ≈ 66 моль%) кардинально отличался от прочих. Размер частиц в этой смеси более чем на порядок превышал таковой в суспензиях из смесей с меньшей концентрацией холестерина, при этом наблюдали две фракции частиц со средними размерами 40-120 и 2500-3500 нм. Среди тех, которые крупнее и хорошо различимы под микроскопом, были видны частицы с формой, характерной для кристаллов холестерина (рис. 2).

Рис. 2. Суспензия, полученная из смеси холестерина и лецитина Le-ciPRO 90 (50:50 по массе) после обработки ультразвуком . Стрелками отмечены частицы с формой, характерной для кристаллов холестерина. Микроскоп Axio Scope FL («Carl Zeiss», Германия), увеличение ½400, контрастирование методом темного поля.
При этом суспензия достаточно устойчива. В течение суток в ней не наблюдали признаков расслоения в отличие от суспензии из кристаллов чистого холестерина, кото- рые осаждаются достаточ но быстро. Можно предположить, что крупная фракция сформирована сложными структурами из кристаллов холестерина и холестерино-фосфолипидных ламелл, а мелкая представляет собой липосомы из смеси с макси- мально возможным содержанием холестерина для соответствующего вида.
Криозащитный эффект липосом, образованных из лецитина LeciPRO 90 и холестерина. Сравнение показателей в стандартной сахарозо-глицеро-желточная среде (контроль) и при использовании липосом или липидных частиц из смеси лецитина и холестерина в разном соотношении не выявило положительного эффекта от введения холестерина в состав липосом из фосфолипидов сои. Более того, жизнеспособность сперматозоидов быка, криоконсервированных в присутствии смесей с высокой концентрацией холестерина (18, 33 и 50 %), оказалась ниже, чем при замораживании с лецитином LeciPRO 90 без холестерина либо с яичным желтком (рис. 3). Обращает на себя внимание постепенное снижение жизнеспособности сперматозоидов по мере повышения концентрации холестерина вплоть до 33 % (≈ 50 моль%). Именно в этом диапазоне концентраций холестерин увеличивает упорядоченность цепей липидов, делая липидный бислой стабильнее и уменьшая флуктуации подвижности молекул.
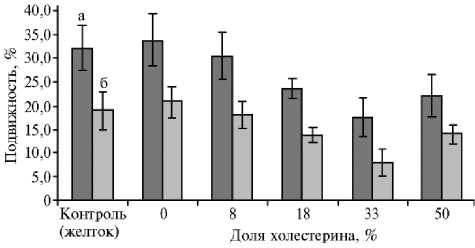
Рис. 3. Подвижность сперматозоидов быка, замороженных в присутствии смесей соевого лецитина и холестеина, через 10 мин (а) и через 5 ч (б) после размораживания (X±SE, n = 10).
Дальнейший рост концентрации холестерина до 50 % (≈ 66 моль%) сопровождался некоторым повышением жизнеспособности сперматозоидов от- носительно минимального значения при содержании холестерина 33 %. Так, суспензия липидной смеси с 50 % холестерина обеспечила достоверно (Р < 0,05) более высокую подвижность сперматозоидов через 5 ч после размораживания, чем смесь с 33 % холестерина (см. рис. 3). Именно в этом диапазоне концентраций холестерина кардинально изменяется структура и размеры липидных частиц в суспензии (см. табл. 1, рис. 1, 2).
Из этого можно сделать вывод, что добавление холестерина ухудшает взаимодействие липидов суспензии с цитоплазматической мембраной сперматозоида. При прямом негативном влиянии холестерина на спермии очевидно монотонное снижение криозащитного эффекта во всем диапазоне исследованных концентраций, что не соответствует нашим данным. Если же объяснять изменение криозащитной эффективности ослаблением взаимодействия липидных частиц с клетками, то противоречия снимаются.
Рост доли холестерина в мембранах часто ведет к снижению фузо-генности липосом (16, 17, 24). Однако эта тенденция наблюдается в диапазоне от 0 до 50 моль% холестерина. При увеличении содержания холестерина более 58 моль% взаимодействие холестериновых и липидных молекул становиться энергетически менее выгодным (25), что может способствовать повышению фузогенности липосом по сравнению с минимумом при 50 моль%. При полной перестройке структуры суспензии, которую мы наблюдали в наших экспериментах (см. рис. 1, 2), можно ожидать существенного изменения взаимодействия между липидами суспензии и цитоплазматическими мембранами сперматозоидов.
Таким образом, введение холестерина в состав липосом из коммерческого соевого лецитина LeciPRO 90 в концентрации 18-33 % по массе увеличивает размер частиц после ультразвукового дробления. Добавление холестерина в концентрации 50 % приводит к полному изменению состояния липидной суспензии с образованием сложных структур из фосфолипидно-холестериновых ламелл, кристаллов монгидрата холестерина и собственно липосом. В концентрации 8 % холестерин не повышает криоза-щитную эффективность лецитина, а при 18-50 % она снижается. Наиболее вероятная причина этого — ухудшение взаимодействия липидов суспензии с цитоплазматической мембраной сперматозоида.
Список литературы Холестерин не повышает криозащитную эффективность среды на основе растительных фосфолипидов, используемой для замораживания спермы быка
- Layek S.S., Mohanty T.K., Kumaresan A., Parks J.E. Cryopreservation of bull semen: Evolution from egg yolk based to soybean based extenders. Anim. Reprod. Sci., 2016, 172: 1-9 ( ) DOI: 10.1016/j.anireprosci.2016.04.013
- Foulkes J.A. The separation of lipoproteins from egg yolk and their effect on the motility and integrity of bovine spermatozoa. J. Reprod. Fert. 1977, 49: 277-284 ( ) DOI: 10.1530/jrf.0.0490277
- Милованов В.К., Семенова В.А. Криопротекторное действие липопротеинов яичного желтка на устойчивость спермиев сельскохозяйственных животных. Доклады ВАСХНИЛ, 1985, 11: 25-26.
- Ерохин А.С., Добровольский Г.И. Замораживание семени быков с сухим соевым лецитином. Молочное и мясное скотоводство, 2009, 5: 16-17.
- Шишова Н.В., Комбарова Н.А., Давыдова Г.А., Серая О.Ю., Миронова Е.А., Абилов А.И., Пашовкин Т.Н., Гахова Э.Н. Исследование криозащитного действия лецитинов растительного происхождения ЛециПРО-С и ЛециПРО-90. Биологические мембраны, 2017, 34(3): 223-230.
- Darin-Bennett A., White I.G. Influence of the cholesterol content of mammalian spermatozoa on susceptibility to cold-shock. Cryobiology, 1977, 14(4): 466-470 ( ) DOI: 10.1016/0011-2240(77)90008-6
- Наук В.А. Структура и функции спермиев сельскохозяйственных животных при криоконсервации. Кишинев, 1991.
- Parks J.E., Lynch D.V. Lipid composition and thermotropic phase behavior of boar, bull, stallion, and rooster sperm membranes. Cryobiology, 1992, 29(2): 255-266 ( ) DOI: 10.1016/0011-2240(92)90024-V
- Blesbois E., Grasseau I., Seigneurin F. Membrane fluidity and the ability of domestic bird spermatozoa to survive cryopreservation. Reproduction, 2005, 129(3): 371-378 ( ) DOI: 10.1530/rep.1.00454
- Drokin S.I. Phospholipid distribution and fatty acid composition of phosphatidylcholine and phosphatidylethanolamine in sperm of some freshwater and marine species of fish. Aquatic Living Resources, 1993, 6: 49-56 ( ) DOI: 10.1051/alr:1993005
- Zidovetzki R., Levitan I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim. Biophys. Acta, 2007, 1768(6): 1311-1324 ( ) DOI: 10.1016/j.bbamem.2007.03.026
- Mocé E., Tomás C., Blanch E., Graham J.K. Effect of cholesterol-loaded cyclodextrins on bull and goat sperm processed with fast or slow cryopreservation protocols. Animal, 2014, 8(5): 771-776 ( ) DOI: 10.1017/S1751731114000226
- Rajoriya J.S., Prasad J.K., Ramteke S.S., Perumal P., Ghosh S.K., Singh M., Pande M., Srivastava N. Enriching membrane cholesterol improves stability and cryosurvival of buffalo spermatozoa. Anim. Reprod. Sci., 2016, 164: 72-81 ( ) DOI: 10.1016/j.anireprosci.2015.11.014
- Mocé E., Blanch E., Tomás C., Graham J.K. Use of cholesterol in sperm cryopreservation: present moment and perspectives to future. Reprod. Domest. Anim., 2010, 45(Suppl 2): 57-66 ( ) DOI: 10.1111/j.1439-0531.2010.01635.x
- Fayyaz M.H., Ahmad M., Ahmad N. Survival of buffalo bull spermatozoa: effect on structure and function due to alpha-lipoic acid and cholesterol-loaded cyclodextrin. Andrologia, 2016 ( ) DOI: 10.1111/and.12652
- Yang S.T., Kreutzberger A.J., Lee J., Kiessling V., Tamm L.K. The role of cholesterol in membrane fusion. Chem. Phys. Lipids, 2016, 199: 136-143 ( ) DOI: 10.1111/j.1439-0531.2010.01635.x
- Wang Z., Ma Y., Khalil H., Wang R., Lu T., Zhao W., Zhang Y., Chen J., Chen T. Fusion between fluid liposomes and intact bacteria: study of driving parameters and in vitro bactericidal efficacy. Int. J. Nanomed., 2016, 11: 4025-4036 ( ) DOI: 10.2147/IJN.S55807
- Falck E., Patra M., Karttunen M., Hyvonen M.T., Vattulainen I. Lessons of slicing membranes: Interplay of packing, free area, and lateral diffusion in phospholipid/cholesterol bilayers. Biophys. J., 2004, 87: 1076-1091. ( ) DOI: 10.1529/biophysj.104.041368
- Национальная технология замораживания и использования спермы племенных быков-производителей/Под ред. Н.М. Решетниковой. М., 2008.
- Scholfield C.R. Composition of soybean lecithin. J. Am. Oil Chem. Soc., 1981, 58: 889-892 ( ) DOI: 10.1007/BF02659652
- Овчинников Ю.А. Биоорганическая химия. М, 1987.
- Huang J., Buboltz J.T., Feigenson G.W. Maximum solubility of cholesterol in phosphatidylcholine and phosphatidylethanolamine bilayers. Biochim. Biophys. Acta, 1999, 1417: 89-100 ( ) DOI: 10.1016/S0005-2736(98)00260-0
- Feigenson G.W., Buboltz J.T. Ternary phase diagram of dipalmitoyl-PC/dilauroyl-PC/cholesterol: nanoscopic domain formation driven by cholesterol. Biophys. J., 2001, 80: 2775-2788 ( ) DOI: 10.1016/S0006-3495(01)76245-5
- Ma Y., Wang Z., Zhao W., Lu T., Wang R., Mei Q., Chen T. Enhanced bactericidal potency of nanoliposomes by modification of the fusion activity between liposomes and bacterium. Int. J. Nanomed., 2013, 8(1): 2351-2360 ( ) DOI: 10.2147/IJN.S42617
- Huang J., Feigenson G.W. A microscopic interaction model of maximum solubility of cholesterol in lipid bilayers. Biophys. J., 1999, 76: 2142-2157 ( ) DOI: 10.1016/S0006-3495(99)77369-8


