Хроматографические методы в изучении химического состава алкогольных напитков
Автор: Агафонов Г.В., Полянский К.К., Шелехова Н.В., Чусова А.Е., Тарарыков М.П.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (99) т.86, 2024 года.
Бесплатный доступ
Данная работа проведена с целью изучения возможностей комплексного применения методов газовой хроматографии, хромато-масс-спектрометрии, капиллярного электрофореза для определения химического состава спиртных напитков на примере водки «Береза». Методом газовой хроматографии выявлены: уксусный альдегид массовой концентрацией 4,18 дм3б.с., ацетон 16,7 мг/дм3б.с., метиловый спирт 0,00119 об. б.с и 2пропанол 0,61 мг/дм3б.с. Обнаружено превышение показателя массовая концентрация уксусного альдегида, который составляет 4,18 дм3б.с. против 3,0дм3б.с.как регламентирует государственный стандарт. Установлены возможные причины повышенного содержания уксусного альдегида и образования ацетона в водке. В качестве референтного использовали метод газовой хромато-масс-спектрометрии, который подтвердил достоверность идентификации более чем на 98%, на основании анализа совпадения библиотечных и экспериментальных масс-спектров. Методом капиллярного электрофореза установлено, что в образце водки присутствуют хлориды, нитраты, формиаты, аммоний, калий, магний, массовая концентрация которых составляет менее 0,5 мг/дм3 каждого. Кроме того, обнаружены цитраты массовой концентрацией 2,32мг/дм3, кальций 4,11мг/дм3, натрий 14,33мг/дм3 и марганец 0,32мг/дм3. Исследование ионного состава березового сока, используемого в качестве ингредиента, при приготовлении водки, показало, что массовая концентрация хлоридов составляет 7,52мг/дм3, сульфатов 18,79мг/дм3, оксалатов 0,24мг/дм3, формиатов 18,84мг/дм3, фторидов 2,02мг/дм3, фумаратов 5,90мг/дм3, малатов 16,60мг/дм3, цитратов 315,72мг/дм3, гликолятов 17,82 мг/дм3, ацетатов 33,80мг/дм3, лактатов 10,05мг/дм3, фосфатов 26,38мг/дм3, аммония 1,70мг/дм3, калия 16,87мг/дм3, кальция 83,23мг/дм3, натрия 1,02 мг/дм3, магния 18,93±14% мг/дм3, марганца 5,21мг/дм3. Присутствиелимонной кислоты массовой концентрацией 315,72мг/дм3, не характерно для березового сока, дает основание полагать, что ее использовали качестве регулятора кислотности при производстве. Таким образом, причиной повышенного содержания уксусного альдегида и образования ацетона в исследуемом образце могло стать использование березового сока, содержащего лимонную кислоту. Проведенное исследование подтвердило целесообразность использования методов газовой хроматографии, хромато-масс-спектрометрии и капиллярного электрофореза в комплексе для изучения состава спиртных напитков.
Водка, капиллярный электрофорез, газовая хроматография, хромато-масс-спектрометрия, ионный состав, ацетон, лимонная кислота
Короткий адрес: https://sciup.org/140305663
IDR: 140305663 | УДК: 663.5 | DOI: 10.20914/2310-1202-2024-1-164-172
Текст научной статьи Хроматографические методы в изучении химического состава алкогольных напитков
Водка – спиртной напиток, произведенный на основе ректификованного этилового спирта и исправленной воды, крепостью от 37,5 до 56,0% об., представляющий собой бесцветный водно-спиртовой раствор с мягким, присущим водке, вкусом и характерным водочным ароматом [1]. Технологический процесс приготовления водок включает следующие основные этапы: приготовление исправленной воды, смешивание ректификованного этилового спирта из пищевого сырья с исправленной водой, обработку водноспиртового раствора активным углем, внесение ингредиентов в соответствии с рецептурой, розлив в потребительскую упаковку, хранение готовой продукции [1–4]. На всех этапах технологического процесса приготовления водок необходим инструментальный контроль [5].
Инструментальные методы контроля широко применяют в различных областях, в том числе и в контроле качества и безопасности алкогольной продукции. Эти методы позволяют выявлять и анализировать различные химические соединения, определять их массовую концентрацию и проверять ее соответствие нормативам. Газовая хроматография применяется для анализа органических соединений, хромато-масс-спектрометрия – для определения масс и структуры веществ, капиллярный электрофорез – для разделения и анализа ионного состава сложных многокомпонентных сред [4–6].
Методы газовой хроматографии, хромато-масс-спектрометрии и капиллярного электрофореза представляют собой мощные инструменты как для скрининга, так и для идентификации целевых аналитов, обеспечивая точные и надежные результаты, которые могут быть использованы в науке и промышленности [7]. Комбинирование этих методов обеспечивает детальное изучение химического состава алкогольной продукции.
Основным положением данного подхода к идентификации спиртных напитков является концепция комплексного исследования, основанного на сочетании газовой хроматографии, хромато-масс-спектрометрии и капиллярного электрофореза, при этом, метод газовой хроматографии используют в целях предварительного анализа для определения массовой концентрации летучих органических примесей, метод хромато-масс-спектрометрии в качестве референтного метода для подтверждения идентификации, метод капиллярного электрофореза для определения катионов, анионов органических и неорганических кислот [8–10]. Эффективность предложенного подхода обеспечивается за счет синергии преимуществ обоих детекторов.
Цель работы – теоретически обосновать и экспериментально подтвердить целесообразность комплексного использования методов газовой хроматографии, хромато-масс-спектрометрии и капиллярного электрофореза для повышения информативности анализа спиртных напитков. На примере образа водки «Береза» выявить причину превышения нормативных показателей по уксусному альдегиду, определить неидентифи-цированный пик на хроматограмме и установить причину его возникновения.
Материалы и методы
Объект исследования. Образец водки «Береза» (Название изменено, любое совпадение следует считать случайностью.) Состав: вода питьевая исправленная, спирт этиловый ректификованный «Люкс» из пищевого сырья, сок березовый натуральный, сахар, мед натуральный, фруктоза, регулятор кислотности сода пищевая, молочная кислота. Промышленный образец березового сока. Состав: сок березы натуральный, экологически чистый, без консервантов.
Хроматографическое исследование проводили на газовом хроматографе Agilent 6850 (США) с пламенно-ионизационным детектором с пределом детектирования не более 5·10–12 гС/с и капиллярной колонкой HP-FFAP. Условия хроматографирования: температура детектора 210 °С, температура испарителя 115 °С, коэффициент деления потока 25:1, объем пробы 0.7 мм3. Начальная температура термостата колонок 80 °С, выдержка 0,1 мин, программирование со скоростью 10 °С до 55 °С (7–8 мин), программирование со скоростью 7 °С до 230 °С (5 мин). Скорость потока газа-носителя (азот) 0.048–0.072 дм3/ч, скорость потока воздуха 18 дм3/ч, скорость потока водорода 1.8 дм3/ч. Время анализа 28 мин.
Хромато-масс-спектрометрическое исследование проводили на газовом хроматографе Маэстро 7820 с масс-селективным детектором (Россия, США) и капиллярной колонкой HP-FFAP. Условия хроматографирования: газ-носитель гелий, скорость потока 0.6 мл/мин, температура испарителя 130 °С, объем дозирования пробы 0.5 мкл, начальная температура термостата 75 °С программа подъема температуры до 220 °С, время анализа 15 мин, энергия ионизирующих электронов 70 эВ, температура интерфейса 210 °С, температура ионного источника 220 °С, режим регистрации – сканирование по полному ионному току в режиме SCAN в диапазоне массовых чисел m/z 19–400. Идентификацию проводили сопоставлением полученных масс-спектров с соответствующими данными библиотеки, с использованием программного обеспечения NIST11.
Электрофоретическое исследование проводили на системе капиллярного электрофореза PrinCE750 (Нидерланды) с кондуктометрическим детектором с пределом детектирования 10-7 – 10-9 моль/л и полым кварцевым капилляром с внутренним диаметром 50 мкм, общей длинной 110 см, эффективной длинной 14 см. Рабочий электролит: 30 мМоль/дм3 L-Histidine, 30 мМоль/дм3 2-Morpholinoetha-nesulfonic acid Monohydrate, 2 мМоль/дм3 18-crown. Условия анализа: напряжение +25кВ, температура капилляра +21°С, ввод пробы гидродинамический 30мБарв течении 40 с, время анализа 22 мин.
Результаты и обсуждение
При проведении настоящего исследования реализован подход, основанный на сочетании современных инструментальных методов анализа.
Предложенный подход позволяет достичь более точных результатов и увеличить надежность идентификации спиртных напитков. Он также позволяет определить массовую концентрацию органических примесей, которые могут влиять на качество и безопасность продукта. Использование различных методов анализа в комбинации позволяет получить наиболее полную информацию о составе спиртных напитков и идентифицировать все компоненты. Это может быть важно в том числе и для выявления фальсификаций алкогольной продукции или нарушения требований к качеству. Таким образом, в целом, предложенный подход к идентификации спиртных напитков обеспечивает более полное и надежное аналитическое исследование продукта. Для реализации предложенного подхода составлен алгоритм идентификации (рисунок 1).
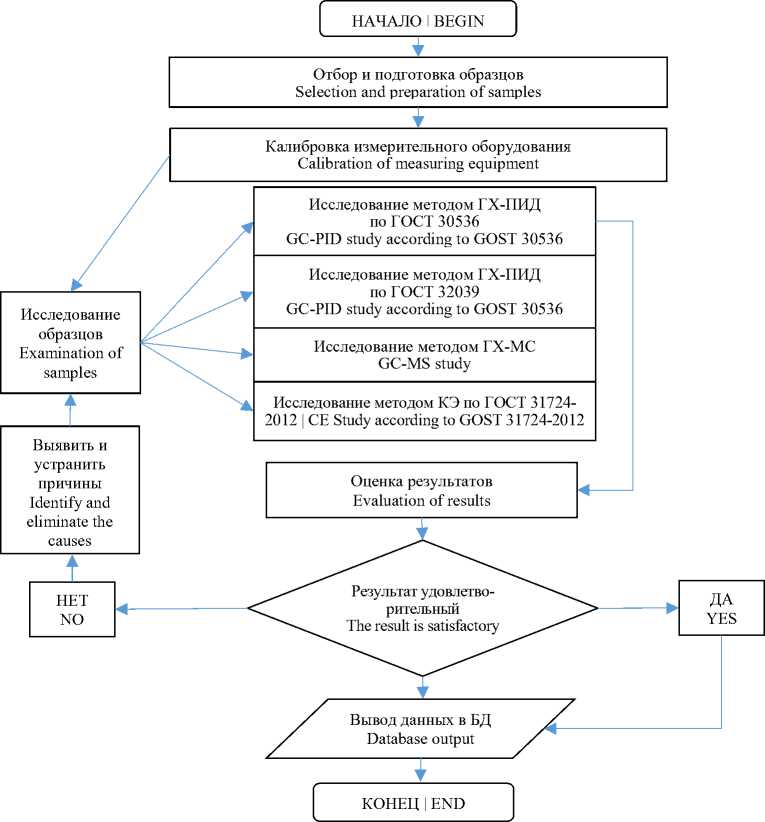
Рисунок 1. Принципиальный алгоритм проведения исследований водок методом газовой газовой хроматографии, хромато-масс-спектрометрии, капиллярного электрофореза
Figure 1. Principle algorithm of vodka studies by gas chromatography, chromatography-mass spectrometry, capillary electrophoresis methods
Следует отметить, что разработанный алгоритм идентификации может быть более сложным и содержать дополнительные шаги в зависимости от специфики задачи. Предлагаемый алгоритм представляет общий подход и может быть настроен и модифицирован в соответствии с конкретными требованиями и условиями задачи. Необходимо подчеркнуть, что перспективным направлением развития данной тематики является использование искусственного интеллекта в контроле качества и безопасности алкогольной продукции.
На первом этапе исследования методом газовой хроматографии в соответствии с ГОСТ 30536–2013 «Водка и спирт этиловый из пищевого сырья. Газохроматографический экспресс-метод. Определения содержания токсичных микропримесей» [11], который регламентирует определение уксусного альдегида (ацетальдегид), метилацетата, этилацетата, 2-пропанола, 1-пропанола, изобутанола, 1-бутанола и изоамилола в диапазоне от 0.5 мг/дм3 до 10.0 мг/дм3б.с. и метилового спирта в диапазоне от 0,0001% об. б.с. до 0,0500% об. б.с. в водках, водках особых и этиловом ректификованном спирте из пищевого сырья (рисунок 2).
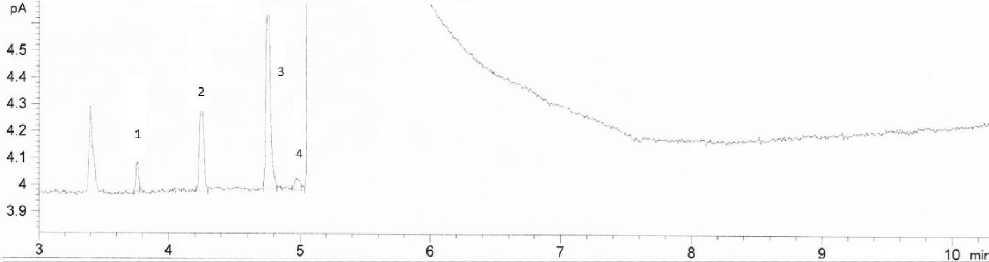
Рисунок 2. Хроматограмма водки «Береза»: 1 – 1-уксусный альдегид (ацетальдегид), 2 – неидентифицированный пик, 3 – метанол, 4 – 2-пропанол
Figure 2. Chromatogram of vodka "Birch": 1 - 1 acetic aldehyde (acetaldehyde), 2 - unidentified peak, 3 - methanol, 4 - 2 propanol
Установлено, что в образце присутствует уксусный альдегид (ацетальдегид) массовой концентрацией 4,18 Δ±0,63мг/дм3 б.с., метиловый спирт 0,00119 Δ± 0,00018% об. б.с., 2-пропанол 0,61 Δ± 0,092 мг/дм3 б.с. Кроме того, обнаружен неидентифицированный пик. Следует отметить превышение показателя «массовая концентрация уксусного альдегида», который составляет 4,18Δ±0,63мг/дм3 б.с., тогда как нормативный документ ГОСТ 12712–2013 «Водки и водки особые. Общие технические условия» [12] регламентирует содержание уксусного альдегида для водок из спирта «Люкс» не более 3,0 мг/дм3 . Дальнейшие исследования водки «Береза» проводились с целью выявления причины превышения нормативных показателей по уксусному альдегиду, идентификации неидентифицирован-ного пика, обнаруженного на хроматограмме и установление причины его возникновения.
В соответствии с составленным алгоритмом проведено исследования образца водки «Береза». В целях идентификации неидентифицированного пика, проведено исследование образца в соответствии с ГОСТ 32039–2013 «Водка и спирт этиловый из пищевого сырья. Газохроматографический метод определения подлинности» [13]. Стандарт предназначен для исследовательских работ и накопления статистических данных, распространяется на водки и водки особые, спирт этиловый ректификованный из пищевого сырья и устанавливает газохроматографический метод определения содержания токсичных микропримесей, не характерных для водки и спирта. Проведенное исследование водки Береза, кроме уксусного альдегида, метилового спирта, 2-пропанола, позволило идентифицировать ацетон массовой концентрацией 16,7 Δ± 2,5мг/дм3б.с., не определяемый по ГОСТ 30536–2013.
В целях подтверждения достоверности идентификации в качестве референтного метода был выбран метод газовой хромато-масс-спектро-метрии [14]. Методом хромато-масс-спектромет-рии с применением библиотеки масс-спектров NIST 11 подтвержден качественный состав представленного образца (рисунок 3).
Проведена идентификация полученных масс-спектров путем сравнения с масс-спектрами библиотеки. При сопоставлении библиотечного и экспериментального масс-спектров индивидуальные химические соединения считали идентифицированными, если экспериментальные спектры, соответствовали не менее, чем на 90%, масс-спектрам известных химических соединений, зарегистрированных в библиотеке NIST11. В качестве иллюстрации на рисунке 4 отображены экспериментальный и библиотечный масс-спектры ацетона (рисунок 4).
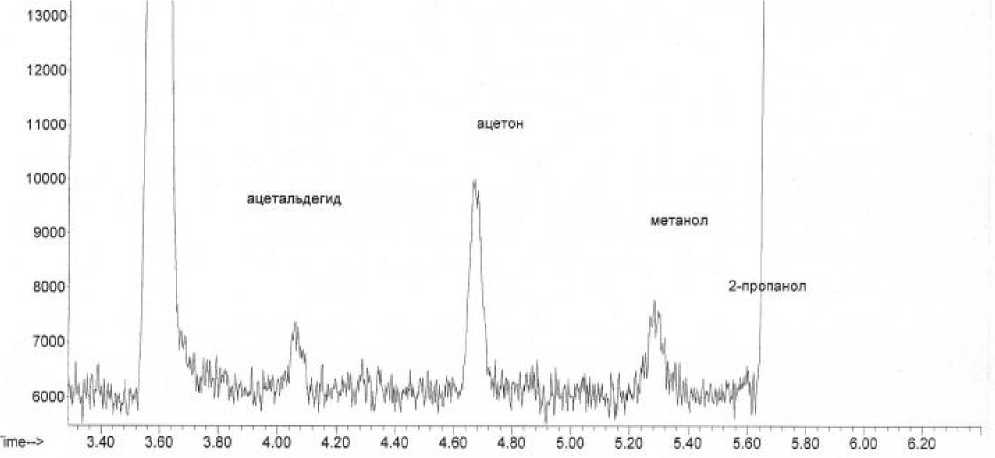
Рисунок 3. Хроматограмма водки «Береза»
Figure 3. Chromatogram of "Birch" vodka
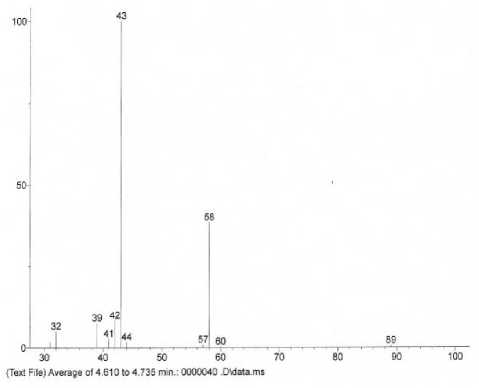
(a)
Рисунок 4. Масс-спектр ацетона: (a) – экспериментальный; (b) – библиотечный
Figure 4. Acetone mass spectrum: (a) - experimental; (b) - library spectrum
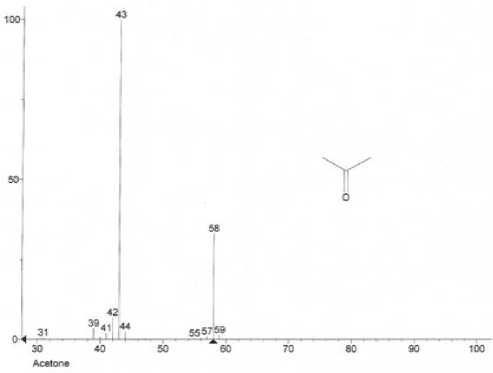
(b)
Таким образом, методом газовой хромато-масс-спектрометрии экспериментально подтверждено присутствие в исследуемом образце уксусного альдегида, ацетона, метилового спирта, 2-пропанола. Следует отметить, что ацетон не является характерной примесью спирта этилового ректификованного и водок, приготовленных на его основе.
Ацетон (пропан-2-он, диметилкетон) – жидкость с характерным резким запахом и температурой кипения 58.08 °С, хорошо растворима в воде, спиртах и эфирах, обладает способностью к окислению и восстановлению, вступает в реакции альдольной и кротоновой конденсации. Ацетон является естественным метаболитом организма человека и животных, однако, при накоплении в высоких концентрациях может приводить к развитию кетоациодоза [15, 16].
В литературе представлены разноречивые сведения о влиянии ацетона в водке на организм человека [15, 16]. Известно, что ацетон может содержаться во многих спиртных напитках, полученных методом дистилляции, в том числе в коньяках, виски, кальвадосе, роме и других напитках. Однако, данные в пользу того, что дистиллированные напитки оказывают более выраженное токсичное действие на организм человека – отсутствуют [17].
Исследования, направленные на изучение причин образования ацетона в водках, проведенные группой исследователей ВНИИПБТ под руководством доктора технических наук, профессора, академика РАН Полякова В.А., показали, что «внесение лимонной кислоты способствует значительному образованию ацетона в водках при хранении, внесение натурального меда и аскорбиновой кислоты практически не оказывает влияния на образование ацетона. Однако, внесение уксусной и аскорбиновой кислот может способствовать существенному увеличению уксусного альдегида» [17].
На основании вышеизложенного, можно предположить, что причиной повышенного содержания уксусного альдегида и образования ацетона в исследуемом образце водки «Береза» может является наличие лимонной кислоты в составе напитка. Важно отметить, что на этикетке водки «Береза» в информации о составе отсутствуют сведения о наличии лимонной кислоты.
В этой связи целесообразно проведение исследования образца методом капиллярного электрофореза, который позволяет определять, в том числе и лимонную кислоту. С применением метода капиллярного электрофореза по ГОСТ31724–2012 «Водки, водки особые и вода для их приготовления. Определение массовой концентрации катионов, аминов, анионов неорганических и органических кислот методом капиллярного электрофореза» [18] исследован образец водки «Береза» (рисунок 5).

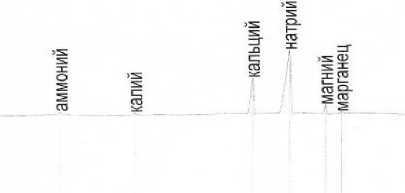

Рисунок 5. Электрофореграмма водки «Береза»
Figure 5. Electrophoregram of "Birch" vodka
мин
Установлено, что в образце присутствуют хлориды, нитраты, формиаты, аммоний, калий магний, массовая концентрация которых составляет менее 0,5 мг/дм3 каждого. Кроме того, обнаружены цитраты (лимонная кислота) массовой концентрацией 2,32±0,33 мг/дм3, кальций 4,11±0,58 мг/дм3, натрий 14,33±2,01 мг/дм3 и марганец 0,32±0,05мг/дм3 .
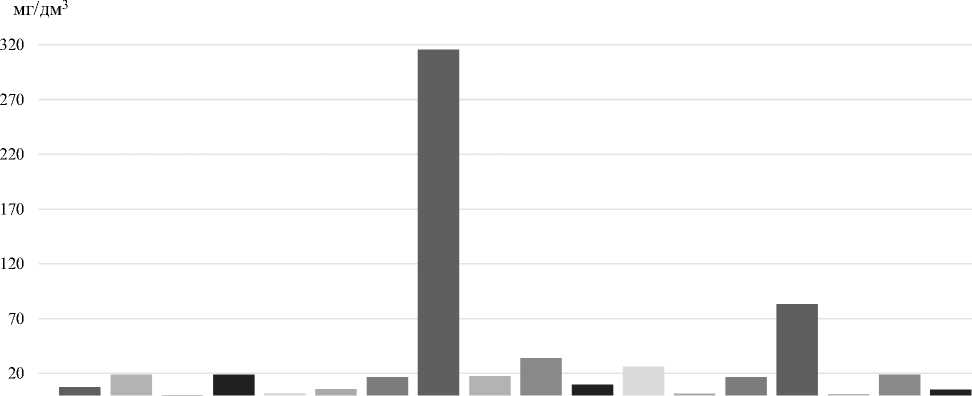
В целях выявления возможных путей внесения лимонной кислоты проведены исследования ионного состава березового сока, используемого при приготовлении купажа водки «Береза». Показано на рисунке 6, что массовая концентрация хлоридов в исследуемом образце составляет 7,52±10,05мг/дм3, сульфатов 18,79±2,63 мг/дм3, оксалатов 0,24±0,04мг/дм3, формиатов 18,84±2,64мг/дм3, фторидов 2,02±0,28мг/дм3, фумаратов 5,90±0,82мг/дм3, малатов 16,60±2,32мг/дм3, цитратов 315,72±44,2мг/дм3, гликолятов 17,82мг/дм3±2,49, ацетатов 33,80±4,73мг/дм3, лактатов
10,05±1,41мг/дм3, фосфатов 26,38±3,69% мг/дм3, аммония 1,70±0,24 мг/дм3, калия 16,872,36мг/дм3, кальция 83,23±11,65% мг/дм3, натрия 1,02±0,14мг/дм3, магния 18,93±2,65мг/дм3, марганца 5,21±0,73мг/дм3.
Анализ информации научных источников показал, что лимонная кислота массовой концентрацией 315,72 ±44,2 мг/дм3не является характерным компонентом берёзового сока [19, 20].
Таким образом, в ходе проведенных исследований установлено, что образец березового сока содержит катионы, анионы неорганических и органических кислот, в том числе и циртат-ионы, массовой концентрацией 315,72 ±14% мг/дм3. В этой связи, с высокой степенью вероятности можно предположить, что лимонную кислоту производители березового сока использовали качестве регулятора кислотности. Важно отметить, что данный факт не нашел отражения на этикетке емкости березового сока.
-30
-
■ хлориды ■ сульфаты ■ оксалаты ■ формиаты фториды ■ фумараты ■ малаты ■ цитраты ■ гликоляты
-
■ ацетаты ■ лактаты фосфаты ■ аммоний ■ калий ■ кальций ■ натрий ■ магний ■ марганец
chlorides sulfates oxalates formates fluorides fumarates malates citrates glycolates acetates phosphates ammonium potassium calcium calcium sodium magnesium manganese
Рисунок 6. Ионный состав березового сока
Figure 6. Ionic composition of birch sap
На основании вышеизложенного, можно сделать вывод, что целесообразно учитывать возможное влияние ингредиентов на ионный состав спиртных напитков. Это позволит более точно контролировать и регулировать химический состав спиртных напитков в целях обеспечения выпуска продукции с заданными качественными характеристиками. Кроме того, исследование химического состава полуфабрикатов на всех стадиях технологического процесса будет способствовать соответствию требованиям и нормативам по содержанию определенных веществ в алкогольных напитках.
Заключение
В процессе исследований предложен новый комплексный подход к определению химического состава водок. Составлен принципиальный алгоритм комплексного исследования водок методом газовой газовой хроматографии, хромато-масс-спектрометрии, капиллярного электрофореза. На примере водки «Береза» изучен химический состав летучих органических примесей и ионный состав спиртного напитка.
Установлены возможные причины повышенного содержания уксусного альдегида и образования ацетона в водке. Показано, что комплексное использование инструментальных методов анализа позволяет не только установить химический состав спиртного напитка, но и выявить причины образования некоторых химических соединений, образующихся в процессе хранения.
Список литературы Хроматографические методы в изучении химического состава алкогольных напитков
- ГОСТ 33880–2016. Напитки спиртные. Термины и определения. Москва: Стандартинформ,2019. 12с.
- Агафонов Г.В. Инновационные решения в технологии производства алкогольной продукции // Материалы LVI отчетной научной конференции преподавателей и научных сотрудников ВГУИТ за 2017 год. 2018. С. 59-59.
- Новикова И.В., Агафонов Г.В., Яковлев А.Н., Чусова А.Е. Технологическое проектирование производства спиртных напитков. Санкт-Петербург: Лань, 2015. 384 с.
- Яровенко В.Л. Справочник технолога ликероводочного производства; под ред. В.Л. Яровенко, И.И. Бурачевского. М.: ВО «Агропромиздат», 1988. 205 с.
- Шелехова Н.В.,. Поляков В.А Совершенствование системы контроля технологических процессов производства спиртных напитков // Пиво и напитки. 2017. № 1. С 34–36.
- Шелехова Н.В. Экспресс метод определения анионов в алкогольных напитках на основе сочетания КЭ-КД // Сорбционные и хроматографические процессы. 2023. Т. 23. № 2. С. 199–215.
- Якуба Ю.Ф., Темердашев З.А. Хроматографические методы в анализе и идентификации виноградных вин // Аналитика и контроль. 2015. Т. 19. № 4. С. 288–301.
- Шелехова Н.В. Экспресс-метод определения летучих органических примесей в спиртных дистиллированных напитках на основе сочетания ГХ/ПИД и ГХ/МСД // Сорбционные и хроматографические процессы. 2022. Т.22. № 1. С. 58–68. doi: 10.17308/sorpchrom.2022.22/9021
- Лебедев А.Т. Современная масс-спектрометрия в России и в мире // Мир измерений. 2013. № 11. С. 4–9.
- Buglass A.J. Handbook of alcoholic beverages: Technical, analytical and nutritional aspects. JohnWiley&Sons, 2011. 1208 p. doi: 10.1002/9780470976524 ГОСТ 30536–2013.
- Водка и спирт этиловый из пищевого сырья. Газохроматографический экспресс-метод определения содержания токсичных микропримесей. Москва: Стандартинформ, 2014. 33 с. ГОСТ 12712–2013.
- Водки и водки особые. Общие технические условия. Москва: Стандартинформ,2014. 6 с. ГОСТ 32039–2013.
- Водка и спирт этиловый из пищевого сырья. Газохроматографический метод определения подлинности. Рудаков О.Б., Никитина С.Ю. Тренды в аналитическом контроле качества питьевого этанола. Аналитика и контроль. 2017.Т.21. №3. С.180-196. https://doi.org/10.15826/analitika.2017.21.3.010
- Савчук С.А., Нужный В.П. К вопросу об идентификации природы этилового спирта. Ацетон в водках и спиртах различного происхождения // Партнеры и конкуренты. 2005. №. 1. С. 32-38.
- Нужный В.П., Савчук С.А. Токсичность алкогольных напитков и ацетон // Токсикологический вестник. 2005. №. 6. С. 22-24.
- Поляков В.А., Абрамова И.М., Зенина Г.П., Шелехова Т.М. и др. Образование ацетона и других микропримесей в водках в процессе хранения // Пиво и напитки. 2014. № 6. С. 10–13. ГОСТ 31724–2012.
- Водки, водки особые и вода для их приготовления. Определение массовой концентрации катионов, аминов, анионов неорганических и органических кислот методом капиллярного электрофореза. Москва: Стандартинформ, 2013. 47 с.
- ЛисоваО.С., ЦаралунгаВ.В., Прохорова Н.Л. Проблемы и перспективы заготвки березового сока в лесах Воронежской области // НАУ. 2015. № 10–1 (16). URL: https://cyberleninka.ru/article/n/problemy-i-perspektivy-zagotovki-berezovogo-soka-v-lesah-voronezhskoy-oblasti
- Янин Е.П. Химические элементы в березовом соке как индикаторы техногенного загрязнения окружающей среды // Экологическая экспертиза. 2012. № 1. С. 101–112.


