Хронический миелолейкоз сегодня: 16 лет наблюдения
Автор: Лямкина А. С., Маслова Л. М., Науменко О. В., Мельниченко Е. В., Обгольц Ю. Н., Логинова А. Б., Дараган Е. В., Нечунаева И. Н., Воронцова Е. В., Шпагина Л. А., Юданов А. В., Хальзов К. В., Поспелова Т. И.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.16, 2020 года.
Бесплатный доступ
В статье проанализирована заболеваемость хроническим миелолейкозом с 2004г. по 2020г., которая составила 0,64 на 100 тыс. населения в год. Распространенность хронического миелолейкоза за последние 16 лет выросла с 1,88 случаев до 7,43 случаев на 100 тысяч населения. Проанализированы результаты терапии хронического миелолейкоза в группе больных (204 человека), получавших терапию иматинибом более 12 месяцев. В результате проводимой терапии полный клинико-гематологический ответ достигнут у 90,2% больных (184 человека). Полный цитогенетический ответ (Рh+
Хронический миелолейкоз, эпидемиология, полный цитогенетический ответ, большой молекулярный ответ, выживаемость
Короткий адрес: https://sciup.org/170172546
IDR: 170172546
Текст научной статьи Хронический миелолейкоз сегодня: 16 лет наблюдения
Согласно данным международных иссле-дований,в процессе таргетной терапии полный цитогенетический ответ удается достичь у 75–90 % пациентов, получающих иматиниб в качестве терапии первой линии в хронической фазе (ХФ) [3]. В фазе акселерации (ФА) эффективность терапии значительно снижается, полный цитогенетический ответ удается получить лишь 24 % случаев, а в фазе бластного криза (БК) цитогенетический ответ достигается редко, прогноз является неблагоприятным, медиана выживаемости составляет около 6–8 месяцев.
Часть больных в ХФ также не достигают ПЦО или впоследствии его утрачивают. Риск цитогенетического рецидива и прогрессии болезни в ФА или БК при достижении БМО приближается к нулю, однако на фоне терапии иматини-бом БМО достигают только около половины пациентов.Имеются данные о развитии резистентности к иматинибу у 25–30 % пациентов [4,5,6]. С целью ее преодоления были разработаны препараты ИТК II поколения(дазатиниб, нилотиниб и бозутиниб), которые в России зарегистрированы для применения в случаях резистентности к иматинибу или при его непе- as 90 %, 10-years OS rate — more than 77 %, calculated 15-years OS — more than 60 %.
реносимости [7, 8]. Клинические исследования по применению новых ингибиторов тирозин-киназы (ИТК) — нилотиниба и дазатиниба — в ХФ ХМЛ доказали их преимущество перед иматинибом в получении ПЦО и БМО, снижении риска трансформации в ФА и БК и увеличении общей выживаемости пациентов [9].
Целью данного исследования явилось изучение заболеваемости, распространенности и результатов терапии хронического миелолейкоза вг.Новосибирске и Новосибирской области за период с 2004 г. по июнь 2020 г.
Материал и методы. С января 2004 г. в поликлиническом отделении ГБУЗ НСО ГКБ № 2 (Городском гематологическом центре) г. Новосибирска, Консультативно-диагностической поликлинике Новосибирской областной клинической больницы и отделении гематологии ГБУЗ НСО ЦКБ ВАСХНИЛ наблюдался 251 больной хроническим миелолейкозом.На момент диагностики заболевания в хронической фазе находилось (231человек), в фазе акселерации 12 человек, в фазе бластного криза — 8 пациентов.
Группа состояла из 111 лиц мужского пола (44,2 %) и 140 женщин (55,8 %). Возраст пациентов варьировал от 8 до 82 лет, средний возраст был равен 46,8 ± 7,32 года. В последние годы имеется устойчивая тенденция к выявлению хронического миелолейкоза в молодом возрасте: 79 больных в исследуемой группе (31,5 %) — это молодые люди до 40 лет (из них 5 человек — несовершеннолетние пациенты 8–16 лет).
Заболеваемость хроническим миелолейкозом в целом с 2004 г. по 2020 г. составила 0,64 случая на 100 тыс.населения в год.При детальном анализе в первые 10 лет с 2004 г. по 2013 г. заболеваемость составляла 0,55 случаев на 100 тыс. населения в год, а в последние 6 лет отмечается рост заболеваемости до 0,95 случаев на 100 тыс. населения в год, что на 72 % превышает результаты заболеваемости в предыдущие 10 лет и на 35 % — результаты популяционного российского исследования в 6 регионах России (0,7:100 тыс. населения в год), но соответствуют международным данным (1–2 больных:100 тыс. населения в год) [10, 11, 12, 13].
Полученные данные, превышающие показатели 2004 г.-2013 г. и общероссийские показатели, вероятно, связаны с улучшением диагностики хронических миелопролиферативных заболеваний врачами первичного амбулаторного терапевтического звена. Врачи-терапевты поликлинических отделений г. Новосибирска и Новосибирской области имеют возможность регулярно получать информацию о заболеваниях системы крови от сотрудников кафедры терапии, гематологии и трансфузиологии ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России. Проводятся лекции, семинары, круглые столы с обсуждением клинических случаев и тактики ведения больных.
Распространенность хронического миелолейкоза, благодаря улучшению результатов терапии и повышению общей выживаемости пациентов, за последние 16 лет также неуклонно возрастает [14]. Если в 2004 г. распространенность ХМЛ в Новосибирской области составляла 1,88 случая на 100 тыс. населения, то через 10 лет в 2013 г. уже 4,44 случая на 100 тыс. населения и соответствовала данным Российского регистра ХМЛ (4,76 случая на 100 тыс. населения), а в 2020 г. распространенность составила 7,43 случая на 100 тыс. населения, что согласуется с международными данными [13]. Распространенность хронического миелолейкоза с 2004 г. по 2020 г. представлена на рис 1 .
Распространенность ХМЛ
(чел. на 100 тыс. населения в год, 2004-2020 гг.)
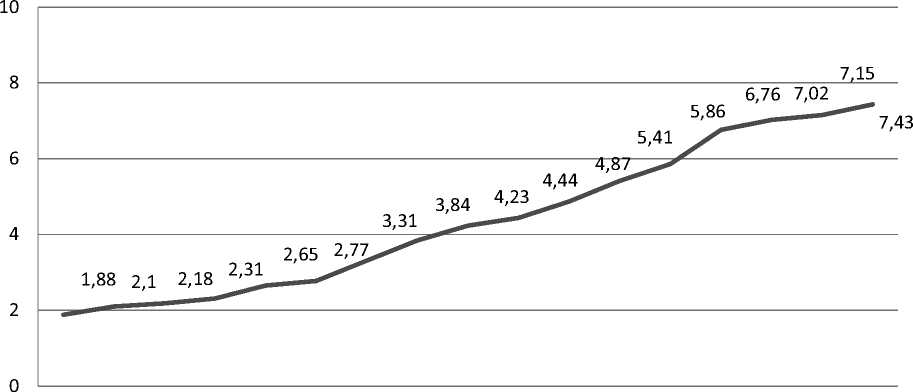
2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017 2018 2019 2020
Рисунок 1 . Распространенность случаев хронического миелолейкоза на 100 тыс. населения в г. Новосибирске и Новосибирской области в период с 2004 г. по 2020 г.
Больные на момент диагностики заболевания были отнесены к различным группам риска для определения дальнейшего прогноза и эффективности терапии. Использовались 2 прогностические шкалы: Sokal (прогноз прогрессии в ФА и БК); EUTOS (прогноз достижения ПЦО к 18 месяцам терапии иматинибом). Группа низкого риска по Sokal [15] диагностирована у 128 больных (51 %), промежуточного — у 78 (31,1 %), высокого — у 45 (17,9 %). По шкале EUTOS [16] группу низкого риска составили 182 пациентов (72,5 %), группу высокого риска — 69 человек (27,5 %).
Всем больным до начала лечения ИТК было проведено цитогенетическое исследование костного мозга для выявления Ph-хромосомы, по показаниям — FISH исследование, помогающее выявить транслокацию t(9; 22). Молекулярное исследование на наличие гена BCR/ ABL при диагностике заболевания до 2014 года проводилось по показаниям, с 2014 года — всем пациентам.
Иматиниб назначался в ХФ заболевания в дозе 400 мг в сутки пациентам из низкой группы риска, 600 мг в сутки пациентам из промежуточной и высокой группы риска (Sokal, EUTOS), в фазе акселерации — 600–800 мг в сутки, бластного криза — 800 мг в сутки.
При первичной или вторичной резистентности к иматинибу пациентам назначали ИТК
II поколения (нилотиниб 800 мг в сутки, даза-тиниб 100–140 мг в сутки, с 2020 г. — бозутиниб 500 мг в сутки).
Для оценки выживаемости использовался метод подсчета кумулятивной доли выживших (метод Каплан-Мейера), за критерий статистической значимости принималось p < 0,05. Статистическая обработка полученных данных проводилась на персональном компьютере типа IBM PC/AT с использованием пакета прикладных программ Statistica 6,0 и электронных таблиц Exсel 2007.
Результаты. Анализ результатов терапии проводился в группе пациентов, получающих терапию ИТК (в качестве терапии первой линии в России применяется иматиниб) более 12 месяцев на 01.07.2020 года (204 человека), 36 пациентов получает терапию менее 12 месяцев, эти пациенты в анализ не включались, 11 человек получают другие виды терапии.В результате проводимой таргетной терапии ИТК I поколения (иматинибом) полный клиникогематологический ответ (ПКО) достигнут у 184 человек (90,2 %). Частичный цитогенетический ответ (ЧЦО) (ph + < 35 %) — у 6 человек (3 % больных), полный цитогенетический ответ (ПЦО) (ph + < 0 %) — у 149 человек (73 %), таким образом,большой цитогенетический ответ (БЦО) получен у 155 человек (76 % пациентов). Большой молекулярный ответ (БМО, уровень гена BCR/ABL < 0,01 %, МО3,0) достигнут у 104 человек (51 % больных), при этом стабильный глубокий молекулярный ответ (отсутствие выявляемого гена BCR/ABL при чувствительности метода МО4,0 — МО5,0 в течение более 2 лет) — у 56 человек (27,4 %). Полученные результаты несколько ниже результатов исследования IRIS (5-летнее наблюдение) [17], а также аналогичных российских и зарубежных исследований, однако, статистически не отличаются. Так по данным Голенкова А. К. и соавт., 2012 [18], ПГО и БЦО получен у 93,2 % и 70,5 % пациентов соответственно. В исследовании Alsobhi E. et al., 2015 [19], ПГО, ПЦО и БМО достигнут у 93,1 %, 83,2 % и 61,4 % больных соответственно. В исследовании Nakamae H. et al., 2017 [20], ПЦО и БМО достигнут у 87 % и 74 % больных соответственно. Аналогичные результаты представлены и на педиатрической популяции в исследовании Smeding C. et al., 2019 [21], (ПГО у 100 % пациентов, ПЦО — у 92,8 % и БМО — у 64,3 %).
В нашем регионе не удалось получить ПЦО у 55 человек. Первичная резистентность к има- тинибу наблюдалась у 41 обследуемого (20,1 %), вторичная — у 14 (6,9 %) человек (9 больных утратили ПКГО и ПЦО, 5 — ПЦО и БМО). При анализе выписки льготных рецептов и индивидуального ежемесячного расхода иматиниба установлено,что у 15 больных с первичной резистентностью и у всех со вторичной резистентностью (всего 29 пациентов из 55–52,7 %) неэффективность терапии возникла в связи с нарушением пациентами режима приема препарата и уменьшением дозы,что может являться причиной незначительно меньших результатов терапии.
Мутации гена BCR/ABL выявлены у 4 обследованных: у одного — E255K, E275K и Y253H, у второго — M244T/731, у третьего — T315I, у четвертого — 250E и T315I. В результате первичной или вторичной резистентности к иматинибу, 18 человек из 55 были переведены на терапию ингибиторами тирозинкиназы 2 поколения (ИТК): 9 человек на терапию препаратом дазатиниб (по 100–140 мг в сутки), 7 больных — на терапию препаратом нилотиниб (800 мг в сутки) и 2 больных на препарат бо-зутиниб.На фоне проводимой терапии ИТК 2 поколения у 17 человек из 18 сохраняется полный клинико-гематологический ответ (94,4 %), у 12 — достигнут полный цитогенетический ответ (66,7 %) и у 10 — большой молекулярный ответ (55,5 %), из них одному пациенту в ФА после достижения БМО в октябре 2018 г. проведена аллогенная трансплантация стволовых кроветворных клеток.
В группе больных,получавших терапию ингибиторами тирозинкиназы, медиана общей выживаемости (ОВ) не достигнута, 5-летняя ОВ на ИТК I–II поколения составила 90 %, беcсобытийная выживаемость (БСВ) — 80,3 %, выживаемость без прогрессирования (ВБП) — 86,7 %, 10-летняя ОВ — 77 %, расчетная 15-летняя ОВ — 62 %. Полученные результаты соответствуют данным других авторов: Kantarjian H. M. (2012) [22], Alsobhi E. et al., 2015 [19].
Летальность пациентов за период с 2004 г. по 2020 г. составила 37 человек из 251 (14,7 %). У 20 пациентов из 37 (54 %) это было обусловлено постоянным нарушением больными рекомендаций врача и режима приема ИТК, вследствие чего развилась резистентность к терапии и прогрессирование основного заболевания.У 9 человек (24,3 % случаев) летальность была связана с имеющейся у пациента сопутствующей патологией при достижении полного цитогенетического и большого молекулярного ответа
(вторые опухоли — у трёх человек (солидные опухоли молочной железы, толстого кишечника, простаты), патология сердечно-сосудистой системы диагностирована у шести).Только в 21,6 % случаев (8 больных из 37), летальность была связана с первичной резистентностью к ИТК и прогрессированием ХМЛ.
Заключение. Полученные эпидемиологические данные свидетельствуют о неуклонном значительном повышении распространенности хронического миелолейкоза,что связано с увеличением продолжительности и улучшением качества жизни больных,с достижением длитель- ной стойкой цитогенетической и молекулярной ремиссии и максимального уровня минимальной резидуальной болезни (глубокого молекулярного ответа МО4,0–5,0). Регулярное наблюдение за эффективностью терапии необходимо осуществлять, согласно рекомендациям European Leukemia Net, 2013 г. [1]. Неудача терапии, прогрессирование в фазу акселерации и бластного криза связаны с первичной и вторичной резистентностью к ингибиторам тирозинкиназы, при этом в половине случаев причиной резистентности является плохая приверженность пациентов к проводимому лечению.
Список литературы Хронический миелолейкоз сегодня: 16 лет наблюдения
- Baccarani M., Deininger M. W., Rosti G. et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia // Blood. — 2013. — № 122. — P. 872–884
- Hughes T., Deininger M., Hochhaus A. et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results // Blood. — 2006. — Vol. 108, № 1. — P. 28–37.
- Туркина А. Г., Хорошко Н. Д. Практические рекомендации по лечению больных хроническим миелолейкозом // Москва. — 2008. — С. 3–6.
- Зарицкий А. Ю., Ломаиа Е. Г., Виноградова О. Ю. и др. Факторы прогноза при терапии иматиниба мезилатом у больных в хронической фазе Ph-позитивного хронического миелолейкоза: данные многоцентрового нерандомизированного исследования в России // Терапевтический архив. — 2007. — Т. 79, № 8. — С. 17–22.
- Apperley J. F.: Part I: Mechanisms of resistance to imatinib in chronic myeloid leukemia // Lancet Oncol. — 2007. — № 8. — P. 1018–1029.
- Apperley J. F.: Part II: Management of resistance to imatinib in chronic myeloid leukemia // Lancet Oncol. — 2007. — № 8. — P. 1116–1129.
- Hochhaus A., Baccarani M., Deininger M. et al. Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with resistance or intolerance to imatinib // Leukemia. — 2008. — № 22. — P. 1200–1206.
- Kantarjian H. M., Giles F., Gattermann N., et al. Nilotinib (AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome–positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance // Blood. — 2008. — № 110. — P. 3540–3546.
- Волкова М. А. Новые возможности в терапии хронического миелолейкоза: дазатиниб // Клиническая онкогематология. — 2008. — Т. 1, № 3. — С. 218–226.
- Куликов С. М., Виноградова О. Ю., Челышева Е. Ю. и др. Заболеваемость хроническим миелолейкозом в 6 регионах России по данным популяционного исследования 2009–2012 г. г. // Терапевтический архив. — 2014. — Т. 86, № 7. — С. 24–30.
- Лазарева О. В., Туркина А. Г., Челышева Е. Ю. и др. Клиническая и гематологическая характеристика больных хроническим миелолейкозом в современных условиях: результаты российской части международного многоцентрового проспективного популяционного исследования EUTOS Population-based CML Study // Клиническая онкогематология. — 2017. — Т. 10, № 1. — С. 65–74.
- Туркина А. Г., Голенков А. К., Напсо Л. И. и др. Российский регистр по лечению хронического миелоидного лейкоза в рутинной клинической практике: итоги многолетней работы // Эффективная фармакотерапия. — 2015. — № 10. — С. 10–15.
- Hoffmann V. S., Baccarani M., Hasford J. et al. The EUTOS population-based registry: incidence and clinical characteristics of 2904 CML patients in 20 European countries // Leukemia. — 2015. — Vol. 29, № 6. — P. 1336–1343.
- Hehlmann R. Innovation in hematology. Perspectives: CML 2016 // Haematologica. — 2016. — Vol. 101, № 6. — P. 657–659.
- Sokal J. E., Cox E. B., Baccarani M. et al. Prognostic discrimination in “good-risk” chronic granulocytic leukemia // Blood. — 1984. — № 63. — P. 789–799.
- Hasford J., Baccarani M, Hoffmann V. et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: the EUTOS score // Blood. — 2011. — Vol. 118, № 3. — P. 686–692.
- Gambacorti C., Talpaz M., Sawyers C. et al. Five-year follow-up results of a phase II trial in patients with late chronic phase chronic myeloid leukemia treated with Imatinib who are refractory/intolerant of interferon alfa // Blood. — 2005. — Vol. 106, № 317а. — Abstr. 1089.
- Голенков А. К., Высоцкая Л. Л., Трифонова Е. В. и др. Эффективность лечения больных хроническим миелолейкозом иматинибом в широкой клинической практике // Онкогематология. — 2012. — № 3. — С. 17–21.
- Alsobhi E., Abrar M. B., Abdelaal M. et al. Response to imatinib therapy in adult patients with chronic myeloid leukemia in Saudi population: a single-center study // Leuk. Lymphoma. — 2015. — Vol. 56, № 4. — P. 882–886.
- Nakamae H., Fujisawa S., Ogura M. et al. Dasatinib versus imatinib in Japanese patients with newly diagnosed chronic phase chronic myeloid leukemia: a subanalysis of the DASISION5-year fi nal report // Int J. Hematol. — 2017. — Vol. 105, № 6. — P. 792–804.
- Smeding C., Szydło A., Pieluszczak K. et al. Effi cacy and safety of imatinib in paediatric CML — a single centre study // In Vivo. — 2019. — № 33. — P. 869–875.
- Kantarjian H., O’Brien S., Garcia-Manero G. et al. Very long-term follow-up results of imatinib mesylate therapy in chronic phase chronic myeloid leukemia after failure of interferon alpha therapy // Cancer. — 2012. — Vol. 118, № 12. — P. 3116–3122.


