Идентификация алкилированных аддуктов глобина крысы методами масс-спектрометрии
Автор: Дубровский Ярослав Александрович, Подольская Е.П., Войтенко Н.Г., Краснов И.А., Гладилович В.Д., Бабаков В.Н., Гончаров Н.В., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
В данной работе была исследована возможность образования аддуктов глобина крысы с сернистым ипритом (HD) in vitro. В результате был обнаружен ряд триптических пептидов: EFTPCHDAQAAFQK (1444.62 Да), GTFAHLSELHCHDDK (1561.66 Да), IGGHGGEYGEHDEALQR (1676.78 Да), - модифицированных остатком HD по С126, С93 и E27 соответственно и относящихся к глобину крысы.
Гемоглобин, сернистый иприт, аддукты, масс-спектрометрия, малди
Короткий адрес: https://sciup.org/14264689
IDR: 14264689 | УДК: 621.384.668.8:
Текст научной статьи Идентификация алкилированных аддуктов глобина крысы методами масс-спектрометрии
В последние десятилетия масс-спектрометрия с мягкими методами ионизации является одним из наиболее интенсивно развивающихся методов анализа. Этот метод отличается высокой чувствительностью, что позволяет его использование во многих областях, касающихся биохимии и протеомики человека, в том числе и токсикологии [1]. Ряд токсикологических задач, в которых масс-спектрометрия может являться основным, или даже единственным, средством решения, весьма широк, и особое внимание уделяется такой значимой области, как поиск биомаркеров интоксикации [2].
Соответственно существует необходимость разработки нового чувствительного метода выявления биомаркеров интоксикации ОВ, не требующего трудоемкой пробоподготовки и позволяющего быстро и надежно фиксировать факт воздействия ОВ. К таким биомаркерам в первую очередь относятся белки и пептиды, входящие в состав крови, которые способны образовывать аддукты с ОВ.
В последнее время появляются работы, в которых проводится поиск аддуктов различными ОВ с белками, например фосфорорганическими соединениями с сывороточным альбумином человека и крысы, методами масс-спектрометрии. В частности, такие работы проводились в группе Оксаны Локридж (Eppley Institute and Department of Biochemistry and Molecular Biology, University of Nebraska Medical Center), в которых коммерческие препараты сывороточного альбумина человека обрабатывали ФОС [3, 4]. Было показано, что основными мишенями для присоединения остатка ФОС в сывороточном альбумине человека являются пять тирозинов в положениях Y138, Y148, Y401,
Y411, Y452, а также два серина S232 и S287. Аддукты ФОС с сывороточным альбумином человека являются стабильными в условиях in vitro в течение нескольких месяцев [5].
Выявление интоксикации такими соединениями, как сернистый иприт (по международной номенклатуре HD), в настоящее время ведется методами, предполагающими сложную многоэтапную пробоподготовку [6]. Известно, что методами MALDI-TOF и ESI-TOF могут быть обнаружены алкилированные триптические пептиды сывороточного альбумина, которые содержат ковалентную модификацию с остатком сернистого иприта [7, 8]. Исследование аддуктов сывороточного альбумина с HD представляется эффективным ввиду того, что альбумин является основным компонентом белкового пула плазмы и сыворотки крови человека. Концентрация сывороточного альбумина в плазме или сыворотке крови составляет от 40 до 50 мг/мл (600–770 мкМ). Остальные белки представлены в более низких концентрациях. Это позволяет обнаружить соединения HD—альбумин без отделения от остальных белков плазмы. Период полужизни этого белка составляет ~25 дней, что позволяет проводить ретроспективную диагностику в течение нескольких недель после воздействия ОВ [9]. Альбумин имеет сложную третичную структуру, т. к. помимо водородных связей в молекуле также присутствуют так называемые дисульфидные мосты. Поэтому при проведении ферментативного гидролиза стандартной является методика с восстановлением дисульфидных связей дититреитолом ДТТ и модифицирование цистеинов йодацетамидом. Такая методика не подходит для обнаружения аддуктов с HD, т. к. происходит замещение остатка последнего. В результате отказа от использования йодацетамида проведение трипсинолиза значительно затрудняется. Поэтому возникает необходимость в обнаружении других белков-маркеров, обладающих болеe простой структурой.
Соответственно большой интерес для обнаружения аддуктов с HD может вызывать гемоглобин. Химически гемоглобин относится к группе хромопротеидов. Молекула гемоглобина состоит из белковой части — глобина и простетической группы небелковой природы — гема, в состав которого входит железо. Гемоглобин — основной белок эритроцитов, который также способен образовывать ковалентные аддукты с сернистым ипритом, сохраняющиеся на протяжении всего времени жизни белка [10]. Концентрация гемоглобина в крови составляет от 140 до 160 мг/мл. Среднее время жизни эритроцитов в организме составляет 3–4 месяца, что может позволить проводить ретроспективную диагностику в течение нескольких месяцев [11, 12]. В отличие от альбумина в глобине нет дисульфидных связей, что значительно облегчает проведение ферментативного гидролиза в случае, когда невозможно использовать методику с модифицированием йодацетамидом.
Основной целью настоящей работы было исследование формирования аддуктов глобина крысы с сернистым ипритом в условиях in vitro и выявление остатков аминокислот глобина, по которым возможно присоединение сернистого иприта.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение глобина крысы : см. соответствующий раздел в [13].
Инкубирование выделенного глобина с HD: та же методика инкубирования относительно HD, что и описанная в [13] относительно ацетилсалициловой кислоты.
Получение триптических гидролизатов глобина крысы : см. соответствующий раздел в [13].
Масс-спектрометрический анализ методом MALDI-TOF : см. соответствующий раздел в [13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что сернистый иприт взаимодействует с сульфгидрильными группами аминокислот, входящих в состав белков. Наибольшей чувствительностью к HD обладает аминокислота цистеин. В результате взаимодействия HD с цистеином происходит алкилирование последнего, и после взаимодействия с белком остаток HD гидролизуется до остатка тиодигликоля (рис. 1). Можно было ожидать, что при добавлении HD к раствору глобина in vitro масса белка изменится соответственно количеству присоединенных остатков HD. Были получены спектры цельных белков в линейном режиме. На рис. 2 видно, что в пробе, инкубированной с ипритом, появляются сигналы, смещенные в область больших масс по сравнению с контролем примерно на 100 и 200 Да. Наблюдаемое смещение подтверждает возможность присоединения иприта к глобину.
Для поиска аминокислот, модифицированных остатком HD, был проведен триптический гидролиз без восстановления дисульфидных связей с последующим масс-спектрометрическим анализом. Идентификация, проведенная методом PMF (белковая база данных SwisProt, программный комплекс MASCOT, URL: matrixscience.com),
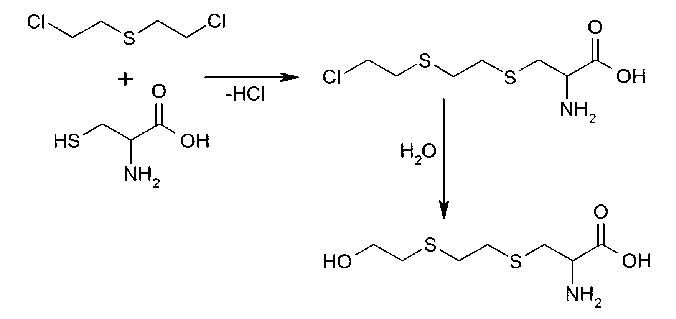
Рис. 1. Схема присоединения иприта к цистеину
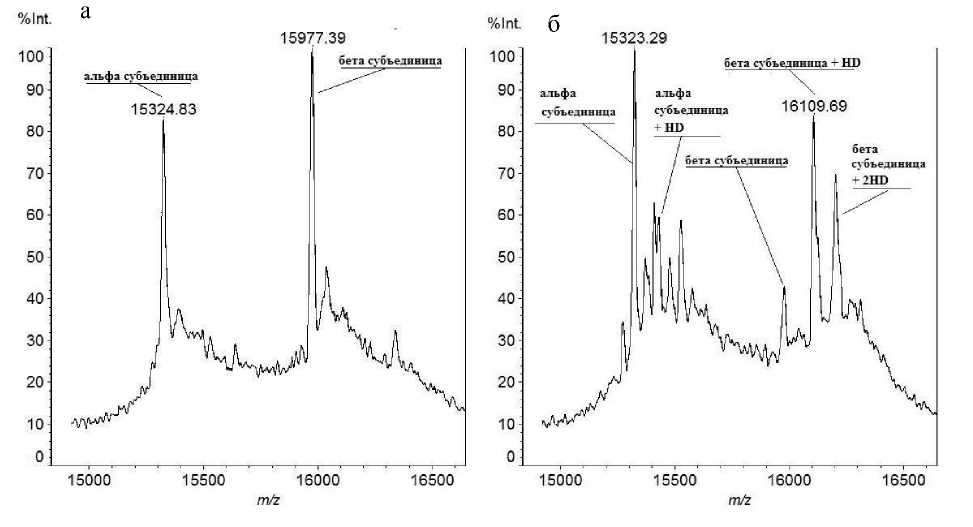
Рис. 2. Масс-спектры цельных альфа- и бета-субъединиц глобина крысы. а — контроль , б — белок, инкубированный с ипритом
Табл. 1. Результаты идентификации PMF
-
1. HBB2RAT Mass: 15972 Score: 82 Expect: 4.2e-05 Matches: 7
-
2. HBB1RAT Mass: 15969 Score: 66 Expect: 0.0021 Matches: 6
-
3. HBA RAT Mass: 15319 Score: 55 Expect: 0.026 Matches: 5 Hemoglobin subunit alpha-1/2 OS=Rattus norvegicus GN=Hbal PE=1 SV=3
Hemoglobin subunit beta-2 OS=Rattus norvegicus PE=1 SV=2
Hemoglobin subunit beta-1 OS=Rattus norvegicus GN=Hbb PE=1 SV=3
показала, что в образце содержится смесь альфа- и бета-субъединиц глобина (табл. 1), причем все мажорные сигналы в масс-спектре принадлежат именно триптическим пептидам указанных белков. Затем в масс-спектрах проводился поиск сигналов, которые по значению массы отличались бы от триптических пептидов на величину, соответствующую массе остатка HD (104.02 Да).
Так, был обнаружен ряд сигналов с MH+ 1444.62, 1561.66 и 1676.76 Да, которые могли принадлежать модифицированным пептидам, входящим в состав глобина, что продемонстрировано на рис. 3. Сигналы с MH+ 1444.62 и 1561.66 Да соответствуют пептидам EFTPCAQAAFQK (1340.63 Да) и GTFAHLSELHCDK (1457.68 Да) бета-субъединицы глобина крысы (рис. 3, а, б), а сигнал с MH+ 1676 Да — пептиду IGGHGGEYGEEALQR (1572.74 Да), принадлежащему альфа-субъединице глобина крысы (рис. 3, в), модифицированным одним остатком HD. Стоит отметить, что для одного из трех сигналов в масс-спектре наблюдается предшественник (рис. 3, в). Это позволяет сделать предположение, что при высоких концентрациях HD пептиды, сигналы которых представлены на рис. 3, а и б, модифицируются полностью.
Для каждого обнаруженного сигнала был проведен (МС-МС)-анализ, который показал, что сигналы действительно принадлежат триптическим пептидам глобина, модифицированным остатками HD. С помощью программы Sequence Viewer 2.0 (ИАП РАН) были размечены спектры фрагмент-ных ионов, что позволило точно установить ами- нокислотную последовательность проанализированных пептидов и доказать, что сигналы принадлежат пептидам, описанным выше. Кроме того, были установлены аминокислоты, содержащие модификацию остатком HD. Результаты представлены в табл. 2 и на рис. 4.
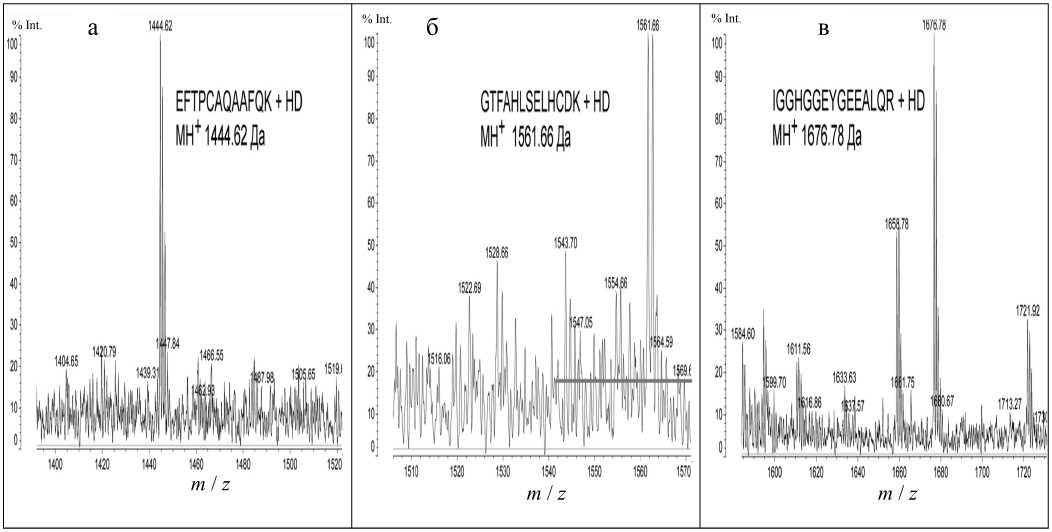
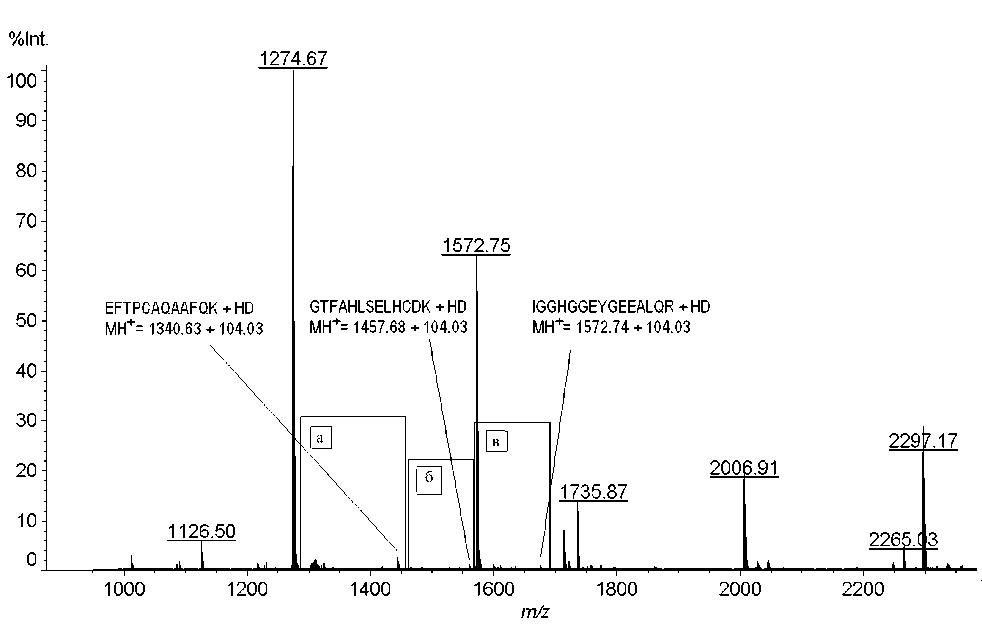
Рис. 3. Общий масс-спектр триптического гидролизата глобина крысы, инкубированного с ипритом. а — область 1340–1450 Да; б — область 1480–1570 Да; в — область 1570–1680 Да
Табл. 2. Выявленные пептиды, модифицированные ипритом
|
Пептид |
Масса MH+, Да |
Масса (МН+ + +HD), Да (теор.) |
Масса (МН+ + +HD), Да (экспер.) |
Место присоединения HD |
Субъединица |
|
EFTPCAQAAFQK |
1340.63 |
1444.65 |
1444.62 |
С126 |
Бета |
|
GTFAHLSELHCDK |
1457.68 |
1561.70 |
1561.66 |
С93 |
Бета |
|
IGGHGGEYGEEALQR |
1572.74 |
1676.76 |
1676.78 |
Е27 |
Альфа |
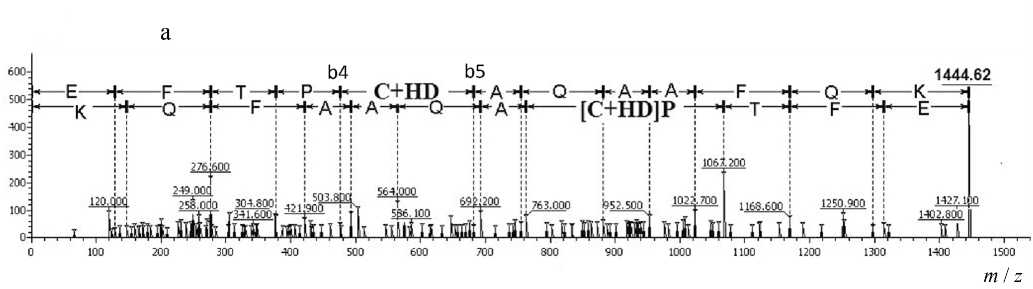
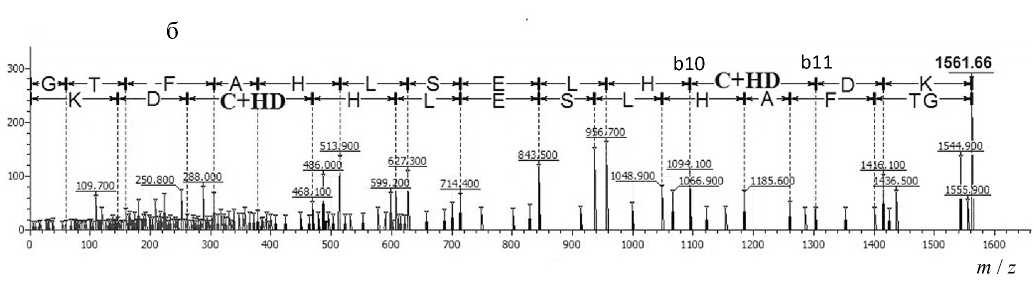
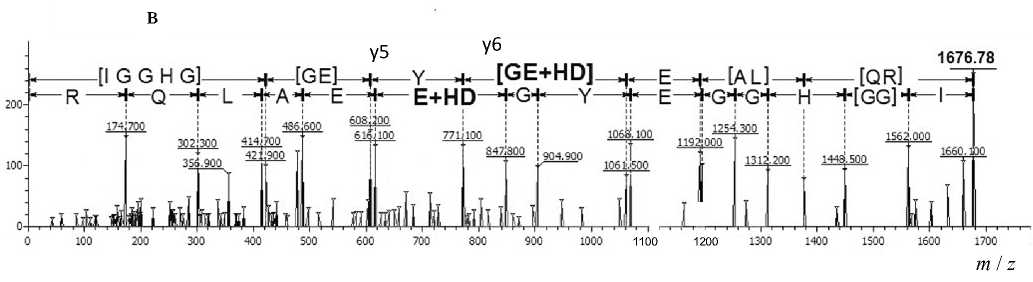
Рис. 4. МС-МС-спектры пептидов, модифицированных ипритом, представленные в программе Sequence Viewer 2.0.
а — пептида EFTPCAQAAFQK, входящего в состав субъединицы бета глобина крысы, модифицированного по С126; б — пептида GTFAHLSELHCDK, входящего в состав субъединицы бета глобина крысы, модифицированного по С93; в — пептида IGGHGGEYGEEALQR, входящего в состав субъединицы альфа глобина крысы, модифицированного по Е27
Как показано на рис. 4, а, разница масс между ионами b4 и b5 соответствует массе остатка цистеина, модифицированного остатком HD, входящего в состав пептида EFTPС HD AQAAFQK. Разница масс между ионами b10 и b11 на рис. 4, б, также соответствует массе остатка цистеина, несущего модификацию HD в пептиде GTFAHLSELHC HD DK.
В пептиде IGGHGGEYGEHDEALQR остаток HD присоединяется к глутаминовой кислоте (E), находящейся в положении 27, что видно из соответствующей разницы масс между сигналами фрагментных ионов y5 и y6.
Таким образом, в результате данной работы были получены новые данные о сайтах присоединения HD к глобину; было показано, что глобин крысы может нести модификации в субъединице альфа на глутаминовой кислоте в положении 27 и в субъединице бета на цистеинах в положениях 93 и 126.


