Идентификация генетических мутаций GSD и FXID у быков-производителей
Автор: Тюлькин С.В., Хатыпов И.И., Ахметов Т.М., Вафин Р.Р.
Статья в выпуске: 2 т.218, 2014 года.
Бесплатный доступ
В данной работе представлены результаты ДНК-анализа по идентификации генетических мутаций GSD и FXID у чистопородных и помесных по голштинской породе быков-производителей. У исследованных быков-производителей выявлена только мутация в гене, ответственном за FXID ; частота мутантного аллеля «-» FXID в гетерозиготном состоянии составила 0,007.
Бык-производитель, мутация, пцр
Короткий адрес: https://sciup.org/14288258
IDR: 14288258 | УДК: 636.2.034:636.2.082.
Текст научной статьи Идентификация генетических мутаций GSD и FXID у быков-производителей
На сегодняшний день достижения молекулярной биологии позволяют безошибочно определять генетические мутации у сельскохозяйственных животных. В связи с возможным распространением генетических мутаций и использованием ограниченного числа производителей оценка на носительство мутантных аллелей в определённых генах у сельскохозяйственных животных получает широкое распространение в племенных предприятиях, что способствует выявлению и исключению из воспроизводства мутантных аллелей [2].
К таким наследственным заболеваниям у крупного рогатого скота относят дефицит миофосфорилазы ( GSD ) и дефицит фактора XI ( FXID ).
Аутосомная рецессивная мутация GSD – гликогеновая болезнь V типа (glycogen storage disease V) характеризуется дефицитом в мышцах фосфорилазы [10, 4].
Данная наследственная болезнь вызывает непереносимость физических нагрузок, миалгии и периодические миоглобинурии [3].
Многолетний мониторинг различных популяций показал, что GSD -мутация приводит к увеличению эмбриональной смертности и снижению рождаемости у крупного рогатого скота [9, 4].
Аутосомная рецессивная мутация FXID (factor XI deficiency) у животных и человека связана с одним из главных белков, участвующих в свертывание крови. FXID был идентифицирован у нескольких видов млекопитающих, включая людей, собак и крупный рогатый скот [7, 8, 1].
FXID может привести к длительному кровотечению из пуповины, а в дальнейшем и к анемии. Также может наблюдаться длительное кровотечение после проведения обезроживания и кастрации животных. У отелившихся коров с FXID довольно часто молозиво с красноватым оттенком. Наличие крови в молоке привело к выявлению этого признака в британском молочном стаде [6]. Дополнительно FXID понижает воспроизводительные качества у животных; такие животные восприимчивы к болезням как пневмония, мастит и метрит. Поэтому в целом, присутствие этого генетического дефекта у крупного рогатого скота может привести к существенным экономическим потерям молочной промышленностью [5, 8].
Животные с дефицитом фактора XI в течение многих лет могут клинически не проявляться, притом, что среди таких животных достаточно высокий уровень заболеваемости и смертности [7].
В связи с этим, исследования, посвященные выявлению GSD- и FXID -мутаций, связанных с важными хозяйственно-полезными признаками у крупного рогатого скота являются актуальными.
Материал и методика исследований. Для проведения исследований было отобрано 70 чистопородных и помесных по голштинской породе быков-производителей в ГУП ГПП «Элита» Высокогорского района Республики Татарстан.
Для проведения ДНК-диагностики у крупного рогатого скота были отобраны пробы крови. Кровь, полученную у быков-производителей, вносили в пробирки с 100 мМ ЭДТА до конечной концентрации 10 мМ. ДНК из крови выделяли комбинированным щелочным способом.
Анализ GSD -мутации у крупного рогатого скота. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl 2 , 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, 0,5 мкМ праймера GSD-V-F: 5/-CCAGGAAGACCCTCATTCCA-3/, 0,5 мкМ праймера GSD-V-R: 5/-AGGGAAACACACACACAG-3/, отобранных E.C. Soethout et al. (2002) для амплификации специфичного ПЦР-продукта длиной 252 bp, 1 мкл пробы ДНК в следующем режиме:
×1: 94 0С – 4 мин; ×40: 94 0С – 5 сек, 67 0С – 5 сек, 72 0С – 5 сек;
×1: 72 0С – 5 мин; хранение: 4 0С.
Для идентификации GSD -мутации 20 мкл ПЦР пробы обрабатывали 10 ед. эндонуклеазы рестрикции ErhI в 1×буфере «W» фирмы СибЭнзим (Россия) при 37 0С течение ночи.
Анализ FXID -мутации у крупного рогатого скота. АС-ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, 0,5 мкМ праймера FXID-F: 5/-CCCACTGGCTAGGAATCGTT-3/, 0,5 мкМ праймера FXID-R: 5/-CAAGGCAATGTCATATCCAC-3/, отобранных B.M. Marron et al. (2004) для амплификации ПЦР-продукта FXID -мутации длиной 320 bp больных животных, ПЦР-фрагмента размером 244 bp здоровых животных, а также животных-носителей мутации FXID – 320/244 bp, 1 мкл пробы ДНК в следующем режиме:
×1: 94 0С – 4 мин; ×30: 94 0С – 5 сек, 65 0С – 5 сек, 72 0С – 5 сек;
×1: 72 0С – 5 мин; хранение: 4 0С.
Детекция. Для визуализации фрагментов ДНК пробы вносили в лунки 3% агарозного геля с содержанием этидия бромида (0,5 мкг/мл) и проводили горизонтальный электрофорез при 15 В/см в течение 40 мин в 1×ТВЕ буфере.
После электрофореза гель просматривали в УФ-трансиллюминаторе при длине волны 310 нм. Идентификацию генотипов определяли по количественным и качественным признакам ПЦР и ПЦР-ПДРФ.
Результаты собственных исследований. Для оценки качества работы ПЦР-ПДРФ-протокола по идентификации у крупного рогатого скота мутации GSD , были протестированы праймеры GSD-V-F: 5/-CCAGGAAGACCCTCA-TTCCA-3/ и GSD-V-R: 5/-AGGGAAACACACACACAG-3/, отобранные E.C. Soethout et al. (2002), в оптимизированной нами технике ПЦР-ПДРФ-анализа.
Праймеры GSD-V-F+GSD-V-R инициируют амплификацию специфичного ПЦР-продукта длиной 252 bp (рис. 1, трек 8). ErhI -ПДРФ-профиль здоровых животных = 252 bp (генотип GG ) (рис. 1, треки 1-7), больных GSD -синдромом животных = 133/119 bp (генотип gg ), а животных-носителей GSD- мутации = 252/133/119 bp (генотип Gg ).
Среди чистопородных и помесных по голштинской породе быков-производителей не выявлено ни одного животного с генотипами Gg и gg , связанных с GSD -мутацией.
Для оценки качества работы известного протокола генотипирования крупного рогатого скота по FXID -гену были протестированы праймеры FXID-F: 5/-CCCACTGGCTAGGAATCGTT-3/ и FXID-R: 5/-CAAGGCAATGT-CATATCCAC-3/, отобранные B.M. Marron et al. (2004), в оптимизированной нами технике АС-ПЦР.
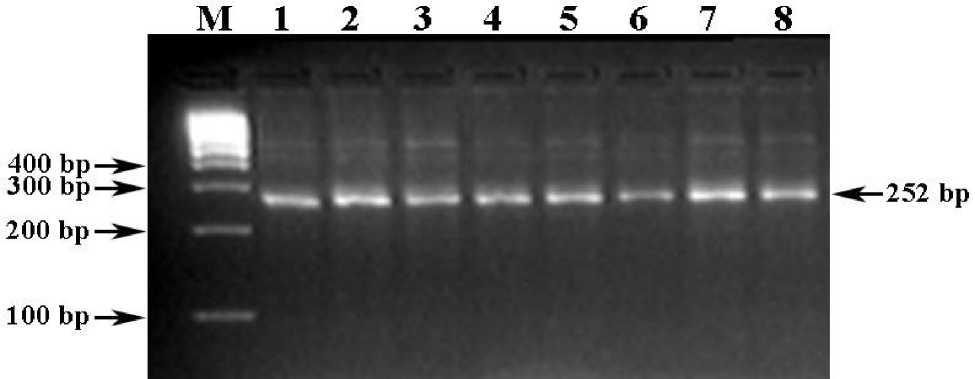
Рис. 1. Электрофореграмма результата ПЦР-ПДРФ-анализа GSD -мутации с праймерами GSD-V-F+GSD-V-R и эндонуклеазным расщеплением ErhI Обозначения: М) ДНК-маркеры 100 bp (СибЭнзим); 1-7) ErhI -ПДРФ-профиль генотипа GG (252 bp); 8) цельный ПЦР-продукт (252 bp).
М12345678
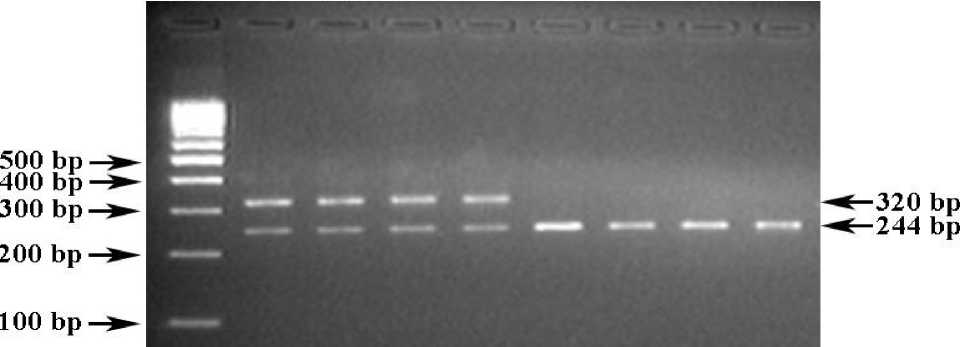
Рис. 2. Электрофореграмма результата АС-ПЦР-анализа FXID -мутации с праймерами FXID-F+FXID-R
Обозначения: М) ДНК-маркеры 100 bp (СибЭнзим); 1-4) генотип +/- (320/244 bp);
5-8) генотип +/+ (244 bp).
Праймеры FXID-F+FXID-R инициируют амплификацию как единичного ПЦР-продукта длиной 320 bp (больные животные, генотип -/-) или 244 bp (здоровые животные, генотип +/+, рис. 2, треки 5-8), так и одновременно двух ПЦР-фрагментов размерами 320/244 bp (животные-носители мутации, генотип +/-, рис. 2, треки 1-4).
Анализ чистопородных и помесных по голштинской породе быков-производителей по FXID -мутации показал, что из 70 быков-производителей 69 (98,6%) имели генотип +/+ (здоровые животные), 1 (1,4%) – генотип +/– (животных-носителей FXID -мутации), быков с генотипом –/– (больных животных) не обнаружено. При этом частота аллелей «+» и «–» соответственно составила 0,993 и 0,007.
Скрытое носительство FXID-мутации выявлено у быка- производителя, принадлежащего к линии Р.О.Р.Э. Элевейшн.
Выводы. 1. Для эффективного выявления GSD - и FXID -мутаций у крупного рогатого скота необходимо использовать методы ДНК-анализа; 2. При скрининге GSD -мутации среди чистопородных и помесных по голштинской породе быков-производителей не выявлено наличия у них данного наследственного заболевания; 3. Установлено наличие дефектного аллеля «–» FXID -мутации среди чистопородных и помесных по голштинской породе быков-производителей только у одного быка, при этом частота мутантного аллеля составила 0,007.
ЛИТЕРАТУРА: 1. Крюков, В.И. ДНК-диагностика в селекции крупного рогатого скота / В.И. Крюков, О.А. Шалимова, Н.Г. Друшляк, А.В. Пикунова // Вестник Орел ГАУ. – 2012 – № 1. – С. 62-68. 2. Четвертакова, Е.В. Генетические дефекты и аномалии в молочно-мясном и молочных породах скота Красноярского края / Е.В. Четвертакова // Вестник Красноярского ГАУ. – 2013. – № 5. – С. 167-172. 3. Angelos, S. Myophosphorylase deficiency associated with rhabdomyolysis and exercise intolerance in 6 related Charolais cattle / S. Angelos, [et al.] // Muscle Nerve. – 2010. – V. 18. – P. 736–740. 4. Citek, J. Monitoring of the genetic health of cattle in the Czech Republic / J. Citek, V. Rehout, J. Hajkova, J. Pavkova // Vet. Medicina. – 51. – 2006. – V. 6. – P. 333-339. 5. Ghanem, M.E. Factor XI mutation in a Holstein cow with repeat breeding in Japan / M.E. Ghanem, [et al.] // J. Vet. Med. Sci. – 2005. – V. 67. – P. 713-715. 6. Haton, B.M. Mutation that causes factor XI deficiency in Holstein cattle. [Электронный ресурс] / B.M. Haton, J.E. Beever, J.L. Robinson // Illini DairyNet. The Online Resource for the Dairy Industry. – 2000. – Режим доступа:
http://www.livestocktrail.uiuc.edu/dairynet/paperDisplay.cfm?ContentID=332]. 7. Marron, B.M. Identification of a mutation associated with factor XI deficiency in Holstein cattle / B.M. Marron [et al.] // Anim. Genet. – 2004. – V. 35. – P. 454-456. 8. Meydan, H. Screening for bovine leukocyte adhesion deficiency, deficiency of uridine monophosphate synthase, complex vertebral malformation, bovine citrullinaemia, and factor XI deficiency in Holstein cows reared in Turkey / H. Meydan, M.A. Yildiz, J.S. Agerholm // Acta Vet. Scanlinavica. – 2010. – V. 52:56. P. 1-8. 9. Molteni, L. Fertility of cryoconserved sperm in three bulls with different Robertsonian translocations / L. Molteni, [et al.] // Anim. Reproduction Sci., V. 86. – P. 1-36. 10. Soethout, E.C. A direct StyI polymerase chain reaction – restriction fragment length polymorphism (PCR-RFLP). Test for the myophosphorylase mutation in cattle / E.C. Soethout [et al.] // Journal of Veterinary Medicine Series A, Physiology Pathology Clinical Medicine. – 2002. – V. 49. – P. 289-290.
ИДЕНТИФИКАЦИЯ ГЕНЕТИЧЕСКИХ МУТАЦИЙ GSD И FXID У БЫКОВ-ПРОИЗВОДИТЕЛЕЙ
Тюлькин С.В., Хатыпов И.И., Ахметов Т.М., Вафин Р.Р. Резюме
В данной работе представлены результаты ДНК-анализа по идентификации генетических мутаций GSD и FXID у чистопородных и помесных по голштинской породе быков-производителей. У исследованных быков-производителей выявлена только мутация в гене, ответственном за FXID ; частота мутантного аллеля «–» FXID в гетерозиготном состоянии составила 0,007.
IDENTIFICATION OF GSD AND FXID GENETIC MUTATIONS IN STUD BULLS
Tjulkin S.V., Khatipov I.I., Ahmetov T.M., Vafin R.R.


