Идентификация порошкообразных продуктов методом газовой хроматографии с предварительной дериватизацией проб
Автор: Мухутдтинов Руслан Рамильевич, Пилипенко Татьяна Владимировна, Кручина-Богданов Игорь Вадимович
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.7, 2019 года.
Бесплатный доступ
В статье приведены результаты исследований, направленные на разработку метода идентификации сорта плодов унаби, из которого были изготовлены порошки. Решение этой проблемы актуально для всех порошков из сырья растительного происхождения, которые используют в качестве функциональных добавок. В работе были исследованы порошки из сорта, который условно назван «Краснодарский» по основному региону его выращивания и сорта «Китайский-2», который широко распространен в Крыму, Краснодарском крае и Ростовской области. Кроме того, были исследованы порошки из новых перспективных сортов селекции Никитского ботанического сада. При подготовке проб к газохроматографическому исследованию проводилась подготовка проб порошков методом дериватизации. На основании аналитического обзора методов дериватизации, используемых зарубежными и отечественными исследователями, был выбран метод силилирования. Силильные реагенты реагируют как со спиртами, так и с кислотами с образованием летучих легко отделяемых триметилсилиловых эфиров. Методика подготовки проб, использованная в работе, заключалась в следующем: экстракт образца 50 % этанолом высушивали в вакууме при 38 °С, после чего обрабатывали 1,1,1,3,3,3-гексаметилдисилазаном в смеси 1 мл пиридина и 1 мл ацетонитрила в присутствии трифторуксусной кислоты при 60 °С в течение 1 часа. Полученный раствор помещали в пробозадатчик хроматографа. Для идентификации состава компонентов порошков из плодов унаби предварительно были определены времена удерживания серии калибровочных анализов модельных смесей заданного состава. Расчет содержания компонентов по усредненной площади пиков проводили после калибровки без поправок на удельную чувствительность. Анализ данных хроматографического исследования показал, что изученный химический состав порошков из плодов унаби отличается не только количественно, но и качественно. Для идентификации сорта унаби, из которого был приготовлен порошок, можно предложить спектр отсутствующих и присутствующих на хроматограмме основных компонентов. На основании проведенных исследований была предложена матрица для идентификации порошков из плодов унаби по сортам на основании отсутствия отдельных компонентов их биохимического состава.
Порошки из плодов унаби, метод дериватизации проб, разработка метода идентификации сорта плодов унаби
Короткий адрес: https://sciup.org/147233294
IDR: 147233294 | УДК: 543.544:
Текст научной статьи Идентификация порошкообразных продуктов методом газовой хроматографии с предварительной дериватизацией проб
В настоящее время значительно изменилась стратегия, используемая при проведении исследований состава сырья растительного происхождения. В первую очередь это связано с его широким использованием для обогащения продуктов питания функциональными компонентами.
Для обеспечения возможности бесперебойного использования обогащающих добавок чаще всего последние подвергают сушке. Порошки из сырья растительного происхождения по органолептическим и физикохимическим показателям невозможно идентифицировать по сортовой, а иногда и по ви- довой принадлежности, что может приводить к их фальсификации. Более подробная оценка по биохимическому составу требует использования нескольких современных, требующих использования дорогостоящего оборудования, методов. Хорошие результаты по идентификации биологически активных веществ сублимированного порошка плодов аронии были получены при исследовании методом высокоэффективной жидкостной хроматографии [1].
При исследованиях функциональных свойств и химического состава порошков, полученных из целых плодов, а также из мякоти и косточек плодов унаби различными авторами был использован целый ряд сложных ана- литических методов - хроматографических, спектральных и др. [2-7].
Наиболее перспективным в настоящее время представляется использование газохроматографического метода, позволяющего в одном эксперименте количественно определять концентрации сотен компонентов за 1-2 часа. При исследовании растительных метаболитов принципиальное значение имеет подготовка пробы к анализу. При этом для ГХ, как правило, необходима дериватизация - получение летучих производных для аминокислот, углеводов и других компонентов с высокой температурой/теплотой испарения. Дери-ватизация блокирует высокополярные карбоксильные, гидроксильные, тио- и аминогруппы, замещая активный водород неполярными алкильными, ацильными, триалкилсилильными остатками, в результате чего разрушаются сильные межмолекулярные водородные связи и этим обеспечивается необходимая для ГХ летучесть получаемых продуктов при разумных температурах без термического разложения [8].
Реакции дериватизации, используемые для газовой хроматографии (ГХ), делятся на три основных типа реакций: алкилирование, ацилирование и силилирование. Реакции алкилирования могут быть использованы для получения простых эфиров, тиоэфиров и тиоэфиров, налкиламинов, амидов и сульфонамидов. Силилирование является наиболее распространенным методом дериватизации, так как легко испаряет образец и поэтому очень подходит для нелетучих образцов для анализа ГХ [9-13].
Изучены условия дериватизации широкого круга веществ, принадлежащих к классам аминокислот, жирных, дикарбоновых, гидрокси- и оксокислот, а также сахаров, спиртов и стеролов с использованием различных реагентов. Показаны преимущества и недостатки каждого способа получения летучих производных и установлены оптимальные условия деривати-зации и определения изученных веществ при их совместном присутствии [14-17].
С использованием метода дериватизации при подготовке проб были проведены исследования биохимического состава свежих, мороженных и подснежных ягод клюквы [18].
Основными биологически активными компонентами плодов унаби, определенными в исследованиях китайских ученых, являются витамин C, фенолы, флавоноиды, тритерпено- вые кислоты и полисахариды. В их состав входят галловая, хлорогеновая, кофейная кислоты; кумарин, (+)-катехин, п-кумаровая кислота, феруловая кислота, кверцетин, (-) -эпикатехин и рутин. Плоды унаби в своём составе содержат большое количество сахаров, в основном представленные сахарозой и глюкозой, в меньшей степени рамнозой и фруктозой, до 30 % от общего содержания. Такой широкий спектр компонентов в составе порошков плодов унаби позволяет предположить возможность использования метода де-риватизации при подготовке проб к анализу [19-21].
Цель исследования
Целью исследования в данной работе являлась разработка быстрого и достоверного метода идентификации порошков из плодов унаби по их сортовой принадлежности. Для этого в течение 2-х лет были проведены исследования по изучению методом газожидкостной хроматографии состава компонентов в пробах порошков из плодов унаби с предварительной дериватизацией образцов.
Объекты и методы исследования
В качестве объектов исследования были выбраны порошки из плодов унаби следующих сортов: «Радослав» (Л80-92); «Коктебель» (Л80.94); «Цукерковый» (Л-203); «Синит» (Л80.206); «Китайский-2» (Л253) и «Краснодарский» (JJ07) (распространенный в Краснодарском крае).
Использовали метод анализа: газовая хроматография (ГХ) триметилсилильных производных. Подготовка пробы: экстракт образца 50 % этанолом (1:15 вес/объем) высушивали в вакууме при 38 °С, после чего обрабатывали 1,1,1,3,3,3-гексаметилдисилазаном в смеси 1 мл пиридина и 1 мл ацетонитрила в присутствии трифторуксусной кислоты при 60 °С в течение 1 часа. Полученный раствор помещали в пробозадатчик хроматографа.
Условия анализа: колонка SBP5-25 (25 м х 0,25 мм х 0,2 мкм); газ-носитель N2, 20 см/с; программа температур - 1 мин при 70 °С, подъем 4°С/мин. до 320 °С, 5 мин при 320 °С; температура ввода пробы 240 °С, делитель потока 1:20, объем пробы 2 мкл; детектор пламенно-ионизационный, температура 325 °С, скорость подачи водорода - 40 мл/мин, азота -25 мл/мин, кислорода - 250 мл/мин.
Отнесение пиков осуществляли по временам удерживания после серии калибровочных анализов модельных смесей заданного состава. Расчет содержания компонентов по усредненной площади пиков проводили после калибровки без поправок на удельную чувствительность.
На основании этих исследований были получены времена удерживания основных элементов компонентного состава и индекс удерживания Ковача (RI), который характеризует удерживание вещества в колонке неподвижной фазой при данной температуре относительно двух н-алканов с числом углеродных атомов n и (n + 1), рассчитывается путем линейной интерполяции (табл. 1).
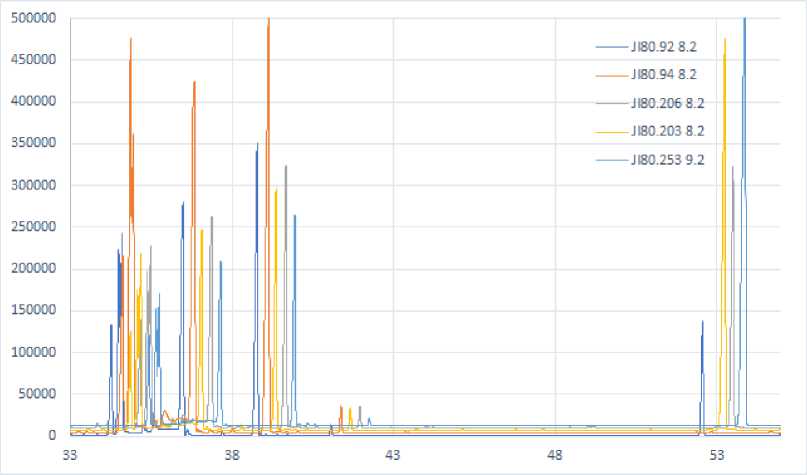
На рис. 1 представлены участки хроматограмм порошков из плодов унаби 5 сортов по участкам.
Анализ данных, приведенных в табл. 1, показал, что изученный химический состав порошков из плодов унаби отличается не только количественно, но и качественно, некоторые образцы отличались отсутствием некоторых компонентов химического состава. Для идентификации сорта унаби, из которого
а)
б)
Рис. 1. Выходные кривые ГХ образцов унаби: участок выхода органических кислот и аминокислот (а) и углеводов (б)
Таблица 1
Компонентный состав порошков из плодов унаби, мг/100 г*
|
Наименование компонента |
JI80.92 |
JI80.94 |
JI80.203 |
JI80.206 |
JI80.253 |
JJ07 |
Времена удерживания t, мин |
RI |
|
Свободные аминокислоты |
||||||||
|
Аланин |
12,4 |
37,2 |
20,9 |
65,9 |
45,6 |
2,4 |
10,7 |
1081 |
|
Лейцин |
6,8 |
17,6 |
5,6 |
10,3 |
8,8 |
4,3 |
16,4 |
1254 |
|
Треонин |
37,2 |
66,6 |
42,3 |
66,9 |
51,3 |
17,5 |
19,6 |
1353 |
|
Пролин |
10,9 |
27,4 |
75,5 |
151,6 |
204,4 |
55,2 |
20,1 |
1369 |
|
Лизин |
– |
– |
1,1 |
– |
1,9 |
– |
31,8 |
1730 |
|
Свободные жирные кислоты |
||||||||
|
Пальмитолеиновая |
5,6 |
— |
7,3 |
14,8 |
— |
10,2 |
38,4 |
2022 |
|
Пальмитиновая |
5,3 |
— |
6,2 |
10,8 |
26,9 |
5,2 |
38,9 |
2044 |
|
Линолевая |
3,4 |
5,2 |
2,3 |
3,0 |
4,4 |
1,4 |
42,6 |
2217 |
|
Олеиновая |
4,1 |
4,6 |
1,7 |
3,9 |
8,1 |
2,3 |
42,7 |
2221 |
|
α-Линоленовая |
2,6 |
3,3 |
2,3 |
4,9 |
13,1 |
4,3 |
42,8 |
2229 |
|
Стеариновая |
1,1 |
3,3 |
1,7 |
2,0 |
3,8 |
0,9 |
43,2 |
2248 |
|
Органические кислоты |
||||||||
|
Молочная |
5,3 |
2,6 |
– |
– |
– |
16,2 |
10,2 |
1066 |
|
Янтарная |
2,3 |
2,0 |
1,7 |
3,9 |
3,1 |
1,0 |
18,9 |
1333 |
|
α-Кетоглута-ровая |
16,5 |
14,4 |
41,1 |
43,8 |
31,3 |
3,3 |
19,4 |
1347 |
|
Фумаровая |
0,4 |
– |
0,6 |
1,0 |
– |
– |
20,0 |
1365 |
|
Глутаровая |
– |
– |
– |
1,0 |
– |
– |
21,9 |
1422 |
|
Яблочная |
74,7 |
94,0 |
117,2 |
272,2 |
330,6 |
107,2 |
24,7 |
1509 |
|
Винная |
– |
2,0 |
– |
2,5 |
– |
– |
29,4 |
1651 |
|
Аконитовая |
– |
– |
– |
– |
21,9 |
0,7 |
32,0 |
1735 |
|
Лимонная |
754,2 |
– |
857,1 |
1693,0 |
1532,5 |
1253,4 |
34,0 |
1852 |
|
Фенолы и фенольные кислоты |
||||||||
|
Резорцин |
0,4 |
– |
– |
– |
– |
0,2 |
21,1 |
1398 |
|
Салициловая |
– |
4,6 |
– |
– |
– |
– |
25,2 |
1525 |
|
4-оксибензойная |
1,9 |
10,4 |
3,4 |
6,4 |
6,3 |
2,2 |
28,5 |
1649 |
|
Ванильная |
– |
– |
– |
– |
– |
2,2 |
32,3 |
1790 |
|
2-кумаровая |
3,4 |
3,3 |
5,6 |
17,2 |
18,8 |
1,8 |
33,4 |
1827 |
|
Галловая |
9,0 |
25,5 |
25,9 |
8,9 |
3,8 |
4,9 |
37,2 |
1968 |
|
Феруловая |
– |
– |
– |
– |
– |
0,4 |
40,1 |
2101 |
|
Кофейная |
0,4 |
– |
– |
1,0 |
– |
– |
41,0 |
2150 |
|
Хлорогеновая |
6,0 |
– |
– |
– |
– |
– |
59,1 |
3176 |
|
Полиолы |
||||||||
|
Глицерин |
3,0 |
90,1 |
5,1 |
8,9 |
21,3 |
11,6 |
17,7 |
1294 |
|
Пентаэритрит |
44,7 |
45,7 |
38,9 |
90,1 |
56,9 |
67,6 |
25,4 |
1530 |
|
Арабит |
– |
– |
– |
– |
– |
0,2 |
31,5 |
1718 |
|
Маннит |
1,5 |
7,2 |
– |
4,4 |
– |
0,7 |
36,9 |
1955 |
|
Сорбит |
– |
3,9 |
– |
– |
– |
74,9 |
37,1 |
1964 |
|
Инозит |
45,4 |
197,1 |
139,8 |
227,4 |
108,1 |
46,9 |
40,5 |
2120 |
* Относительная погрешность ±10 %.
Окончание табл. 1
Анализ полученных результатов показал, что полного совпадения отсутствующих компонентов в исследованных порошках из разных сортов плодов унаби нет. Например, сорт «Радослав» не содержит лизин, глутаровую и винную кислоты, резорцин и 6-дезокси-глюкозу, 2-дезоксиглюкозу, мальтозу и цела-биозу. В то время как сорт «Китайский-2» не содержит аспаргин, пальмитолеиновую кислоту; глутаровую, винную, фумаровую и молочные кислоты; кофейную и хлорогеновую кислоты; сорбитол и маннитол, но содержит 6-дезоксиглюкозу. Только сорт «Краснодарский» содержит такие компоненты, как аргинин, лауриновую кислоту, арбидол, 6-дезоксиглюкозу, 2-дезоксиглюкозу, мальтозу и целабиозу.
Заключение
Использование при подготовке проб порошков из плодов унаби к газохроматографическому анализу метода силилирования обоснованно, так как силилирующие реагенты будут реагировать как со спиртами, так и с кислотами с образованием летучих триметилсилиловых эфиров.
Анализ данных компонентного состава показал, что порошки из плодов унаби различных сортов имеют весьма значительные различия в компонентном составе, что может быть использовано при проведении их идентификации.
На основании проведенных исследований был предложен метод идентификации порошков из плодов унаби на основании отсутствия или присутствия отдельных компонентов, наличие которых в компонентном составе порошков различных сортов является стабильным и не меняется даже при хранении.
Таблица 2
Матрица для идентификации порошков из плодов унаби по сортам на основании отсутствия отдельных компонентов их биохимического состава
|
Наименование |
Радослав |
Коктебель |
Цукерковый |
Синит |
Китайский 2 |
Краснодарский |
|
Свободные аминокислоты |
||||||
|
Лизин |
— |
— |
+ |
— |
+ |
— |
|
Свободные жирные кислоты |
||||||
|
Пальмитолеиновая |
+ |
— |
+ |
+ |
— |
+ |
|
Пальмитиновая |
+ |
— |
+ |
+ |
+ |
+ |
|
Органические кислоты |
||||||
|
Молочная |
+ |
+ |
— |
— |
— |
+ |
|
Фумаровая |
+ |
— |
+ |
+ |
— |
— |
|
Глутаровая |
— |
— |
— |
+ |
— |
— |
|
Винная |
— |
— |
— |
+ |
— |
— |
|
Аконитовая |
— |
— |
— |
— |
+ |
+ |
|
Лимонная |
+ |
— |
+ |
+ |
+ |
+ |
|
Фенолы и фенольные кислоты |
||||||
|
Резорцин |
+ |
— |
— |
— |
— |
+ |
|
Салициловая |
— |
+ |
— |
— |
— |
— |
|
Ванильная |
— |
— |
— |
— |
— |
+ |
|
Феруловая |
— |
— |
— |
— |
— |
+ |
|
Кофейная |
+ |
— |
— |
+ |
— |
— |
|
Хлорогеновая |
+ |
— |
— |
— |
— |
— |
|
Полиолы |
||||||
|
Арабит |
— |
— |
— |
— |
— |
+ |
|
Маннит |
+ |
+ |
— |
+ |
— |
+ |
|
Сорбит |
— |
+ |
— |
— |
— |
+ |
|
Углеводы |
||||||
|
6-Дезоксиглюкоза |
— |
— |
+ |
— |
+ |
+ |
|
Рафиноза |
+ |
+ |
+ |
+ |
+ |
— |
|
Флавоноиды |
||||||
|
Рутин |
— |
— |
+ |
— |
+ |
+ |
|
Кверцетин |
— |
— |
— |
— |
+ |
+ |
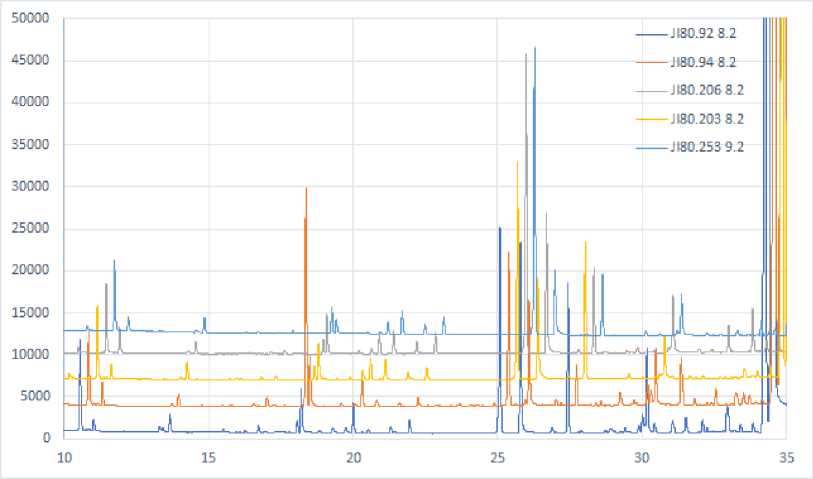
На рис. 2 приведены выходные кривые образцов унаби Краснодарского в увеличенном варианте, общий вид.
Список литературы Идентификация порошкообразных продуктов методом газовой хроматографии с предварительной дериватизацией проб
- Соколова, Л.В. Идентификация биологически активных веществ сублимированного порошка плодов аронии / Л.В. Соколова, В.П. Лозовый, Е.В. Лозовая // Евразийский союз ученых. - 2014. - № 5. - С. 132-136.
- Плоды унаби - функциональный пищевой ингредиент / Г.Н. Дубцова, И.У. Урузмаговна, И.В. Дедова, Е.И. Сажина // Пищевая промышленность. - 2015. - № 5. - С. 31-33.
- Исследование антиоксидантной активности свежих плодов унаби / Е.С. Романенко, Е.А. Сосюра, А.Ф. Нуднова, К.В. Парусова // Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. - 2016. - Т. 1, № 9. - С. 176-179.
- Химический состав продуктов переработки плодов унаби / Е.С. Панюшкина, В.А. Мельников, С.Ю. Хохлов, Е.А. Мелкозерова // Труды Кубанского государственного аграрного университета. - 2018. - № 73. - С. 154-157.
- Хохлов, С.Ю. Оценка показателей качества плодов зизифуса / С.Ю. Хохлов, Е.С. Панюшкина, В.А. Мельников // Бюллетень Государственного Никитского ботанического сада. - 2018. - № 128. - С. 133-136.
- Пономаренко, Л.В. Биологические особенности Китайского финика (унаби) в Западном Предкавказье / Л.В. Пономаренко // Научный журнал КубГАУ. - 2014. - № 103(09). - С. 1-14.
- Zhao, Z. Characterization of water soluble polysaccharides from organs of Chinese Jujube (Ziziphus jujuba Mill. cv. Dongzao) / Z. Zhao, M. Liu, P. Tu // European Food Research and Technology. - 2007. - V. 226(5). - P. 985-989.
- Пунегов, В.В. Повышение информативности метода ГЖХ/МС анализа путем дериватизации веществ с "подвижными" атомами водорода в их структуре / В.В. Пунегов, И.В. Груздев // Вестник института биологии Коми научного центра Уральского отделения РАН. - 2010. - № 10. - С. 28- 31.
- Danielson, Neil D. Chemical Reagents and Derivatization Procedures in Drug Analysis / Neil D. Danielson, Patricia A. Gallagher, James J. Bao // Encyclopedia of Analytical Chemistry. - John Wiley & Sons Ltd, Chichester, 2000. - Р. 7042-7076.
- Comparison of silylation and esterification/acylation procedures in GC-MS analysis of amino acids / T.G. Sobolevsky, I.R. Alexander, B. Miller et al. // Journal of Separation Science. - 2003. - V. 26, Is. 17. - Р. 1474-1478.
- Saraji, M. Single-drop micro extraction Followed by in-syringe derivatization and GC-MS detection for the determination of parabens in water and cosmetic products / M. Saraji, S. Mirmahdieh // Journal of Separation Science. - 2009. - V. 32. - P. 988-995.
- Derivatization and Gas chromatography - low-resolution Mass Spectrometry of Bisphenol A. / K. Szyrwińska, A. Kołodziejczak, I. Rykowska et al. // Acta Chromatographica. - 2007. - № 18.
- Chemical Derivatization for the Analysis of Drugs by GC-MS - A Conceptual Review / D.-L. Lin, S.-M. Wang, C.-H. Wu et al. // Journal of Food and Drug Analysis. - 2008. - V. 16, № 1. - P. 1-1.
- Груздев, И.В. Дериватизация при газохроматографическом определении следов фенолов и анилинов в водных средах / И.В. Груздев, И.Г. Зинкевич, Б.М. Кондратенок // Успехи химии. - 2015. - № 6. - C. 653-664.
- Cамохин, А.С. Улучшенный подход к определению степени дериватизации и его применение для изучения реакции силилирования ряда анаболических стероидов/ А.С. Самохин, Д.В. Перевозчикова, А.И. Ревельский // Масс-Спектрометрия. - 2013. - Т. 10, № 1. - С. 25-30.
- Корягина, Н.Л. Применение методов газовой хроматографии с иоанизационно-пламенным и масс-селективным детектированием для определения содержания фторацетата натрия в воде и биомедицинских пробах / Н.Л Корягина, Е.И. Совельева, Н.В. Гончаров и др. // Токсикологический вестник. - 2007. - № 1. - С. 29-36.
- Беризовская, Е.И. Методы обработки масс-спектрометрических данных при идентификации пептидов и белков / Е.И Березовская, А.А. Ихалайнен, А.М. Антохин // Вестник Московского университета. Серия 2: Химия. - 2015. - Т. 56, № 5. - С. 266-278.
- Лютикова, М.Н. Компонентный состав свежих, подмороженных и подснеженных ягод клюквы (Okycoccus Palustris) / М.Н. Лютикова, Ю.П. Туров // Химия растительного сырья. - 2011. - № 3. - С. 231-237.
- Textural Characteristic, Antioxidant Activity, Sugar, Organic Acid, and Phenolic Profiles of 10 Promising Jujube (Ziziphus jujube Mill.) Selections / Q.-H. Gao, C.-S. Wu, J.-G. et al. // Journal of Food Science. - 2012. - V. 77(11). - P. C1218-C1225.
- Comprehensive assessment of phenolic compounds and antioxidant performance in the developmental process of jujube (Ziziphus jujuba Mill.) / P. Xie, F. You, L. Huang, C. Zhang // Journal of Functional Foods. - 2017. - V. 36. - P. 233-242.
- Distribution of Free Amino Acids, Flavonoids, Total Phenolics, and Antioxidative Activities of Jujube (Ziziphus jujuba) Fruits and Seeds Harvested from Plants Grown in Korea / S.-H. Choi, J.-B. Ahn, N. Kozukue et al. // Journal of Agricultural and Food Chemistry. - 2011. - V. 59(12). - 6594-6604.


