Иксазомиб в лечении больных множественной миеломой
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Обзор литературы
Статья в выпуске: 3 т.19, 2023 года.
Бесплатный доступ
Иксазомиб – первый пероральный ингибитор протеасомы, одобренный в комбинации с леналидомидом-дексаметазоном (Ixa-Rd) для лечения пациентов с ММ, которые ранее получали ≥1 терапии. Одобрение было основано на результатах между- народного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования III фазы TOURMALINE-MM1. TOURMALINEMM1 продемонстрировало статистически значимое улучшение выживаемости без прогрессирования (PFS) при применении иксазомиба-Rd по сравнению с плацебо-Rd у пациентов с рецидивирующей/рефрактерной множественной миеломой (РРММ) (медиана PFS 20,6 и 14,7 месяцев) с ограниченной дополнительной токсичностью. В статье мы сообщаем об окончательном анализе общей выживаемости по результатам исследования TOURMALINE-MM1. Однако результаты клинических испытаний не всегда воплощаются в реальные результаты. Схема Ixa-Rd зарекомендовала себя как безопасный и эффективный вариант лечения для реальных пациентов с рецидивами/рефрактерными формами множественной миеломы. В любом случае, полная пероральная комбинированная терапия у пациентов с PPMM положила начало новой эре в лечении этого заболевания. Иксазомиб-Rd, полностью пероральный триплетный режим, является эффективным и хорошо переносимым вариантом лечения пациентов с РРММ. Иксазомиб успешно комбинируют с другими препаратами (циклофосфамид, даратумумаб, помалидомид). В исследовании I/II фазы изучалась безопасность и эффективность иксазомиба/помалидо- мида/дексаметазона у пациентов, которые ранее проходили многократную терапию, были невосприимчивы только к леналидомиду или к леналидомиду и бортезомибу, или леналидомиду, бортезомибу и карфилзомибу. Учитывая многообещающие предварительные показатели ответа, особенно у пациентов, невосприимчивых как к леналидомиду, так и к ингибиторам протеасомы, комиссия NCCN включила иксазомиб/помалидомид/дексаметазон в качестве варианта лечения для пациентов с рецидивирующей/рефрактерной ММ, которые ранее получали по крайней мере две линии терапии, включая иммуномодулирующие агенты и ингибиторы протеасомы, и продемонстрировали прогрессирование заболевания на или в течение 60 дней после завершения последней терапии. Режимы на основе иксазомиба являются эффективными и хорошо переносимыми вариантами лечения пациентов с множественной миеломой.
Иксазомиб, рецидивы/рефрактерные форма множественной миеломы, тройные комбинации, реальная клиническая практика, почечная недостаточность
Короткий адрес: https://sciup.org/170199865
IDR: 170199865
Текст научной статьи Иксазомиб в лечении больных множественной миеломой
в комбинации с леналидомидом и дексаметазоном для лечения пациентов c ММ, получивших, по крайней мере, одну линию предшествующей терапии [8]. Препарат также получил одобрение в Европейском Медицинском Агентстве (EMA), а в 2017 г. зарегистрирован в Российской Федерации.
Иксазомиб – это новый селективный обратимый ингибитор 20S протеасомы, подобно бортезоми-бу являющийся производным борной кислоты. В миеломных клетках иксазомиб ингибирует проте-асомную активность с концентрацией полумакси-мального ингибирования (IC50), равной 3,4 нмоль. Он преимущественно связывается и подавляет химотрипсиноподобную активность субъединицы β5 20S протеасомы. Иксазомиб быстро абсорбируется после приема через рот с достижением максимальной концентрации в плазме через 1 час. Препарат представляет собой стабильный эфир лимонной кислоты, который попадая в физиологическое состояние плазмы крови, быстро подвергается гидролизу с высвобождением активного соединения (MLN2238, иксазомиб). Абсолютная биодоступность одной принятой капсулы составляет 58%. Короткий период диссоциации иксазомиба от протеасомы (18 мин против 110 мин для бортезомиба) обеспечивает лучшее распределение в тканях.
Результаты объединенного популяционного анализа фармакокинетики больных раком (с гематологическими и негематологическими злокачественными новообразованиями), который включал четыре исследования фазы I иксазомиба, показали, что клиренс иксазомиба не изменяется у пациентов с легкой или умеренной почечной недостаточностью, определяемой как клиренс креатинина 30-89 мл/мин, подтверждая вывод о том, что у этих пациентов не требуется модификация дозы иксазомиба [9]. В исследовании Gupta N. et al. была поставлена цель охарактеризовать однократную фармакокинетику дозы иксазомиба у больных раком с нормальной функцией почек или тяжелой почечной недостаточностью, включая конечную стадию, требующую гемодиализа. После однократной дозы 3 мг иксазомиб быстро всасывался независимо от функционального состояния почек. Установлено, что системные воздействия иксазомиба были на 38% и 39% выше у пациентов с тяжелым нарушением функции почек или конечной стадией, требующей диализа. По заключению авторов, уменьшенная начальная доза 3 мг рекомендуется для пациентов с ММ с тяжелой стадией почечной недостаточности или диализ-зависимой почечной недостаточностью, поскольку ожидается, что доза 3 мг обеспечит системные воздействия иксазоми-ба у этих пациентов, которые сопоставимы с теми, которые наблюдаются у пациентов с нормальной функцией почек после получения рекомендуемой дозы, равной 4 мг [10,11]. Иксазомиб был примерно на 99% связан с белками плазмы при всех трех стадиях почечной недостаточности, что указывает на то, что функция почек не изменяет степень связывания белка плазмы для иксазомиба. У пациентов с терминальной стадией, нуждающихся в гемодиализе, концентрации иксазомиба были одинаковыми на протяжении всего сеанса гемодиализа, указывая на то, что иксазомиб не является диализуемым. Кроме того, клиренс гемодиализа иксазомиба составлял менее 2 мл/мин у всех пациентов с терминальной стадией, что менее 10% от общего системного клиренса (2 л/ч) [9], и предполагает, что гемодиализ оказывает незначительное влияние на клиренс иксазомиба. Эти результаты указывают на то, что иксазомиб можно принимать независимо от сроков диализа. Таким образом, основываясь на результатах фармакокинетики и безопасности, уменьшенная доза иксазомиба, равная 3 мг (на 1, 8 и 15 день 28-дневных циклов), рекомендуется для пациентов с ММ с тяжелой почечной недостаточностью или терминальной стадией, требующей гемодиализа. Стандартная доза 4 мг рекомендуется для пациентов с нормальной функцией почек, легкой или умеренной почечной недостаточностью. Пациентам, нуждающимся в гемодиализе, иксазомиб можно назначать независимо от сроков диализа.
В доклинических исследованиях иксазомиб продемонстрировал синергизм действия с леналидомидом. Было показано, что иксазомиб сохраняет противоопухолевую активность в клеточных линиях, полученных от пациентов с резистентностью к бортезомибу, леналидомиду и дексаметазону, и даже способен преодолевать резистентность к бор-тезомибу [12].
В клинических исследования ранних фаз (1/2) иксазомиб применялся перорально 1 раз в неделю в комбинации с леналидомидом и дексаметазоном у пациентов с множественной миеломой, ранее не получавших лечение, и продемонстрировал многообещающую эффективность (58% пациентов, результаты которых были включены в анализ, достигли полного либо очень хорошего частичного ответа) и управляемый профиль безопасности: зафиксировано лишь несколько случаев возникновения периферической нейропатии [13]. Результаты данного исследования показали возможность проведения долгосрочной терапии в течение более 4 лет
В исследование фазы I было включено 60 пациентов с рецидивами/рефрактерными формами множественной миеломы (медиана числа предшествующих линий терапии 4: бортезомиб, леналидомид, талидомид и карфилзомиб/маризомиб у 88%, 88%,
62% и 5% больных соответственно) [14]. Больным был назначен иксазомиб в дозах от 0,24 до 2,23 мг/ м2 (дни 1, 4, 8, 11; 21-дневные циклы). При дозе равной 2,23 мг/м2 наблюдалась токсичность, ограничивающая дальнейшее лечение (сыпь 3 ст. тяжести; тромбоцитопения 4 ст. тяжести – тромбоциты <10 х 109/л не менее 7 дней). Максимальная допустимая доза составила 2,0 мг/м2, которую получили 40 пациентов. Медиана числа циклов иксазомиба составила 4 (диапазон 1-39); 18% получили ≥12 циклов. В целом нежелательные явления (НЯ) выявлены у 88% больных: тошнота (42%), тромбоцитопения (42%), усталость (40%) и сыпь (40%); НЯ ≥3 степени, включали тромбоцитопению (37%) и нейтропению (17%); периферическая нейропатия 1/2 степени обнаружена у 12%. Два пациента умерли во время исследования (оба случая считаются несвязанными с лечением). Конечный период полураспада иксазо-миба составил от 3,3 до 7,4 дней. 15% больных достигли частичного ответа (ЧО) или лучше (стабилизация опухолевого процесса или выше – 76%).
Между тем, по результатам исследования Kumar S.K. et al. [15], дозолимитирующей токсичностью были гастроинтестинальные симптомы (тошнота, рвота и диарея) и кожная сыпь, а максимальной переносимой дозой при еженедельном приеме икса-зомиба – 2,97 мг/м2. Следует отметить, что и в это исследование вошли больные ММ, получившие 4 (медиана) линии предшествующей терапии, т.е. пациенты в обоих исследованиях были тяжело пред-леченные.
В исследовании II фазы эффективность и безопасность иксазомиба оценивалась в комбинации с дексаметазоном [16]. Использованы 2 дозовых режима иксазомиба (4 мг и 5,5 мг в неделю в течение 3 из 4 недель) с 40 мг в неделю дексаметазона. Среди 70 участников исследования по 35 пациентов получали ту или иную дозу иксазомиба. Медиана линий предшествующей терапии составила 4; ранее получали леналидомид 79%, помалидомид – 14% и бортезомиб – 30% больных. Рефрактерными к леналидомиду были 46% больных. В целом 30 (43%; 95%CI: 31-55) пациентов достигли подтвержденного частичного ответа или лучше, при этом 31% достигли ответа при дозе иксазомиба 4 мг и 54% – 5,5 мг. Медиана выживаемость без событий (EFS) для всей исследуемой популяции составила 8,4 мес. (95%CI: 4,5-12,8), причем различий по дозам не получено (рис. 1). Общая выживаемость за 1 год составила 96%. Выяснилось, что EFS составила 5,7 мес. (95%CI: 3,7-9,2) для пациентов, получавших ранее бортезомиб и 11,0 мес. (95% CI: 6,0-14,5) для бортезомиб-наивных пациентов. Неблагоприятные события 3 или 4 степени, наблюдались у 11 (32%) пациентов при дозе иксазомиба 4 мг и у 21 (60%) при дозе 5,5 мг. Снижение дозы иксазомиба было более частым в когорте пациентов с дозой 5,5 мг (16 против 10 случаев).
Таким образом, представленные здесь данные подтверждают активность режима иксазомиб+дексаметазон. Оценена эффективность 2 дозовых режимов иксазомиба – 4 мг и 5,5 мг в комбинации с дексаметазоном у пациентов с ММ с рецидивом/ рефрактерностью. По заключению авторов, такое сочетание препаратов обладает хорошей эффективностью, имеет более высокую частоту ответа при дозе 5,5 мг, но, в то же время, эта доза обладает большей токсичностью. Доза равная 4 мг является оптимальной.
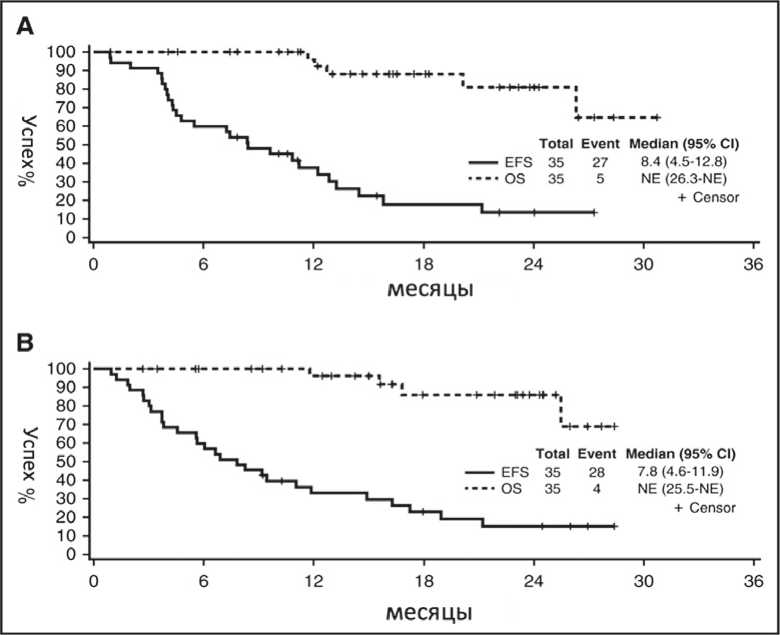
Рисунок 1. Бессобытийная и общая выживаемость при использовании двух дозовых режимов иксазомиба [16]
Примечание. А – доза иксазомиба 4 мг, В – доза иксазомиба 5,5 мг, EFS – бессобытийная выживаемость, OS – общая выживаемость, NE – не оценивалась
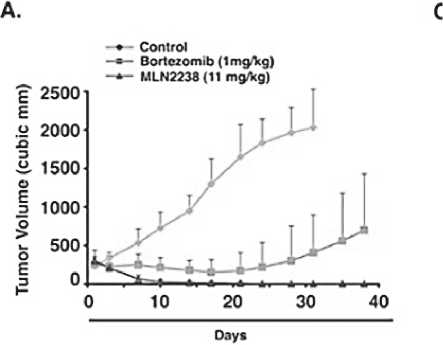
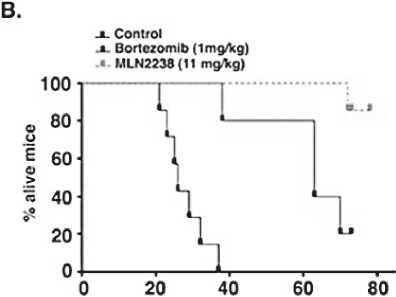
Несмотря на эффективность двухкомпонентных схем терапии, в том числе дуплета иксазомиб+дексаметазон, к настоящему времени терапевтические варианты при РРММ значительно расширились и привели к появлению тройных комбинаций на основе иксазомиба. В доклинических исследованиях иксазомиб продемонстрировал, во-первых, активное воздействие на жизнеспособность и апоптоз опухолевых клеток, а во-вторых – синергизм с леналидомидом. Так, в исследовании D. Chauhan et al. [17] установлено, что при воздействии на клетки множественной миеломы MLN2238 (биологически активная форма иксазомиба цитрата) преимущественно ингибирует химотрипсиноподобную активность протеасомы и индуцирует накопление убиквитинированных белков. Кроме того, подавляет рост и индуцирует апоптоз в ММ- клетках, устойчивых к бортезомибу, не влияя на жизнеспособность нормальных клеток. В мышиных моделях клетки MM (5 × 106 клеток/мышь) были имплантированы самкам мышей (в возрасте 6 недель). На 28-30 день мыши были рандомизированы на три группы – внутривенно MLN2238 (11 мг/ кг) или бортезомиб (1 мг/кг) по два раза в неделю в течение 3 недель; 3 группа была контрольной. Выявлено существенное уменьшение объёма опухоли у мышей после внутривенных введений MLN2238 по сравнению с бортезомибом и мышами контрольной группы. Значительно увеличилась (р <0,05) выживаемость мышей, получавших MLN2238 (11 мг/кг) или бортезомиб (1 мг/кг), по сравнению с контролем (рис. 2). И, наконец, при использовании MLN2238 с леналидомидом или дексаметазоном наблюдалось синергичное воздействие на опухолевые клетки.
Survival (Days)
Рисунок 2. MLN2238 подавляет рост трансплантированных ММ-клеток человека у мышей CB-17 SCID [17]
Примечание. А – среднее и стандартное отклонение объема опухоли (мм3) показано у мышей (верхняя кривая – контроль, средняя – бортезомиб, нижняя – MLN2238); В – выживаемость мышей (верхняя кривая – MLN2238, средняя – бортезомиб, нижняя – контроль). MLN2238 – биологически активная форма иксазомиба цитрата
В японском исследовании, с целью уменьшения НЯ при сохранении эффективности при рецидиви-рующей/рефрактерной ММ, использован иксазомиб в возрастающих дозах в комбинации с леналидомидом и дексаметазоном [18]. Иксазомиб вводили на 1, 8 и 15 день каждого 28-дневного цикла, леналидомид на 1-21 день и дексаметазон на 1, 8, 15 и 22-й день (Ixa-Rd). Пациенты были разделены на две группы в соответствии с начальной дозой ик-сазомиба: группа стандартной (фиксированной) дозы (4 мг) и группа эскалации дозы, т.е. начальная доза 2,3 мг иксазомиба с увеличением дозы до 4 мг в зависимости от переносимости. Установлено, что у больных при начальной дозе 2,3 мг иксазомиба с последующим ее увеличением было меньше перерывов в лечении из-за НЯ по сравнению с группой, получающей стандартную дозу 4 мг. Причем число пациентов, у которых наблюдалась непереносимость лекарственных препаратов до терапии Ixa-Rd, составило ноль в группе с начальной дозой 2,3 мг и 14% – в группе со стандартной дозой. Частота гематологических осложнений 3 или более степени и не- гематологических побочных эффектов 2 или более степени была ниже в группе с повышением дозы, чем в группе со стандартными дозами. Среднее время до прекращения лечения было значительно больше в группе с повышением дозы, чем в группе со стандартной дозой. Не было существенной разницы в частоте ответа между двумя группами и частоте контроля над опухолевым процессом (70% против 80%). Результаты этого исследования показывают, что глубокий ответ может быть получен путем соответствующего титрования дозы даже при начальной низкой дозе.
Доклинические данные и результаты исследований I и II фазы стали основой для проведения рандомизированного двойного слепого плацебо-контро-лируемого исследования III фазы TOURMALINE-MM1 [19].
Согласно рекомендациям международной рабочей группы, ключевым фактором, определяющим выбор второй линии терапии (первого рецидива), является устойчивость к леналидомиду. При этом следует обратить внимание еще на 2 фактора – высокий риск и ослабленный соматический статус пациента.
В нескольких рандомизированных исследованиях оценивалась эффективность Rd и Rd + третий препарат (один из ингибиторов протеасомы – кар-филзомиб или иксазомиб) или моноклональные антитела (элотузумаб или даратумумаб). Пациенты, рефрактерные к леналидомиду, были исключены из исследования. Убедительных данных об эффективности триплетов на основе леналидомида у пациентов с рефрактерностью к леналидомиду нет, поэтому такие схемы редко используются в данной ситуации.
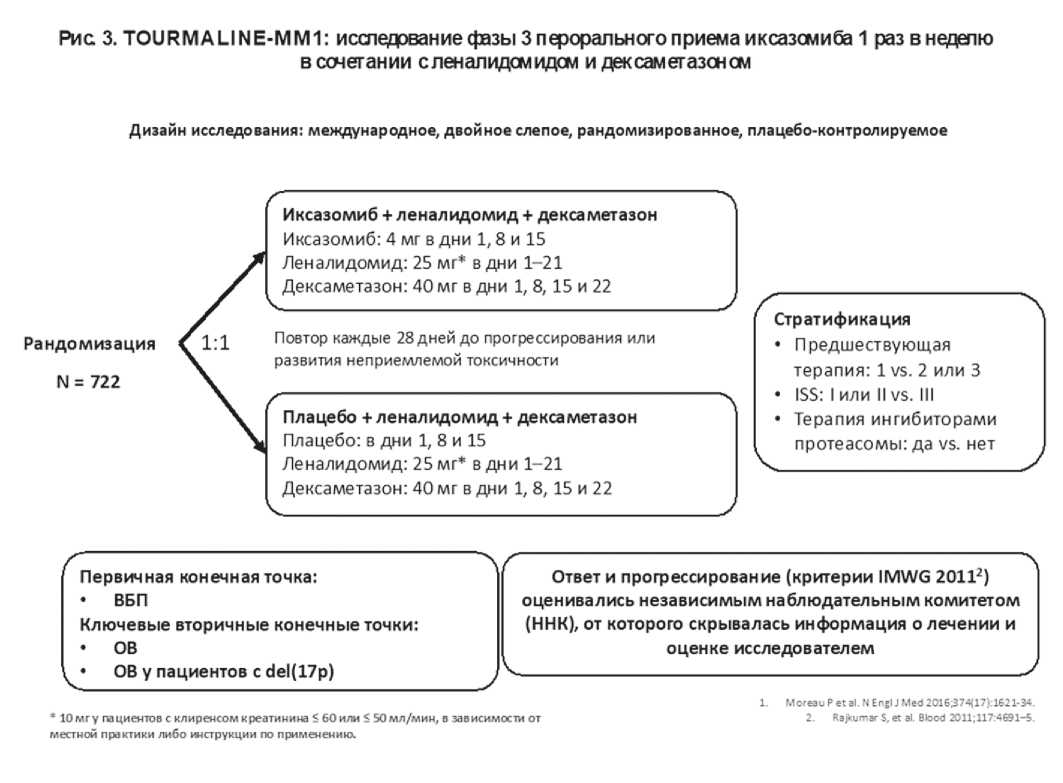
В исследовании TOURMALINE-MM1 участвовало 722 пациента с рецидивирующей/рефрактерной ММ [19]. Пациенты были рандомизированы в соотношении 1:1 для проведения 28-дневными циклами терапии Ixa-Rd: иксазомиб 4 мг перорально или плацебо в 1, 8 и 15 дни; кроме того, все пациенты по-
• 10мг у пациентов с клиренсом креатинина S 60 или < 50мл/мин, в зависимости от местной практики либо инструкции по применению.
Первичная конечная точка;
• ВВП
Ключевые вторичные конечные точки:
• ОВ
• ОВ у пациентов с del(17p)
Ответ и прогрессирование (критерии IMWG 20112) оценивались независимым наблюдательным комитетом (ННК), от которого скрывалась информация о лечении и оценке исследователем
Moreau Р et al. N Engl J Med 2016;374(17):1621-34.
2. Rajkumar S, et al. Blood 2011:117:4691-5.
Дизайн исследования: международное, двойное слепое, рандомизированное, плацебо-контролируемое
Рис 3. TOURMALINE-MM1: исследование фазы 3 перорального приема иксазомиба 1 раз в неделю в сочетании с леналидомидом и дексаметазоном
Рандомизация
N = 722
Повтор каждые 28 дней до прогрессирования или развития неприемлемой токсичности
Стратификация
• Предшествующая терапия: 1 vs. 2 или 3
• ISS: 1или II vs. Ill
• Терапия ингибиторами протеасомы: да vs. нет
Плацебо + леналидомид + дексаметазон
Плацебо: в дни 1, 8 и 15
Леналидомид: 25 мг* в дни 1-21
Дексаметазон: 40 мг в дни 1, 8,15 и 22
Иксазомиб + леналидомид + декса метазон
Иксазомиб: 4 мг в дни 1,8 и 15
Леналидомид: 25 мг* в дни 1-21
Дексаметазон: 40 мг в дни 1, 8,15 и 22
Примечание. ВБП – выживаемость без прогрессирования, ОВ – общая выживаемость, IMWG – международная рабочая группа по диагностике и лечению множественной миеломы
Коррекция доз в случае развития токсических эффектов допускалась и проводилась согласно инструкции по медицинскому применению каждого из исследуемых препаратов и соответствующим руководствам, что предусмотрено в протоколе иссле- лучали леналидомид внутрь в дозе 25 мг в 1-21 дни цикла (у пациентов с клиренсом креатинина ≤60 или ≤50 мл/мин/1,73 м2 в дозе 10 мг) и дексаметазон внутрь в дозе 40 мг в 1, 8, 15 и 22 дни (Ixa-Rd vs placebo-Rd). В исследование включались пациенты с 1-3 линиями предшествующего лечения (медиана 1 линия), которые, в ряде случаев, ранее получали бортезомиб (69%) и леналидомид (12%), но не были к ним рефрактерными. То есть пациенты, рефрактерные к леналидомиду или бортезомибу, были исключены из исследования. Поэтому стратификация осуществлялась в зависимости от количества ранее проводившихся линий терапии (1 vs 2 или 3), в зависимости от предшествующего применения ингибиторов протеасомы, а также стадии по ISS (I или II vs III). Терапия продолжалась до прогрессирования заболевания или развития непереносимости терапии (дизайн исследования представлен на рисунке 3.).
дования. Первичной конечной точкой являлась выживаемость без прогрессирования (PFS). Вторичные конечные точки включали общую выживаемость (OS) и OS больных с делецией 17p. Цитогенетические аномалии высокого риска были определены как del(17p), t(4;14) и t(14;16), с добавлением амплификации 1q21 для расширенной цитогенетики высокого риска. Выделено 2 группы больных в количестве 360 и 362, которые получали Ixa-Rd или placebo-Rd.
К моменту закрытия базы данных для проведения первого анализа (30 октября 2014 года) медиана продолжительности наблюдения составила 14,8 мес. для группы Ixa-Rd и 14,6 месяца для группы placebo-Rd. Общая частота ответов составила 78,3% в группе Ixa-Rd и 71,5% - в группе placebo-Rd (P = 0,04). Причем в группе Ixa-Rd бо́льшее количество пациентов имели очень хороший частичный ответ (охЧО) и полный ответ. Полный ответ (ПО) установлен у 12 и 7,0% пациентов соответственно. Ответы достигались быстро, были стойкими и становились более глубокими при увеличении длительности терапии. Медиана PFS (mPFS) составила 20,6 против 14,7 мес. (HR = 0,74; Р = 0,01), т.е. разница в пользу Ixa-Rd равнялась 5,9 мес. Коэффициент риска прогрессирования заболевания или смертельного исхода составил 0,74 (95%CI: 0,59 – 0,94; P = 0,01). Преимущество по PFS получено во всех выделенных подгруппах пациентов, включая высокий цитогенетический риск, низкий клиренс креатинина, стадию III по ISS и возраст >75 лет. Медиана выживаемости без прогрессирования в подгруппе пациентов с цитогенетическими аномалиями высокого риска (75 пациентов в группе иксазомиба и 62 пациента в группе плацебо) составила 21,4 месяца и 9,7 месяца соответственно (HR=0,54 в группе иксазомиба; 95%CI: 0,32-0,92; P = 0,02). У пациентов с del(17p) и с изолированной t(4;14) или t(14;16) наблюдалось сход- ное преимущество Ixa-Rd vs placebo-Rd в отношении PFS. Медиана выживаемости без прогрессирования в подгруппе пациентов с del(17p) (36 пациентов в группе иксазомиба и 33 пациента в группе плацебо) составила 21,4 месяца и 9,7 месяца соответственно (HR = 0,60; 95%CI: 0,29-1,24), в подгруппе пациентов с t(4;14) без del(17p) или t(14;16) без del(17p) (36 в группе иксазомиба и 25 в группе плацебо) составила 18,5 месяца и 12,0 мес. соответственно (HR = 0,65; 95%CI: 0,25-1,66). Медианы PFS в группах высокого и стандартного риска (21,4 мес. и 20,6 мес.) мало различались. Преимущество в отношении PFS в группе Ixa-Rd по сравнению с placebo-Rd было устойчивым при анализе различных пороговых значений для положительных результатов del(17p) и t(4;14).
Обращала на себя внимание высокая эффективность Ixa-Rd у пациентов с двумя или тремя линиями предшествующей терапии (HR = 0,88), в группе как наивных к бортезомибу или леналидомиду пациентов, так и получавших ранее эти препараты. Медиана общей выживаемости не была достигнута.
Однако она была достигнута при более длительном периоде наблюдения за больными, вошедшими в исследование TOURMALINE-MM1 [20]. В группах Ixa-Rd и placebo-Rd медиана наблюдения составила уже 85,0 и 85,1 мес. соответственно. Результаты оказались неожиданными – общая выживаемость существенно не различалась между группами (HR = 0,939; 95%CI: 0,784 до 1,125; P = 0,495). Медиана OS, как видно из рисунка 4А, составила 53,6 мес. (95%CI: 49,25 до 62,95) в группе Ixa-Rd и 51,6 мес. (95%CI: 44,78 до 59,14) в группе placebo-Rd. 7-летняя выживаемость достигла 30,8 и 29,8 мес. соответственно.
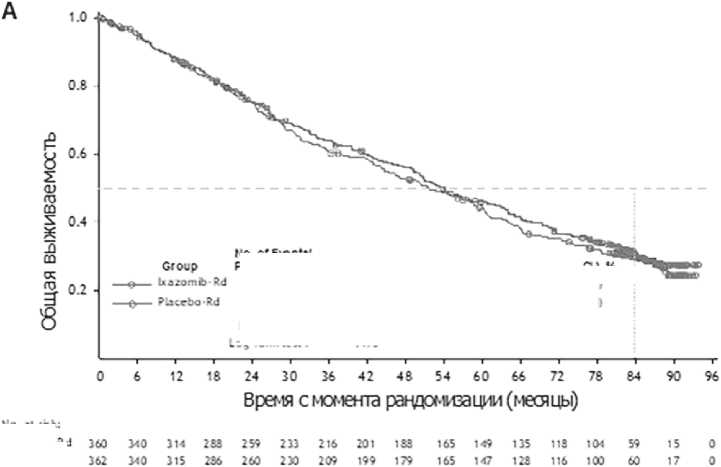
NO. OfE^nW Pibtnti
240/360
244/362
HR (951СЦ Log-rank teit P
Мфопп
S3.6 <49.25 to 62.95}
51.6<44,78 to 59.14)
7-у»lfOS р5% О).% 30.3 <25.8 ю 35.9) 29.8 <25.0 to 34.8)
0.939<0.734 to 1.12 5) .495
No. at гвк: lu^qmibRd Placebo Rd
|
В СоОьлня. пГ N 1*»дшна Еьг и844 МОСТ и (vtcm^) Virup)» Подгруппы ixizomiO-Rd P4atx>-Rd IxizomiO-Rd P4c»tx>-№ |
hr «% а |
|
Эсебогьмые See (N 722) 240/360 244/36 2 53.6 51.6 |—4 Зобаст, годи П65(п 3 44) 106/168 111/17 6 54.9 60.4 J—
> 65-75 |
-| 0.939 0.734 to 1.125 •---1 1.079 0.822 to 1.416 1 0 7 57 0 559 to 1 0 27 |
|
> 75 (n 108) 41/47 43/61 36 9 37 9 |_____ |
T -| 1 0 68 0 670 to 1 7 04 |
|
ISStHAHH lor IHn- 63 21 ЯМИ 207,316 y); 57.7 f—< Ш(п 90) 18/46 17/44 2 7 6 23 6 к Г |
-| 0.970 0.798 to 1.173 | 0 7 79 0 437 to 1 2 47 |
|
U* : сиене* ичесхем Highrak P*-* Standard (n 416) 12 3/200 140/216 54.9 5 5.8 h-* |
-{ 0.8 75 0.634 to 1.113 -| 0 862 0 //<1 to 1 124 |
|
npcAurcisyiMM , |n е5| 136,212 140,213 M.3 M.3 ]__ |
I—I 1.016 0.301 to 1.287 |
|
104/143 104/149 А л * |
-| 0 8 45 0 642 to 1 114 |
|
|IV»S) Предяг11бучмя1 , („ у7| 141,223 143,214 M.3 M.3 t— 2 n 71/98 73/1 13 j л л t * |
н 0.976 0.773IO1.2 33 | 0 9 26 0 669 to 1 2 82 |
|
Q3(n: 74) 28/39 23/35 5^3 47, ) » |
1 0 8 81 0 498 to 1 5 64 |
|
Ингибиторы Получали nporeucow in 71O1 А7/11П 75/1П9 i — |
I—{ 0.994 0.303 to 1.211 t П A17 Л W to 1 14? |
|
IMiD ttcparnn Получали(п: 397) 130/193 133/204 52.4 50.5 <-—♦ 110/167 106/158 1 56 6 1 i |
—I 0.913 0.717 to 1.176 |
|
Рецидив или Ре1*«ди» (п 557) 186/278 188/279 53.9 57.7 |— рефрдагерность Рефр*1грнасть (п 30) 21/40 30/0 51 0 32 0 | < |
H 1.000 0.815 to 1.2 2 7 —| 0 6 30 0 375 to 1 2 36 |
|
Рефрл ктерюст» дл m 1б5) 54/82 56/81 52 2 15 5 1 е |
| rt 07(1 П 511 to 1 5^3 —| 0 7 94 0 518 to 1 172 |
|
кгебойлинж п 1 - герл** Her In . 5571 IS6/278 IM,279 53.9 57.7 |— |
>—| 1.000 0.315 to 1.2 2 7 |
|
последней лииж Het (n 6Q5) 204/3 01 204/30 4 54.3 56.9 |— терапж |
H 1.003 0.824 to 1.2 21 I 0 781 0 461 to 1 3 22 |
|
к талидомиду No|n 6J3J 214/3 21 208/312 54.3 57.7 >— |
H 0.975 0.304 to 1.183 |
|
0.25 0.5 1 |
0 2.0 4.0 ----> Placebo-Rd |
Рисунок 4. Общая выживаемость больных ММ, получивших Ixa-Rd по сравнению с placebo-Rd [20] Примечание. А – медиана общей выживаемости (верхняя кривая Ixa-Rd, нижняя - placebo-Rd); В – общая выживаемость по результатам подгруппового анализа; IMID -терапия – терапия иммуномодуляторами
Триплет Ixa-Rd зарекомендовал себя у пациентов с изолированной del(17p) (HR = 0,916; 95%CI: 0,516 до 1,626) и у пациентов с высоким цитогенетическим риском (HR = 0,870; 95%CI: 0,580 до 1,305) (рис. 4B). Медиана OS в группе пациентов Ixa-Rd c высоким цитогенетическим риском была выше (на 16 мес.) по сравнению с placebo-Rd. При этом в группе Ixa-Rd медиана OS при высоком риске составила 46,9 мес., а при стандартном риске 56,9 мес. (HR = 870 и HR = 875). Таким образом, добавление иксазомиба к Rd приблизило, по сути, к преодолению высокого риска у пациентов с рецидивирующей ММ.
В других подгруппах пациентов схема Ixa-Rd по сравнению с placebo-Rd выявила положительную тенденцию при рефрактерности к любой (HR = 0,74; 95%CI: 0,538 до 1,172) или к последней (HR = 0,74; 95%CI: 0,460 до 1,198) линии лечения, или рефрак-терности к талидомиду (HR = 0,781; 95%CI: 0,461 до 1,322); стратифицированных как ISS III (HR = 0,779; 95%CI: 0,487 до 1,247); получивших 2-3 предшествующие линии терапии (HR = 0,845; 95%CI: 0,642 до 1,114).
Медиана времени до следующей терапии составила 29,7 (95% CI: 24,51-32,85) и 26,9 (95%CI: 22,34-30,52) мес. в группах Ixa-Rd и placebo-Rd соответственно. Последующие методы лечения включали даратумумаб (24,7% против 33,9%), бортезомиб (56,8% против 61,8%) и карфилзомиб (27,0% против 33,5%) в группах Ixa-Rd и placebo-Rd соответственно.
Медиана OS у пациентов, получивших последующую терапию, составила 54,3 (95%CI: 49,84 до 62,95) по сравнению с 58,1 (95%CI: 50,30 до 60,94) мес. в группах Ixa-Rd и placebo-Rd соответственно (HR = 0,985; 95%CI: от 0,800 до 1,213). В то же время у 212 пациентов, которые не получали последующую терапию, медиана OS составила 50,4 (95%CI: 26,97 до 76,94) по сравнению с 31,5 (95%CI: 22,70 до 50,17) мес. Среди пациентов, получавших даратумумаб в последующих линиях терапии, медиана общей выживаемости была 78,9 против 83,4 мес., а не получавших – 49,2 против 35,5 мес. соответственно. При назначении в последующих линиях терапии ингибиторов протеасомы – 52,0 vs 56,9 мес., а у остальных - 54,6 vs 48,8 мес. в группах Ixa-Rd и placebo-Rd соответственно.
Таким образом, по результатам ключевого глобального исследования III фазы TOURMALINE-MM1, применение триплета иксазомиб-Rd приводило к значительному улучшению выживаемости без прогрессирования (PFS) по сравнению с плацебо-Rd (медиана 20,6 против 14,7 месяцев), медиана OS не достигнута. Однако обращал на себя внимания окончательный анализ общей выживаемости (OS), который не выявил значительного улучшения при применении иксазомиба-Rd по сравнению с плацебо-Rd в общей популяции (медиана 53,6 против 51,6 месяцев; разница 2 мес.). Польза при расчете OS в общей популяции была сведена на нет применением последующей терапии (≥70% пациентов). Но ингибиторы протеасомы и даратумумаб назначались чаще в группе плацебо-Rd из-за более раннего прогрессирования заболевания по сравнению с группой иксазомиб-Rd. Кроме того, у пациентов, которые не получали последующую терапию, наблюдалась бо́льшая польза от применения иксазомиба-Rd, чем плацебо-Rd, по сравнению с теми, которые получали терапию.
Эффективность Ixa-Rd нашла подтверждение в исследовании, проведенном в Китае (отдельное региональное рандомизированное плацебо-кон-тролируемое исследование III фазы), в котором участвовали пациенты с рецидивами/рефрактерными формами ММ [21]. Пациенты были рандомизированы (1:1) для получения иксазомиба в дозе 4,0 мг или плацебо в дни 1, 8 и 15, плюс леналидомид в дозе 25 мг в дни 1-21 и дексаметазон в дозе 40 мг в дни 1, 8, 15 и 22-й в 28-дневных циклах. Рандомизация была стратифицирована в соответствии с количеством предшествующих линий терапии, стадией заболевания и предшествующим воздействием ингибиторами протеасом. В общей сложности были рандомизированы 115 китайских пациентов (57 пациентов получали иксазомиб, 58 – плацебо). При медиане наблюдения 7,4 мес. в группе больных иксазомиб-Rd и 6,9 мес. – в placebo-Rd наблюдалось 67 событий (подтвержденное прогрессирование или смерть): 30 (53%) и 37 (64%) больных в группе иксазомиб-Rd и placebo-Rd соответственно. Отмечено существенное (на 67%) улучшение PFS при применении иксазоми-ба в сравнении с плацебо (HR = 0,598, 95%CI: 0,367– 0,972; p = 0.035; медиана составила 6,7 мес. (95%CI: 4,63–9,53) против 4,0 мес. (95%CI: 2,79–5,52) (рис. 5.).
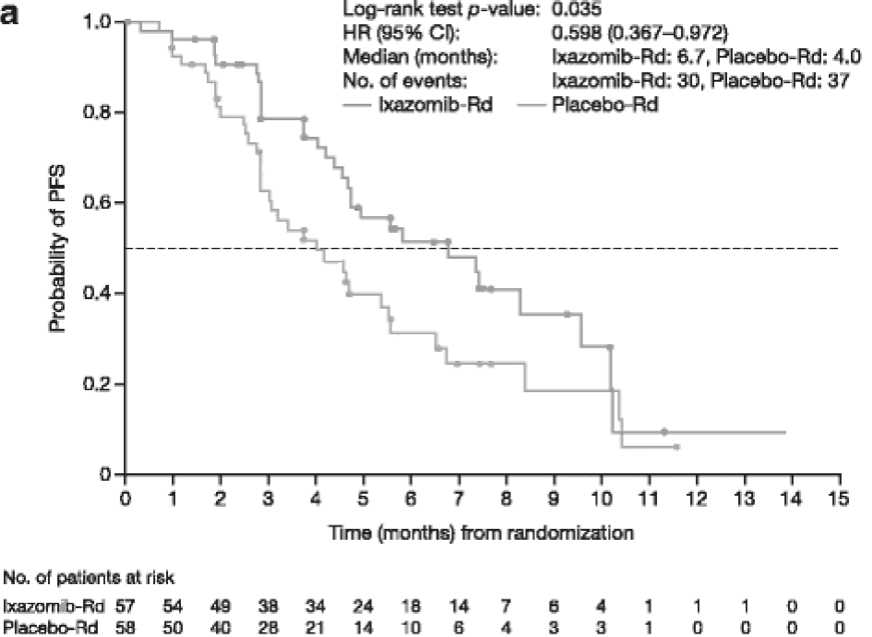
Рисунок 5. Кривые беспрогрессивной выживаемости по Kaplan–Meier при использовании Ixazomib-Rd (иксазомиб+леналидомид+дексаметазон) – верхняя кривая и Placebo-Rd (плацебо+леналидомид +дексаметазон) – нижняя кривая [21]
При медиане наблюдения 20,2 и 19,1 мес. в группах, получавших иксазомиб и плацебо, 21 (37%) и 36 (62%) пациентов умерли, главным образом, из-за прогрессии миеломы – 16/21 (76%) и 27/36 (75%) соответственно. В китайском исследовании медиана общей выживаемости достигнута и составила 25,8 мес. (95%CI: 19,42 – не поддается оценке) против 15,8 мес. (95%CI: 9,95–21,29) (рис. 6.). В этом исследовании отмечено улучшение OS на 139% при применении иксазомиба-Rd по сравнению с плацебо-Rd (р = 0,001), причем с 10-месячной разницей между группами. Преимущество OS при применении иксазомиба-Rd наблюдалось во всех анализируемых подгруппах, и не зависело от возраста, статуса заболевания, предшествующей терапии и функции почек [21].
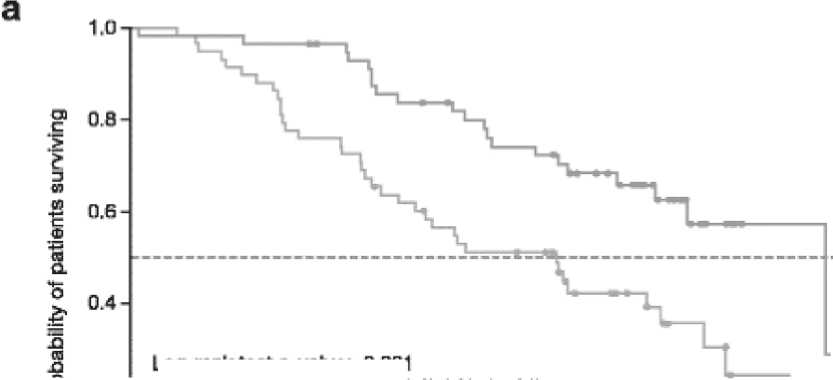
Log-rank test p-value: 0.001
P
0 2- HR (95% Cl):
Median (months): No. of events: — Ixazomib-Rd
0.419 (0.242-0.726}
Ixazomib-Rd; 25.8, Placebo-Rd; 15.8
Ixazomib-Rd: 21. Placebo-Rd: 36
— Placebo-Rd
T
Time (months) from randomization
No. of pet ents at r ek
Ixazorr b-Rd 57 56
Placebo-Rd 58 55
о о
Рисунок 6. Кривые общей выживаемости по Kaplan–Meier при использовании Ixazomib-Rd (иксазом иб+леналидомид+дексаметазон) – верхняя кривая и Placebo-Rd (плацебо+леналидомид+дексамета зон) – нижняя кривая (медиана наблюдения – 20,2 и 19,1 мес. соответственно) [21]
Таким образом, в этом исследовании убедительно продемонстрировано существенное улучшение как PFS, так и OS в группе пациентов, получавших лечение триплетом Ixa-Rd в сравнении с группой placebo-Rd. Однако, следует отметить, что китайское исследование было относительно короче, чем TOURMALINE-MM1. Кроме того, пациенты в Китае не имели доступа к широкому спектру новых одобренных или исследуемых препаратов, доступных в Северной Америке и Европе. Этот результат может свидетельствовать о том, что в странах с ограниченной доступностью новых терапевтических вариантов польза от применения иксазомиба-Rd более очевидна.
В последующем, в исследовании Spencer A. et al., был проведен анализ отдаленных результатов исследования TOURMALINE-MM1 [22]. Этот анализ включал пациентов из стран с развивающимися рынками (Австралия, Китай, Новая Зеландия, Россия, Сингапур, Южная Корея и Турция), где доступность новых терапевтических средств (даратумумаб, элоту-зумаб, изатуксимаб и CAR T-клеточная терапия) во время исследования TOURMALINE-ММ1 была ограниченной. На момент анализа медиана наблюдения составила 85,4 мес. в группе, получавшей иксазомиб, и 84,5 мес. в группе, получавшей плацебо, с 49 и 56 смертями соответственно. Примечательно, что по результатам этого анализа, медиана OS была на 32,6 мес. больше в группе Ixa-Rd (63,5 мес.) по сравнению с группой placebo-Rd (30,9 мес.; HR = 0,794; 95%CI: 0,530-1,189; p = 0,261). Вероятность выживания в разные периоды времени показала более низкую выживаемость в группе плацебо-Rd, которая варьировала от 36 до 60 мес.: 76,6% против 61,8% через 24 мес., 64,4% против 47,0% через 36 мес., 61,3% против 42,9% через 48 мес. и 52,0% против 38,7% через 60 мес. наблюдения за больными. Значительно более низкий риск смерти был выявлен при применении Ixa-Rd по сравнению с placebo-Rd в подгруппах пациентов с ≥2 предшествующими линиями терапии (HR = 0,465; 95%CI: 0,276-0,784), у больных, получавших ранее иммуномодуляторы (HR = 0,517; 95%CI: 0,283-0,944) и рефрактерных к талидомиду (HR = 0,3; 95%CI: 0,099-0,913). Кроме того, наблюдалась тенденция к снижению риска смерти при применении Ixa-Rd у пациентов старше 75 лет, с ≥3 предшествующими линиями терапии и рефрактерным заболеванием. Медиана PFS была существенно длительнее в группе Ixa-Rd, чем placebo-Rd (18,7 vs 10,2 мес., HR = 0,504; 95%CI: 0,300–0,847; p=0,008). В большинстве выделенных подгрупп реже наблюдалась прогрессия заболевания при терапии Ixa-Rd, включая пациентов ≤65 лет, стадии ISS I или II, среди пациентов стандартного цитогенетического риска, больных, получивших ≥2 предшествующих линий терапии, получавших ранее иммуномодуляторы и ингибиторы протеасомы. Все остальные подгруппы, за исключением пациентов, получивших 1 предшествующую линию терапию, продемонстрировали тенденцию к снижению риска прогрессирования заболевания в пользу группы Ixa-Rd.
Таким образом, анализ долгосрочных результатов после завершения исследования TOURMALINE-MM1, включивший пациентов из стран с формирующимся рынком, где новые агенты для ММ-терапии не были доступны на момент исследования, продемонстрировал тенденцию к существенному улучшению выживаемости при применении иксазомиба-Rd по сравнению с плацебо-Rd. Это, безусловно, контрастирует с основным исследованием, которое показало аналогичную медиану OS между двумя группами (53,6 против 51,6 мес.), которая, тем не менее, показывает клиническую пользу иксазомиба-Rd по сравнению с плацебо-Rd. Примечательно, что более низкая вероятность выживания в группе плацебо-Rd по сравнению с группой иксазомиб-Rd более отчетлива в период наблюдения от 36 до 60 мес., но эта тенденция не наблюдалась при длительных периодах наблюдения ≥72 мес. Изменчивость результатов может отражать, во-первых, небольшой размер выборки на ≥72 мес. и, во-вторых, потенциально увеличенный доступ к новым препаратам, которые к этому времени были уже одобрены.
Не вызывает сомнений польза от применения иксазомиба-Rd у пациентов с неблагоприятными прогностическими факторами, такими как ≥2 линий предшествующей терапии, предшествующее воздействие иммуномодуляторов и рефрактерность к терапии талидомидом. Кроме того, наблюдалась тенденция к снижению риска смерти при применении иксазомиба по сравнению с плацебо у пациентов старше 75 лет с ≥3 предшествующими линиями терапии и низким соматическим статусом.
В заключении авторы отмечают, что в целом, пациенты с РРММ продемонстрировали клинически значимое преимущество в выживаемости при применении иксазомиба-Rd по сравнению с плацебо-Rd, без каких-либо новых сигналов токсичности. Схема Ixa-Rd – первая полностью оральная тройная комбинация, обладающая благоприятным профилем безопасности, что позволяет проводить длительную терапию.
Оценка данных безопасности в исследовании TOURMALINE-MM1 проводилась как в рамках первого, так и в рамках последующих анализов. Профиль безопасности при более длительном периоде наблюдения соответствовал профилю безопасности во время первого, более короткого периода наблюдения. Пациенты получили 18 и 16 циклов (медиана) Ixa-Rd и placebo-Rd соответственно. Общие профили безопасности и показатели тяжелой токсичности (≥3 степени), имеющие клиническое значение, указывали на отсутствие новых или дополнительных проблем безопасности в течение 7-летнего периода наблюдения. Чаще в группе иксазомиба были лишь гастроинтестинальные жалобы (тошнота, рвота, диарея и запоры), кожная сыпь и тромбоцитопения. При объединенных периодах наблюдения частота развития тромбоцитопении ≥3 степени составила 21,3% против 10,3%, диареи –10,0% против 3,1%. Однако только эти два осложнения наблюдались с более высокой частотой в группе Ixa-Rd по сравнению с placebo-Rd. Досрочное прекращение терапии по причине НЯ наблюдалось у 17% больных, находящихся на терапии Ixa-Rd, т.е. 83% больных продолжали принимать стартовую дозировку иксазомиба до конца исследования. Показатель новых первичных злокачественных новообразований составил 10,3% и 11,9% в группах Ixa-Rd и placebo-Rd соответственно.
При оценке качества жизни с использованием вопросника EORTC или QoL отмечено улучшение. Не было никаких очевидных различий качества жизни между группами в ходе лечения (Ixa-Rd – 49,2% против placebo-Rd – 52,2%). При периоде наблюдения за больными 23 мес. профиль безопасности режима IxaRd по сравнению с плацебо-Rd был сходным у пациентов как с высоким, так и со стандартным риском.
Результаты ключевых клинических исследований, в первую очередь результаты международного, многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования III фазы TOURMALINE-MM1, привели к одобрению Европейскими и Российскими регулирующими органами триплета иксазомиб+леналидомид+дексаметазо ном (Ixa-Rd) для лечения пациентов с ММ, которые получили как минимум одну линию предшествующей терапии [6,23-25]. Комбинация рекомендована и экспертами NCCN [26] (таблица 1).
Среди других рекомендуемых схем эксперты NCCN обращают внимание на пероральный триплет иксазомиб/циклофосфамид/дексаметазон. Этот режим был оценен в исследовании фазы II, в котором участвовали больные ММ с рецидивами и рефрак-терностью к предшествующей терапии. Обнаружено, что он хорошо переносится. При медиане наблюдения в 15,2 месяца медиана PFS составила 14,2 месяца. Наилучшие результаты зарегистрированы у пациентов в возрасте 65 лет и старше по сравнению с пациентами моложе 65 лет (mPFS 18,7 мес. против 12,0 мес.; HR = 0,62, P = 0,14) [27]. Группа NCCN включила этот пероральный режим в список «других рекомендуемых схем» для рецидивирующих/рефрак-терных форм ММ (таблица 1).
Множественная миелома является второй по распространенности гематологической злокачественной опухолью, которая чаще встречается у пожилых людей, при этом почти треть пациентов в возрасте 75 лет на момент постановки диагноза. Между тем, большинство клинических исследований не вклю- чали значительную долю пожилых пациентов, чтобы обеспечить сравнение лечения по возрасту [28]. Пожилой возраст часто связан с недостаточностью функции органов, что может снизить переносимость и повлиять на результаты терапии. Однако строгие критерии приемлемости в рандомизированных клинических испытаниях (РКИ) исключали пациентов с сопутствующими заболеваниями, такими как нарушения функции почек и сердечно-сосудистые заболевания (ССЗ), ограничивая обобщаемость РКИ.
Таблица 1
Рекомендации по лечению рецидивов множественной миеломы (NCCN Clinical Practice Guidelines in Oncology. Multiple Myeloma.
Version 4.2022 — December 14, 2021)
|
ТЕРАПИЯ РАНЕЕ ЛЕЧЕННОЙ МНОЖЕСТВЕННОЙ МИЕЛОМЫ |
|
|
Примечание. Если схема, указанная для ранее леченной множественной миеломы, использовалась в качестве первичной индукционной терапии, а длительность ремиссии до рецидива >6 месяцев, тот же режим может быть повторен. |
|
|
Предпочтительные схемы для ранних рецидивов (1–3 предшествующих линий терапии) Порядок схем не свидетельствует о сравнительной эффективности |
|
|
|
|
Другие рекомендуемые схемы для ранних рецидивов (1-3 предыдущих терапии) |
|
(категория 1)
(категория 1) |
|
Примечание. IMiD – иммуномодулирующие агенты, PI – ингибиторы протеасомы
Почечная недостаточность является распространенным осложнением ММ и одним из неблагоприятных прогностических факторов, с частотой от 20% до 50% при постановке диагноза и до 60% при первом рецидиве [29]. Заболеваемость ССЗ выше у пациентов с ММ, при этом у 52%, ранее пролеченных пациентов, наблюдаются ССЗ по сравнению с 35% контролем (р <0,0001) [30].
Существует быстро растущее число активных вариантов лечения, доступных для лечения пациентов с рецидивирующей и/или рефрактерной множественной миеломой (РРММ) [6,31]. В то же время недопредставленность пожилых пациентов и пациентов с распространенными сопутствующими заболеваниями и пониженным соматическим статусом в
РКИ может привести к заметным пробелам в реальной клинической практике [7]. Например, данные, полученные из реестра CONNECT MM, свидетельствуют о том, что примерно 40% реальных пациентов не будут иметь права на участие в клинических испытаниях III фазы на основе стандартного вклю-чения/критерии исключения и, в частности, у этих пациентов была значительно более низкая 3-летняя выживаемость по сравнению с пациентами, которые имели бы право на участие в клинических испытаниях (63% против 70%, Р = 0,0392) [32]. Однако среди различных исследовательских групп растет понимание того, что «реальная» популяция пациентов с РРММ в сообществе не полностью представлена популяциями пациентов, включенных в клиниче- ские исследования III фазы [33,34], и что “разрыв” между клиническими испытаниями и условиями реального мира может привести к различным результатам [7]. Учитывая эти результаты, врачам важно понимать различия между популяциями, участвующими в реальных и клинических испытаниях, и то, как они могут повлиять на перевод результатов клинических испытаний в их реальную практику. Таким образом, данные о схемах лечения РРММ в реальных условиях представляют собой важный компонент принятия терапевтических решений в этой среде.
В этой связи мы хотим обратить внимание на результаты исследования Sokol J. et al., целью которого была оценка эффективности и безопасности триплета Iха-Rd (иксазомиб+леналидомид+декса метазон) в реальной клинической практике [35]. В этом когортном исследовании были проанализированы результаты 106 пациентов с рецидивом или рецидивами/рефрактерными формами ММ (РРММ), получавших Iха-Rd в сопоставлении с исследованием TOURMALINE-MM1. Медиана возраста больных на момент постановки диагноза составила 63 года (диапазон 44-78), из них 55 (52%) были мужчинами. Медиана числа линий предшествующей терапии составляла 2 (диапазон 1-7) по сравнению с 1 линией в исследовании TOURMALINE-MM1. Большинство пациентов в обеих исследуемых популяциях имели рецидив заболевания: 79,2% в настоящем исследовании и 77% в исследовании TOURMALINE-MM1. Основная часть пациентов имела высокий риск по шкале ISS: 18 (17%), 29 (27%) и 59 (56%) соответственно ISS I, ISS II и ISS III, в то время как в исследовании
TOURMALINE-MM1 число больных с ISS III равнялось 12%. По сравнению с исследованием TOURMALINE-MM1, пациенты в этом исследовании были моложе, с продвинутым стадиями по ISS, с большим числом линий предшествующей терапии, и почти все пациенты ранее получали бортезомиб. Медиана времени от момента постановки диагноза ММ была короче (28,5 против 44,2 месяца). Это означает, что пациенты в данном когортном исследовании находились на лечении иксазомибом более короткий промежуток времени.
Пациенты получали 28-дневные циклы терапии Iха-Rd: 4 мг перорального иксазомиба в день 1, 8 и 15-й; 25 мг леналидомида с 1 по 21-й дни цикла (10 мг для пациентов с креатинином ≤60 или ≤50 мл в минуту на 1,73 м2) и 40 мг дексаметазона в день 1, 8, 15, и 22-й. Оценка результатов терапии Iха-Rd проводилась в двух словацких университетских клиниках (Martin University Hospital and Kosice University Hospital). Iха-Rd был доступен для пациентов с РРММ в рамках программы раннего доступа с июня 2016 по декабрь 2018. Терапия продолжалась до прогрессирования заболевания или неприемлемой токсичности или смерти. Обязательной была тром-бопрофилактика.
После 29 месяцев наблюдения 41,5% пациентов все еще продолжали лечение, mPFS составила 43 мес. (95%CI: 35,6-50,4), то есть почти вдвое больше, чем в исследовании TOURMALINE-MM1 (рис 7.). Был проведен анализ PFS по подгруппам с учетом возраста, стадий ISS, числа линий предшествующей терапии, цитогенетического риска и ответа на лечение.
Результаты: ВБП в общей когорте пациентов
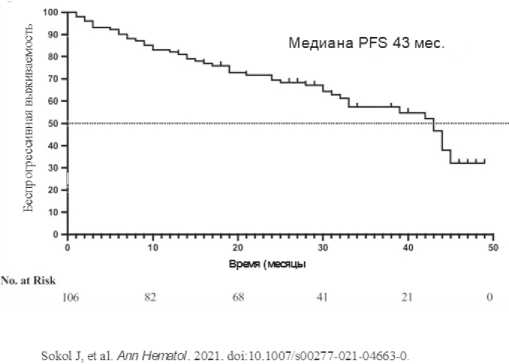
Рисунок 7. Выживаемость без прогрессии в группе больных, получавших Ixa-Rd в реальной клинической практике
Наблюдалась тенденция к более длительной выживаемости без прогрессии у молодых пациентов в сравнении с пожилыми пациентами (≤65 лет: 43 мес. [95%CI: 25,7/52,3] против >75 лет: 13 мес. [95%CI: 0,0– 28,0]); у пациентов с ISS I по сравнению с продвинутым стадиями ММ (ISS I: не достигнута против ISS II+ISS III:
42 мес. [95%CI: 34,0–50,0]); у пациентов, которые получили меньшее количество предшествующих линий терапии (1 линия: 45 мес. [95%CI: 43,4–46,6] против 2-х линий: 33 месяца [95%CI: 24,3–41,7]) (Рис. 8.); у пациентов с лучшим ответом на терапию (ПО: не достигнут против стабилизации: 7 мес. [95%CI: 25,0–41,3]).
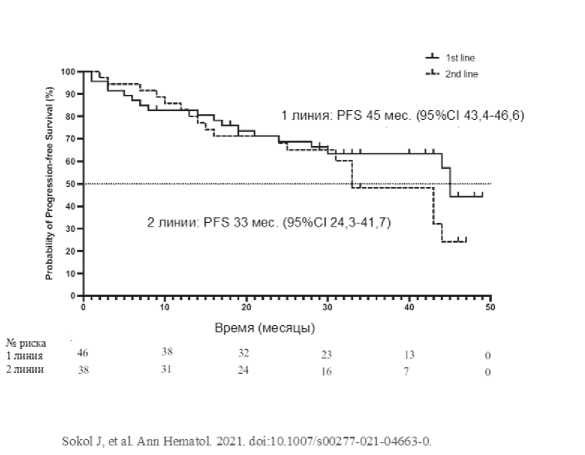
Рисунок 8. Беспрогрессивная выживаемость больных ММ в зависимости от количества линий предшествующей терапии
Обращала на себя внимание совершенно иная ситуация среди пациентов стандартного и высокого цитогенетического риска. Медиана PFS у пациентов со стандартным риском составила 39 месяцев (95% CI: 25,8–52,2), а при высоком риске 31 мес. (95%CI: 29,0–
33,0), то есть существенных различий не обнаружено (рис. 9.). Наблюдалась тенденция к росту PFS при стандартном риске по сравнению с группой высокого риска. Возможно, это было связано с отсутствием цитогенетического исследования более чем у половины пациентов.
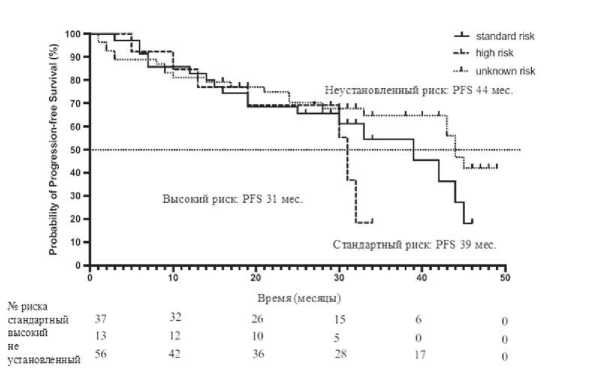
Рисунок 9. Беспрогессивная выживаемость больных ММ, получавших Ixa-Rd, в зависимости от группы цитогенетического риска
Примечание. standart risk – стандартный риск, high risk – высокий риск, unknown risk – не установленный риск
Медиана общей выживаемости не достигнута. Общий уровень ответа составил 74,5%. Полный ответ (ПО) получен у 8 (7,5%), охЧО – у 41 (38,7%),
ЧО – у 30 (28,3%), стабилизация – у 19 (18%) и прогрессия – у 8 (7,5%) пациентов. В целом достижение более глубокого ответа статистически значимо свя- зано с меньшим количеством предыдущих линий терапии. Пациенты, которые получили только одну предыдущую линию лечения, достигли 13,1% ПО, 80,4% охЧО или ЧО. У пациентов, получивших более двух линий предшествующей терапии, частота охЧО или ЧО составила 27,3%, стабилизация – 50% и прогрессия наблюдалась у 22,7% больных. Ни один из этих пациентов не достиг полного ответа.
По данным 29-месячного анализа, самими частыми негематологическими побочными эффектами были: слабость, инфекции, боли в костях, диарея, кожная сыпь и бессонница. Профили безопасности при 29-месячном анализе обобщены в таблице 2. Ме- диана циклов терапии составила 21 (диапазон 1-38). Режим исследования прекращен у 62 (58,5%) пациентов. Основными причинами стоп терапии были рецидив ММ (48,1%) и прогрессирование заболевания (7,5%) пациентов. Из-за НЯ лечение прекратили 3 (3%) пациента (1 диарея, 1 боль в костях, 1 сепсис и смерть). Достаточно часто наблюдалось снижение уровня гемоглобина, нейтрофилов и тромбоцитов. Нейтропения 3–5 степени зарегистрирована у 48,1%, анемия у 26,4%, тромбоцитопения у 19,8% больных. Однако чаще всего все НЯ можно было отнести к 1-2 ст. тяжести. Поэтому в целом терапия триплетом Ixa-Rd переносилась удовлетворительно.
Таблица 2
Нежелательные явления , наблюдаемые в группе больных , получавших Ixa-Rd
|
1–2 ст. |
3 ст. |
4 ст. |
5 ст. |
|
|
Гематологические, n (%) |
||||
|
Нейтропения |
45 (42,4) |
40 (37,7) |
11 (10,3) |
0 |
|
Анемия |
31 (29,2) |
28 (26,4) |
0 |
0 |
|
Тромбоцитопения |
25 (23,6) |
21 (19,8) |
0 |
0 |
|
Негематологические, n (%) |
||||
|
Слабость |
60 (56,6) |
4 (3,8) |
0 |
0 |
|
Инфекции |
52 (49,1) |
9 (8,5) |
0 |
1 (0,9) |
|
Боли в костях |
46 (43,4) |
1 (0,9) |
0 |
0 |
|
Диарея |
31 (29,4) |
4 (3,8) |
0 |
0 |
|
Кожная сыпь |
14 (13,2) |
0 |
0 |
0 |
|
Бессонница |
11 (10,4) |
0 |
0 |
0 |
|
Аритмия |
3 (2,8) |
0 |
0 |
0 |
|
Тромбоэмболии |
0 |
0 |
0 |
0 |
|
Периферическая нейропатия |
0 |
0 |
0 |
0 |
Таким образом, в представленном исследовании больные ММ с рецидивом/рефрактерностью получили Ixa-Rd в реальной клинической практике. Длительность наблюдения в этом исследовании была на 6 месяцев дольше, чем в TOURMALINE-MM1, изученная популяция моложе, но с более продвинутыми стадиями ММ по ISS, с большим числом линий предшествующей терапии, и почти все пациенты ранее получали бортезомиб в отличие от исследования TOURMALINE-MM1. Тем не менее, mPFS в два раза превысила таковую в исследовании TOURMALINE-MM1 (43,0 против 20,3 месяца). По мнению авторов, это улучшение было связано с тем, что пациенты, вошедшие в исследование, имели менее длительный анамнез, чем пациенты в TOURMALINE-MM1 (28,5 против 44,2 месяцев) [19]. Это предположение также подтверждается тем, что пациенты, получившие меньше линий лечения, достигали более глубоких ответов и более длительной беспрогрессивной выживаемости. По результатам исследований Sokol
J. et al. [35] не выявлено преимущества в отношении PFS у пациентов с цитогенетическими аномалиями высокого риска. Однако это преимущество наблюдалось в исследовании TOURMALINE-MM1. Вероятно, это связано с тем, что более половины пациентов, в реальной клинической практике, не имели генетического теста. Лечение по схеме Ixa-Rd переносилось вполне удовлетворительно. Выявленные нежелательные побочные явления были в основном 1-2 ст. тяжести. Режим Ixa-Rd оказался безопасным и эффективным вариантом лечения для реальных пациентов с РРММ.
Привлекает внимание еще одно исследование, целью которого была оценка результатов лечения пациентов с РРММ в реальных условиях комбинацией на основе иксазомиба [36]. Исследование также имело ретроспективный характер, проведено в период с июня 2013 года по июнь 2018 года и включало 8 медицинских центров Израиля. Данные для оценки результатов исследования были извле- чены из медицинских карт, собирались в электронную базу и размещались в Tel Aviv Sourasky Medical Center. В общей сложности в исследование вошло 78 больных ММ с рецидивом/рефрактерностью, разного пола. Медиана возраста составила 68 лет (диапазон 38-90), медиана наблюдения – 22 мес. (диапазон 1-39) и 55 мес. с момента постановки диагноза. Среди 60 пациентов с доступными результатами FISH, 48% имели критерии среднего/высокого риска; у 71% установлена ISS II/III. У 63% выявлены костные деструкции, у 50% – анемия, а 26% пациентов имели почечную недостаточность при постановке диагноза. Болезнь была оценена как «клинически агрессивная» у 37% пациентов. 64% больных получили иксазомиб во 2-й линии терапии, 19% – в 3-й линии. Большинство больных (87%) ранее получали бортезомиб-содержащие режимы терапии, 41% – иммуномодуляторы (леналидомид, талидомид). 35% больных рецидивировали после выполненной ранее аутологичной трансплантации гемопоэтических столовых клеток (АутоТГСК). У двадцати девяти (48% из 60 доступных) больных выявлены хромосомные аберрации высокого риска t(4:14), t(14:16), del17p) или (+1q21). Большинство пациентов (82%) получали иксазомиб в сочетании с леналидомидом и дексаметазоном. Лечение в целом было хорошо переносимым; 70% имели одно нежелательное событие, связанное с иксазо-мибом, а в 31% случаев зарегистрированы НЯ 3-4 ст. В основном наблюдалась гематологическая и желудочно-кишечная токсичность. Не было смертей, связанных с иксазомибом; у 31% больных потребовалось снижение дозы, а 11% прекратили прием препаратов из-за токсичности.
Частота общего ответа (ЧОО) на комбинацию на основе иксазомиба составила 88%, 45% пациентов достигли охЧО или выше. Не выявлено существенной разницы в зависимости от числа линий предшествующей терапии, при этом ЧОО при назначении иксазомиба во 2-й, 3-й и > 3-й линиях достигла 85%, 100% и 82% соответственно. Медиана PFS составила 77% и 47% за 12 и 24 мес. соответственно. Медиана OS не была достигнута и составила 91% и 80% на 12 и 24 мес. соответственно. Высокая активность ЛДГ, пожилой возраст (> 65 лет) и клиническая агрессивность болезни были связаны с худшим значением PFS, в то время как более глубокий ответ на икса-зомиб (≥ охЧО) и большая длительность ответа на бортезомиб в первой линии (≥ 24 мес.) были связаны с улучшением PFS. Не было обнаружено никакого влияния на PFS цитогенетического риска (FISH, ISS/ R-ISS), признаков CRAB синдрома, предшествующей противоопухолевой терапии и АутоТГСК.
Таким образом, это второе исследование режима Ixa-Rd, подтвердившее его эффективность и безопасность у пациентов с РРММ в реальных условиях, сопоставимых с данными клинических испытаний. Причем этот режим имел наиболее благоприятные результаты среди пациентов, которые оставались без прогрессирования более чем через 24 мес. после индукционной терапии бортезомибом.
Такие оптимистичные результаты подтверждаются сообщениями нескольких других исследовательских групп. Так, были представлены данные реальной клинической практики о результатах лечения 163 пациентов из 9 стран [37], основанных на данных из чешского регистра моноклональной гаммапатии и INSIGHT [38]. В анализ были включены больные ММ с медианой возраста 67 лет; 50% получили иксазомиб в качестве 3 линии терапии. ЧОО составила 74% для всей когорты и 91% для пациентов, получивших иксазомиб во 2-й линии (n = 82). Медиана PFS составила 20,9 мес. и не была достигнута для когорты второй линии. По сводным данным греческих, чешских и американских баз данных, mPFS пациентов, получавших Ixa-Rd, и с числом линий предшествующей терапии равным 1,5, составила 27,6 мес., ЧОО – 68,5% для всей когорты и 76,6% для пациентов 2-й линии [39]. Опубликованы также результаты реальной клинической практики венгерской когорты больных с рецидивом/рефрак-терными формами ММ, получавших Ixa-Rd [40]. Авторы сообщили о медиане PFS равной 11,4 мес. Выявлена тенденция к более длительному выживанию без прогрессирования у пациентов, получивших 1 линию терапии против >1, с одинаково хорошей эффективностью в группах стандартного и высокого риска.
Таким образом, полная пероральная комбинированная терапия по протоколу иксазомиб+ленал идомид+дексаметазон у пациентов с рецидивами/ рефрактерными формами ММ открыла новую эру в лечении этого заболевания.
Одним из ключевых вопросов является продолжительность терапии. Важность непрерывного лечения миеломы была обоснована обширным анализом из реальной клинической практики [41]. Во-первых, установлено, что прекращение приема терапии из-за НЯ коррелирует с повышенным риском смерти в течение первых 6 месяцев жизни; во-вторых, продолжительность терапии второй линии напрямую связана с улучшением 1-летней общей выживаемости пациентов с РРММ. Причем больше пользы от долгосрочной терапии второй линии получали как молодые, так и пожилые пациенты. Авторы указывают на необходимость устранения любых барьеров для удержания пациентов на терапии до прогрессирования заболевания. Режим на основе иксазомиба может быть особенно привлекательным для пациентов, которые остаются без прогрессирования в течение 24 мес. и более после индукционной терапии схемами, содержащими бортезомиб, и для тех, у кого более индолентный вариант заболевания. В этих условиях удобство полностью орального тройного режима Ixa-Rd при рецидивах ММ не вызывает сомнений.
Лечение пациентов с рецидивирующей и рефрактерной множественной миеломой, получивших две или более предшествующих линий терапии, становится особенно сложным. Нередко наблюдается развитие невосприимчивости, в первую очередь, к ингибитору протеасомы бортезомибу и иммуномодулирующему препарату леналидомиду. Леналидомид часто используются как в первой, так и во второй линии терапии и, нередко, с развитием к нему резистентности. Для таких пациентов рекомендуемыми чаще являются триплеты, включающие препараты с учетом чувствительности к леналидомиду [42]. Однако большинство препаратов, входящих в тройные комбинации, вводятся парентерально, увеличивая лечебную нагрузку на тяжело предле-ченных больных, нередко ослабленных, с низким соматическим статусом (ECOG ≥ 2), что требует их госпитализации [6,43]. Больные ММ – чаще пациенты пожилого возраста, имеющие различные сопутствующие заболевания [1,44], и, поскольку пациенты уже нескольких лет получают различные циклы терапии, они, вероятно, будут ослабленными и потенциально менее способными переносить токсичность лечения [45,46], особенно при применении триплетов [47,48]. Поэтому при лечении таких больных существует необходимость в более удобных схемах, содержащих оральные препараты, которые активны, имеют управляемую токсичность, не оказывают негативного влияния на качество жизни и, зачастую, не требуют госпитализации.
Как уже указывалось выше, в последние годы лечебные протоколы множественной миеломы пополнились новыми препаратами, что привело в целом к улучшению результатов. Иксазомиб в комбинации с леналидомидом и дексаметазоном прекрасно зарекомендовал себя при лечении первого рецидива, у больных, ранее получавших леналидомид или бортезомиб. Но пациенты, которые были рефрактерны к предшествующей терапии леналидомидом или ингибиторами протеасомы, были исключены из исследования TOURMALINE-MM1. Как оказалось, иммуномодулирующий препарат пома-лидомид является привлекательной альтернативой леналидомиду, обладая противоопухолевым и иммуностимулирующим эффектом при рецидивах/ рефрактерности [42], в том числе у пациентов, рефрактерных к леналидомиду, что было продемонстрировано в исследовании MM-003 [49]. В этом исследовании, у больных различного возраста с рецидивом и рефрактерностью к предшествующей терапии (>2 линий), в том числе к бортезомибу и/ или леналидомиду, сопоставлена эффективность двух режимов – помалидомид+низкие дозы дексаметазона (Pom+LoDEX) с высокодозовым дексаметазоном (HiDEX). Согласно данным исследования, при медиане наблюдения 10 мес. mPFS была существенно выше в группе больных, получавших Pom+LoDEX, чем HiDEX (4,0 мес. vs 1,9 мес., р <0,0001), а медиана
OS – 12,7 и 8,1 мес. (р = 0,0285) соответственно. Прогрессия наблюдалась в 10% и 27% случаев соответственно. Однако применение Pom+LoDEX сопряжено с развитием тяжелых НЯ. Так, гематологическая токсичность 3-4 ст. тяжести характеризовалась нейтропенией (48%), анемией (33%) и тромбоцитопенией (22%), а негематологическая, в первую очередь, включала пневмонию 3-4 ст. (13%) [49].
Выше уже были представлены результаты исследования II фазы по оценке эффективности и безопасности 2 дозовых режимов иксазомиба (4 мг и 5,5 мг) с 40 мг в неделю дексаметазона [16]. Установлено, что такое сочетание препаратов обладает хорошей эффективностью и переносимостью, а оптимальной дозой иксазомиба является 4 мг.
Dimopoulos M.A. et al. [50] провели и опубликовали результаты международного многоцентрового рандомизированного исследования II фазы, в котором сопоставили эффективность двух схем пероральной терапии: помалидомид+дексаметазон (pom-dex) и иксазомиб-дексаметазон (Ixa-dex). Пациенты были централизованно рандомизированы (3:2) с помощью технологии интерактивного опроса для получения либо Ixa-dex, либо pom-dex. В группе Ixa-dex назначали пероральный иксазомиб 4 мг в дни 1, 8 и 15 и пероральный дексаметазон 20 мг (10 мг у пациентов в возрасте ≥75 лет при рандомизации) в дни 1, 2, 8, 9, 15, 16, 22 и 23-й. Пациенты на pom-dex получали пероральный помалидомид 4 мг в дни 1-21 и пероральный дексаметазон 40 мг (20 мг у пациентов в возрасте ≥75 лет при рандомизации) в дни 1, 8, 15 и 22-й. Лечение в обеих группах до прогрессии или неприемлемой токсичности. Рандомизация была стратифицирована по возрасту (<65 против ≥65 лет), стадии заболевания по ISS (I или II против III) и количеству предыдущих линий терапии (2 против ≥3), получавших ранее или непереносимых леналидомид [50]. Группы больных были хорошо сбалансированы по основным характеристикам. Средний возраст у пациентов, получавших Ixa-dex или pom-dex, составил 72 против 68 лет (75% против 73% были в возрасте ≥65 лет и 36% против 18% были в возрасте ≥75 лет), 52% против 53% больных получили ≥3 предшествующих линий терапии (бортезомиб, леналидомид, даратумумаб, карфилзомиб).
Согласно полученным данным [50], медиана выживаемости без прогрессирования (mPFS) при Ixa-dex и pom-dex составила 7,1 против 4,8 мес. (HR = 0,847, 95%CI: 0,535-1,341, р = 0,477; медиана наблюдения: 15,3 мес. против 17,3 мес.); статистически значимой разницы между группами не было. У пациентов с 2 и ≥3 предшествующими линиями терапии mPFS составил 11,0 против 5,7 мес. (HR = 1,083, 95%CI: 0,547–2,144) и 5,7 против 3,7 мес. (HR = 0,686, 95%CI: 0,368–1,279) в группах Ixa-dex pom-dex соответственно. Анализ PFS в возрастных группах с Ixa-dex против pom-dex показал, что у пациентов в возрасте <75 лет mPFS составила 6,5 мес. против 4,8 мес. (HR = 0,843, 95%CI: 0,491-1,448), а ≥75 лет – 8,0 мес. против 4,7 мес. (HR = 0,890, 95%CI: 0,309-2,562). В целом 30 (42%) против 23 (49%) пациентов в группах Ixa-dex и pom-dex при прогрессии были переведены на последующие линии терапии. Среди пациентов с Ixa-dex и pom-dex 69% против 81% имели НЯ 3 степени, при этом серьезные НЯ наблюдались у 51% против 53%. У 39% против 36% больных, возникшие НЯ были причиной прекращения приема препарата, у 44% против 32% - снижения дозы. Наиболее часто в группах Ixa-dex vs pom-dex наблюдались (разница в показателях ≥10%) диарея (40% vs 28%), периферическая нейропатия (29% vs 6%), бессонница (22% vs 11%) и периферические отеки (14% vs 4%). Серьезными НЯ, возникшими у больных, получавших pom-dex или Ixa-dex, с более высокой частотой (≥10% разница в показателях) были нейтропения (45% vs 3%), анемия (38% vs 18%), зуд (11% vs 0), астения (17% vs 6%) и пирексия (15% vs 4%) соответственно. Пневмония реже встречалась при применении дуплета Ixa-dex, чем pom-dex (13% vs 21%). Качество жизни было одинаковым между группами и сохранялось во время лечения.
Таким образом, по мнению авторов, Ixa-dex представляет собой важный, не содержащий леналидомид, пероральный вариант терапии для пациентов с РРММ, получивших ранее 2 и более линии терапии, невосприимчивых к леналидомиду, подвергшихся воздействию ингибиторов протеасом. На фоне терапии Ixa-dex сохраняется вполне удовлетворительное качество жизни. Ixa-dex является подходящим вариантом для пожилых пациентов, пациентов, которые не могут переносить комбинации триплетов, или которые предпочитают пероральные лекарственные препараты, или которым требуется не иммуномодулирующий подход к медикаментозному лечению.
Еще одна двойная комбинация, на которую стоит обратить внимание, – иксазомиб+ антиCD38-моноклональное антитело даратумумаб (Ixa-Dara). Она была протестирована у пациентов с РРММ: иксазомиб перорально (4 мг дни 1, 8, 15-й), внутривенно даратумумаб (16 мг/кг дни 1, 8, 15, 22-й, циклы 1-2; дни 1, 15-й, циклы 3-6; день 1-й, циклы 7+) [51]. В исследование вошли больные после 1 или 2 предшествующих линий терапии. У пациентов был первый (n = 36) или второй рецидив (n = 19). Тридцать три пациента (60%) ранее получали бортезомиб, 37 (67%) – леналидомид и 20 (36%) были рефрактерны к леналидомиду. У семнадцати (36%) пациентов выявлен высокий цитогенетический риск, включая t(4;14) (n = 8) или del17p (n = 10). Сообщается о нежелательных явлениях ≥3 ст., возникших у 27 (49%) человек. Наиболее частыми проявлениями токсичности 3-4 степени были тромбоцитопения (n = 9), другие цитопении (n = 4), инфекции (n = 8), гипертония (n = 3) и желудочно- кишечные расстройства (n = 3). Обращала на себя внимание высокая эффективность дуплета. Так, общая частота ответа, включая минимальный ответ, составила 86 % при частоте ≥охЧО равной 32%. Причем у пациентов, рефрактерных к леналидомиду, ЧОО была сопоставимой (82%), а число больных с ≥охЧО выросло до 41%. Аналогичные показатели обнаружены у пациентов с высоким цитогенетическим риском – 85% и 46% соответственно. Таким образом, дуплет Ixa-Dara является перспективной лечебной опцией, эффективной даже у пациентов с рефрактерностью к леналидомиду и высоким цитогенетическим риском. При медиане наблюдения 11,6 месяцев mPFS составила 16 мес., а медиана OS не достигнута (1-летняя 76%) [51].
Поскольку иксазомиб и дексаметазон (Ixa-dex) при рефрактерных формах ММ можно безопасно комбинировать с леналидомидом, было бы полезно повысить эффективность этого дуплета за счет добавления другого иммуномодулятора – помалидо-мида.
Этому посвящено открытое многоцентровое исследование фазы I/II, которое было разработано для оценки безопасности, переносимости и активности еженедельного перорального приема иксазомиба в сочетании с помалидомидом и дексаметазоном (Ixa-PomDex) у пациентов с рецидивом или рецидиви-рующей/рефрактерной ММ [52]. Для первой фазы были протестированы две дозы иксазомиба – 3 и 4 мг. Как для исследований I, так и II фазы пациенты получали иксазомиб в 1, 8 и 15-й дни 28-дневного цикла; кроме того, всем пациентам ежедневно давали помалидомид в дни 1-21 цикла и дексаметазон в дни 1, 8, 15 и 22-й. Помалидомид и дексаметазон назначались в дозах 4 и 40 мг соответственно, за исключением пациентов старше 75 лет, получавших 20 мг дексаметазона. Исследование проводилось по стандартной схеме 3 + 3, и решения об увеличении дозы принимались на основе ограничивающей дозу токсичности, возникающей в цикле 1. Максимально переносимая доза (МПД) определялась выявлением одной или нескольких токсических реакций, возможно, связанных с иксазомибом или помалидо-мидом: нейтропения 4-й степени или 3-й степени с лихорадкой ≥38,5°C, 4-я степень тромбоцитопении или 3-я степень с кровотечением, задержка начала 2-го цикла более чем на 7 дней из-за токсичности, связанной с лечением, и любое изменение дозы или задержка приема иксазомиба или помалидомида во время 1-го цикла. Кроме того, МПД включала любую негематологическую токсичность ≥3 степени, за исключением диареи, усталости, тошноты и рвоты, восстанавливающихся до <3 степени в течение 48 час, и аллергической реакции/гиперчувстви-тельности или электролитной/метаболической токсичности, поддающихся коррекции до степени <1 в течение 48 часов. В исследовании участвовали пациенты с числом линий предшествующей тера- пии от 1 до 5 (медиана 2), которые включали бор-тезомиб (100%) и карфилзомиб (19%). Все больные были рефрактерны к леналидомиду и две трети – к бортезомибу. При медиане наблюдения равной 12,0 мес. (диапазон 1,9–32,1), медиана количества полученных циклов составила 4,5 (диапазон 1-28). В общей сложности 48% пациентов достигли ≥ЧО, при этом 20% – охЧО (95%CI: 6,8-40,7) и у 76% больных установлена стабилизация или лучше (95%CI: 54,990,6). Медиана PFS составила 8,6 месяцев (95%CI: 1,8 – не достигнута); 1-летняя OS – 82% (95%CI: 5993), а медиана OS не была достигнута. Нежелательные события любой степени, которые считалась связанными с лечением, были зарегистрированы у 97% пациентов независимо от дозы. Смертей, связанных с лечением, не было. Нежелательные явления 3 или 4 степени, возможно, связанные с комбинацией препаратов, наблюдались у 74% пациентов. Наиболее распространенными НЯ 2-й степени или выше были анемия, нейтропения, тромбоцитопения и инфекции. Отмечен один случай лизиса опухоли 3 степени, который разрешился в течение 48 час. Периферическая нейропатия, связанная с лечением, наблюдалась нечасто: у трех пациентов была периферическая сенсорная нейропатия при назначении 3 мг иксазомиба (у всех 1-я степень); у 7 пациентов при использовании 4 мг иксазомиба (у пяти – 1-я степень и у двух – 2-я степень). В ходе исследования умерло десять пациентов; наиболее частой причиной смерти было прогрессирование заболевания (9), за которым следовала гипертоническая болезнь, не связанная с лечением (1). Основываясь на многообещающей эффективности и контролируемой токсичности, возникающих в результате применения схемы иксазомиб-помали-домид-дексаметазон у пациентов с леналидомид-резистентностью, авторы считают, что полученные результаты оправдывают применение этой комбинации у пациентов с рецидивом миеломы, которые рефрактерны к леналидомиду. Полностью пероральный характер этого режима позволил обеспечить устойчивый прирост эффективности во время пандемии COVID-19 [52].
В другом исследовании фазы I/II изучалась безопасность и эффективность иксазомиба/помалидо-мида/дексаметазона у пациентов, которые имели несколько предыдущих линий лечения, были рефрактерны только к леналидомиду или рефрактерны к леналидомиду и бортезомибу, или леналидомиду, бортезомибу и карфилзомибу. Частота общего ответа составила 33% и 40% при различных дозировках иксазомиба [53].
Учитывая многообещающие результаты ответа, особенно у пациентов, рефрактерных как к леналидомиду, так и к ингибиторам протеасомы, группа NCCN включила иксазомиб/помалидомид/дексаме-тазон в качестве варианта лечения для пациентов с рецидивирующим/рефрактерным течением ММ, которые получили по крайней мере две предыдущие линии терапии, включая иммуномодуляторы и ингибиторы протеасомы, и продемонстрировали прогрессирование заболевания через или в течение 60 дней после завершения последней линии терапии (таблица 1).
Другие комбинации, в частности на основе моноклональных антител, хорошо зарекомендовали себя при рецидивах/рефрактерных формах ММ [6]. Так, 3-компонентный режим, включающий даратумумаб (Dara), помалидомид (POM) и дексаметазон (dex) (DPd) продемонстрировал достижение глубоких и длительных ответов, включая отсутствие минимальной остаточной болезни (МОБ-негативность), у пациентов с рецидивирую-щей/рефрактерной ММ. Однако, как показали последующие исследования, четырехкомпонентные схемы лечения могут существенно повысить результативность терапии этой категории больных. Недавно Kumar A.D. et al. сообщили о многоцентровом исследовании фазы II, в котором изучалась эффективность квадриплета (DIPd: даратумумаб+икс азомиб+помалидомид+дексаметазон) у пациентов с ранним рецидивом MM [54]. Основной целью исследования был оценка общего ответа и безопасности квадриплета DIPd. Вторичные конечные точки включали выживаемость без прогрессирования (PFS), общую выживаемость (OS) и частоту МОБ-негативности. Пациенты, участвующие в исследовании, получили ≥1 и ≤3 предшествующих линий различной терапии (медиана 1), не содержащей даратумумаб (Dara) или иксазомиб. Не было больных, которые прогрессировали на помалидомиде (ПОМ). Все пациенты ранее получали, в том числе, леналидомид и у 47% выявлены цитогенетические особенности высокого риска. Первым шести пациентам, участвовавшим в тестировании безопасности, был назначен даратумумаб 16 мг/кг внутривенно еженедельно по 8 доз, раз в две недели по 8 доз, затем ежемесячно; ПОМ по 4 мг перорально в дни 1-21 28-дневного цикла; иксазомиб по 4 мг перорально в дни 1, 8, 15 каждые 28 дней и дексаметазон 20-40 мг еженедельно. Наиболее частыми нежелательными явлениями 3-4 степени были нейтропения (78%), инфекция (30%), лейкопения (11%), респираторные заболевания (7%), психические расстройства (4%) и тромбоз (4%). При медиане длительности лечения равной 4 мес. (диапазон 1-29), ЧОО составила 84%. Лучшие ответы включали: 26% строгих ПО, 21% охЧО, 37% ЧО. После медианы наблюдения 12 мес. медиана OS составила 39 месяцев, а mPFS – 9,5 мес.
Авторы резюмируют: квадриплет DIPd – это хорошо сбалансированная и вполне удовлетворительно переносимая комбинация, которая показала высокую ЧОО при рецидиве миеломы, включая пациентов с генетическими аномалиями высокого риска.
Заключение
Таким образом, подводя итог представленным данным и результатам многоцентровых рандомизированных клинических исследований, можно с уверенностью констатировать, что терапевтические стратегии при множественной миеломе за последние два десятилетия значительно продвинулись. Ингибиторы протеасомы действительно стали краеугольным камнем терапии ММ, и их использование в непрерывном режиме, до прогрессии ММ привело к улучшению долгосрочных результатов.
Исказомиб – это первый оральный ингибитор протеасомы, одобренный международными регулирующими органами, в том числе в Российской Федерации, для применения в комбинации с леналидомидом и дексаметазоном при лечении пациентов с ММ, получивших ранее как минимум одну линию предшествующей терапии. В исследовании III фазы TOURMALINE-MM1 триплет Ixa-Rd показал значительное преимущество по сравнению с дуплетом Rd во всех клинических ситуациях, включая пациентов высокого цитогенетического риска, получавших ранее ингибиторы протеасомы и/или иммуномодуляторы. Так, по результатам исследования TOURMALINE-MM1, у пациентов с рецидивирующей и рефрактерной множественной миеломой с цитогенетическими аномалиями высокого риска, получавших иксазомиб плюс леналидомид-дексаметазон (Ixa-Rd), выживаемость без прогрессирования была аналогична таковой при цитогенетическом стандартном риске и выше по сравнению с пациентами, получившими плацебо-Rd. То есть, добавление иксазомиба к дуплету Rd существенно снижает повышенный риск, создаваемый цитогенетическими аномалиями. Вряд ли мы можем утверждать, что ик-сазомиб преодолевает высокий риск. Однако врач, выявив цитогенетические аномалии, характерные для высокого риска, должен понять, каким образом он может помочь пациенту «усилить» факторы со знаком «плюс» и нивелировать факторы со знаком «минус». На наш взгляд, иксазомиб – это тот препарат, который поможет такому пациенту.
Данные клинических испытаний III фазы показали, что Ixa-Rd активен, а сетевые мета-анализы показывают, что Ixa-Rd является одним из наиболее активных, хотя и не самым активным, режимов лечения РРMM [6]. В этом контексте Ixa-Rd, элотузумаб-Rd и карфилзомиб-Rd, по-видимому, демонстрируют аналогичную относительную пользу для выживаемости без прогрессирования по сравнению только с Rd [6,8,26]. Однако результаты клинических испытаний не всегда воплощаются в реальные результаты [35,55]. Между тем, схема Ixa-Rd зарекомендовала себя как безопасный и эффективный вариант лечения для реальных пациентов с рецидивами/реф-рактерными формами множественной миеломы. Более того медиана беспрогрессивной выживаемости, наблюдаемая в исследовании Sokol J. et al. [35], в реальной практике была вдвое больше, чем в исследовании TOURMALINE-MM1. Возрастающее внимание к вопросу возможности проведения непрерывной терапии максимально длительное время, свидетельствует об особой значимости применения режимов терапии с приемлемыми профилями безопасности, позволяющих сохранить качество жизни пациентов и характеризуемых лёгкостью проведения. Длительная терапия становится эффективным способом увеличения времени до прогрессирования заболевания и выживаемости. В этой связи следует обратить внимание на продолжительность терапии при использовании комбинации с иксазомибом. Сегодня мы действительно имеем неопровержимые доказательства тому, что в реальных условиях Ixa-Rd может быть предпочтительным вариантом для длительного лечения, например, ослабленных пациентов, таких как те, у кого есть сопутствующие сердечно-сосудистые заболевания, из-за сердечной токсичности, которая была связана с применением кардиотоксических препаратов. Иксазомиб в комбинации с Rd становится важным вариантом лечения пациентов с рецидивирующей и/или рефрактерной ММ независимо от группы риска, особенно для пациентов с высоким риском, требующих длительной, активной терапии, позволяющей контролировать заболевание.
Иксазомиб комбинируют с целым рядом других лекарственных препаратов (циклофосфамидом, даратумумабом, помалидомидом), причем его используют уже не только в тройных, но и четверных комбинациях. Все текущие исследования свидетельствуют о хорошей эффективности таких комбинаций, способных преодолеть рефрактерность, в том числе двойную рефрактерность. Например, в исследовании I/II фазы изучалась безопасность и эффективность тройной комбинации – иксазомиб/ помалидомид/дексаметазон у пациентов, которые ранее получили 2 и более линии предшествующей терапии, были невосприимчивы не только к леналидомиду, но и бортезомибу, карфилзомибу. Триплет проявил многообещающую эффективность, особенно у пациентов, невосприимчивых как к леналидомиду, так и к ингибиторам протеасомы, что послужило основанием для включения экспертами NCCN схемы иксазомиб+помалидомид+дексаметазон в лечение пациентов с рецидивирующей/рефрактер-ной ММ, которые ранее получали по крайней мере две линии терапии, включая иммуномодулирующие агенты и ингибиторы протеасомы, и продемонстрировали прогрессирование заболевания через или в течение 60 дней после завершения последней терапии.
В любом случае, полностью пероральные иксазо-миб-содержащие комбинации у пациентов с PPMM положили начало новой эре в лечении этого заболевания. Такие режимы являются эффективными и хорошо переносимыми вариантами лечения пациентов с множественной миеломой. Они могут рассматриваться как предпочтительный вариант по сравнению со схемами, включающими парентерально вводимые агенты для пациентов, которым необходимо преодо- левать большие расстояния, чтобы посетить клинику, для которых бремя повторных посещений для внутривенных/подкожных инъекций могут ограничить целесообразность длительной терапии
Список литературы Иксазомиб в лечении больных множественной миеломой
- Бессмельцев С.С., Абдулкадыров К.М. Множественная миелома: рук. для врачей. – М.: МК, 2016. – 504 с.
- The Global Cancer Observatory. Globocan multiple myeloma fact- sheet. World Health Organization; Lyon, France: International Agency for Research on Cancer; 2020. https://gco.iarc.fr/today/data/ factsheets/cancers/35- Multiple- myeloma- fact- sheet.pdf.
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). / Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. Москва: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. P. 250.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия (часть 1) // Вестник гематологии. – 2022. – №2. – С. 4- 26.
- Kumar S.K., Lee J.H., Lahuerta J.J. et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study // Leukemia. – 2012. – Vol. 26. – P. 149–157.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия. (Часть 2) // Вестник гематологии. – 2022. – №3. – С. 4-31.
- Richardson P.G., San Miguel J.F., Moreau P. et al. Interpreting clinical trial data in multiple myeloma: translating findings to the real-world setting //Blood Cancer J. – Vol. 2018. – Vol. 8. – P. 109.
- Leleu X., Martin T.G., Einsele H. et al. Role of proteasome inhibitors in relapsed and/or refractory multiple myeloma // Clin Lymphoma Myeloma Leuk. – 2019. – Vol. 19, N 1. – P. 9–22.
- Gupta N., Zhao Y., Hui A.M. et al. Switching from body surface area-based to fixed dosing for the investigational proteasome inhibitor ixazomib: a population pharmacokinetic analysis // British Journal of Clinical Pharmacology. – 2015b. – Vol. 79. – P. 789–800.
- Gupta N., Hanley M.J., Harvey R.D. et al. A pharmacokinetics and safe- ty phase 1/1b study of oral ixazomib in patients with multiple myeloma and severe renal impairment or end-stage renal disease requiring haemodialysis // Br J Haematol. – 2016. – Vol. 174, N 5. – P. 748-759.
- Семочкин С.B. Иксазомиб в лечении рецидивирующей множественной миеломы. Медицинский Совет– // 2018. - № 10. – С. 84-91.
- Chauhan D., Tian Z., Zhou B. et al. In vitro and in vivo selective anti- tumor activity of a novel orally bioavailable proteasome inhibitor MLN9708 against multiple myeloma cells // Clin Cancer Res. – 2011. – Vol. 17, N 16. – 5311-5321.
- Kumar S.K., Berdeja J.G., Niesvizky R. et al. Safety and tolerability of ixazomib, an oral proteasome inhibitor, in combination with lenalidomide and dexamethasone in patients with previously untreated multiple myeloma: an open-label phase 1/2 study // Lancet Oncol. – 2014. – Vol. 15. – 1503-1512.
- Richardson P.G., Baz R., Wang M. et al. Phase 1 study of twice-weekly ixazomib, an oral proteasome inhibitor, in relapsed/refractory multiple myeloma patients // Blood. – 2014. – Vol. 124, N 7. – P. 1038-1046.
- Kumar S.K., Bensinger W.I., Zimmerman T.M., Reeder C.B. et al. Phase 1 study of weekly dosing with the investigational oral proteasome inhibitor ixazomib in relapsed/refractory multiple myeloma // Blood. – 2014. – Vol. 124, N 7. – P. 1047-1055.
- Kumar S.K., LaPlant B.R., Reeder C.B. et al. Randomized phase 2 trial of ixazomib and dexamethasone in relapsed multiple myeloma not refractory to bortezomib // Blood. – 2016. – Vol. 128, N 20. – P. 2415-2422.
- Chauhan D., Tian Z., Zhou B. et al. In vitro and in vivo selective antitumor activity of a novel orally bioavailable proteasome inhibitor MLN9708 against multiple myeloma cells // Clin Cancer Res. – 2011. – Vol. 17. – P. 5311-5321.
- Ohashi Y., Yatabe M., Niijima D. et al. Safety and Effectiveness of Ixazomib Dose-escalating Strategy in Ixazomib-Lenalidomide-Dexamethasone Treatment for Relapsed/Refractory Multiple Myeloma //In Vivo. – 2020. – Vol. 34, N 5. – P. 2821–2828.
- Moreau P., Masszi T., Grzasko N. et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma // N Engl J Med. – 2016. – Vol. 374. – P. 1621-1634.
- Richardson P.G., Kumar Sh.K., Masszi Tama ́s et al. Final Overall Survival Analysis of the TOURMALINE-MM1 Phase III Trial of Ixazomib, Lenalidomide, and Dexamethasone in Patients with Relapsed or Refractory Multiple Myeloma // J Clin Oncol. – 2021. – Vol. 39, N 22. – P. 2430-2442.
- Hou J., Jin J., Xu Y. et al. Randomized, double-blind, placebo-controlled phase III study of ixazomib plus lenalidomide-dexamethasone in patients with relapsed/refractory multiple myeloma: China Continuation study // J Hematol Oncol. – 2017. – Vol. 10, N 1. – P. 137.
- Spencer A., Samoilova O., Wee-Joo Chng et al. Impact of ixazomib-lenalidomide-dexamethasone therapy on overall survival in multiple myeloma patients: Analysis of the emerging-markets subgroup of the TOURMALINE-MM1 trial // eJHaem (published by British Society for Haematology and John Wiley & Sons Ltd.). – 2022. – C. 1–11.
- Менделеева Л.П., Вотякова О.М., Рехтина И.Г. Множественная миелома // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. Москва, 2018. P. 213–241.
- Клинические рекомендации. Множественная миелома. – 2020.
- Dimopoulos M. A., P. Moreau P., Terpos E. et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Annals of Oncology. – 2021. – Vol. 32, N 3. – P. 309-322.].
- NCCN Clinical Practice Guidelines in Oncology. Multiple Myeloma. Version 4.2022 – December 14, 2021
- Kumar S.K., Grzasko N., Delimpasi S. et al. Phase 2 study of all-oral ixazomib, cyclophosphamide and lowdose dexamethasone for relapsed/refractory multiple myeloma // Br J Haematol. – 2019. – 184. – P. 536-546.
- Larocca A., Palumbo A. Optimizing treatment for elderly patients with newly diagnosed multiple myeloma: a personalized approach // J Clin Oncol. – 2016. – Vol. 34. – P. 3600-3604.
- Hari P., Romanus D., Luptakova K. et al. The impact of age and comorbidities on practice patterns and outcomes in patients with relapsed/refractory multiple myeloma in the era of novel therapies // J Geriatr Oncol. – 2018. – Vol. 2. - 138-144.
- Chari A., Mezzi K., Zhu S. et al. Incidence and risk of hypertension in patients newly treated for multiple myeloma: a retrospective cohort study // BMC Cancer. – Vol. 2016. – Vol. 16. – P. 912.
- Chim C.S., Kumar S.K., Orlowski R.Z. et al. Management of relapsed and refractory multiple myeloma: novel agents, antibodies, immunotherapies and beyond // Leukemia. – 2018. – Vol. 32, N 2. – P. 252–262.
- Shah J.J., Abonour R., Gasparetto C. et al. Analysis of common eligibility criteria of randomized controlled trials in newly diagnosed multiple myeloma patients and extrapolating outcomes // Clin Lymphoma Myeloma Leuk. – 2017. – Vol. 17, N 9. – P. 575–583.
- Jagannath S., Roy A., Kish J. et al. Real-world treatment patterns and associated progression-free survival in relapsed/refractory multiple myeloma among US community oncology practices // Expert Rev Hematol. – 2016. – Vol. 9, N 7. – P. 707–717.
- Blimark C.H., Turesson I., Genell A. et al. Outcome and survival of myeloma patients diagnosed 2008-2015. Realworld data on 4904 patients from the Swedish myeloma registry // Haematologica. – 2018. – Vol. 103, N. 3. – P. 506–513.
- Sokol J., Guman T., Chudej J. et al. Ixazomib, lenalidomide, and dexamethasone combination in “real-world” clinical practice in patients with relapsed/refractory multiple myeloma // Annals of Hematology https://doi.org/10.1007/s00277-021-04663-0.
- Cohen Y.C., Magen H., Lavi N. Ixazomib-based regimens for relapsed/refractory multiple myeloma: are real-world data compatible with clinical trial outcomes? A multi-site Israeli registry study // Annals of Hematology. https://doi.org/10.1007/s00277-020-03985-9.
- Hajek R., Terpos E., Lee H.C. et al (2018) Ixazomib plus lenalidomide-dexamethasone (IRd) in relapsed/refractory multiple myeloma (MM) patients (Pts) – effectiveness in routine clinical practice is similar to the efficacy in the phase 3 tourmaline-MM1 trial: a pooled analysis from the insight MM // O. Blood [Internet] Vol. 132, Suppl 1. – 1971 LP–1971971: http://www.bloodjournal.org/content/132/Suppl_1/1971.
- Costello C., Davies F.E., Cook G. et al. INSIGHT MM: a large, global, prospective, non-interventional, realworld study of patients with multiple myeloma // Future Oncol. – 2019. – Vol. 15, N 13. – P. 1411–1428.
- Terpos E., Maouche N., Minarik J. et al. Real world" data on the efficacy and safety of ixazomib in combination with lenalidomide and dexamethasone in relapsed/refractory multiple myeloma: a combined study from the Greek, Czech and UK Databases // Blood [Internet]. – 2017. – Vol. 130, Suppl 1. – P. 3087.
- Varga G., Nagy Z., Demeter J. et al. Real world efficacy and safety results of ixazomib lenalidomide and dexamethasone combination in relapsed/ refractory multiple myeloma: data collected from the Hungarian ixazomib named patient program // Pathol Oncol. – 2019. – Vol. 25, N 4. – P. 1615-1620.
- Hari P., Romanus D., Palumbo A. et al. Prolonged duration of therapy is associated with im- proved survival in patients treated for relapsed/refractory multiple myeloma in routine clinical care in the United States // Clin Lymphoma, Myeloma Leuk [Internet]. – 2018. – Vol. 18, N 2. – P. 152–160.
- Бессмельцев С.С. Режимы на основе помалидомида и дексаметазона при лечении рефрактерной/рецидивирующей множественной миеломы // Вестник гематологии. – 2022. – Т. XVIII, № 4. – С. 4-20.
- Chari A., Romanus D., DasMahapatra P. et al. Patient- reported factors in treatment satisfaction in patients with relapsed/refractory multiple myeloma (RRMM) // Oncologist. – 2019. – Vol. 24. – P. 1479–1487.
- Snowden J.A., Greenfield D.M., Bird J.M., Boland E. et al. Guidelines for screening and management of late and long-term consequences of myeloma and its treatment // Br J Haematol. – 2017. – Vol. 176. – P. 888–907.
- Yong K., Delforge M., Driessen C. et al. Multiple myeloma: patient outcomes in real-world practice //Br J Haematol. – 2016. – Vol. 175. – P. 252–264.
- Kumar S.K., Callander N.S., Adekola K. et al. Multiple Myeloma, Version 3.2021, NCCN Clinical Practice Guidelines in Oncology //Natl Compr Canc Netw. – 2020. – Vol. 18. – P. 1685–1717.
- Dimopoulos M.A., Lonial S., White D. et al. Elotuzumab plus lenalidomide/dexamethasone for relapsed or refractory multiple myeloma: ELOQUENT-2 follow-up and post-hoc analyses on progression-free survival and tumour growth. // Br J Haematol. – 2017. – Vol. 178. – P. 896–905.
- Dimopoulos M.A., Oriol A., Nahi H. et al. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma // N Engl J Med. – 2016. – Vol. 375. – P. 1319–1331.
- San Miguel J., Weisel K., Moreau P. et al. Pomalidomide plus low-dose dexamethasone versus high dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial // Lancet Oncol. – 2013. – Vol. 14. – P. 1055–1066.
- Dimopoulos M.A., Schjesvold F., Doronin V. et al. Oral ixazomib-dexamethasone vs oral pomalidomide dexamethasone for lenalidomide-refractory, proteasome inhibitor-exposed multiple myeloma: a randomized Phase 2 trial // Blood Cancer Journal. – 2022. – Vol. 12, N 9. https://doi.org/10.1038/s41408-021-00593-2.
- Leleu X., Macro M., Touzeau C. et al. Ixazomib and daratumumab without dexamethasone (I-Dara) in elderly frail RRMM patients: A multicenter phase 2 study (IFM 2018-02) of the Intergroupe Francophone du Myelome (IFM) // ASCO Annual Meeting. – 2022. – Abstract 8000. 10.1200/JCO.2022.40.16_suppl.8000.
- Krishnan A., Kapoor P., Palmer J.M. et al. Phase I/II trial of the oral regimen ixazomib, pomalidomide, and dexamethasone in relapsed/refractory multiple myeloma // Leukemia. – 2018. – Vol. 32. – P. 1567–1574.
- Krishnan A.Y., Kapoor P., Palmer J. et al. A phase I/II study of ixazomib (Ix) pomalidomide (POM) dexamethasone (DEX) in relapsed refractory (R/R) multiple myeloma: Initial results // Journal of Clinical Oncology. – 2016. – Vol. 34. – P. 8008.
- Kumar A.D., Padilla M., Liu L. et al. Phase II study of the combination of daratumumab, ixazomib, pomalidomide, and dexamethasone as salvage therapy in relapsed/refractory multiple myeloma: Stage 2 interim results // ASCO Annual Meeting. – 2022. – Abstract 8041. 10.1200/JCO.2022.40.16_suppl.8041.
- Голенков А.К., Бессмельцев С.С. Концепция клинических исследований в гематологии, интегрированных в реальную клиническую практик у// Вестник гематологии. – 2020. – Т.XVI, №1. – С. 6-14.


