Иммунная система при гемобластозах
Автор: Глазанова Т.В., Шилова Е.Р.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 3 т.19, 2023 года.
Бесплатный доступ
В представленной лекции описаны основные аспекты, характеризующие связь между состоянием иммунной системы и гемобластозами. Представлены основные методы изучения иммунологических показателей и их место в процессе диагностики как самих заболеваний, так и иммунных нарушений, возникающих в процессе терапии. Описаны механизмы ускользания злокачественно трансформированных клеток от противоопухолевой защиты. Охарактеризованы методы и задачи иммунофенотипирования при диагностике гемобластозов. Дана характеристика изменений в иммунной системе в дебюте заболевания и на фоне лечения, представлены данные о связи состояния иммунной системы с терапией больных онкогематологическими заболеваниями. Кратко описаны аутоиммунные осложнения и особенности подходов к вакцинации у этой категории пациентов. Лекция может представить интерес для врачей-гематологов, онкогематологов, клинических ординаторов.
Гемобластозы, иммунная система, противоопухолевая защита, иммунофенотипирование, иммунодефицит
Короткий адрес: https://sciup.org/170199862
IDR: 170199862
Текст научной статьи Иммунная система при гемобластозах
цитами подразумевают такие иммунные нарушения, которые развиваются через определенный срок после рождения и их возникновение связано с воздействием на организм какого-либо повреждающего фактора. Вторичные иммунодефициты могут развиваться как у детей, так и у взрослых и быть следствием нарушения факторов естественной резистентности или специфических звеньев иммунитета. Эти нарушения проявляются в развитии острых и хронических инфекционных процессов, вызываемых различными возбудителями.
Во-вторых, проявлением нарушений в иммунной системе являются различные аутоиммунные заболевания, связанные с отменой иммунологической толерантности и нарушением распознавания «своего» и «чужого».
Попадание в организм антигена вызывает по крайней мере два вида иммунного ответа: клеточный и гуморальный. Под клеточным иммуни- тетом подразумевают способность субпопуляции Т-хелперов распознавать специфический антиген, представленный на антиген-презентирующих клетках, и реагировать на него синтезом целого каскада цитокинов, что ведет к образованию антиген-спец-ифических эффекторных клеток. Цитокины являются регуляторами многочисленных функций лимфоцитов и других клеток иммунной и кроветворной системы. В основе механизма их действия лежит свойство вызывать дифференцировку, пролиферацию или гибель клеток. В процессе иммунного ответа цитокины начинают продуцироваться клетками только в результате антигенной стимуляции.
Под гуморальным иммунитетом подразумевают синтез специфических иммуноглобулинов – антител – В-лимфоцитами в результате их активации находящимися на антиген-презентирующих клетках антигенами, а также цитокинами, продуцируемыми Т-лимфоцитами.
Т-лимфоцит является центральным элементом, определяющим характер иммунного ответа, его интенсивность и продолжительность. Поэтому количественное определение Т-лимфоцитов и их популяций, идентификация продуцируемых ими цитокинов и выявление способности осуществлять эффекторные функции лежат в основе изучения клеточного иммунитета.
Необходимо подчеркнуть, что как Т-, так и В-лимфоциты, наряду с клетками кроветворной системы, начинают свой путь развития в костном мозге из стволовых кроветворных клеток и иммунная система исходно тесно связана с системой кроветворения.
В отличие от солидных опухолей гемобластозы являются системными заболеваниями, происходящими из клеток гемопоэтической ткани со всеми присущими этим клеткам свойствами. Лейкозные клетки, так же, как и нормальные лимфоциты, легко поступают в кровеносное русло, способны циркулировать в крови и заселять любые участки организма человека. По этим причинам многообразны объекты иммунологического, а также морфологического исследования при диагностике гемобластозов. Объектами иммунологического исследования являются как клеточные суспензии (кровь, костный мозг, цереброспинальная жидкость, экссудаты в серозных полостях), так и биопсийный материал опухолевой ткани. В ряде случаев (особенно при острых лейкозах и хроническом лимфолейкозе/лимфоме из малых лимфоцитов) именно клетки крови или костного мозга являются наиболее доступным объектом для иммунологического исследования.
В основе классификации злокачественных заболеваний системы крови лежат представления о стадиях дифференцировки миелоидных и лимфоидных клеток. В большинстве случаев опухолевые клетки являются аналогами нормальных клеток, то есть, экспрессируют те же антигены, которые появляются на мембране или в цитоплазме клеток в процессе их дифференцировки на разных этапах созревания. Сходство между лейкозными и нормальными клетками позволяет установить линейность и стадию созревания патологических клеток, что необходимо для классификации, диагноза и прогностической оценки различных онкогематологических заболеваний.
Основные иммунологические методы
Иммунофенотипирование – один из иммунологических методов дифференциации клеток периферической крови, костного мозга, лимфатических узлов и других органов и тканей – получило широкое распространение в гематологии. Метод основан на реакции «антиген–антитело», в результате которой по наличию определенного набора клеточных маркеров –кластеров дифференцировки (cluster of differentiation, CD) на поверхности или внутри клетки определяют вид и функциональное состояние клетки. Метод иммунофенотипирования включает проточную флуориметрию и иммуногистохимию.
Метод иммуногистохимии используют для фе-нотипирования клеток в гистологических препаратах. Оценка иммунологического фенотипа как нормальных, так и опухолевых клеток периферической крови и костного мозга наиболее часто проводится при помощи лазерной проточной цитофлуориме-трии. Ее несомненными достоинствами являются следующие: возможность исследования большого количества клеток (несколько сотен или даже тысяч клеток в секунду); возможность их сортировки, одновременное исследование экспрессии на одной клетке нескольких антигенных структур, что для клинической иммунологии подразумевает возможность определения различных субпопуляций иммунокомпетентных клеток, а для онкогематологии – выделение различных подвариантов трансформированных клеток в пределах одной популяции; анализ различных этапов апоптоза, изучение синтеза внутриклеточных цитокинов и ряд других.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости лазерный луч монохроматического цвета. Фотометрические каналы используются для оценки размеров клеток и внутриклеточных структур. Частицы, отличающиеся по размерам, по-разному рассеивают свет, при этом характер светорассеяния зависит от соотношения длины волны света и диаметра частиц. Существует два вида светорассеяния: прямое и боковое, при их одновременной регистрации можно выделить все клеточные популяции лейкоцитов (рис. 1). В этом случае удается определить физические свойства любой неокрашенной клетки (например, ее гранулярность и размеры) и, таким образом, разделить анализируемую популяцию клеток на отдельные субпопуляции (например, лейкоциты периферической крови на лимфоциты, моноциты и гранулоциты) (рис. 2).
Прямое светорассеяние

Боковое светорассеяние
Рисунок 1 - Схема каналов светорассеяния (по [1])
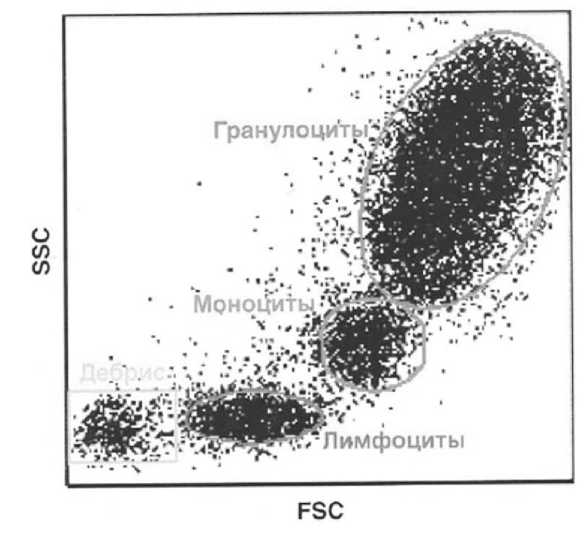
Рисунок 2 - Разделение лейкоцитов на три популяции по каналам светорассеяния (по [1])
Для изучения экспрессии клеточных маркеров применяется флуоресцентный канал. При этом используют моноклональные антитела к разнообразным мембранным и внутриклеточным компонентам клеток, меченные различными флуорохромами. После окрашивания клеток моноклональными антителами происходит их специфическое связывание с клеточными структурами с последующей регистрацией флуоресценции, индуцированной излучением лазера. Принцип метода состоит в том, что суспензия предварительно окрашенных флуоресцентными красителями клеток помещается в контейнер для проб проточного цитометра. Через наконечник специальной конструкции под давлением клеточная суспензия впрыскивается в центр быстро движущегося потока жидкости. Клетки, попавшие в этот поток, выстраиваются друг за другом, образуя «цепочку» (принцип гидродинамического фокусирования (рис. 3)), при этом суспензия клеток не перемешивается с обжимающей ее жидкостью.
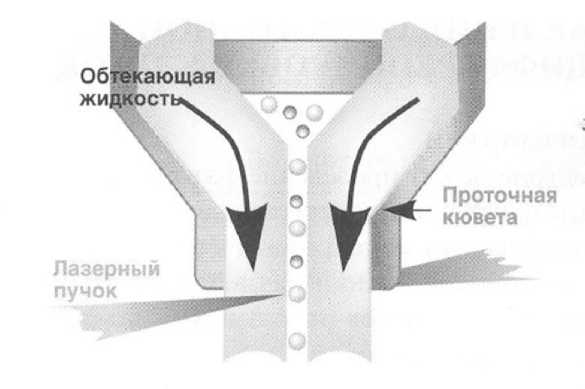
Рисунок 3 - Принцип гидродинамического фокусирования (по [1])
Измерения происходят в проточной кювете прибора при пересечении клеткой луча аргонового лазера, охлаждаемого воздухом (длина волны 488 нм), где молекулы флуоресцентных красителей, связанные с клетками, переходят в возбужденное состояние. Возвращаясь вскоре в исходное состояние, молекулы испускают кванты света с иными длинами волн. Это вторичное излучение, имеющее строго определенную для каждого флуорохрома длину волны, проходя через оптическую систему прибора, регистрируется фотоэлектронными умножителями, преобразующими его в электрические сигналы, поддающиеся компьютерной обра- ботке. Проточные цитофлуориметры могут быть оборудованы одним, двумя или более лазерами и четырьмя или более фотоумножителями. В случае использования двух и более лазеров в исследования могут быть включены флуорохромы, возбуждаемые на разных длинах волн (488 нм, 635 нм, 407 нм и др.). При выборе сочетаний флуорохромов для одновременного определения нескольких клеточных маркеров следует учитывать длину волны источника света и способность оптической системы прибора разделять и одновременно регистрировать сигналы от используемых флуорохромов (таблица 1).
Флуорохромы, наиболее часто используемые в проточной цитометрии (по [1])
Таблица 1
|
Длина волны используемого источника лазера |
Флуорохром |
Длина волны эмиссии |
|
488 нм |
FITC |
520 нм |
|
Alexa Fluor |
519 нм |
|
|
PE (RPE, RDI) |
576 нм |
|
|
PE-Texas Red (PE-TR, ECD) |
615 нм |
|
|
Texas Red |
615 нм |
|
|
PE-Cy5 |
670 нм |
|
|
PE-Cy7 |
767 нм |
|
|
PerCP |
675 нм |
|
|
PerCP -Cy5.5 |
694 нм |
|
|
635 нм или 633 нм |
APC |
660 нм |
|
APC-Cy7 |
767 нм |
|
|
Alexa Fluor 647 |
668 нм |
Использование многоцветного проточного цитофлуориметра позволяет одновременно получить информацию о нескольких антигенах на поверхности и/или внутри клеток. Проточные цитофлуориметры выпускаются несколькими компаниями, соответ- ственно, сочетание возможных для использования флуорохромов может несколько варьировать.
В таблице 2 представлены усредненные показатели клеточного иммунитета, определяемые в норме у взрослых людей.
Таблица 2
|
Параметр |
Биологический референтный интервал, % |
Биологический референтный интервал, х109/л |
|
Т-лимфоциты – CD3+CD19- |
61–80 |
1,0–2,0 |
|
Т-хелперы – CD3+CD4+ |
34–50 |
0,59–1,31 |
|
Цитотоксические Т-лимфоциты – CD3+CD8+ |
19-33 |
0,37–1,1 |
|
В-лимфоциты – CD19+ |
10–19 |
0,12–0,36 |
|
NK-клетки – CD16+CD3- |
61–80 |
0,11–0,41 |
Показатели клеточного иммунитета у здоровых взрослых (усредненные данные, взятые из нескольких источников)
Из методов, необходимых для определения состояния иммунной системы у пациентов с гемобластозами, необходимо также упомянуть определение уровня иммуноглобулинов, что важно при диагностике и клиническом мониторинге имму-нодефицтов, моноклональных гаммапатий, аутоиммунных заболеваний и других патологических состояний. Для определения уровня иммуноглобулинов в биологических жидкостях, включая сыворотку крови, мочу, слюну и проч., в настоящее время наиболее часто применяется метод турбидиметрии и нефелометрии. В основе данных методов лежит формирование комплекса антиген-антитело в растворе: растворы антигена и антитела смешиваются, при этом реактив используется в очень малых количествах, а формирование агрега- тов происходит быстро. Турбидиметрия измеряет количество непреломленного света, прошедшего через раствор. Фотосенсор расположен на прямой линии с источником света, абсолютно прозрачный раствор пропускает до 100% света, чем выше концентрация частиц, тем меньше проходит света. Нефелометрия измеряет количество рассеянного под прямым углом по отношению к лучу света, фотосенсор расположен под углом 90° к источнику освещения, абсолютно прозрачный раствор не преломляет свет. Метод нефелометрии с наибольшей чувствительностью выявляет малые концентрации исследуемых веществ.
В таблице 3 представлены уровни основных классов иммуноглобулинов в сыворотке крови здоровых людей.
Таблица 3
|
Параметры |
IgG (г/л) |
IgА (г/л) |
IgМ (г/л) |
|
Среднее значение |
12,3 |
2,1 |
1,45 |
|
Границы колебаний |
8,8 – 19,7 |
0,9 – 3,9 |
0,5 – 2,0 |
Уровни основных классов иммуноглобулинов в сыворотке крови здоровых людей (собственные данные)
Определение растворимых циркулирующих иммунных комплексов необходимо проводить при появлении подозрения на аутоиммунное расстройство. Экзогенные или эндогенные антигены могут образовывать в организме иммунные комплексы с соответствующими антителами. Этот процесс может стать причиной системной или органной патологии. Судьба циркулирующих иммунных комплексов (ЦИК) зависит от их величины и от индивидуальной активности фагоцитарной системы. Антитела в составе иммунных комплексов могут включать каскад активации комплемента, кроме того, IgG- и
IgМ-антитела могут оказывать влияние на функцию клеток, связываясь с их Fc-рецепторами. Во многих работах описано повышение концентрации ЦИК при системных, аутоиммунных и инфекционных заболеваниях (лепра, шистозоматоз), а также при злокачественных новообразованиях. Величина и состав иммунных комплексов зависит как от свойств антигена, так и от свойств антител, и в то же время, от их абсолютной и относительной концентрации. Соотношение антиген/антитело в составе ЦИК зависит от относительных концентраций обоих компонентов. В ряде случаев в составе ЦИК находили ДНК, инсулин, иммуноглобулин G и антигены вирусов гепатита. Специфические антигены можно обнаружить только в случае довольно ограниченного числа заболеваний. Принято считать, что ЦИК, возникающие в условиях небольшого избытка антигена, представляют наибольшую опасность ввиду длительности их циркуляции и высокой комплементак-тивирующей способности.
Наиболее распространенным методом выявления ЦИК является метод их осаждения полиэтиленгликолем (ПЭГ). Он основан на различной растворимости мономеров иммуноглобулинов в составе ЦИК при наличии с среде ПЭГ-6000. Результаты выражают в условных единицах (усл. ед.).
Общие принципы интерпретации иммунограммы. Полноценный клинический анализ иммунограммы может быть проведен лишь в комплексе с оценкой клинической картины заболевания у данного пациента и данных его анамнеза. Реальную информацию об изменениях иммунограммы дают значительные нарушения показателей иммунограммы (на 20–40% от нормы и более). В связи с лабильностью показателей иммунограммы их незначительные колебания возможны у совершенно здоровых лиц. Анализ иммунограммы в динамике (особенно в сопоставлении с клинической динамикой) более информативен с точки зрения как диагностики, так и прогноза течения заболевания, помогает избежать ошибочного трактования.
Необходимость исследования иммунологических характеристик при гемобластозах следует рассматривать в нескольких аспектах. Во-первых, не до конца остается решенным вопрос о том, что является первоначальным событием: изменения в иммунной системе, дающие возможность возникновению и пролиферации опухолевых клеток или развитие опухолевого процесса, что приводит к супрессии и/или активации ряда звеньев иммунной системы. Следует отметить, что на возникновение и прогрессирование опухолевого заболевания несомненно, оказывают влияние особенности индивидуального иммунного реагирования. При этом важно отметить, что в процессе развития клинических манифестаций гемобластозов иммунная система закономерно страдает, что проявляется в соответствующей клинической симптоматике, характерной для каждой из нозологий.
Во-вторых, как уже указывалось выше, иммунологические исследования необходимы для диагностики развившегося злокачественного заболевания системы крови – острых лейкозов лимфоидной и миелоидной природы, а также лимфопролиферативных заболеваний.
Кроме того, как в дебюте заболевания, так и в процессе терапии гемобластозов важно определять состояние иммунной системы, так как высока вероятность возникновения иммунодефицита либо аутоиммунного состояния, что не может не отразиться на тактике ведения таких пациентов.
Отдельной задачей иммунологических исследований является определение минимальной остаточной болезни (МОБ). Также в процессе подготовки к трансплантации гемопоэтических стволовых клеток (ГСК) необходимо определять их количество в заготавливаемом продукте – определение клеток с фенотипом CD34+.
Отдельным аспектом вовлеченности иммунной системы при заболеваниях системы крови является также иммунотерапия . Это связано с появлением препаратов на основе моноклональных антител к определенным антигенам на поверхности злокачественных клеток, применение которых приводит к характерным изменениям иммунологических показателей пациентов, в зависимости от того, на какой виду клеток избирательно действует препарат. Необходимо отметить, что применение в клинической практике терапевтических моноклональных антител требует предварительной оценки степени экспрессии таргетных антигенов на мембранах опухолевых клеток, в частности, CD20 при использовании мабтеры, CD52 при использовании Кэмпас, CD38 при использовании даратумумаба.
Кроме того, разработаны и применяются препараты класса ингибиторов иммунных контрольных точек , направленные на блокаду цитотоксического T-лимфоцит-ассоциированного белка 4 (CTLA-4) и белка запрограммированной клеточной смерти 1 (PD-1) или его лиганда PD-L1, которые демонстрируют высокий потенциал противоопухолевой активности при множестве онкологических заболеваний.
Ускользание от противоопухолевой защиты
В организме человека постоянно происходит процесс образования злокачественных клеток, однако в норме иммунная система их своевременно распознает и уничтожает. Согласно концепции иммунного надзора, существует три его фазы, названные фазами элиминации, равновесия и выхода (ускользания) из-под надзора. В фазе элиминации иммунная система обнаруживает и уничтожает опухолевые клетки, развивающиеся в результате нарушения в работе клеточных механизмов апоптоза и пролиферации. Эта фаза элиминации может быть полной, сопровождаясь уничтожением всех опухолевых клеток, или частичной, когда уничтожена только их часть. В таком случае наступает временная фаза равновесия между иммунной системой и развивающейся опухолью. При этом считается, что опухолевые клетки либо остаются бездействующими, либо продолжают развиваться, накапливая дальнейшие изменения (такие как мутации ДНК или изменения в экспрессии генов), которые могут модулировать опухолеспецифические антигены и индуцированные стрессом антигены. Во время этого процесса иммунная система может избирательно уничтожать чувствительные клоны опухолевых клеток, сдерживая тем самым опухолевый рост. Однако если опухолевый клон не полностью устраняется, это приводит к выходу из-под иммунологического надзора. На этом этапе иммунная система больше не может сдерживать рост опухолевого клона, который, напротив, подавляет ее активность посредством различных механизмов. Было показано, что отсутствие иммуногенности опухолевых клеток может быть результатом неспособности иммунной системы к активации.
Одним из важнейших компонентов противоопухолевой защиты при новообразованиях, в том числе злокачественных заболеваниях системы крови, является эффекторное звено клеточного иммунитета, к которому относятся NK-клетки , или натуральные киллеры, цитотоксические Т-лимфоциты (ЦТЛ) и NKT-клетки. NK-клетки представляют собой первую линию защиты человека против опухоли. Они являются важной частью врожденного иммунитета и представляют собой большие гранулярные лимфоциты. Одной из наиболее значимых их функций является способность распознавать и уничтожать опухолевые клетки, постоянно образующиеся в организме, при этом регулируя активность адаптивного звена иммунитета путем секреции цитокинов, что и делает их первой линией противоопухолевой защиты человека. Отличительной характеристикой NK-лимфоцитов является их способность к активации без предварительной антигенной стимуляции.
Мишенями NK-клеток являются клетки, утратившие частично или полностью молекулы Главного комплекса гистосовместимости (Major Histocompatibility Complex, MHC-I), и экспрессирующие повышенное количество белков клеточного стресса, вызванное инфицированием вирусом или опухолевой трансформацией. Злокачественные или инфицированные клетки уходят от распознавания Т-лимфоцитами путем снижения количества MHC-I на мембране, что отменяет ингибирование NK-клеток и ведет к активации рецепторов для осуществления или цитотоксического эффекта.
NK-клетки экспрессируют антигены CD16 и/ или CD56 при отсутствии линейных маркеров Т-и B-клеток (CD3 и CD19).
Необходимо отметить, что важную роль играет баланс между содержанием популяций Т- и NK-лимфоцитов. Установлена способность NK-клеток регулировать количество антиген-специфических Т-лимфоцитов при различных вирусных и онкологических заболеваниях. Так, было показано, что при уменьшении количества NK-лимфоцитов резко возрастает количество антиген-специфических Т-лимфоцитов. В процессе иммунного ответа эта особенность может оказывать как негативное, так и положительное воздействие. При низких дозах вирусной нагрузки сниженное количество Т-клеток являлось губительным для организма из-за низкой способности к элиминации вируса. При более высокой вирусной нагрузке Т-клетки вызывали иммунопатологические реакции вследствие гиперактивности иммунного ответа, а NK-клетки уменьшали эти иммунопатологические эффекты. Такие регуляторные свойства NK-клеток могут иметь определяющее значение для осуществления противоопухолевой функции Т-клетками. Фактически, NK-клетки могут препятствовать иммунному ответу на опухоли путем прямого уменьшения количества Т-клеток.
Цитокины, секретируемые NK-клетками, относятся, в основном, к провоспалительному ряду (ФНОα, ИФН-гамма). В то же время некоторые NK-клетки способны синтезировать ИЛ-10, подавляющий иммунный ответ.
Т-лимфоциты являются ключевым звеном адаптивного иммунитета. Их развитие и созревание включают в себя сложное разнообразие взаимодействий с нелимфоидными клетками и рецепторами. Т-клеточные предшественники возникают в костном мозге и через ряд определенных и скоординированных этапов развития, мигрируют в тимус, подвергаются дифференцировке и селекции, и, в конечном счете, созревают в функциональные Т-клетки, что и определило их название (тимусза-висимые, или Т-лимфоциты). Обладающие высокой специфичностью действия в отношении определенных бактериальных и вирусных инфекций, Т-клетки также опосредуют реакции на чужеродные ткани и осуществляют иммунный надзор за опухолевыми клетками, что представляет большой интерес для онкологов и гематологов.
Для Т-лимфоцитов характерно распознавание комплекса антигенов с молекулами MHC и участие в реализации иммунного ответа в качестве эффекторных и регуляторных клеток. Т-лимфоциты от других популяций, их дифференцируют по экспрессии на их поверхности маркерных молекул. Характерным и специфичным для всех разновидностей Т-лимфоцитов является молекулярный комплекс антиген-распознающего димера Т-клеточного рецептора (ТCR).
Существует множество механизмов, с помощью которых опухоль подавляет активность Т-лимфоцитов. Показано, что на опухолевых клетках молекула MHC-I представлена на 25-94% меньше, что позволяет ей избегать распознавания ЦТЛ. Кроме того, злокачественные клетки активно вырабатывает цитокины и хемокины, привлекающие и активирующие клетки, которые обладают ингибирующим воздействием на иммунную систему, например миелоидные супресссорные клетки (MDSC) или Т-регуляторные лимфоциты (Treg).
Т-клеточная толерантность может также быть связана с экспрессией игибиторных регуляторных факторов (ингибиторных костимулирующих молекул, E3 убиквитин-лигазы и транскрипцион- ных репрессоров) и эпигенетической модуляцией. Недавние открытия новых ингибирующих кости-мулирующих молекул указывают на сложные механизмы, с помощью которых организм человека предотвращает чрезмерную иммунную активацию. Повышенная экспрессия этих молекул обнаружена в микроокружении опухоли, что свидетельствует об их участии в развитии иммунной толерантности и опухолевом росте.
Модуляция этих костимуляторных путей остается одним из привлекательных подходов к контролю Т-клеточной толерантности.
Иммунологические контрольные точки — это система ингибиторных механизмов, которые участвуют в регуляции активации иммунного ответа, модулируют его, ограничивают вызванные иммунными клетками повреждения в органах и тканях, а также препятствуют запуску аутоиммунных реакций. Один из молекулярных механизмов основан на передаче ингибирующего сигнала от рецепторов CTLA4 или PD1 на CD8+ Т-лимфоцитах, что вызывает анергию опухоль-специфических клонов. Опухоль может непосредственно инактивировать Т-лимфоциты путем передачи сигнала через взаимодействие PD-L1, представленного на клетках опухоли, и рецептора PD-1, запускающего апоптоз лимфоцита.
NKT-лимфоциты , как и NK-клетки, относят к клеткам врожденного иммунитета. Они выполняют цитотоксическую функцию и служат основным источником цитокинов на первом этапе внедрения патогена. Описано, что в NKT-лимфоцитах присутствует предварительно сформированная мРНК цитокинов, что позволяет быстро воспроизводить их при развитии инфекции и задавать направление дальнейшему адаптивному иммунному ответу. Различные дефекты в системе NKT-клеток наблюдались у онкологических и онкогематологических больных. Их число уменьшалось у больных раком по сравнению со здоровыми донорами при ряде солидных опухолей. Кроме того, продуцирование IFN-γ клетками NKT было значительно снижено у пациентов с множественной миеломой. Высокое количество инфильтрирующих клеток I типа NKT было предиктором пролонгированной общей выживаемости при колоректальном раке, а низкие уровни циркуляции клеток NKT типа I были предиктором плохой выживаемости при плоскоклеточном раке головы и шеи. У больных с впервые выявленным ХЛЛ и с рецидивом заболевания уровень важнейших эффекторов противоопухолевого иммунного ответа – NK- и NKT-клеток оказался значительно снижен. У пациентов с асимптоматической формой впервые выявленного заболевания содержание NKT-клеток в периферической крови было значительно выше, а Т-лимфоцитов существенно ниже, чем у больных с симптоматической формой ХЛЛ как в периферической крови, так и в костном мозге.
В норме цитокины стимулируют пролиферацию, выживание, самоподдержание, дифференцировку и активацию гемопоэтических клеток. Нарушения цитокиновой сети характерны для всех видов лейкоза. Важным компонентом таких цитокинов как IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21 является общая сигнальная субъединица гамма (γ-) цепи. Было доказано, что цитокины с общей субъединицей γ-цепи служат критическими регуляторами развития, выживания, пролиферации, дифференцировки и/или функционирования клеток как врожденной, так и адаптивной иммунной системы и участвуют в патогенезе ряда неоплазий. Они играют важную роль в поддержании нормального гемопоэза и лимфопоэза. Регулирование клеточной пролиферации, поддержания клеточного пула, дифференцировки и иммунного ответа осуществляется в результате воздействия цитокинов с общей субъединицей γ-цепи на сигнальный путь JAK-STAT. С другой стороны, с индуцированной этими цитокинами передачей сигнала через JAK-STAT ассоциировано развитие ряда злокачественных новообразований, включая гематологические. Основной функцией цитокинов с общей субъединицей γ-цепи при развитии опухолей негематологического происхождения является активация эффекторных клеток, таких как NK- и цитотоксические T-клетки, что в итоге приводит к противоопухолевому эффекту. Так как злокачественные клетки при гематологических неоплазиях обладают фенотипом, похожим на таковые нормальные лимфоциты, предполагается, что гематологические опухолевые клетки могут активно пролиферировать в ответ на стимуляцию перечисленными цитокинами, что в итоге приводит к преобладанию злокачественно трансформированных над остаточными нормальными клетками.
При остром лимфобластном лейкозе (ОЛЛ) наблюдается выраженное снижение содержания лимфоцитов, синтезирующих цитокины IFN-у, TNF-a и IL-2. Кроме того, отмечена отрицательная корреляция между уровнем бластных клеток в крови и количеством лимфоцитов, синтезирующих эти цитокины. При этом в дебюте ОЛЛ лимфоциты периферической крови больных обладали высокой способностью к синтезу внутриклеточных цитокинов.
Иммунорегуляция является ключевым фактором патогенеза B-клеточного ОЛЛ (B-ОЛЛ). Известно, что клетки Th17, субпопуляция Т-хелперов, участвуют в патогенезе некоторых гематологических заболеваний. Показано достоверное повышение содержания клеток Th17 и снижение Th1 в периферической крови и костном мозге пациентов с вновь диагностированным B-ОЛЛ. Кроме того, у пациентов с B-ОЛЛ наблюдалось повышение уровня цитокинов, продуцируемых Th17, включая IL-17, IL-21, IL-23, IL-1β и IL-6.
Существует мнение, что развитие ОЛЛ у детей может быть связано с нарушением иммунного от- вета на различные инфекционные агенты. При этом остается неясным, может ли отличаться пренатальное развитие иммунной системы детей, у которых в последующем развивается ОЛЛ, от такового у здоровых детей. Результаты изучения ассоциации неонатального профиля цитокинов, как маркера пренатального развития иммунной системы, с последующим возникновением ОЛЛ у детей показало, что из 11 изученных цитокинов выявлялись лишь 5 (IL-4, IL-6, IL-10, IL-12 и IL-13). За исключением IL-12, уровень остальных четырех цитокинов был статистически значимо снижен по сравнению с нормальными значениями. При этом авторы считают, что пониженный неонатальный уровень IL-10, ключевого регулятора, модулирующего выраженность и продолжительность иммунного ответа и критичного для предупреждения гиперактивного воспалительного ответа на патогены, связан с последующим риском развития ОЛЛ.
На различных стадиях развития В-ХЛЛ закономерной особенностью изменения цитокинового статуса является увеличение содержания в сыворотке крови IL-4, IL-6 и IL-7, IL-10 и TNF-α, обладающих по-липотентным локальным и системным действием. 2. Возрастание интенсивности секреции IL-4, IL-6 и IL-7, IL-10 и TNF-α при различной степени тяжести течения заболевания свидетельствует о важной роли указанных цитокинов в механизмах аутокринной и паракринной стимуляции пролиферативных процессов лимфоидной ткани и является одним из ведущих патогенетических факторов нарушений межклеточного взаимодействия в лимфоидной ткани в динамике развития ХЛЛ.
Иммунофенотипированиедля диагностики гемобластозов
Острые лейкозы. Острые лейкозы – это опухолевые клональные заболевания кроветворной системы с первичным поражением костного мозга. Острым лейкозам свойственно нарушение механизма нормальной дифференцировки и созревания клеток, выражающееся в опухолевой трансформации и клональной пролиферации клеток-предшественников. В большинстве случаев острых лейкозов бластные клетки имеют иммунофенотип, сравнимый с нормальными гемопоэтическими клетками различных стадий дифференцировки, а бластные клетки рассматриваются как злокачественные аналоги нормальных клеток ранних стадий лимфо- и миелопоэза. По набору поверхностных и внутриклеточных антигенов можно определить линейную принадлежность, стадию дифференцировки и функциональное состояние бластной клетки.
В соответствии с функциональной значимостью выделяют следующие группы антигенов: 1. Линейно-специфические, экспрессия которых ассоциирована с линией дифференцирования клеток. Они подразделяются по направленности на миелоидные и лимфоидные, которые, в свою очередь можно разделить на В-клеточные и Т-клеточные. 2. Диффе-ренцировочные антигены, появляющиеся или исчезающие на различных стадиях созревания клеток, например, CD34. 3. Линейно нерестриктированные антигены, экспрессия которых не ограничена одной клеточной линией. Их можно условно разделить на ранние и активационные.
На основе линейной направленности острые лейкозы делятся на основные группы: В-лимфобластные (В-ОЛЛ), Т- лимфобластные (Т-ОЛЛ) и мелобластные (ОМЛ).
Дифференцировочные антигены могут обнаруживаться на злокачественных клетках в комбинациях, которые не выявляются в нормальном костном мозге (аберрантный фенотип). Аберрации иммунофенотипа являются отражением генетических нарушений, лежащих в основе опухолевой трансформации.
Лимфопролиферативные заболевания. При лимфопротиферативных заболеваниях (ЛПЗ) особенностью лимфопоэза является способность клеток к опухолевой трансформации практически на всем пути клеточной дифференцировки. Это определяет многообразие ЛПЗ. При иммунофенотипи-ровании клеток пациентов в части случаев удается установить стадию дифференцировки, на уровне которой наступила злокачественная трансформация, но есть ряд ЛПЗ, при которых не найдены нормальные клеточные аналоги, например, волосатоклеточный и пролимфоцитарный лейкозы. При ряде В- и Т-клеточных ЛПЗ могут наблюдаться утрата типичных антигенов, появление активационных маркеров либо коэкспрессия антигенов, несвойственных данной стадии дифференцировки лимфоцитов.
Наряду с диагностической значимостью, проточная цитометрия позволяет исследовать маркеры, имеющие прогностическую ценность при некоторых ЛПЗ, например, CD38, ZAP-70 при ХЛЛ. Необходимо отметить, что применение в клинической практике терапевтических моноклональных антител требует предварительной оценки степени экспрессии тар-гетных антигенов на мембранах опухолевых клеток, в частности, CD20 при использовании ритуксимаба, CD52 при использовании алемтузумаба, CD38 при использовании даратумумаба.
Минимальная остаточная болезнь. Под минимальной остаточной болезнью (МОБ) подразумевается остаточное количество опухолевых клеток, сохранившихся в организме после достижения клинико-гематологической ремиссии. МОБ является прогностически значимым показателей при онко-гематологических заболеваниях, являясь основной причиной рецидивов болезни, поэтому терапия после достижения ремиссии направлена именно на уничтожение остатков лейкозного клона.
Проточная цитофлуориметрия является одним из основных и наиболее чисто используемых методов оценки МОБ. Определение МОБ широко применяется при лечении пациентов с острыми лимфобластными лейкозами (ОЛЛ), В-клеточным хроническим лимфолейкозом (В-ХЛЛ)/лимфомой из малых лимфоцитов и другими ЛПЗ, множественной миеломой (ММ). Подходы к определению МОБ при ОМЛ несколько сложнее, однако они также активно разрабатываются.
В основе метода определения МОБ лежат имму-нофенотипические отличия опухолевых клеток от нормальных кроветворных клеток. При некоторых патологиях (ОЛЛ, В-ХЛЛ, некоторые В-ЛПЗ, ММ) данные отличия весьма существенны, тогда как при ряде злокачественных заболеваний системы крови (таких как ОМЛ) проблема отличить остаточные трансформированные клетки от нормальных клеток регенерирующего кроветворения может быть достаточно сложной. Поэтому для определения МОБ принципиально важно располагать исходным иммунологических фенотипом опухолевых клеток до терапии.
Изменения в иммунной системев дебюте заболевания и на фоне лечения
Ввиду того, что при опухолевых заболеваниях кроветворной ткани неизбежно злокачественным процессом затрагиваются и иммунокомпетентные клетки, сами являющиеся субстратом злокачественной трансформации при ряде форм лейкозов, изменения в иммунной системе при гемобластозах проявляются достаточно рано и носят выраженный характер. В то же время, при солидных опухолях зачастую иммунная система страдает лишь на поздних стадиях, и во многих случаях эти изменения практически не проявляются, в зависимости от формы рака.
Для лейкозов характерна опухолевая инфильтрация костного мозга и подавление нормального кроветворения, появление в крови низкодифференцированных форм, иммунодефицитные состояния, поскольку недифференцированные клетки, злокачественные в своем большинстве, не выполняют своей защитной функции. Отсюда становится понятным снижение резистентности больных к инфекции, которая и служит основной причиной гибели больных лейкозами. Кроме того, опухоль гемопоэтической ткани дает метастазы в различные органы, связанные с кроветворной и иммунной системами, наиболее часто в печень, селезенку и лимфоузлы.
Клинические проявления у пациентов с острыми лейкозами (ОЛ) неспецифичны и связаны с развитием тех или иных симптомов, обусловленных вытеснением опухолевыми клетками нормального кроветворения. У 80-85% больных ОЛ, ХЛЛ наблюдается синдром вторичного иммунодефицита, который является грозным, трудно купируемым осложнением, включающим пневмонию, сепсис, гнойные процессы. В последнее время увеличились тяжелые инфекционные осложнения вирусного и грибкового генеза. Причина иммунодефицита заключается в гранулоцитопении и неполноценности клеточного и гуморального звеньев иммунитета. Отсутствие зрелых лейкоцитов резко снижает активность иммунного ответа. В результате у больного могут обостряться хронические инфекции (например, пиелонефрит, гepпeс) или развиваться системные болезни (пневмония, грибковые заболевания и др.).
Для лейкозов характерно вовлечение таких органов, как селезенка, лимфатические узлы, печень и области, независимо от того, находится ли источник лейкоза в костном мозге или в лимфатических узлах. Обычными симптомами лейкоза являются развитие инфекции, тяжелая анемия и склонность к кровотечениям, связанным с тромбоцитопенией. Эти симптомы являются в основном результатом замещения нормальных клеток костного мозга и лимфоидной ткани нефункционирующими опухолевыми клетками.
Клинически это проявляется лихорадкой, нередко гектического типа, появляются очаги хронической инфекции разной локализации. Характерно возникновение язвенно-некротической ангины, перитонзиллярных абсцессов, некротического гингивита, стоматита, пиодермии, параректальных абсцессов, пневмонии, пиелонефрита. Генерализация инфекции с развитием сепсиса, множественных абсцессов в печени, почках, гемолитической желтухи, ДВС-синдрома часто является причиной смерти больного.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции.
Известно существование иммунодефицит-ассо-циированного варианта лимфомы Беркитта, когда это заболевание возникает на фоне иммунодефицитных состояний: у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами. Чаще всего встречается у ВИЧ-инфицированных пациентов, причем на ранних этапах развития (до снижения CD4+-клеток).
Исследования комплекса показателей в дебюте заболевания у больных ОМЛ показали, что ведущими синдромами являются анемический 40 %, инфекционный 25 %, геморрагический 16 %, гиперпластический 8 %, язвенно-некротический 4 %. В 7 % случаев заболевание было выявлено случайно в ходе различных обследований. У пациентов с ОЛЛ на первом месте стоят инфекционный и анемический синдромы – по 27 %, на втором геморрагический и гиперпластический – поровну 18 %, 10 % пришлось на случайно выявленные случаи.
При реализации программной химиотерапии (ХТ) у больных гемобластозами регистрируется вы- сокая частота инфекционных осложнений, характер которых определяется рядом факторов, включая гранулоцитопению. Гранулоцитопения являлется предиктором развития инфекционных осложнений у больных ОМЛ и ОЛЛ. Корреляция длительности гранулоцитопении и частоты инфекций была выявлена у больных ОЛЛ, в то время как у больных ОМЛ частота инфекционных осложнений была высокой вне зависимости от длительности гранулоцитопе-нии.
Кроме того, иммунный ответ организма снижается в результате снижения чувствительности гранулоцитов и моноцитов к хемотаксическим факторам, а также в результате нарушения процессов адгезии и интеграции.
При ОЛЛ значительно меняется функциональное и метаболическое состояние лимфоцитов и нейтрофильных гранулоцитов по мере прогрессирования заболевания, которое, вероятно, является ответственным не только за возникновение осложнений, но и обуславливает возникновение повторного рецидива и ухудшает прогноз заболевания в целом.
Хронический лимфоцитарный лейкоз (ХЛЛ) – опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующая плазматическая клетка. В-лимфоциты при ХЛЛ вследствие изменений в клеточном геноме не развиваются до плазматических клеток. Это ведет к резкому уменьшению в организме больного выработки иммуноглобулинов, к которым относятся все антитела. В связи с гипогаммаглобулинемией, которая постепенно углубляется по мере прогрессирования заболевания и к 7–8 годам болезни отмечается у 70% больных, при ХЛЛ имеется повышенная склонность к развитию оппортунистических инфекций, чаще всего легочных. Инфекционные осложнения при ХЛЛ могут возникнуть в любой стадии заболевания, в том числе и в начальной, но гораздо чаще они развиваются у больных с выраженными клинико-гематологическими проявлениями болезни. Проводимое лечение (операция, лучевая и химиотерапия) также усугубляет возникший иммунодефицит.
Однако механизмы возникновения дефицита антител и, следовательно, восприимчивости к инфекции при ХЛЛ являются многофакторными. Предполагается, что дефектная функция не клональных СD5-негативных В-клеток и прямое подавление СD95+ плазматических клеток костного мозга посредством CD95L/CD95 взаимодействия между плазматическими клетками и В-клетками ХЛЛ вызывает дефект В-клеток. Регуляторные нарушения Т-клеток (например снижение активности Т-хелперов или повышение активности Т-цитотоксических клеток) и дисфункциональные дендритные клетки или естественные киллеры также могут способствовать уве- личению бремени инфекции, обусловленной гипо-гаммаглобулинемией при ХЛЛ и ММ.
Терапия онкогематологических заболеваний и состояние иммунной системы
Терапия онкогематологических заболеваний часто вызывает иммуносупрессию , увеличивая вероятность развития клинически значимой инфекции, включая развитие септицемии, пневмоцистной пневмонии, системного аспергиллеза или кандидоза, распространенный Нerpes Zoster, реактивация цитомегаловирусной инфекции. Иммуносупрессивный эффект зависит от механизма действия препарата, дозы, продолжительности лечения и стадии заболевания. Например, аналоги пурина и ингибиторы синтеза пурина угнетаю синтез ДНК, снижая тем самым пролиферативную активность Т-лимфоцитов и В-лимфоцитов. Использование таких препаратов у больных гемобластозами часто ассоциировано с оппортунистическими инфекциями. Известно также, что иммунодепрессанты (азатиоприн, 6-меркапто-пурин и др.) тормозят пролиферацию лимфоцитов и синтез антител. Глюкокортикостероиды снижают в крови число лимфоцитов, моноцитов, эозинофилов и увеличивают число нейтрофилов, уменьшают интенсивность пролиферативного ответа лимфоцитов на митогены, угнетают неспецифический иммунный ответ.
Среди терапевтических возможностей последнего десятилетия, предлагаемых для больных гемобластозами, особо следует упомянуть таргетные препараты , в частности, те, которые имеют мишени на В-лимфоцитах. Эти терапевтические агенты либо количественно истощают В-клетки (моноклональные антитела анти-CD20, анти-CD52, анти-CD19, анти-CD22) и плазматические клетки (анти-CD38), либо ингибируют выживание В-клеток (активирующий фактор BAFF). Существует также класс биспецифических антител, в качестве примера, можно привести блинатумомаб, который активирует эндогенные Т-клетки, соединяя CD3 в комплексе Т-клеточного рецептора (ТКР) с CD19 на доброкачественных и злокачественных В-клетках. Противоопухолевая активность блинатумомаба является поликлональной по природе и не зависит от молекул человеческого лейкоцитарного антигена (HLA) на клетках-мишенях.
На фоне терапии моноклональными антителами анти-CD20 возможна реактивация вирусного гепатита В, связанная с В-клеточной деплецией и, как следствие, падением титра контролирующих анти-HBs антител. Восстановление титра антител происходит спустя 6 месяцев после последнего введения моноклональных антител. Наличие гепатита не является противопоказанием к началу терапии ХЛЛ монокло-налными антителами, однако это требует сопроводительной терапии противовирусными препаратами и тщательного мониторинга функций печени.
При множественной миеломе применение новых препаратов приводит к появлению инфекций, ранее не связанных с ММ, одной из которых является цитомегаловирусная инфекция. Различные субпопуляции Т-хелперных (CD4+), Т-цитотоксических / эффекторных (CD8+) клеток и естественных киллеров (NK) осуществляют контроль над ЦМВ-инфекцией. Ингибиторы протеасом, в частности, бортезомиб, нарушают пролиферацию и функциональные свойства CD8+ Т-лимфоцитов и NK-клеток. У пациентов с ММ, получающих индукционную терапию на основе бортезомиба, частота реактивации ЦМВ значительно возрастает после аутологичной трансплантации ГСК, в то время как при использовании других индукторов такая закономерность не продемонстрирована.
Даратумумаб, препарат на основе моноклонального антитела анти-CD38, истощает иммунорегу-ляторные клетки с фенотипом CD38+ и нарушает репертуар Т-клеток у пациентов с ММ. Поскольку нормальные плазматические клетки также экспрессируют CD38, их апоптоз в собственной пластинке слизистой оболочки кишечника увеличивает риск развития ЦМВ-энтероколита.
Аутоиммунные нарушения
Нарушения, проявляющиеся дисбалансом субпопуляций Т-лимфоцитов, могут привести к выработке антител к нормальным клеткам крови и другим тканям хозяина. По этой причине от 10-20% больных ХЛЛ страдают такими заболеваниями как аутоиммунная гемолитическая анемия, аутоиммунная тромбоцитопения, ревматоидный артрит. Аутоиммунные осложнения возникают при хроническом лимфоцитарном лейкозе (ХЛЛ) значительно чаще, чем при других лимфопролиферативных процессах. Так, аутоиммунная гемолитическая анемия (АИГА) развивается в процессе заболевания у 10-25 % больных ХЛЛ. С. Engelfriet и соавт. в большой работе по аутоиммунной гемолитической анемии показали, что ХЛЛ является самой частой причиной ее развития, при этом заболевании частота аутоиммунного гемолиза в 2 раза выше, чем при системной красной волчанке, занимающей второе место среди заболеваний, при которых часто развивается АИГА. Положительный антиглобулиновый тест (проба Кумбса) выявляется еще чаще – у 20–35 % больных. Аутоиммунные осложнения могут развиться в любом периоде болезни. Имеются наблюдения, в которых АИГА явилась первым симптомом хронического лимфоцитарного лейкоза. Так же, как инфекции, аутоиммунные процессы чаще возникают у больных с развернутой клинико-гематологической картиной ХЛЛ. Среди больных с аутоиммунными анемиями и тромбоцитопениями у 72 % больных наблюдались выраженные клинико-гематологические проявления ХЛЛ. Эти данные подтверждаются наблюдениями других исследователей. Антитела, обнаружи- ваемые на эритроцитах при АИГА, чаще относятся к классу IgG и только у 10–15 % больных – к классу IgM. При этом показано, что при обнаружении IgG прогноз значительно лучше.
Значительно реже, чем АИГА, развивается анемия, обусловленная парциальной красноклеточной аплазией (ПКА), в 1-6 % случаев ХЛЛ, по данным различных исследователей. ПКА характеризуется тяжелой анемией со снижением гематокрита до 25—20 %, отсутствием ретикулоцитов в крови и практически полным отсутствием эритрокариоцитов в костном мозге. Нет достаточного количества исследований, позволяющих установить причину развития ПКА при ХЛЛ. Иммунная тромбоцитопения встречается реже, чем АИГА, всего у 2-3 % больных ХЛЛ, тем не менее, она может представлять большую опасность, чем АИГА, из-за возможных и действительно часто имеющих место жизненно опасных кровотечений или кровоизлияний в головной мозг, служащих причиной смерти больных.
Существуют разные гипотезы о причинах аутоиммунных конфликтов при ХЛЛ, в частности о причинах возникновения АИГА. Тот факт, что при ревматоидном артрите и других аутоиммунных заболеваниях увеличено количество CD5+ лимфоцитов, позволил высказать предположение о роли этих лимфоцитов в возникновении аутоиммунного гемолиза, тем более что они могут продуцировать аутореактивные IgM-антитела. Однако этой гипотезе противоречит поликлональный характер анти-эритроцитарных антител при ХЛЛ. Описаны случаи аутоиммунного гемолиза после лечения флудараби-ном, который подавляет преимущественно продукцию CD4+ лимфоцитов. В связи с этим ряд авторов высказывают предположение о нарушении соотношения популяций Т-лимфоцитов как о причине развития антиэритроцитарных антител при ХЛЛ. Однако хорошо известно, что в ряде случаев аутоиммунный гемолиз развивался у больных после лечения алкилирующими препаратами, не вызывающими избирательного подавления каких-либо фракций Т-лимфоцитов. Таким образом, в настоящее время нет убедительной концепции о причине столь частого развития аутоиммунного гемолиза эритроцитов при ХЛЛ. Точно так же нет каких-либо данных, позволяющих предположить причины аутоиммунной тромбоцитопении.
Редким аутоиммунным осложнением при ХЛЛ является паранеопластическая пузырчатка. Этот синдром описан в 1990 г. G. J. Anhalt и соавт., ими же впервые доказана его аутоиммунная природа. До сих пор в связи с редкостью этого осложнения публикуется практически каждое наблюдение. В клинической картине преобладающими являются поражения слизистых оболочек и кожи. Они могут быть очень сходными с поражениями кожи при истинной пузырчатке, но чаще напоминают изменения, наблюдаемые при многоформной эритеме, пемфигоиде, плоском лишае или болезни «трансплантат против хозяина». Аутоиммунный характер поражения кожи и внутренних органов доказан обнаружением в тканях отложений, представляющих собой комплекс IgG и комплемента. Иммунологические исследования показали, что это антитела к белкам семейства плакинов. Белки этого семейства (периплакин, енвоплакин, десмоплакин, плектин, десмоглеин) обеспечивают адгезию клеток к окружающим тканям и между собой. Образование антител к этим белкам ведет к разрушению клеточной мембраны и некрозу клеток. Поскольку такие комплексы обнаружены во многих органах и тканях – почках, мочевом пузыре, мышцах – был предложен термин «паранеопластический аутоиммунный мультиорганный синдром» — ПАМС. Он более полно характеризует заболевание, однако яркая картина поражения кожи и слизистых оболочек послужила причиной сохранения прежнего названия. Паранеопластическая пузырчатка описана при разных опухолях, наиболее часто при неходжкинских лимфомах, ХЛЛ и болезни Кастлемана, причем на ХЛЛ приходится около 30 % всех описанных случаев. Причины развития аутоиммунного конфликта неизвестны.
Вакцинация у больных гемобластозами
В связи с характерным для больных гемобластозами состоянием иммунодефицита, обусловленного как самим заболеванием, так и проводимой терапией, встает вопрос о мерах профилактики инфекционных осложнений и вакцинации. Меры профилактики могут включать в себя такие средства сопроводительной терапии, как назначение препаратов гранулоцитарных колониестимулирующих факторов при критической нейтропении, раннее назначение антибиотиков широкого спектра и противогрибковых препаратов, Бисептол для профилактики пневмоцистной пневмонии, а также строгое соблюдение режимов асептики и антисептики.
Что касается вакцинации, то для данной группы больных определены следующие подходы. Имеются данные о том, что предсуществующий постинфекционный иммунитет к ветряной оспе, гриппу, гепатиту
В, а также поствакцинальный иммунитет к кори на фоне или после такой терапии может утрачиваться или ослабевать. При этом многими исследованиями убедительно показана безопасность вакцинации лиц с иммуносупрессией инактивированными вакцинами и анатоксинами.
Иммуносупрессия является противопоказанием для введения живых вакцин – вакцин от полиомиелита, кори, краснухи, паротита, туберкулеза. Вакцинация живыми вакцинами возможна после наступления ремиссии и не ранее, чем через 3 месяца после окончания иммуносупрессивной терапии. Как правило, иммуносупрессивные препараты отменяются за 1 неделю до вакцинации и на 1 неделю после прививки, стероиды – за 1 неделю до и на 2 недели после прививки.
Для больных ЛПЗ рекомендуется, при отсутствии противопоказаний, вакцинация в целях профилактики пневмококковых инфекций после установления диагноза и сезонная вакцинация для профилактики гриппа. При этом в отношении пациентов, получающих терапию моноклональными антителами к CD20, вакцинация рекомендуется после восстановления уровня В-лимфоцитов, то есть обычно через 9 месяцев после терапии.
Следует учитывать, что имеются данные о снижении эффективности вакцинации у пациентов с гемобластозами, что связано с иммунной дисре-гуляцией, сниженной способностью к выработке поствакцинальных антител и их сниженной вирус-нейтрализующей способности (в том числе против SARS-CoV-2) при ряде гемобластозов, особенно у пациентов с моноклональными гаммапатиями. На выработку антител в результате вакцинации может дополнительно оказывать отрицательное влияние терапия ибрутинибом и антителами к CD20.
Таким образом иммунная система играет важную роль на всех этапах развития опухолевого процесса, в том числе, при онкогематологических заболеваниях, будучи исходно связана с системой кроветворения, так как иммунокомпетентные клетки начинают свой путь развития в костном мозге из стволовых кроветворных клеток наряду с клетками кроветворной системы и развиваются во тесной взаимосвязи с последними.
Список литературы Иммунная система при гемобластозах
- Луговская С.А., Почтарь М.Е., Тупицын Н.Н. Иммунофенотипирование в диагностике гемобластозов. М. – Тверь, 2005. 2005 – 168 с.
- Ярец Ю.И. Интерпретация результатов иммунограммы (Практическое пособие для врачей). Гомель: ГУ «РНПЦРМиЭЧ», 2020 г. – 38 с.
- Dunn G.P., Old L.J., Schreiber R.D. The three Es of cancer immunoediting // Annu Rev Immunol. — 2004. — Vol.22. — P.329-60
- Swann J., Smyth M. Immune surveillance of tumors // J Clin Invest. — 2007. — Vol.117. — P.1137–1146
- Табаков Д.В. Фенотипическая гетерогенность эффекторных клеток онкологических больных: Автореф. дис. … канд. мед. наук, М., 2019.
- Waggoner S.N., Cornberg M., Selin L.K., Welsh R.M. Natural killer cells act as rheostats modulating antiviral T cells // Nature. – 2012. — Vol.481. — P. 394–8
- Baba T., Hanagiri T., Ichiki Y., et al. Lack and restoration of sensitivity of lung cancer cells to cellular attack with special reference to expression of human leukocyte antigen class I and/or major histocompatibility complex class I chain related molecules A/B // Cancer Sci. – 2007. – Vol. 98. – P. 1795–1802
- Nurieva R., Wang J., Sahoo A. T-cell tolerance in cancer // Immunotherapy. – 2013. – Vol. 5. – P. 513–531
- Ключагина Ю.И., Соколова З.А., Барышникова М.А. Роль рецептора PD1 и его лигандов PDL1 и PDL2 в иммунотерапии опухолей // Онкопедиатрия. – 2017. – Т. 4, № 1. – С. 49-55.
- Акинфиева О.В. Значение активности иммунорегуляторных Т-лимфоцитов и естественных киллерных клеток в противоопухолевом иммунном ответе у больных хроническим лимфолейкозом: Автореф. дис. … канд. мед. наук, СПб., 2011.
- Tae Sik Goh, Changwan Hong. New insights of common gamma chain in hematological malignancies // Cytokine. – 2017. – N89. – P.179–184
- Глазанова Т.В., Черников Р.А., Бубнова Л.Н., Шестериков А.С. Особенности иммунного статуса у больных дифференцированным раком щитовидной железы после оперативного вмешательства // Медицинская иммунология. 2003. – Т. 5, № 3-4. – С. 352-353
- Царегородцева А.Д. Лейкозы и иммунодефицит // Материалы VII Международной студенческой научной конференции «Студенческий научный форум» URL: /scienceforum.ru/2015/article/2015009981 (дата обращения: 20.02.2023)
- Кузнецова Е.Ю., Михалев М.А., Соколова-Попова Т.А., и соавт. Анализ начальных проявлений острого лейкоза и его осложнений в ходе лечения у больных городского гематологического отделения г. Красноярска за период с 2010 по 2013 годы // Современные проблемы науки и образования. – 2014. – № 6 (сетевое издание)
- Охмат В.А., Клясова Г.А., Паровичникова Е.Н. и др. Инфекционные осложнения у больных острыми лейкозами в зависимости от длительности гранулоцитопении. Онкогематология 2018;13(3):55—62 DOI: 10.17650/1818-8346-2018-13-3-55-62
- Смирнова О.В., Манчук В.Т. Особенности клеток иммунной системы при остром лимфобластном лейкозе. Медицинская иммунология. 2013;15(6):577-584. doi. 10.15789/1563-0625-2013-6-577-584
- Поддубная И.В., Бабичева Л.Г. Вторичные иммунодефициты в онкогематологии. Учебное пособие. М., 2019. – 63 с.
- Engelfriet CP, Overbeeke MA, von dem Borne AE. Autoimmune hemolytic anemia // Semin Hematol. – 1992. – Vol.29, N 1. – P.3-12.
- https://meduniver.com/Medical/gematologia/autoimmunnie_oslognenia_pri_xronicheskom_limfoleikoze.html MedUniver
- Зотина Е.Н., Малых О.В., Загоскина Т.П. Инфекционные осложнения у больных хроническим лимфолейкозом на фоне лечения алемтузумабом // Фундаментальные исследования. – 2011. – № 9-3. – С. 404-407.
- Савченко В.Г. и др. Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Москва: Практика, 2018. – 1006 c.
- Tamariz-Amador L.E., Battaglia A., Maia C. et al. Immune biomarkers to predict SARS-CoV-2 vaccine effectiveness in patients with hematological malignancies // Blood Cancer J. – 2021. – Vol. 11, N 12. – 202. doi: 10.1038/s41408-021-00594-1
- Addeo A, Shah PK, Bordry N, et al. Immunogenicity of SARSCoV-2 messenger RNA vaccines in patients with cancer // Cancer Cell // 2021. – Vol. 39, N 8. – P. 1091–1098.e2


