Иммуногистохимическое исследование дефекта челюстной костной ткани после проведения зубосохраняющих операций
Автор: Столяров Максим Вениаминович, Любовцева Любовь Алексеевна, Московский Александр Владимирович, Кандейкина Наталия Владимировна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Медицинские науки
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Введение. Одной из важнейших проблем хирургической стоматологии является оптимизация процессов регенерации костной ткани. Высокая распространенность и трудности лечения деструктивных форм хронического периодонтита обусловливают актуальность поиска новых и усовершенствования существующих методов лечения. В статье описан процесс новообразования костной ткани в течение 1 года после зубосохраняющих операций с применением остеотропных материалов различного происхождения: аутогенного, аллогенного и ксеногенного. Цель исследования - изучить клеточный состав послеоперационного дефекта челюсти для выбора оптимального остеопластического наполнителя для применения при зубосохраняющих операциях. Материалы и методы. В рамках исследования было проведено 32 зубосохраня-ющие операции. Материал здоровой челюстной костной ткани был получен во время удаления зубов по ортодонтическим показателям. Исследование проводилось с помощью иммуногистохимических методов через 3, 7, 30, 90, 120, 150, 180 и 360 дней после операции. Результаты исследования. В послеоперационном периоде происходит уменьшение числа CD68-позитивных клеток и количества клеток, экспрессирующих маркер пролиферации Ki-67. Обсуждение и заключения. На ранних сроках исследования клеточные популяции в дефекте костной ткани находятся в состоянии активной пролиферации. Со временем интенсивность пролиферативной активности в группах исследования снижается.
Зубосохраняющая операция, дефект костной ткани, остеотроп-ный материал, иммуногистохимия, "аллоплант", "остеоматрикс"
Короткий адрес: https://sciup.org/14720234
IDR: 14720234 | УДК: 611.716:616.31 | DOI: 10.15507/0236-2910.026.201604.533-547
Текст научной статьи Иммуногистохимическое исследование дефекта челюстной костной ткани после проведения зубосохраняющих операций
Формирование хронического одонтогенного очага инфекции в организме часто приводит к удалению причинного зуба [1]. Существуют методики хирургических вмешательств, позволяющие сохранять зубы с воспалительно-деструктивными изменениями в периапикальных тканях, которые получили название зубосохраняющих операций . Однако во время оперативного вмешательства возникают дефекты костной ткани, которые могут привести к послеоперационным осложнениям. Одной из важнейших проблем хирургической стоматологии является оптимизация процессов регенерации костной ткани [2]. Высокая распространенность и трудности лечения деструктивных форм хронического 534
периодонтита обусловливают актуальность поиска новых и усовершенствования существующих методов лечения [3].
Для стимуляции остеогенеза большое значение имеют создание в костном дефекте депо из остеотропного материала и стабилизация в нем кровяного сгустка. Костеобразующие материалы тормозят активность остеокластов и, как следствие, уменьшают резорбцию костной ткани [4]. Также они ускоряют процессы новообразования и минерализации костной ткани [5].
Цель исследования – изучить клеточный состав послеоперационного дефекта челюсти для выбора оптимального остеопластического наполнителя для применения при зубосохраняющих операциях.
Материалы и методы
У 36 пациентов было проведено 32 гранулэктомии с резекцией верхушки корня (18 оперативных вмешательств – на верхней челюсти и 14 – на нижней). Во время оперативного вмешательства появлялся дефект ~ 180 мм³, который заполняли остеотропным материалом.
Все пациенты были разделены на 5 групп. 1 группа (8 пациентов) – контрольная; после проведения зубосохраняющей операции в ране организовывался кровяной сгусток. Во 2-й группе (8 пациентов) дефект костной ткани восполнялся аутогенной костной стружкой, полученной с помощью дрель-канюли из угла нижней челюсти во время операции; в 3-й (8 пациентов) – материалом «Аллоплант» (регистрационное удостоверение № 901 от 22.07.1987; производство ФГУ «Все-росийский Центр глазной и пластической хирургии Росздрава», г. Уфа), получаемым из трупной костной ткани человека; в 4-й (8 пациентов) – материалом «Остеоматрикс» (регистрационное удостоверение № ФСР 2010/09830; производство ООО «Конектбиофарм», г. Москва). Источником данного биоматериала являются губчатые и кортикальные кости крупного рогатого скота, как правило, быков. В 5-й группе (4 пациента) проводилось исследование здоровой костной ткани. Материал был получен во время удаления ретинированных и дистопированных зубов по ортодонтическим показаниям.
Исследование материала проводилось на 3-й, 7-й, 30-й, 90-й, 120-й, 150-й, 180-й и 360-й день после операции. На 3-й и 7-й день слизистая оболочка на месте разреза еще не зажила и материал из раны получали с помощью кю-ретажной ложки. Начиная с 30-го дня проводили пункционную биопсию созревающей костной ткани с помощью иглы набора «Ostycut» («Bard», США).
Исследование срезов дефекта костной ткани проводилось с помощью иммуногистохимического метода.
Для выявления CD68 + -клеток в послеоперационном дефекте костной ткани челюсти использовались иммуногистохимические автостейнеры «Autostainer 360» («Thermo Scientific») и микроскоп «Leica DM4000B» («Leica Microsystems») с увеличением 400; материалом для исследования послужили моноклональные антитела к кластеру дифференцировки 68 типа (CD68+), клон ED-1 («Abcam», Великобритания), – маркер макрофагов.
Для выявления клеток, экспрессирующих маркер Ki-67, были использованы моноклональные антитела к маркеру клеточной пролиферации Ki-67, клон ММ-1 («NovoCastra», Великобритания) [6–7].
Для определения направленности и выраженности статистических изменений применялся Т-критерий Вилкок-сона. Различия считали достоверными при p < 0,05.
Научное исследование проводилось в соответствии со стандартами этического комитета ФГБОУ ВО «ЧГУ им. И. Н. Ульянова» и пересмотренного варианта Хельсинкской декларации этических принципов (2008 г.).
Результаты исследования
В здоровой костной ткани челюсти при иммуногистохимическом окрашивании на CD68+-клетки было обнаружено очень низкий уровень концентрации макрофагов – 1 клетка на 2–3 поля зрения (рис. 1).
С помощью маркера Ki-67 была определена выраженность процессов пролиферации в здоровой челюстной костной ткани (рис. 2) и в дефекте костной ткани с применением различных остеотропных материалов. Результаты иммуногистохимической реакции Ki-67 отличались в группах исследования на различных сроках. Полученные данные были подтверждены результатами вычисления митотического индекса. Известно, что чем выше данный показатель, тем интенсивнее протекает новообразование костной ткани.
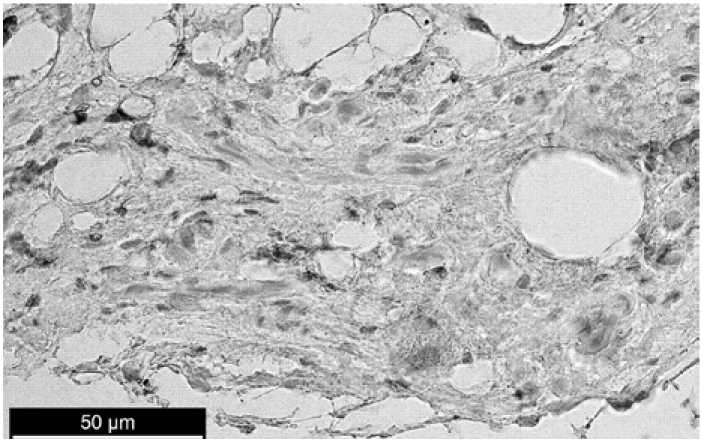
Р и с. 1. Здоровая костная ткань челюсти. Иммуногистохимическая реакция к CD68+
F i g. 1. Healthy bone tissue of the jaw. Immunohistochemical reaction for CD68+
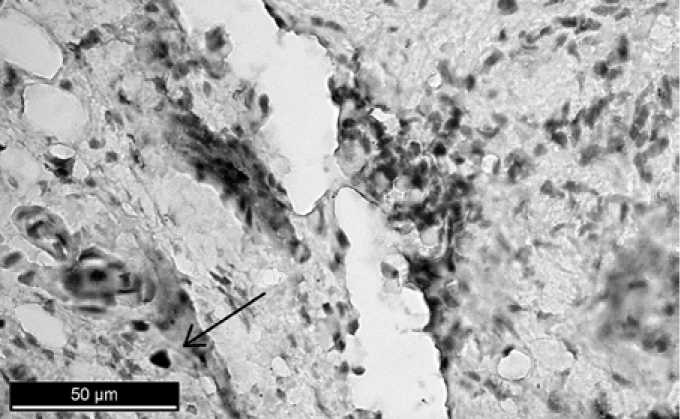
Р и с. 2. Здоровая костная ткань челюсти. Иммуногистохимическая реакция к Ki-67. Заметны единичные клетки, экспрессирующие белок Ki-67
F i g. 2. Healthy bone tissue of the jaw. Immunohistochemical reaction to Ki-67. Single cells expressing protein Ki-67 are visible
На ранних сроках исследования материала дефекта челюсти с организацией в ране кровяного сгустка было обнаружено большое количество CD68+-клеток – 11–12 макрофагов на 1 поле зрения (рис. 3; табл. 1), а также клеток, экспрессирующих белок Ki-67, ~ 70 % от общего количества (табл. 2). Морфологически они характеризуются овальной формой с разной степенью окраски ядер.
На 30-й день количество CD68+-клеток уменьшилось и составило в среднем 10 макрофагов на 1 поле зрения; количество клеток, экспрессирующих Ki-67, незначительно снизилось и составило 60,5 ± 2 % (рис. 9).
На 90-й день после операции количество CD68+-клеток составило ~7 клеток на 1 поле зрения (табл. 1); количество клеток, экспрессирующих Ki-67, – в среднем 47,1 ± 0,9 % (табл. 2).
На 120-й день количество CD68+-клеток составило 4–5 клеток на 1 поле зрения; количество клеток, экспрессирующих Ki-67, – 37 ± 1 % (Там же).
С 180-го дня количество CD68+-кле-ток стало схожим с количеством макрофагов в здоровой челюстной кости – не более 1 клетки на 2 поля зрения (табл. 1); также произошло снижение экспрессии белка Ki-67, и его значение приблизилось к аналогичному показателю в здоровой челюстной кости (табл. 2).

Р и с. 3. Иммуногистохимическая реакция к CD68+ (1). 7-й день после операции с организацией в ране кровяного сгустка
F i g. 3. Immunohistochemical reaction for CD68+ (1). 7th day after operation with the organization in the wound blood clot

Р и с. 4. Иммуногистохимическая реакция к Ki-67. 30-й день после операции с организацией в ране кровяного сгустка. Заметно большое количество клеток, экспрессирующих белок Ki-67
F i g. 4. Immunohistochemical reaction to Ki-67. Material received on 30th day after operation with organization of blood clot in the wound. A large number of cells expressing Ki-67 protein are visible
В послеоперационном периоде с применением в дефекте челюсти аутогенной костной стружки количество CD68+-клеток на ранних сроках исследования колебалось от 3–5 клеток на 1 поле зрения (Рис. 5); количество клеток, экспрессирующих Ki-67, на 3-й день составило 42,9 ± 2,1%, а на 7-й день произошло статистически значимое ее увеличение – 46,8 ± 2,2% (табл. 2).
На 30-й день исследования количество CD68+-клеток составило в среднем 2 клетки на 1 поле зрения; количество пролиферирующих клеток уменьшилось до 36 ± 1 % (рис. 7; табл. 2).
На 90-й день после операции в материале дефекта костной ткани с применением аутогенной костной стружки количество CD68+-клеток достоверно стало соответствовать количеству данных клеток в здоровой костной ткани челюсти – 1 клетка на 2 поля зрения. На более поздних сроках исследования ситуация не претерпела серьезных изменений (табл. 1). Количество пролиферирующих клеток достигло значения показателей здоровой челюстной костной ткани; в последующих исследованиях данный показатель сохранял стабильность (табл. 2).

Р и с. 5. Аутогенная костная стружка в дефекте челюсти. 7-й день после операции. Иммуногистохимическая реакция к CD68+ (1)
F i g. 5. Autogenous bone chips in a jaw defect. 7th day after operation.
Immunohistochemical reaction for CD68+ (1)
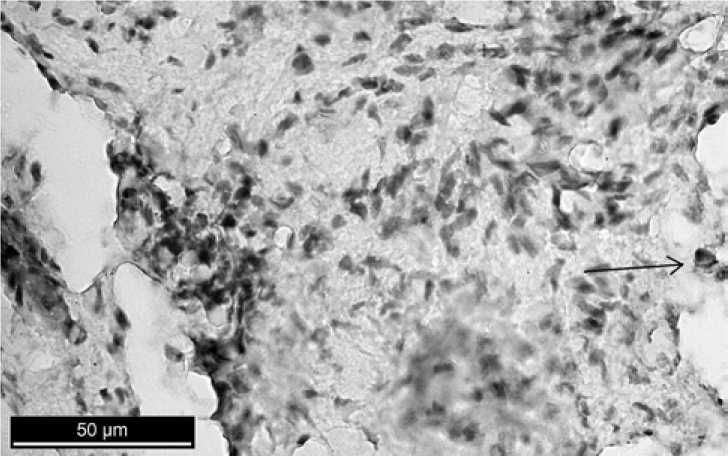
Р и с. 6. Иммуногистохимическая реакция, выявляющая маркер Ki-67. 30-й день после операции с применением в дефекте аутогенной костной стружки.
Заметны клетки, экспрессирующие белок Ki-67
F i g. 6. Immunohistochemical reaction, identifying marker Ki-67. 30th day after operation using the defect with autologous bone chips. cells expressing protein Ki-67 are visible
На 3-й и 7-й день после проведения зубосохраняющей операции с применением в дефекте костной ткани материла «Аллоплант» количество CD68+-клеток составило ~ 6 клеток на 1 поле зрения (табл. 1). Было замечено, что макрофаги рассасывают остеотропный материал, в который прорастает соединительная ткань. Экспрессия Ki-67 незначительно снизилась, но осталась высокой – 49 ± 1 % (табл. 2).
На 90-й день было обнаружено снижение количества CD68+-клеток до
3-х на 1 поле зрения (рис. 7); экспрессия Ki-67 клеток также снизилась и составила 34,5 ± 1,5 % (табл. 2).
На 120-й, 150-й, 180-й и 360-й дни после операции количество макрофагов составило в среднем 1 клетку на 2 поля зрения (табл. 1). Данный показатель соответствует содержанию макрофагов в здоровой челюстной костной ткани. Кроме этого, произошло статистически значимое уменьшение экспрессии Ki-67 до показателей здоровой челюстной кости – 25 ± 1 % (рис. 8).
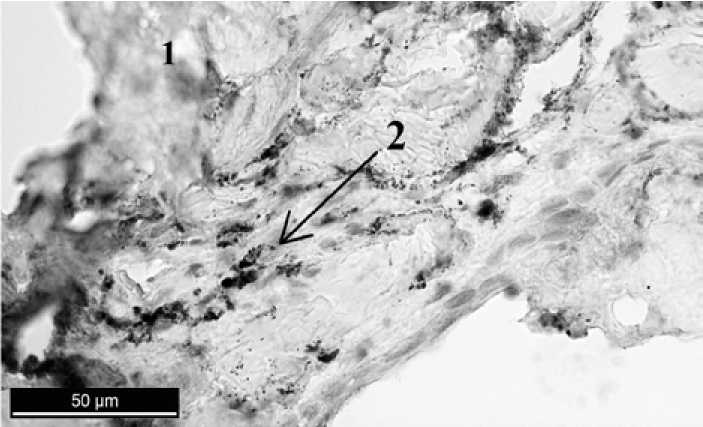
Р и с. 7. Материал «Аллоплант» в дефекте челюстной кости. 90-й день после операции. Иммуногистохимическая реакция к CD68+. 1 – остеотропный материал;
2 – единичные CD68+-клетки
F i g. 7. Material Alloplant in the defect of the jawbone. 90th day after operation. Immunohistochemical reaction for CD68+. 1 – оsteotropic material; 2 – single CD68+cells
На ранних сроках исследования материала «Остеоматрикс» обнаружены CD68+-клетки; в среднем заметно 10–11 макрофагов на 1 поле зрения (рис. 9). Количество клеток, экспрессирующих Ki-67, составило ~ 58 % (табл. 2).
На 30-й день количество CD68+-клеток уменьшилось и составило
8 клеток на 1 поле зрения (табл. 1); количество клеток, экспрессирующих Ki-67, достигло 50,0 ± 0,5 % (табл. 2).
На 90-й день количество CD68+-клеток уменьшилось и составило 6 клеток на 1 поле зрения; количество клеток, экспрессирующих Ki-67, достигло 42,8 ± 1,2 % (Там же).
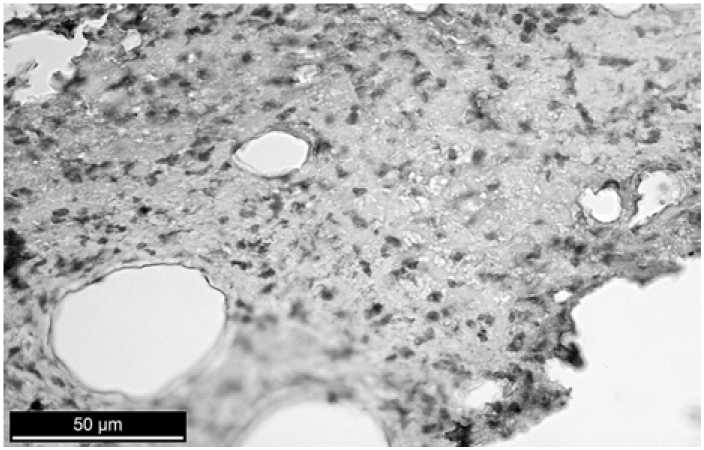
Р и с. 8. Иммуногистохимическая реакция, выявляющая маркер Ki-67. 120-й день после операции с применением в дефекте материала «Аллоплант». Клетки, экспрессирующие белок Ki-67, практически отсутствуют
F i g. 8. Immunohistochemical reaction identifying marker Ki-67. 120th day after operation using the defect material Alloplant. Cells expressing Ki-67 protein are absent

Р и с. 9. Препарат «Остеоматрикс» в дефекте челюстной кости. 7-й день после операции. Иммуногистохимическая реакция к CD68+
F i g. 9. Medicament Osteomatrix in the defect of the jawbone. 7th day after operation. Immunohistochemical reaction for CD68+
На 120-й день после операции было обнаружено небольшое количество макрофагов – 2 клетки на 1 поле зрения (табл. 1); количество клеток, экспрессирующих Ki-67, снизилось до 33,3 ± 0,7 % (рис. 10).
На 150-й, 180-й и 360-й дни количество макрофагов не превышало
1 клетки на 2 поля зрения, что соответствует аналогичному показателю в материале здоровой костной ткани (табл. 1); количество клеток, экспрессирующих Ki-67, составило 26 ± 1 %, что схоже с экспрессией Ki-67 в здоровой челюстной кости (табл. 2).
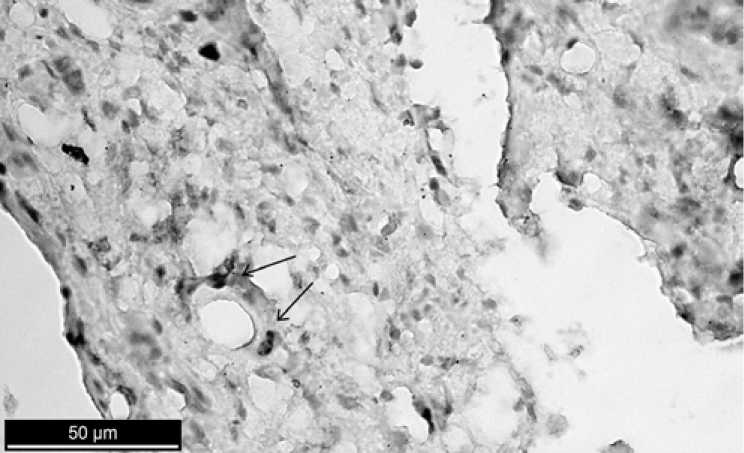
Р и с. 10. Иммуногистохимическая реакция, выявляющая маркер Ki-67. 120-й день после операции с применением в дефекте препарата «Остеоматрикс». Клетки, экспрессирующие белок Ki-67, практически отсутствуют
F i g. 10. Immunohistochemical reaction, identifying marker Ki-67. 120th day after operation using medicament Osteomatrix. Cells expressing Ki-67 protein are absent
Обсуждение и заключения
В дефекте челюстной костной ткани на ранних сроках исследования количество CD68+-клеток достигало максимума. Увеличение данного показателя свидетельствует об усилении иммунного процесса и, следовательно, появлении гибнущих лимфоцитов. В дальнейшем количество CD68+-клеток приближается к аналогично-
му показателю в здоровой костной ткани. На 90-й день после операции это происходит в дефекте челюстной костной ткани с применением аутогенной костной стружки; на 120-й день – материала «Аллоплант»; на 150-й – материала«Остеоматрикс». Дольше всего данный процесс проходил в группе с организацией в дефекте кровяного сгустка (табл. 1).
Т а б л и ц а 1
T a b l e 1
Динамика распределения иммунокомпетентных клеток (CD68+ – маркер макрофагов) дефекта костной ткани после зубосохраняющих операций с применением различных остеотропных материалов
Dynamics of immunocompetent cells distribution (CD68+ macrophage marker) of bone defect after toothprotecting operations using different osteotropic materials
|
Сроки / Date Группы / Groups |
3-й день / 3 rd day |
7-й день / 7 th day |
30-й день / 30th day |
90-й день / 90th day |
120-й день / 120th day |
150-й день / 150th day |
180-й день / 180th day |
360-й день / 360th day |
|
1 группа (контрольная) / Group 1 (Control) |
12,42 ± 1,53 |
11,02 ± 1,16* |
10,02 ± 0,95 |
7,52 ± 0,87 |
5,35 ± 0,53 |
3,12 ± 0,56* |
0,63 ± 0,21 |
0,76 ± 0,23 |
|
2 группа (аутоген. кость) / Group 2 (autogenous bone) |
4,24 ± 1,02 |
3,55 ± 0,54 |
2,14 ± 0,57 |
0,82 ± 0,44* |
0,76 ± 0,23 |
0,94 ± 0,21 |
0,87 ± 0,21 |
0,73 ± 0,35 |
|
3 группа («Аллоплант») / Group 3 (Alloplant) |
9,15 ± 1,03 |
6,53 ± 0,88 * |
5,95 ± 0,61 |
3,06 ± 0,86 |
0,82 ± 0,17* |
0,75 ± 0,13 |
0,62 ± 0,25 |
0,61 ± 0,27 |
|
4 группа («Остеоматрикс») / Group 4 (Osteomatrix) |
11,03 ± 1,36 |
10,43 ± 1,27 |
8,52 ± 1,14 |
6,54 ± 0,71 |
2,53 ± 0,96 |
0,93 ± 0,76* |
0,84 ± 0,92 |
0,82 ± 0,76 |
Примечание: * – статистически достоверное изменение показателя (p < 0,05). Количество клеток указано на 1 поле зрения. Количество наблюдений – 10 / Note: * – statistically significant change of index (p < 0,05). The number of cells is indicated on one field of view. Number of observations – 10
Известно, что в формировании костной ткани участвуют биологически активные вещества белковой природы. Иммуногистохимическая реакция с антителами к маркеру клеточной пролиферации Ki-67 позволяет идентифицировать и давать количественную оценку уровня экспрессии таких веществ [8–10]. Активаторные субъединицы (циклины) регулируют митотическое деление клетки на различных стадиях. Следовательно, выявленная положи-
тельная реакция отражает цикличность процессов сборки и разборки макромолекулярного комплекса в процессе каждого клеточного цикла.
Маркер Ki-67 способен косвенно определять скорость деления клеток. Следовательно, выявленная положительная реакция в дефекте костной ткани после зубосохраняющих операций с применением различных остео-тропных материалов указывает на скорость созидания клеточных элементов.
Т а б л и ц а 2
T a b l e 2
Экспрессия Ki-67 в клетках послеоперационного дефекта костной ткани челюсти, % The expression of Ki-67 in cells of the postoperative bone defect jaw, %
|
Сроки / Date Группы / Groups |
3-й день / 3rd day |
7-й день / 7th day |
30-й день / 30th day |
90-й день / 90th day |
120-й день / 120th day |
150-й день / 150th day |
180-й день / 180th day |
360-й день / 360th day |
|
1 группа (контрольная) / Group 1 (Control) |
70,13 ± 1,24 |
71,32 ± 1,45 |
60,53 ± 2,17 |
47,12 ± 0,96 |
37,21 ± 1,53* |
32,63 ± 1,46 |
25,12 ± 0,94 |
24,53 ± 0,55 |
|
2 группа (аутоген. кость) / Group 2 (autogenous bone) |
42,91 ± 2,16 |
46,85 ± 2,22* |
36,33 ± 1,27 |
26,32 ± 0,75 |
26,12 ± 0,91 |
25,22 ± 1,66* |
24,32 ± 1,26 |
25,22 ± 0,85 |
|
3 группа («Аллоплант») / Group 3 (Alloplant) |
54,63 ± 2,47 |
54,56 ± 2,53 |
49,45 ± 1,56 |
34,51 ± 1,53 |
25,38 ± 1,42* |
26,91 ± 1,31 |
25,42 ± 0,66 |
25,35 ± 0,77 |
|
4 группа («Остеоматрикс») / Group 4 (Osteomatrix) |
59,52 ± 1,17 |
58,81 ± 1,26 |
50,21 ± 0,57 |
42,85 ± 1,22 |
33,33 ± 0,76 |
26,22 ± 1,55* |
25,41 ± 1,56 |
25,12 ± 1,54 |
Примечание: * – статистически достоверное изменение показателя (p < 0,05). Количество клеток указано на 1 поле зрения. Количество наблюдений – 10 / Note: * – statistically significant change of index (p < 0,05). The number of cells is indicated on one field of view. Number of observations – 10
В процессе исследования было зарегистрировано непрерывное уменьшение митотического индекса. Максимальное количество клеток, экспрессирующих белок Ki-67, было замечено на ранних сроках исследования в группе с применением в дефекте кровяного сгустка (70,1 ± 1,2 %); меньшее – в дефекте костной ткани с применением материалов «Остеоматрикс» (59,5 ± 1,0 %) и «Аллоплант» (54,6 ± 2,4 %) (табл. 2). Таким образом, в послеоперационном периоде происходит увеличение пролиферативной активности клеток.
На ранних сроках исследования клеточные популяции в дефекте костной ткани находились в состоянии ак-
тивной пролиферации; впоследствии ее интенсивность снизилась (Там же).
Применение аутогенной костной стружки, полученной во время операции, сокращало срок новообразования костной ткани более чем в 2 раза, и в основном завершалось к 90-му дню послеоперационного периода.
На более поздних сроках наблюдалось снижение количества клеток, экспрессирующих Ki-67. На 90-й день после операции с применением в дефекте челюсти аутогенной костной стружки митотический индекс составил 26,3 ± 0,7 %, что приближено к значению аналогичного показателя в здоровой костной ткани. На 120-й
день статистически значимо похожая ситуация наблюдалась в дефекте костной ткани с применением материала «Аллоплант» (25 ± 1 %); к 150-му дню – материала «Остеоматрикс» (26 ± 1 %). На 180-й день после операции с применением в дефекте кровяного сгустка индекс пролиферации сни-
зился до значений здоровой челюстной костной ткани (25,1 ± 0,9 %) (Там же).
Таким образом, наибольшая вероятность полноценного восстановления дефекта костной ткани после зубосохраняющих операций возможна при применении аутогенной костной стружки.
Список литературы Иммуногистохимическое исследование дефекта челюстной костной ткани после проведения зубосохраняющих операций
- Боровский Е. В. Состояние эндодонтии в цифрах и фактах//Клиническая стоматология. 2003. № 1. С. 38-40. URL: http://www.fesmu.ru/elib/Article.aspx?id=89830
- Лобанов С. А., Усиков Д. В. Применение препарата «Коллапан» при зубосохраняющих операциях // Институт стоматологии. 2010. № 4. С. 38-89. URL: https://docviewer.yandex. ru/?url=http%3A%2F%2Fwww.collapan.ru%2Fmedia%2Fstatii%2Fstomatolog%2Flobanov_zubosohran_ operacii_2010.pdf&name=lobanov_zubosohran_operacii_2010.pdf&lang=ru&c=5808bb1958fb&page=1
- Байрамов Г. Р. Исследование пародонтопатогенной микрофлоры и ее этиологическая значимость в формировании разных клинических форм воспалительных заболеваний пародонта//Клиническая стоматология. 2010. № 2. С. 84-86. URL: http://www.fesmu.ru/elib/Article.aspx?id=224363
- Возрастные и гендерные аспекты изменения минеральной плотности опорно-двигательного аппарата, зубов и пародонта/С. Ю. Максюков //Фундаментальные исследования. 2012. № 5-1. С. 74-79. URL: http://cyberleninka.ru/article/n/vozrastnye-i-gendernye-aspekty-izmeneniya-mineralnoy-plotnosti-oporno-dvigatelnogo-apparata-zubov-i-parodonta
- Ремоделирование тканей пародонта в динамике ортодонтического перемещения зубов у собак/Е. В. Венскель //Стоматология детского возраста и профилактика. 2007. № 3. С. 29-31. URL: http://elidrary.ru/download/88580758.pdf
- Kumar G. L., Rudbeck L. Иммуногистохимические методы: руководство/Пер. с англ.; под ред. Г. А. Франка, П. Г. Малькова. М., 2011. 224 с. URL: https://docviewer.yandex.ru/?url=http%3A%2F%2Fistina. msu.ru%2Fmedia%2Fpublications%2Fbook%2Fa91%2F142%2F997256%2F207.pdf&name=207. pdf&lang=ru&c=57db9e451309
- Петрова С. В., Райхлина Н. Т. Руководство по иммуногистохимической диагностике опухолей человека. -3-е изд., перераб. и доп. Казань, 2004. 456 с. URL: http://ru.calameo.com/read/0004188086240ba409e6e
- Albrektsson T, Jonansson C. Osteoinduction, osteoconduktion and osseointegration//Eur. Spine J. 2001. Vol. 10. P. 96-101. URL: http://link.springer.com/article/10.1007/s005860100282
- An Y. H., Martin K. L. Handbook of histology methods for bone and cartilage. New York: Humana Press, 2003. 587 р. URL: http://ua.booksee.org/book/557834
- Chen D., Zhao M., Mundy G. R. Bone morphogenetic proteins//Growth Factors. 2004. Vol. 22, No 4. P. 233-241. URL: http://www.ncbi.nlm.nih.gov/pubmed/15621726


