Индикация вируса артрита-энцефалита коз в ПЦР-РВ и поиск генетических маркеров
Автор: Лукманова Г.Р.
Статья в выпуске: 2 т.242, 2020 года.
Бесплатный доступ
Цель исследования направлена на мониторинг козоводческих хозяйств Республики Татарстан по ВАЭК, а также поиск универсальных локусов генома, имеющихся у всех типов ВАЭК, для использования их в качестве генетических маркеров при ПЦР индикации вируса. Для достоверной амплификации генома ВАЭК требуется применение маркерных последовательностей, характеризующихся максимальной специфичностью и количеством выявляемых штаммов и изолятов вируса. Определенный в данной работе маркерный локус позволяет производить генную индикацию максимального количества изолятов ВАЭК с высокой степенью специфичности, подтвержденной в nBLAST анализе. В результате проведения ПЦР анализа для индикации вируса артрита-энцефалита коз, была найдена провирусная ДНК в 8 образцах, что говорит, о возможности наличия вируса в исследуемых хозяйствах.
Вирус артрита-энцефалита коз (ваэк), штамм, изолят, геном, локус, олигонуклеотиды
Короткий адрес: https://sciup.org/142224252
IDR: 142224252 | УДК: 577.2:619.98:578.828.6 | DOI: 10.31588/2413-4201-1883-242-2-97-101
Текст научной статьи Индикация вируса артрита-энцефалита коз в ПЦР-РВ и поиск генетических маркеров
Для обеспечения населения России безопасными и полноценными продуктами питания необходимо сохранять благополучие по инфекционным болезням в животноводстве, что является главной задачей ветеринарной науки и практики [1]. Козоводство является перспективной отраслью животноводства во многих странах, что обусловлено высокой стоимостью продукции и устойчивым спросом на нее в мировом рынке. Молочное козоводство в России является развивающейся отраслью по сравнению с другими отраслями животноводства, но несмотря на это Россия является страной со значительной численностью молочных коз и относительно большими объемами производства молока [4]. Существует ряд проблем, влияющих на продуктивность коз, одной из которых являются лентивирусы. Заражение коз вирусом артрита-энцефалита коз было обнаружено во многих странах мира. Лентивирусы мелких жвачных имеют высокую генетическую изменчивость, что приводит к появлению новых вирусных штаммов и изоля-тов [8, 10]. Имеются данные об образовании антител к антигенам данного вируса у людей, употреблявших в пищу молоко от инфицированных коз [11].
Вирус артрита-энцефалита коз (ВАЭК) относится к лентивирусам подсемейству ретровирусов. Он вызывает медленно протекающую вирусную болезнь, сопровождающуюся развитием энцефаломиелитов (преимущественно у молодняка), хронических пролиферативных синовитов, периартритов, прогрессирующих интер- стициальных пневмоний и интралобуляр-ных маститов [6]. Основной путь передачи заболевания через молоко и молозиво, но также возможен контактный путь передачи данного вируса. Недавние исследования показали высокую чувствительность, специфичность и точность молекулярных методов для быстрой индикации ВАЭК в клинических образцах, к таким методам относится полимеразная цепная реакция (ПЦР) [7]. Наличие на территории РФ потенциально-восприимчивых животных в сочетании с отсутствием доступных средств диагностики данной болезни и мер борьбы с ней указывает на высокую вероятность распространения ВАЭК в козоводческих хозяйствах России [3].
Для достоверной амплификации генома ВАЭК требуется применение маркерных последовательностей, характеризующихся максимальной специфичностью и количеством выявляемых штаммов и изолятов вируса. Поиск маркерной последовательности проводили методом биоин-формационного анализа. В данной работе методология биоинформационного анализа геномов различных изолятов ВАЭК всех серотипов имеет общие принципы, которые используются и для других микроорганизмов [2, 5, 9].
Цель исследования направлена на поиск универсальных локусов генома, имеющихся у всех типов вируса артрита-энцефалита коз, для использования их в качестве генетических маркеров при ПЦР индикации вируса.
Материал и методы исследова- ний. Было отобрано 112 образцов крови из различных козоводческих хозяйств Республики Татарстан. Отбор проб осуществляли вакуумными пробирками с ЭДТА (этилендиаминтетрауксусная кислота) из яремной вены коз.
Нуклеиновые кислоты выделяли комплектом реагентов «МАГНО-сорб» согласно инструкции производителя. Реакционную смесь для ПЦР-амплификации подготовили по следующей схеме (расчет на 1 реакцию): 1,5 мкл 25 mM раствора MgCl2; 1,5 мкл 2.5 mM раствора dNTP; 1,5 мкл 10x буфера для ПЦР; 0,5 мкл 10 pM раствора зонда для ПЦР (разработанного в рамках данной работы); 10 pM раствора прямого и обратного праймеров по 0,5 мкл (разработанных в рамках данной работы); по 0,5 мкл зонда и праймеров для внутреннего контроля; 0,5 мкл Taq-полимеразы; 7 мкл ДНК. Объем реакционной смеси составил 15 мкл.
Для ПЦР-анализа использовали плазмидную ДНК положительного контроля, а также 112 образцов выделенных нуклеиновых кислот. ПЦР-РВ (ПЦР в режиме реального времени) осуществляли на амплификаторе C1000 с оптическим блоком CFX96 (BioRad). По протоколу амплификации: 1-денатурация ДНК при 95 °C в течение 2 мин; 2-40 циклов, состоящих из 10 с при 95 °C, 30 с при 57 °C. Детекция результата ПЦР (флуоресценции) происходит на каждом из 40 циклов второй стадии ПЦР, при 57 °C по каналу Rox (детекция специфического участка гена) и Cy5 (детекция участка гена внутреннего контроля)
Перед постановкой ПЦР-анализа были найдены нуклеотидные последовательности ВАЭК путем поисковых запросов баз данных ресурсов NCBI (Национального центра биологической информатизации). Видовое (штаммовое) разнообразие выявляемых организмов, с применением анализируемого генетического маркера, определяли в программной утилите «nBLAST», а дизайн нуклеотидных последовательностей праймеров и зондов проводили, используя программу «VectorNTI 9.1.0» (Invitrogen Corporation). В одной реакции учитывали возможность амплификации специфических праймеров (для индикации ВАЭК) и праймеров внутреннего контроля (ДНК восприимчивого животного).
Результаты исследований. В результате анализа биологического разнообразия ретровирусов установлено следующее таксономическое отношение вируса артрита-энцефалита коз, а именно принадлежность вируса к семейству Retroviridae, подсемейству Orthoretrovirinae и роду Lentivirus, к которому кроме ВАЭК относятся ещё 18 видов. Внутри вида ВАЭК насчитывается 5 подвидов: Caprine arthritis encephalitis virus G63; Caprine arthritis encephalitis virus Ov496; Caprine arthritis encephalitis virus Roccaverano; Caprine arthritis encephalitis virus strain Cork; Small ruminant lentivirus, все они являются возбудителями артрита-энцефалита коз.
Геном вируса артрита-энцефалита коз характеризуется величиной более 9000 bp, в геноме можно выделить 7 основных компонентов различной величины, которые визуально можно представить на рисунке 1.
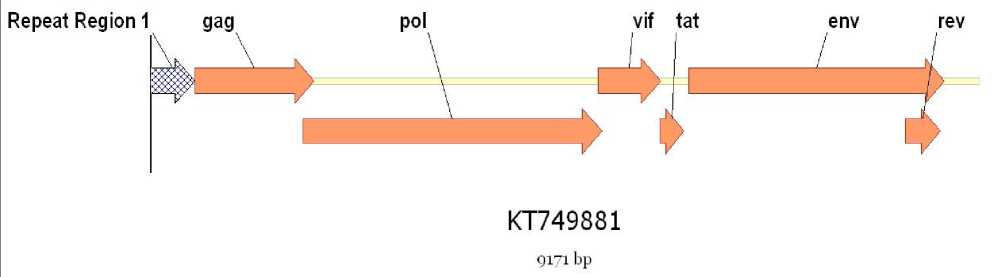
Рисунок 1 – Структура генома ВАЭК
В структуре генома ВАЭК представлены, повторяющийся регион (в начале и в конце генома) и гены: gag, pol, vif, tat, env, rev.
Для дальнейшего анализа специфичности искомой маркерной последовательности были выбраны следующие локусы ВАЭК: Caprine arthritis encephalitis virus (isolate LM30) pol protein gene, 3' end of cds (GenBank: L78449.1); Caprine arthritis encephalitis virus (isolate 8062) pol protein gene, partial cds (GenBank: L78448.1); Caprine arthritis encephalitis virus (isolate LM30) gag protein gene, partial cds (GenBank: L78450.1); Caprine arthritis encephalitis virus (strain 75-G63) gag protein gene, partial cds (GenBank: L78446.1); Caprine arthritis encephalitis virus isolate Shanxi gag protein gene, complete cds (GenBank: GQ996380.1); Caprine arthritis encephalitis virus isolate 3900.2 transmembrane protein (env) gene, partial cds (GenBank: HM049931.1); Caprine arthritis encephalitis virus strain GCTWP 99/01 envelope glycoprotein mRNA, partial cds (GenBank: HM237197.1); Caprine arthritis encephalitis virus isolate SUD08 gag protein gene, partial cds (GenBank: FJ619572.1); Caprine arthritis encephalitis virus isolate SUD07 gag protein gene, partial cds (GenBank: FJ619571.1); Caprine arthritis encephalitis virus isolate CAEV-A U3 region LTR, partial sequence (GenBank: GU263421.1); Caprine arthritis encephalitis virus rev-like mRNA, complete cds (GenBank: M63105.1); Caprine arthritis encephalitis virus isolate Caev-Arg_4 p-24 Protein (gag) gene, partial cds (GenBank: KP876019.1); Caprine arthritis encephalitis virus pol gene, partial cds (GenBank: K03327.1); Caprine arthritis encephalitis virus isolate L-107 gag protein gene, partial cds (GenBank: HM534741.1); Caprine arthritis encephalitis virus isolate btnm1007 capsid protein p25 (p25) gene, partial cds (GenBank: KP325714.1); Caprine Arthritis Encephalitis Virus proviral sequence for Rev-like protein (GenBank: X64828.1); UNVERIFIED: Caprine arthritis encephalitis virus isolate Goat8 capsid protein p28-like (gag) gene, partial sequence (GenBank: MH251626.1).
Наибольший интерес для дальнейшей работы представила последовательность «Caprine arthritis encephalitis virus isolate 3900.2 transmembrane protein (env) gene, partial cds» (GenBank: HM049931.1), характеризующаяся максимальной степенью специфичности к геному ВАЭК и большим числом обнаруживаемых штаммов и изолятов вируса.
Для дальнейшего дизайна олигонуклеотидов и поиска вариабельных участков в пределах интересующего нас гена (GenBank: HM049931.1) было произведено выравнивание всех найденных локусов различных изолятов по данному гену, наглядно такое выравнивание нуклеотидных последовательностей представлено на рисунке 2.
8150 ...... 8160 ...... 8170 ...... 8180 ...... 8190 ...... 8200 ...... 8210 ...... 8220 ...... 8230 ...... 8240 ...... 8250 ...... 8260 ...... 8270 ...... 8280 ...... 8290 ...... 8300
GGCCATAGTGGCTGCTGCAGGAGCATCTCTGGGAGTCGCGAACGCGATTCAGCAGTCCTACACCAGGGACGCTGTCCAGACTCTTGCTAACGCGACTGCTGTGCAACAGCAGGTGTTAGAGGCGTCCTATGCCATGATACAGCATGTGGCTAAGGGAAT GGCGATAATCGCGGCTGCAGGCGCCTCACTGGGAGTTGCAAATGCAATCCAGCAGTCGGAAACACGAACGGCTGTGCAGGAGCTTGCTAACGCCACTGCCGTGCAGCAGCAGGTGTTAGAGGCCGCATACGCCATGGTGCAGCACGTGGCCAGGGGAAT GGCGATAATCGCAGTTGCAGGCGCCTCTCTGGGAGTTGCAAATACTGTCCAGCAGTCGGAGACACGAACGGCTGTGCAGGAGCTTGCTAACGCCACTGCCATACAGCAGCAGGTGTTAGAAGCTGCGTACGCCATGGTACAGCACGTGGCCAAGGGAAT GGCAATAGTGGCTGCTGCAGGGGCAAGTCTGGGAGTCGCAAATGCGATTCAGCAGTCCTATACTAGGGCGGCTGTCCAGACCCTTGCTAACGCAACTGCTGCACAGCAGGATGTGTTAGAAGCAACCTATGCCATGGTACAGCATGTGGCCAAGGGAGT GGCAATAGTGGCTGCTGCAGGGGCAGGTCTGGGAGTTGCAAATGCAATTCAGCAGTCCTACACAAGGGCGGCTGTCCAGACCCTTGCTAACGCAACTGCGGCACAGCAGGATGTGTTAGAAGCGACCTATGCCATGGTGCAGCATGTAGCTAAGGGAGT GGCAAUAGUGGCUGCUGCAGGGGCAUCUCUGGGAGUCGCAAACGCGAUUCAGCAGUCUUACACUAAGGCAGCUGUCCAGACCCUUGCUAACGCAACUGCGGCACAGCAGGAUGUGUUAGAAGCAACCUAUGCCAUGGUACAGCAUGUGGCUAAAGGCGU GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGACGGCTGTCCAGACCCTTGCTAATGCGACTGCTGTACAGCAGGATGTGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAGAGGCGT GGCAAUAGUAGCUGCCGCAGGGGCUUCUCUGGGAGUCGCAAACGCGAUUCAGCAGUCUUACACCAAGGCAGCUGUCCAGACCCUUGCUAAUGCAACUGCUGCACAGCAGGAUGCGUUAGAGGCAACCUAUGCCAUGGUACAGCAUGUGGCUAAAGGCGU GGCAAUAGUAGCUGCCGCAGGGGCUUCUCUGGGAGUCGCAAACGCGAUUCAGCAGUCUUACACCAAGGCAGCUGUCCAGACCCUUGCUAAUGCAACUGCUGCACAGCAGGAUGCGUUAGAGGCAACCUAUGCCAUGGUACAGCAUGUGGCUAAAGGCGU GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGGCAGCTGTCCAGACCCTTGCTAATGCAACTGCTGCACAGCAGGATGCGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAAAGGCGT GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGGCAGCTGTCCAGACCCTTGCTAATGCAACTGCTGCACAGCAGGATGCGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAAAGGCGT GGCAAUAGUAGCUGCCGCAGGGGCUUCUCUGGGAGUCGCAAACGCGAUUCAGCAGUCUUACACCAAGGCAGCUGUCCAGACCCUUGCUAAUGCAACUGCUGCACAGCAGGAUGCGUUAGAGGCAACCUAUGCCAUGGUACAGCAUGUGGCUAAAGGCGU GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGGCAGCTGTCCAGACCCTTGCTAATGCAACTGCTGCACAGCAGGATGCGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAAAGGCGT GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGGCAGCTGTCCAGACCCTTGCTAGTGCAACTGCTGCACAGCAGGATGCGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAAAGGCGT
GGCAATAGTAGCTGCCGCAGGGGCTTCTCTGGGAGTCGCAAACGCGATTCAGCAGTCTTACACCAAGGCAGCTGTCCAGACCCTTGCTAATGCAACTGCTGCACAGCAGGATGTGTTAGAGGCAACCTATGCCATGGTACAGCATGTGGCTAAAGGCGT
Рисунок 2 – Выравнивание нуклеотидных последовательностей у ВАЭК
В результате выравнивания нуклеотидных последовательностей были определены места, где оптимально встанут олигонуклеотиды для индикации ВАЭК. В соответствии с данной информацией был произведен дизайн праймеров и зонда, а именно: прямой праймер gcaaacgcgattcagcagtct; обратный праймер taccatggcataggttgcctctaa; зонд Rox- ctgtccagacccttgctaatgcaactgc-BHQ2. Для внутреннего контроля амплификации были подобраны ранее разработанные олигонуклеотиды для амплификации гена кап-пакозеин крупного рогатого скота (прямой праймер cttggcaggcacagtatttgaca, обратный праймер attactaccaacagaaaccagttgcac, зонд CY5-ttgaagaatttgggcaggtgacctaactg-BHQ3), все последовательности имели направление молекулы 5` -› 3`. Для контроля амплификации был использован плазмидный вектор pAL-2T с маркерной вставкой
«gcaaacgcgattcagcagtcttacaccaaggcagctgtccag acccttgctaatgcaactgctgcacagcaggatgcgttagagg caacctatgccatggtac». Разработанные олигонуклеотиды проверяли в ПЦР с контрольной плазмидой, а сочетаемость с амплификацией внутреннего контроля проверяли в параллельной амплификации в одной пробирке ДНК крупного рогатого скота и плазмидной ДНК. Во всех случаях наблюдали успешную амплификацию. После определения маркерного локуса, провели ПЦР амплификацию для 112 образцов выделенных нуклеиновых кислот. Провирус-ная ДНК обнаружилась в 8 образцах, которые представлены в таблице 1.
Таблица 1 – Результаты ПЦР-амплификации
|
№ пробы |
цикл |
|
61 |
37,6 |
|
62 |
37,1 |
|
66 |
35,6 |
|
76 |
35,8 |
|
77 |
35,6 |
|
84 |
31,4 |
|
85 |
32,1 |
|
86 |
32,2 |
Заключение. Определенный в данной работе маркерный локус позволяет производить генную индикацию максимального количества изолятов ВАЭК с высокой степенью специфичности, подтвержденной в nBLAST анализе. В результате проведения ПЦР анализа для индикации вируса артрита-энцефалита коз, была найдена провирусная ДНК в 8 образцах, что говорит, о возможности наличия вируса в исследуемых хозяйствах.
По официальным данным эпизоотологический статус России по данному вирусу является «благополучным», но клиническая картина у потенциально-больных коз и факты индикации провирусной ДНК дают основания для дальнейших исследований.
Резюме
Цель исследования направлена на мониторинг козоводческих хозяйств Республики Татарстан по ВАЭК, а также поиск универсальных локусов генома, имеющихся у всех типов ВАЭК, для использования их в качестве генетических маркеров при ПЦР индикации вируса. Для достоверной амплификации генома ВАЭК требуется применение маркерных последовательностей, характеризующихся максимальной специфичностью и количеством выявляемых штаммов и изолятов вируса. Определенный в данной работе маркерный локус позволяет производить генную индикацию максимального количества изолятов ВАЭК с высокой степенью специфичности, подтвержденной в nBLAST анализе. В результате проведения ПЦР анализа для индикации вируса артрита-энцефалита коз, была найдена провирусная ДНК в 8 образцах, что говорит, о возможности наличия вируса в исследуемых хозяйствах.
Список литературы Индикация вируса артрита-энцефалита коз в ПЦР-РВ и поиск генетических маркеров
- Будулов, Н.Р. Нозологический профиль инфекционной патологии крупного рогатого скота в Республике Дагестан / Н.Р. Будулов, М.Ш. Шапиев, Р.А. Одемиров // Ветеринария. - 2018. - № 12. - С. 17-23.
- Ндайишимийе, Э.В. Биоинформационный анализ олигонуклеотидов для молекулярно-генетической индикации возбудителей аспергиллеза и аскосфероза пчел. / Э.В. Ндайишимийе, Н.И. Хаммадов, К.А. Осянин [и др.] // Ветеринарный врач. - 2015. - № 2. - С. 3-9.
- Покровская, Е.С. Антигенные кластеры трансмембранных и капсидных белков вируса артрита-энцефалита коз и их биоинформационный анализ / Е.С. Покровская, Э.А. Шуралев, М.Н. Мукминов, И.А. Елизарова [и др.] // Ветеринарный врач. - 2015. - № 6. - С. 16-22.
- Пушкарев, М.Г. Козоводство Удмуртии, состояние и перспективы развития. / М.Г. Пушкарев // Сборник научных трудов ставропольского научно-исследовательского института животноводства и кормопроизводства. - 2014. - № 7(3) - С. 149-151.
- Хаммадов, Н.И. Генетические маркеры вируса ящура крупного рогатого скота, геномный анализ / Н.И. Хаммадов // Проблемы особо опасных инфекций. - 2019. - № 2. -С.111-116.
- Blacklaws, B. Transmission of small ruminant lentiviruses / B. Blacklaws [et al.] // Vet Microbiol. - 2004. - V. 101, 3. - P. 199-208.
- Gholam, Ali Kojouri. Detection of Caprine Arthritis Encephalitis Virus (Caev) in Iran. / Mojdeh Emami, Hasan Momtaz. The First Molecular // Journal of Veterinary Science &Technology. - 2014. - № 5. - P. 3-5.
- Idres, T. Serological Diagnosis of Lentivirus Infection in Goats Raised in Algeria. / T. Idres, A. Lamara, S. Temim [et al.] // J Vet Res. - 2019. - №63 (1). - P.27-33.
- Khammadova, A.V. Design of primers for identification of honey bee viruses in multiplex-PCR. / A.V. Khammadova, E.A. Shuralev, N.I. Khammadov [et al.] // Astra Salvensis. - 2017. - №1(5). - P. 481-490.
- Marinho, R.C. Duplex nested-PCR or detection of small ruminant lentiviruses. / R.C. Marinho, G.R. Martins, K.C. Souza [et al.] // Braz J Microbiol. - 2018. - №1 - P. 83-92.
- Tesoro-Cruz, E. Frequency of the serological reactivity against the caprine arthritis encephalitis lentivirus gp135 in children who consume goat milk / E. Tesoro-Cruz [et al.] // Arch Med Res. - 2009. - V. 40, 3. - P. 204-207.


