Инфекционные осложнения в гематологии: эффект внедрения модулей защитной среды
Автор: Стома И.О., Усс А.Л., Искров И.А., Лендина И.Ю., Карпов И.А.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.14, 2018 года.
Бесплатный доступ
До настоящего времени в международной научной литературе не было опубликовано данных о влиянии инновационных модулей защитной среды на спектр и характеристики инфекций у взрослых пациентов гематологического профиля. Цель исследования: оценить изменения этиологического спектра и нозологических характеристик инфекций у пациентов группы высокого риска на фоне химиотерапии опухолевых заболеваний кроветворной ткани в контексте внедрения технологии многоступенчатой фильтрации, применяемой в аэрокосмической отрасли. В исследование было включено 60 взрослых пациентов группы высокого риска развития инфекций на фоне химиотерапии опухолевых заболеваний кроветворной ткани. Проспективно регистрировались микробиологические и клинические исходы лечения в изолированной стационарной среде и в стандартных условиях инфекционного контроля. Внедрение стационарных защитных модулей внешней среды позволило снизить частоту развития пневмоний у пациентов на фоне химиотерапии, а также сместить спектр возбудителей инфекций кровотока от высокоустойчивых грамотрицательных неферментирующих бактерий госпитальной среды к комменсальным энтеробактериям кишечника. Полученные результаты позволяют говорить о возрастании роли эндогенных инфекций, происходящих из сообщества бактерий кишечного микробиома, в клинике современной гематологии. Таким образом, на фоне повышения стерильности окружающей среды у пациентов при химиотерапии следует оценивать динамический состав микробиома кишечника для прогнозирования и профилактики бактериальных инфекций кровотока. Внедрение инновационных стационарных защитных модулей внешней среды позволяет достичь изменения спектра и характеристик инфекций на фоне химиотерапии, а именно снизить относительный вклад экзогенных инфекций, при сохранении рисков развития эндогенных инфекций, происходящих из бактериального сообщества кишечника
Инфекции в гематологии, сепсис, фебрильная нейтропения, инфекционный контроль, стационарная защитная среда
Короткий адрес: https://sciup.org/170172527
IDR: 170172527
Текст научной статьи Инфекционные осложнения в гематологии: эффект внедрения модулей защитной среды
Введение . Несмотря на внедрение системы инфекционного контроля и учёта антибиотиков в стационарах, инфекции остаются одной из наиболее значимых причин заболеваемости и летальности в гематологии,онкологии, трансплантологии, и сегодня представляют собой реальную угрозу дальнейшему внедрению высокотехнологичных процедур и операций в здравоохранении [1, 2]. Современные терапевтические подходы к лечению таких высокоустойчивых грамотрицательных инфекций резко ограничены,особенно в ситуациях с выделением чрезвычайно-резистентных представителей Enterobacteriaceae spp., P. aeruginosa и A. baumannii ,в то время как ассоциация неадекватно назначенной эмпирической антибактериальной терапии с риском летального исхода была показана ранее неоднократно [3, 4] p 0.01. Ряд профилактических мер используется в условиях современных стационаров, и среди них отдельным направлением является организация изолированной автономной внешней среды с высококачественной фильтрацией и ламинарным потоком воздуха.
В 2017 году в Республиканском центре гематологии (г. Минск) были установлены инновационные стационарные защитные среды Immunair производства компании «Airinspace» (Франция). Используемая в защитной среде система очистки воздуха основана на технологиях, берущих истоки из аэрокосмической отрасли. В частности, технология многоступенчатой фильтрации «HEPA-MD» создана на основе технологии, применяемой на Международной Космической Станции для очистки поступающего внутрь воздуха.
Цельюданного проспективного пилотного клинического исследования было оценить изменения этиологического спектра и нозологических характеристик инфекций у пациентов группы высокого риска на фоне химиотерапии
Материалы и методы. Используемый модуль «Immunair» в сочетании с блоком очистки воздуха представляет собой автономную изолированную систему палаточного типа для обеспечения защиты иммунокомпрометиро-ванных пациентов от воздействия микроорганизмов, летучих соединений и твердых частиц, содержащихся в воздушной среде.В основе многоступенчатой системы фильтрации лежит плазменный фильтр, генерирующий мощное ионизирующее излучение. В результате прохождения через все ступени фильтрации, воздух, подаваемый в модуль, соответствует классу чистоты ISO 5 (согласно международному стандарту ISO 14644–1). Такой класс чистоты требуется при проведении хирургических операций по имплантации или трансплантации органов, изоляции пациентов с иммуносупрессией, в том числе после трансплантации гемопоэтических стволовых клеток и химиотерапии.
В исследование было включено 60 взрослых пациентов группы высокого риска инфекционных осложнений, получающих химиотерапию по поводу опухолевых заболеваний кроветворной ткани на базе 2 блоков отделения гематологии № 3 в 2017–2018 гг., в том числе в стационарной защитной среде (46 и 14 пациентов соответственно). Группа высокого риска инфекций определялась согласно критериям Американского общества инфекционных заболеваний (IDSA) [5]. Клинические и демографические показатели пациентов в зависимости от среды лечения представлены в Таблице 1. Стандартные меры инфекционного контроля соблюдались вне зависимости от среды нахождения пациента.У пациентов с абсолютным числом нейтрофилов менее 100 кл/мкл согласно международным рекомендациям вы- полнялась пероральная антибактериальная профилактика фторхинолонами [5, 6]. При развитии у пациентов синдрома фебрильной нейтропении согласно критериям Американского общества инфекционных заболеваний, назначалась эмпирическая антибактериальная терапия (эскалационная или де-эскалационная стратегия в зависимости от тяжести и факторов риска пациента) [5]. Диагноз пневмонии требовал клинико-рентгенологического подтверждения во всех случаях. Микробиологические исследования выполнялись согласно Приказу МЗ РБ 1301, с использованием стандартных флаконов для исследования крови на стерильность компании BioMerieux, гемокультиватора BacT/ ALERT 3D, идентификация и определение чув- ствительности к антибиотикам проводились с помощью автоматического бактериологического анализатора Vitek 2 (BioMerieux), уровни минимальных ингибирующих концентраций оценивались согласно критериям EUCAST. Критерии профилей резистентности микроорганизмов к антибиотикам определялись согласно рекомендациям Европейского центра по предотвращению и контролю заболеваний (ECDC) [7]. Статистическая обработка данных выполнялась непараметрическими методами медицинской статистики (метод Хи-квадрат, точный тест Фишера), тип распределения данных определялся методом Шапиро-Уилка, различия считались достоверными при значении p < 0.05.
Таблица 1.
|
Характеристика |
Группа стандартной среды предосторожности, абс.( %) |
Группа изолированной стационарной среды, абс.( %) |
|
Возраст, годы (медиана, интеркв. интервал) |
49 (36–61) |
32.5 (28–43) |
|
Пол (женский) |
18 (39.1) |
6 (42.9) |
|
Основной диагноз: Острый миелоидный лейкоз Острый лимфобластный лейкоз Апластическая анемия Множественная миелома Миелодиспластический синдром Хронический миелолейкоз Хронический лимфолейкоз |
26 (56,5) 9 (19,6) 5 (10,9) 4 (8,7) 1 (2,2) 1 (2,2) |
11 (78,6) 2 (14,3) 1 (7,1) — — — — |
|
Стадия основного заболевания: Прогрессия Ремиссия |
26 (56,5) 20 (43,5) |
8 (57,1) 6 (42,9) |
Клинические и демографические базовые характеристики пациентов в исследовании
Этиологический спектр и нозологические характеристики инфекций у пациентов на фоне химиотерапии представлены в Таблице 2. Но- зологические характеристики инфекционного процесса отражены на Рис. 1.
Таблица 2.
|
Характеристика инфекционного процесса |
Группа стандартной среды предосторожности, абс. ( %) |
Группа изолированной стационарной среды, абс. ( %) |
p |
|
Нозология: Инфекция кровотока Пневмония Инф. кожи и мягких тканей Инф. верхних дых. путей Фебрильная нейтропения |
18 (39,1) 17 (37,0) 3 (6,5) 5 (10,9) |
7 (50,0) 1 (7,1) 2 (14,3) 2 (14,3) 1 (7,1) |
0,0263 |
|
Возбудитель: Enterobacteriaceae spp .* ГОНБ ** Enterococcus spp . Коагулазонег. стафилококк |
17 (37,0) 3 (6,5) 1 (2,2) — |
8 (57,1) — 1 (7,1) |
0,2514 |
|
Профиль резистентности: Non-MDR MDR XDR |
8 (17,4) 4 (8,7) 11 (24,0) |
2 (14,3) 4 (28,6) 3 (21,4) |
0,2821 |
Характеристики инфекций у пациентов в исследовании в зависимости от среды нахождения
* Включали E. coli, K. pneumoniae, Proteus spp .
** Включали A. baumannii, P. aeruginosa
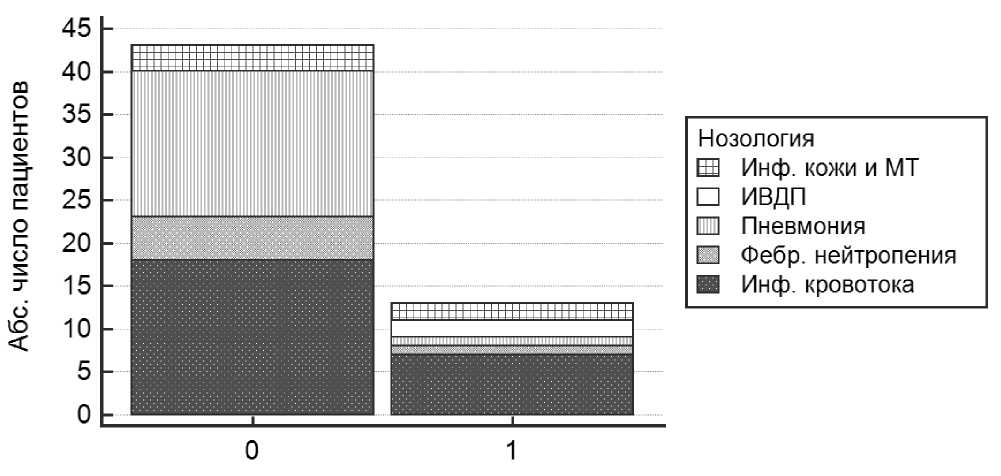
Рисунок 1. Нозологические характеристики инфекционного процесса на фоне химиотерапии в зависимости от среды нахождения.
Результаты и обсуждение. Полученные результаты позволяют говорить об эффективности использования изолированных стационарных систем для профилактики развития высокоустойчивых инфекций госпитальной среды, в частности пневмоний, а также инфекций, вызванных грамотрицательными неферментирующими бактериями (A. baumannii P. aeruginosa). Однако так как состояние хими- отерапевтически-ассоциированного мукозита формирует так называемое «окно» между бактериями микробиома кишечника и кровяным руслом пациента, такие стерильные системы не смогут защитить от энтерогенных инфекций кровотока, вызванных представителями семейства Enterobacteriaceae spp. (E. coli, K. pneumoniae). Стоит также отметить, что полученные результаты соотносятся с последними данными о селективном прессинге в пользу энтеробактерий в кишечнике у пациентов на фоне антибактериальной и противоопухолевой терапии [8, 9]. Показанная нами смена нозологий инфекционных осложнений в результате внедрения изолированных палаток внешней среды также соотносится с аналогичными данными о снижении воздушно-капельных инфекций в когорте пациентов детского возраста [10].
На втором этапе исследования выполнялся предварительный фармакоэкономический анализ прямого расходования наиболее высокозатратных позиций антибактериальной и противогрибковой терапии в связи с внедрением в отделении изолированной защитной среды. Важно отметить, что за период сравнения в анализе брался аналогичный сезонный период, а также нозологическая структура опухолевых заболеваний кроветворной ткани и демографические характеристики пациентов периода сравнения в отделении не поменялись за время внедрения изолированной защитной среды,в то время как интенсивность работы отделения и количество пролеченных пациентов повысилось с её внедрением (629 и 788 пациентов соответственно). При этом наиболее заметно снизился расход противогрибковых лекарственных средств из группы эхинокан-динов (каспофунгин), что может быть объяснено снижением удельного веса пневмоний и отсутствием кандидемий в изменившейся структуре инфекций и, соответственно, более редким включением каспофунгина в состав эмпирической схемы лечения фебрильной нейтропении (12,3 против 3,7 долл. США/пациента соответственно).
Выполненное исследование проводилось на базе одного учреждения,таким образом, протоколы антимикробной терапии и профилактики, а также изначальные эпидемиологические характеристики внешней среды стационара были практически одинаковы в группах сравнения, что позволяет с уверенностью утверждать,что выявленные изменения в спектре и характеристиках инфекций связаны именно с внедрением стационарной внешней среды в гематологии.Стоит также подчеркнуть,что выводы исследования базируются в основном на когорте пациентов с острым миелолейкозом, однако данная клиническая модель глубокой химиотерапевтиче-ски-ассоцированной нейтропении и мукозита достаточно наглядно отражает патогенез инфекций у других гематологических пациентов с медикаментозной иммуносупрессией. Опубликованные исследования в области микробиома человека продемонстрировали, что разнообразный, высокодифференцированный состав кишечного микробиома оказывает защитный эффект против ряда инфекций,а также способен предотвращать колонизацию кишечника высокоустойчивыми патогенами, в том числе возбудителями кишечных инфекций [8, 11, 12], что может в будущем послужить основой для разработки новых лекарственных средств. В заключение отметим, что внедрение в гематологическую практику стационарных защитных сред продолжает являться важным компонентом инфекционного контроля в стационаре, так как позволяет сместить спектр инфекций у пациентов от наиболее резистентных микроорганизмов госпитальной среды к коммен-сальным микроорганизмам кишечника, что при наличии адекватной системы назначения антибиотиков является гораздо менее угрожающим явлением.
Список литературы Инфекционные осложнения в гематологии: эффект внедрения модулей защитной среды
- Albiger B. et al. Carbapenemase-producing Enterobacteriaceae in Europe: assessment by national experts from 38 countries, May 2015 / B.Albiger et al. // Eurosurveillance.— 2015.— Vol. 20, № 45.
- Kazmierczak K. M. et al. Multiyear, Multinational Survey of the Incidence and Global Distribution of Metallo-ß-Lactamase-Producing Enterobacteriaceae and Pseudomonas aeruginosa / K. M. Kazmierczak et al. // Antimicrobial Agents and Chemotherapy.— 2016.— Vol. 60, № 2.— P. 1067-1078.
- Falcone M. et al. Predictors of outcome in ICU patients with septic shock caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae / M. Falcone et al. // Clinical Microbiology and Infection.— 2016.— Vol. 22, № 5.— P. 444-450.
- Tumbarello M. et al. Infections caused by KPC-producing Klebsiella pneumoniae: differences in therapy and mortality in a multicentre study / M. Tumbarello et al. // Journal of Antimicrobial Chemotherapy.— 2015.— Vol. 70, № 7.— P. 2133-2143.
- Freifeld A. G. et al. Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America / A. G. Freifeld et al. // Clinical Infectious Diseases.— 2011.— Vol. 52, № 4.— P. E56-e93.
- Tomblyn M. et al. Guidelines for Preventing Infectious Complications among Hematopoietic Cell Transplantation Recipients: A Global Perspective / M. Tomblyn et al. // Biology of Blood and Marrow Transplantation.— 2009.— Vol. 15, № 10.— P. 1143-1238.
- Magiorakos A.-P. et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance: International standard definitions for acquired resistance / A.-P. Magiorakos et al. // Clinical Microbiology and Infection.— 2012.— Vol. 18, № 3.— P. 268-281.
- Buffie C. G. et al. Microbiota-mediated colonization resistance against intestinal pathogens / C. G. Buffie, E. G. Pamer // Nature Reviews Immunology.— 2013.— Vol. 13, № 11.— P. 790-801.
- Taur Y. et al. Intestinal Domination and the Risk of Bacteremia in Patients Undergoing Allogeneic Hematopoietic Stem Cell Transplantation / Y. Taur et al. // Clinical Infectious Diseases.— 2012.— Vol. 55, № 7.— P. 905-914.
- Libbrecht C. et al. Impact of a change in protected environment on the occurrence of severe bacterial and fungal infections in children undergoing hematopoietic stem cell transplantation / C. Libbrecht et al. // European Journal of Haematology.— 2016.— Vol. 97, № 1.— P. 70-77.
- Becattini S. et al. Antibiotic-Induced Changes in the Intestinal Microbiota and Disease / S. Becattini, Y. Taur, E. G. Pamer // Trends in Molecular Medicine.— 2016.— Vol. 22, № 6.— P. 458-478.
- Taur Y. et al. Microbiome mediation of infections in the cancer setting / Y. Taur, E. G. Pamer // Genome Medicine.— 2016.— Vol. 8, № 1.— P. 40.


