Интенсивность роста в культуре изолятов фомопсиса при разных температурах и токсичность их культуральных фильтратов для проростков подсолнечника
Автор: Арасланова Н.М., Челюстникова Т.А., Антонова Т.С.
Рубрика: Защита и иммунитет
Статья в выпуске: 1 (153-154), 2013 года.
Бесплатный доступ
В статье представлены результаты изучения интенсивности роста колоний и токсичности культурных фильтратов изолятов Фомопсиса, которые отличаются макроморфологическими признаками и наличием спор в альфа-пикнидии. Сравнение темпов роста изолятных культур при разных температурах показало, что выявленные различия не связаны с наличием спор в альфа-пикнидии. Интенсивность роста колоний зависела от температуры культивирования и была максимальной при 26 ° C. Токсичность культурных фильтратов в отношении прорастания семян подсолнечника также не связана с присутствием конидиума в альфа-пикнидии.
Фомопсис, изоляты, интенсивность роста, токсичность, культуральные фильтраты, температура, проростки, подсолнечник
Короткий адрес: https://sciup.org/142171300
IDR: 142171300 | УДК: 633.854.78:632
Текст научной статьи Интенсивность роста в культуре изолятов фомопсиса при разных температурах и токсичность их культуральных фильтратов для проростков подсолнечника
Введение . Фомопсис, возбудителем которого является Phomopsis (Diaporthe)
helianthi Munt.-Cvetk., Michal., Petr. продолжает оставаться одним из массовых заболеваний подсолнечника во многих странах, возделывающих эту культуру: Югославии, Румынии, Венгрии, Франции, Австралии, Аргентине, Бразилии, США, Канаде, Иране. В России этот гриб впервые зарегистрирован более двадцати лет назад и до сих пор является карантинным объектом. За это время он повсеместно распространился в регионах возделывания подсолнечника РФ. Вредоносность и распространённость фомоп-сиса зависят от погодных условий. Несмотря на изменение климата в сторону повышенных температур и неустойчивой влажности, фомопсис – по-прежнему частое явление в посевах этой культуры, что свидетельствует об адаптации биотипов гриба к неблагоприятным условиям высоких температур и пониженной влажности воздуха.
Вариабельность изолятов фомопсиса по степени их агрессивности для вегетирующих растений подсолнечника, а также скорости роста мицелия в культуре изучалась многими авторами. Французскими учеными было доказано, что скорость роста мицелия на питательной среде не коррелирует с размером пятен на пораженных стеблях подсолнечника [2]. Имеются также сведения о большем влиянии погодных условий на агрессивность изолятов фомопсиса нежели места их географического происхождения [3]. По нашим данным, агрессивность географически отдалённых друг от друга изолятов больше связана с токсичностью их культуральных фильтратов, чем со скоростью роста мицелия іn vitro [8].
Разнообразие грибов рода Phomopsis (Diaporthe) на широком ассортименте культурных и дикорастущих растений-хозяев было отмечено многими учёными. Основой для видовой дифференциации до последнего времени являлась связь с хозяином, так как морфологические и культуральные признаки зависимы от условий выращивания чистой культуры.
Недавние исследования, проведённые в Австралии, свидетельствуют о том, что на подсолнечнике может развиваться более одного вида фомопсиса. Изучение более 500 изолятов фомопсиса, выделенных из поражённых растений подсолнечника, показало, что многие из них не относятся к виду helianthi . Это подтверждено молекулярным анализом коллекции изолятов фомопсиса [1].
Исследования морфологических, адаптивных и патогенных свойств грибов рода Phomopsis (Diaporthe), встречающихся в посевах подсолнечника на юге России, не утратили свою актуальность.
Цель данной работы сравнить скорость роста мицелия іn vitro при разных температурах и токсичность культуральных фильтратов для прорастающих семян подсолнечника изолятов фомопсиса, различающихся наличием в пикнидах альфа-конидий.
Материалы и методы. В качестве объекта исследований из 96 изолятов фомопсиса 2011 г. были выбраны восемь. Изоляты гриба хранились на стерильных семянках подсолнечника при -80 °С. Чистые культуры этих изолятов выращивали на картофельно-глюкозном агаре (КГА). Питательную среду КГА готовили следующим образом: 200 г очищенного и измельченного картофеля варили в 1 л воды 2,5 часа, отвар фильтровали, добавляли в него 20 г глюкозы, 5 г поваренной соли, 20 г агара. Стерилизовали при 1,2 атм. в течение 30 мин и разливали в стерильные чашки Петри диаметром 9 см. В каждую чашку высевали по одной семянке, повторность 3-кратная. Чашки с изолятами помещали в термостаты без освещения с температурой 15, 20, 26, 30, 35 оС, где выращивали в течение 14 дней. Через каждые два дня культивирования измеряли диаметр растущих колоний. Отмечали также начало образования пикнид у этих изолятов. Содержимое пикнид изучали препаративно, определяя наличие альфа- и бета-конидий. Получение чистых культур и изучение макро- морфологических признаков проводили по общепринятым методикам [5].
Культуральный фильтрат получали путём выращивания колоний изолятов фомопсиса в жидкой картофельно-глюкозной среде (КГ) при температуре 25– 27 оС и естественном освещении в течение 14 дней. После этого культуры фильтровали. Семянки подсолнечника двух гибридов с разной устойчивостью к фомопсису замачивали на 12 часов в полученном фильтрате, раскладывали на влажную фильтровальную бумагу и проращивали при температуре 26 оС. Через 2 суток учитывали количество непроросших семян, через 5 суток измеряли длину проростка. Контрольными вариантами были вода и чистая КГ среда. Токсичность культуральных фильтратов определяли по методикам Чумакова и Минкевича [6].
Результаты и обсуждение. Наши исследования прошлых лет по сравнению культуральных характеристик, скорости роста мицелия in vitro при разных температурах, токсичности культурального фильтрата для прорастающих семян подсолнечника показали большое внутривидовое разнообразие Phomopsis (Diaporthe) helianthi Munt.-Cvetk., Michal., Petr. по этим признакам [7–9]. Следует отметить, что в пикнидах всех изученных изолятов наблюдались только бета-конидии.
В 2011 г. в окрестностях г. Краснодара и в Ростовской области нами были собраны 96 поражённых стеблей подсолнечника, из которых были выделены изоляты фомопсиса. У шести изолятов в пикнидах наряду с бета- были обнаружены также и альфа-конидии. Видовую принадлежность этих изолятов необходимо подтвердить дополнительными исследованиями. Возможно, они более вредоносны для подсолнечника, чем изоляты Phomopsis (Diaporthe) helianthi. Для установления их патогенности изучали интенсивность развития культур при разных температурных режимах и токсичность культуральных фильтратов для прорастающих семян подсолнечника.
Для исследований были отобраны восемь изолятов, три из которых вместе с бета- имели и альфа-конидии в пикнидах, а пять изолятов различались макромор-фологическими признаками колоний (табл. 1).
Таблица 1
Макроморфологические признаки изолятов фомопсиса
|
№ |
Характеристика мицелия |
наличие стилоспор |
|
1 |
Белый, субстратный |
ß |
|
2 |
Оливковый, плотный, воздушный |
ά и ß |
|
3 |
Белый, пушистый, воздушный |
ß |
|
5 |
Белый, плотный, субстратный |
ά и ß |
|
9 |
Оливковый, плотный, субстратный |
ß |
|
10 |
Желтоватый, плёнчатый, воздушный |
ά и ß |
|
19 |
Грязно-жёлтый, плёнчатый, воздушный |
ß |
|
21 |
Светло-жёлтый, плёнчатый, пикниды погружены в мицелий |
ß |
По полученным данным, самым неблагоприятным для роста и развития гриба был температурный режим 35 оС: у всех изученных изолятов в течение восьми дней наблюдалось полное отсутствие роста мицелия. Однако жизнеспособность мицелия большинства из них сохранилась. Доказательством тому служило последующее культивирование в оптимальных условиях. Уже на четвёртые сутки у 7 изолятов возобновился рост мицелия и только один изолят оставался нежизнеспособным до окончания эксперимента.
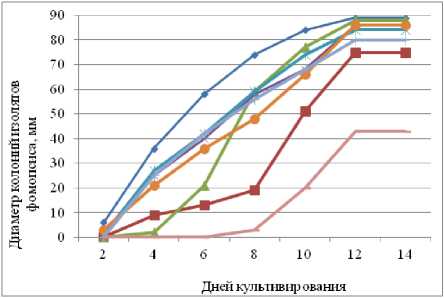
При пониженной температуре культивирования (15 оС) выявились различия по скорости роста колоний гриба (рис. 1). Медленный рост колоний наблюдался у изолятов № 21 и № 2. На 15-й день их диаметр был равен 43 и 74 мм соответственно. У других изолятов колонии достигли 80–90 мм, и было отмечено начало образования пикнид. Быстрый рост колоний отмечен у изолята № 1.
15 оС
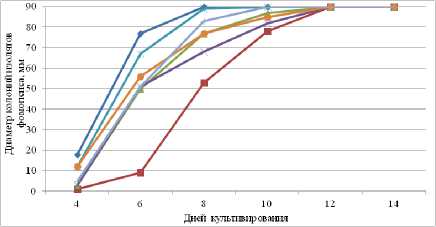
20 оС
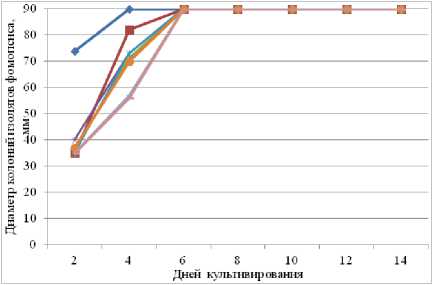
26 оС
При 20 оС колонии всех изолятов на 7– 12-й день после посева полностью покрывали поверхность чашек Петри. На 10-й день на всех культурах были обнаружены первые сформировавшиеся пикниды.
При 26 оС мицелий всех изолятов рос быстро, равномерно распределяясь по поверхности среды, и на 5–7-й день уже достигал 90 мм в диаметре. На 7-й день отмечено начало образования пикнид.
Угнетение скорости роста мицелия у всех изолятов наблюдалось при температуре 30 оС. На 15-е сутки культивирования диаметр их колоний не достиг 90 мм.
Зависимость от температуры средних показателей скорости роста мицелия всех изолятов представлена на рисунке 2. Наиболее интенсивно фомопсис развивался в чистой культуре первые два дня при температуре 26 и 30 оС. Однако через четыре дня рост колоний у всех изолятов фомопсиса при температуре 30 оС замедлился. В конце эксперимента диаметр колоний при 15 оС был больше, чем при 30 оС.
30 оС
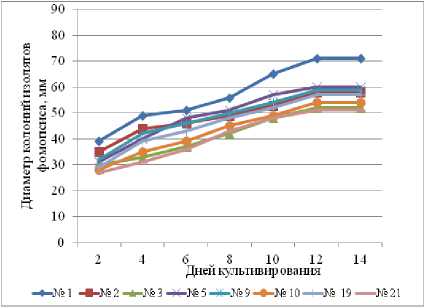
Рисунок 1 – Динамика роста мицелия изолятов фомопсиса на питательной среде (КГА) при различных температурах
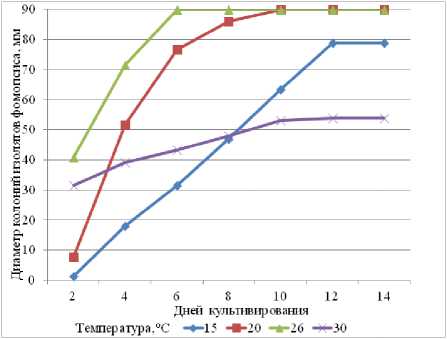
Рисунок 2 – Влияние температурных режимов на скорость роста колоний фомопсиса на агаризованной среде
Таким образом, высокая скорость роста колоний на питательной среде наблюдалась у всех изолятов при температуре 26 оС. Температура 30 оС и выше угнетала рост гриба. Дифференцирование изолятов по диаметру колоний наблюдалось при 15 оС. При всех изученных температурных режимах быстрее других развивался изолят № 1, что, по-видимому, свидетельствует о его большой адаптивности. Различий по интенсивности роста колоний изолятов фомопсиса, связанных с присутствием в пикнидах альфа-конидий, не обнаружено.
Наиболее благоприятным для образования пикнид был температурный режим 26 оС. Пикниды начали формироваться на 7-й день у всех изученных изолятов, и количество их на 15-й день было в десятки раз больше, чем при других температурах культивирования (табл. 2).
Таблица 2
Влияние температуры на образование пикнид в колониях изолятов фомопсиса на 15-й день культивирования на агаризованной среде (КГА )
|
Изолят, № |
Температура, оС |
|||
|
15 |
20 |
26 |
30 |
|
|
Количество пикнид, шт. |
||||
|
1 |
2 |
116 |
816 |
0 |
|
2* |
0 |
63 |
214 |
0 |
|
3 |
3 |
130 |
348 |
0 |
|
5* |
2 |
15 |
97 |
0 |
|
9 |
8 |
3 |
108 |
0 |
|
10* |
1 |
26 |
276 |
0 |
|
19 |
2 |
39 |
412 |
0 |
|
21 |
0 |
1 |
93 |
0 |
* – изоляты, в пикнидах которых обнаружены альфа-конидии
Высокая температура (30 оС) оказала угнетающее действие на формирование пикнид. У всех изолятов на 15-й день на колониях не образовалось ни одной пикниды.
Таким образом, количество сформированных пикнид при разных температурах не связано с присутствием альфа-конидий у изолятов, так как их образование в основном зависит от температурного фактора.
Согласно нашим многолетним исследованиям, токсичность культурального фильтрата может служить критерием агрессивности изолятов фомопсиса. Использование этого критерия позволяет в лабораторных условиях отобрать самый агрессивный изолят для искусственного заражения растений подсолнечника.
Изучение токсичности культуральных фильтратов изолятов фомопсиса с альфа-конидиями в пикнидах показало, что они угнетают прорастание семян и рост проростков у восприимчивого гибрида подсолнечника Юпитер (табл. 3). Культуральные фильтраты всех изолятов, кроме № 1, оказались токсичными по отношению к прорастающим семенам этого гибрида. Количество непроросших семян существенно превышало контрольные варианты.
Таблица 3
Прорастание семян после замачивания в культуральных фильтратах изолятов фомопсиса и длина 5-дневных проростков у гибридов подсолнечника
|
№ изолята |
Кубанский 930 |
Юпитер |
||
|
**коли-чество непроросших семян, шт. |
длина проростка, см |
количество непроросших семян, шт. |
длина проростка, см |
|
|
1 |
8 |
10,2 |
5 |
9,7 |
|
2* |
5 |
8,5 |
8 |
6,0 |
|
3 |
10 |
9,4 |
12 |
4,9 |
|
4 |
9 |
7,1 |
9 |
8,0 |
|
5* |
8 |
8,3 |
10 |
5,7 |
|
6 |
10 |
9,6 |
8 |
9,6 |
|
7* |
8 |
10,3 |
9 |
7,5 |
|
8 |
7 |
8,8 |
11 |
6,8 |
|
Вода (контроль) |
5 |
11,6 |
2 |
11,4 |
|
Питательная среда (КГ) (контроль) |
8 |
6,8 |
5 |
9,4 |
|
НСР 05 |
2,5 |
0,5 |
2,3 |
0,6 |
* – изоляты, в пикнидах которых обнаружены альфа-конидии
** – приведено среднее количество из двух повторностей, в каждой было по 100 семянок
Изоляты различались токсичностью культуральных фильтратов для прорастающих семян гибрида Юпитер. Количество непроросших семян после воздействия культуральных фильтратов № 3 и 8 существенно превышало как № 1, 2, 6, так и контрольные варианты с водой и питательной средой (КГ). Изолят № 1, с высокой скоростью роста мицелия в культуре, по токсичности культурального фильтрата был на уровне контроля КГ.
После воздействия культуральных фильтратов изолятов № 2, 5 и 7 у высоко толерантного гибрида Кубанский 930 наблюдалась стимуляция роста проростков, разница в прорастании семян по сравнению с контролем (питательная среда КГ) была несущественна.
Таким образом, проведенные исследования позволяют сделать следующие выводы: скорость роста колоний изолятов фомопсиса на КГА не имеет прямой связи с токсичностью культурального фильтрата для прорастающих семян. Разнообразие изолятов по отношению к температуре культивирования определяет адаптивность рода Phomopsis (Diaporthe) к внешним условиям среды.
Различия по агрессивности изолятов фомопсиса (токсичности культурального фильтрата по отношению к прорастающим семенам подсолнечника), не связаны с присутствием в пикнидах альфа-конидий.
Для уточнения видовой принадлежности изолятов, в пикнидах которых присутствуют альфа-конидии, необходимы дополнительные исследования.
Исследования выполнены при финансовой поддержке Международного научно-технического центра (МНТЦ), грант 3034.


