Инвазивный аспергиллез у больных множественной миеломой: описание клинического случая и результаты многоцентрового исследования
Автор: Шадривов О.В., Пивоварова В.И., Чудиновских Ю.А., Шнейдер Т.В., Успенская О.С., Волкова А.Г., Попова М.О., Десятик Е.А., Павлюченко Е.С., Борзова Ю.В., Богомолова Т.С., Игнатьева С.М., Зубаровская Л.С., Климко Н.Н.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
В многоцентровое исследование в 1998-2017гг. включили 46 взрослых больных множественной миеломой (ММ) и инвазивным аспергиллезом (ИА), что составляет 7% от взрослой онкогематологической когорты больных ИА. Медиана возраста больных ММ и ИА - 55 лет (26-79), женщин - 59%. В группу сравнения включили 18 сравнимых по полу и возрасту больных ММ с инфекционным синдромом и признаками поражения легких, у которых ИА был исключен. Установлено, что у 54% больных ИА развивался на фоне дебюта или рефрактерного течения ММ. Преобладали пациенты с III стадией ММ по B.Durie, S.Salmon (86%). Установлены факторы риска развития ИА: неконтролируемое течение ММ (34% vs. 5%, p=0.001), длительная>10 дней лимфоцитопения (56% vs. 26%, p=0.01) и проведение алло-ТГСК (11% vs. 0%, p=0.01). Тяжелая бактериальная инфекция предшествовала развитию ИА в 33% случаев. Поражение легких наблюдали у 100% больных. Основные возбудители ИА - A. niger (43%) ИА. fumigatus (38%). Антимикотическую терапию (вориконазол - 87%) получали все пациенты. Общая 12-недельная выживаемость больных ММ и ИА составила 93%.
Инвазивный аспергиллез, множественная миелома, онкогематологические заболевания, лимфоцитопения
Короткий адрес: https://sciup.org/170172541
IDR: 170172541
Текст научной статьи Инвазивный аспергиллез у больных множественной миеломой: описание клинического случая и результаты многоцентрового исследования
Материалы и методы . Регистр больных ИА включает 630 взрослых онкогематологических пациентов, госпитализированных в различные стационары РФ с 1998 по 2020 гг. В ретроспективное многоцентровое исследование включили 46 взрослых больных ММ и ИА, что составляет 7 % от взрослой онкогематологи-ческой когорты. Возраст пациентов основной группы составил от 26 до 79 лет (медиана — 55), женщин — 59 %. В группу сравнения включили 18 взрослых больных ММ с инфекционным синдромом и признаками поражения легких, у которых ИА был исключен в ходе обследования. Возраст пациентов составил от 35 до 70 лет (медиана — 56,5), женщин — 50 %. Анализировали демографические показатели, данные анамнеза заболевания,факторы риска развития ИА, этиологию, а также результаты обследования и лечения.
Для диагностики ИА и оценки эффективности терапии использовали клинические и лабораторные критерии, предлагаемые Европейской организацией по исследованию и лечению рака (EORTС/MSG) [3, 4]. Инструментальные методы диагностики: пациентам проводили компьютерную томографию органов грудной клетки (КТ ОГК) в режиме высокого разрешения, по показаниям — КТ придаточных пазух носа (ППН), органов брюшной полости и забрюшинного пространства,а также биопсию тканей. С диагностической целью выполняли фибробронхоскопию (ФБС) с забором бронхоальвеолярного лаважа (БАЛ). Лабораторная диагностика ИА включала микроскопию и посев БАЛ и другие биосубстраты, а также тест на га- лактоманнан. Из образцов биосубстратов (БАЛ, мокрота и пр.)готовили препараты в просветляющей жидкости (10 % раствор КОН в 10 % водном растворе глицерина) с добавлением флуоресцирующего маркера (калькофлуор белый). Окрашенный препарат просматривали в люминесцентном микроскопе,отмечали наличие септированных нитей мицелия,ветвя-щихся под углом 450. Для получения культуры гриба выполняли посев патологического материала на специализированную среду и инкубировали в течение 10 дней при температуре +28 °C и +37 °C. Содержание галактоманнана в сыворотке крови и БАЛ определяли имму-ноферментным методом с использованием специфической диагностической тест-системы PLATELIA® Aspergillus (BIO–RAD Laboratories, США). Диагностически значимым считали индекс выше «0,5» в сыворотке крови и выше «1,0» в БАЛ. Полученные в процессе исследования медико-биологические данные обрабатывали с помощью программной системы STATISTICA for Windows (версия 10.0) с использованием непараметрической статистики — критерия Уилкоксона-Манна-Уитни.
Описание клинического случая . Пациент 54-х лет в 2016 г. был обследован в микологической клинике СЗГМУ им. И. И. Мечникова. Из анамнеза известно, что в 2014 г. была диагностирована ММ, IgA, IIIA стадия по B. Durie, S. Salmon. После 4-х курсов индукции по протоколу «VD» (бортезомиб + дексаметазон) был достигнут полный клинико-гематологический ответ. Учитывая молодой возраст, в качестве интенсификации терапии в сентябре 2014г. провели аутологичную трансплантацию гемопоэтических стволовых клеток (ауто-ТГСК), после чего пациент получал поддерживающую терапию бортезомибом 1 мг/м2 два раза в месяц и дексаметазоном 20 мг в неделю. В декабре 2015 г. диагностировали прогрессию ММ, инициировали химиотерапию леналидомидом и пульс-терапию дексаметазоном.
В феврале 2016 г. на фоне кратковременного (7 дней) периода агранулоцитоза и клинически значимой лимфоцитопении (количество лимфоцитов менее 1,0 × 109/л) возник инфекционный синдром с признаками поражения легких, нарастала дыхательная недостаточность. На КТ ОГК в обоих легких выявили множественные очаги по типу «матового стекла», в S6 правого легкого — мягкотканный компонент, деструкция 6-го ребра.
С диагностической целью выполнили ФБС. При микроскопии и посеве БАЛ мицелиальных грибов не выявили,тесты на галактоманнан и пневмоцистоз — отрицательны. Пациент получал терапию антибиотиками широкого спектра действия (инванз 1,0/сутки в/в, азитромицин 500 мг/сутки в/в) и эмпирическую антимикотическую терапию микафунгином в дозе 100 мг/сутки. На фоне проводимой терапии достигнуто купирование лихорадки и уменьшение одышки. Однако отмечали отрицательную КТ-динамику в виде нарастания инфильтративных изменений с тенденцией к формированию полостей распада. 10.03.2016 г. пациенту повторно выполнили ФБС. При исследовании БАЛ был получен положительный результат теста на галактоманнан (ИОП = 2,1). На основании клинических симптомов,дан-ных КТ ОГК и результатов серологического исследования диагностировали «вероятный» ИА с поражением легких. Провели коррекцию антимикотической терапии,к лечению добавили вориконазол 800 мг в первые сутки, далее — 400 мг/сутки. По данным КТ ОГК отмечали уменьшение количества и размеров очагов. Продолжили терапию основного заболевания по протоколу «RVD» (бортезомиб, леналидомид, дексаметазон). Общая продолжительность антимикотической терапии составила 3 месяца, была достигнута ремиссия ИА.
Результаты исследования. Анализ демографических данных показал,что среди больных ММ и ИА женщин было несколько больше (59 %), чем мужчин. Возраст пациентов варьировал от 26 до 79 лет (медиана — 55). Среди больных ИА преобладали пациенты с III стадией ММ по B. Durie, S. Salmon — 86 % (IIIA — 54 %; IIIB — 32 %), II стадию ММ диагностировали в 14 % случаев, I линию терапии (VCD, PAD, VD) получали 61 % пациентов. Медиана количества курсов химиотерапии ММ до начала инфекционных проявлений в группе больных ИА — 4 (1–18), в группе без ИА — 5 (1–13). При этом примерно в половине случаев (54 %) ИА развился на фоне рефрактерного/рецидивиру-ющего течения ММ или в период инициации химиотерапии впервые выявленного заболевания. В то время как в группе сравнения инфекционный синдром возник в период дебюта или неконтролируемого течения ММ всего у 22 % пациентов.
При сравнении пациентов с ММ и ИА с больными контрольной группы выявили следующие факторы риска: неконтролируемое течение ММ (34 % vs. 5 %, p = 0.001), длительная, более 10 дней, лимфоцитопения (56 % vs. 26 %, р = 0.01), а также проведение алло-ТГСК (11 % vs. 0 %, p = 0.01). Несмотря на то, что агранулоцитоз является типичным фактором риска развития ИА, его наблюдали с одинаковой частотой в группах сравнения (71 % vs. 72 %), медиана продолжительности агранулоцитоза также не различалась (11 vs. 10,5 дней). Глюкокортикостероиды включены во все протоколы лечения ММ, поэтому различий между группами по данному фактору риска также выявлено не было. Ауто-ТГСК реже применяли у пациентов с ИА (39 % vs. 73 %, p = 0.03). В период, предшествующий развитию ИА, тяжелую бактериальную инфекцию диагностировали у 33 % пациентов. Из других сопутствующих патологий в группе больных ИА ХОБЛ выявили у 9 %, гипергликемию — у одного пациента.
В 100 % случаев диагностировали ИА с поражением легких, у 4 % пациентов было сочетание легочной локализации и ППН. Клинические признаки были неспецифичными,у большинства пациентов отмечали лихорадку (82 %) и кашель (70 %). Примерно в трети случаев поражение легких сопровождалось дыхательной недостаточностью (35 %), кровохарканье было редким симптомом (4 %).
На КТ ОГК преимущественно отмечали одно- или двустороннее очаговое поражение легких — 61 %, у 22 % больных выявили двусторонние инфильтраты, гидроторакс — у 9 %. Типичные для ИА КТ-признаки выявляли редко: симптом «серпа» — 7 %, симптом «ореола» — 4 % (рисунок 1).
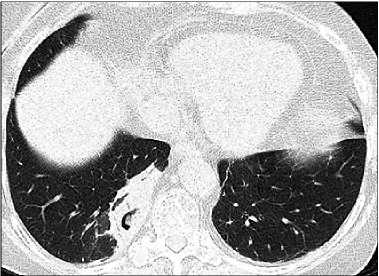
Рисунок 1. КТ ОГК пациентки с ММ.
Симптом «серпа».
Лабораторная диагностика ИА включала микологическое и серологическое исследования. Положительный результат теста на галактоманнан в БАЛ и/или сыворотке крови выявили у 84 % больных ИА; септированный мицелий при микроскопии и/или рост Aspergillus spp. при посеве респираторных биосубстратов — 57 %, (рисунок 2).
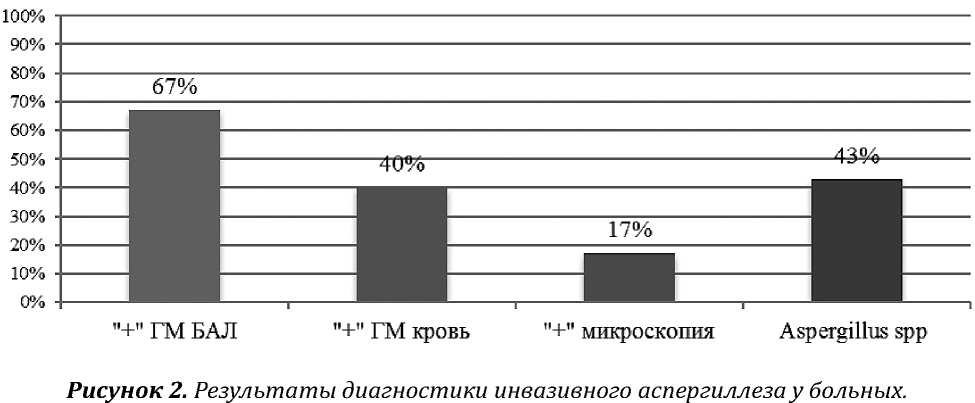
На основании критериев EORTC/MSG, 2008 в большинстве случаев диагностировали «вероятный» ИА — 98 %. Возбудителями ИА были A. niger (43 %), A. fumigatus (38 %), а также редкие (A. сandidus , A. ochraceus — 9 %) и не-уточненные (5 %) Aspergillus spp . (рисунок 3) .
Рисунок 3. A. ochraceus, выделенный з БАЛ больного ММ и ИА.
Все пациенты получали антимикотическую терапию. Основным используемым препаратом был вориконазол, который использовали как монотерапию или в составе комбинированной терапии ИА у 87 % пациентов. Реже использовали итраконазол (15 %), позаконазол (13 %), каспо-фунгин (11 %) и амфотерицин В (9 %). Комбинированную терапию применяли у 11 % больных. Медиана продолжительности антимикотической терапии — 68 (6–180) дней. Общая 12-недельная выживаемость больных ИА и ММ составила 93 %.
Обсуждение . Инфекционные осложнения у пациентов с ММ представляют собой актуальную проблему в силу нескольких причин. У данной группы больных наблюдается серьезное нарушение работы различных звеньев иммунитета: В-клеточная дисфункция (проявляется в виде гипогаммаглобулинемии), количественная и функциональная недостаточность дендритных клеток, вследствие этого — неадекватное представление антигена и нарушение активации Т-лимфоцитов, а также дисфункция NK-клеток [5, 6, 7].
За последние два десятилетия значительно расширились возможности терапии больных ММ. В эпоху таргетной терапии появились новые высокоэффективные противоопухолевые препараты,например ингибиторы про-теасом (бортезомиб), также была доказана эффективность иммуномодулирующей терапии (леналидомид и др.), одновременно с этим значительно увеличилось число проводимых ауто- и алло-ТГСК. В то же время, особенности лечения ММ с тенденцией к интенсификации схем химиотерапии, применением ТГСК, а также использованием леналидомида и высоких доз системных глюкокортикостероидов (ГКС)значительно повышает риск серьезных инфекционных осложнений у больных ММ [8, 9]. Наибольшему риску инфекций подвержены пациенты с рецидивирующей/рефрактер-ной к терапии ММ, а также больные в период инициации терапии выявленной в поздней стадии ММ [10, 11]. В нашем исследовании 54 % больных ИА имели неконтролируемое течение ММ,либо впервые выявленное заболевание, преобладали пациенты с III стадией ММ по B. Durie, S. Salmon (86) % и у половины пациентов (50 %) ИА развился после ауто- или алло-ТГСК.
Согласно последним рекомендациям (Donelly J., et al., 2019), пациенты с активным течением он-когематологического заболевания,в том числе и ММ, представляют группу высокого риска развития ИА [4]. Однако диагностика ИА остается одной из актуальных проблем у этих больных ввиду неспецифичности клинических и радиологических проявлений. Микологические методы обладают низкой чувствительностью: в нашем исследовании септированный мицелий при микроскопии респираторных биосубстратов был обнаружен лишь у 17 % обследованных, при посеве БАЛ рост грибов получили в 43 % случаев. Тест на галактоманнан в сыворотке крови эффективен преимущественно у пациентов с агранулоцитозом, однако в нашей когорте 29 % больных не имели нейтропении на момент развития ИА. Поэтому оптимальным подходом к диагностике является комплекс диагностических мероприятий, включающих серологическое и микологическое исследование [12].
Согласно международным рекомендациям, препаратом выбора для терапии ИА является вориконазол (A II) [12]. В нашем исследовании преобладающее количество пациентов (87 %) получали вориконазол в качестве первой линии терапии.
Публикации, описывающие эпидемиологию и результаты терапии ИА у больных ММ, малочисленны, количество проанализированных в исследованиях пациентов ограничено,при этом летальность от ИА высока — от 44 % до 50 % [11]. Как правило, данные о выживаемости больных ИА представлены по результатам исследований общей когорты гематологических больных, где показатели летальности широко варьируют в зависимости от фоновой патологии и терапии [13]. Так, например, Dib R. W. и соавторы показали, что среди онкогематоло-гических пациентов с ИА, получающих вориконазол, летальность в течение 6-ти недель была достоверно ниже, чем в группе пациентов, не получающих вориконазол, и составляла 5–9 % и 56 %, соответственно [14]. Согласно нашему исследованию, общая 12-недельная выживаемость больных составила 93 %.
Выводы .
-
1. Основными факторами риска развития инвазивного аспергиллеза у больных множественной миеломой являются неконтролируемое течение множественной миеломы (34 % vs. 5 %, p = 0.001), длительная, более 10 дней, лимфоцитопения (56 % vs. 26 %, p = 0.01) и проведение алло-ТГСК (11 % vs. 0 %, p = 0.01).
-
2. Характерна легочная локализация аспер-гиллезной инфекции — 100 %.
-
3. Основные возбудители ИА — A. niger (43 %) и A. fumigatus (38 %).
-
4. Общая 12-недельная выживаемость больных ИА и ММ составила 93 %.
Список литературы Инвазивный аспергиллез у больных множественной миеломой: описание клинического случая и результаты многоцентрового исследования
- Garth J. M., Steele C. Innate Lung Defense during Invasive Aspergillosis: New Mechanisms // Journal of Innate Immunity. — 2017. — № 9. — P. 271–280; DOI: 10.1159/000455125.
- Hohl T. M. Immune responses to invasive aspergillosis: new understanding and therapeutic opportunities // Current Opinion in Infectious Diseases. — 2017. — Vol.30, № 4. — P. 364–371; doi:10.1097/ QCO.0000000000000381.
- De Pauw B., Walsh T. J., Donnelly J. P., et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer // Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. // Clinical Infectious Diseases. — 2008. — Vol.46, № 12. — P. 1813–21; doi. org/10.1086/588660.
- Donelly J. P., Chen S. C., Kauffman C. A., et al. Revision and Update of the Consensus Definitions of Invasive Fungal Disease From the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium // Clinical Infectious Diseases. — 2019. — Dec 5; pii: ciz1008. doi: 10.1093/cid/ciz1008.
- Менделеева Л. П., Вотякова О. М., Покровская О. С. и др. Национальные клинические рекомендации по диагностике и лечению множественной миеломы // Гематология и трансфузиология. — 2016. — 61 (1, Приложение 2).
- Michels T. C., Petersen. K. E. Multiple myeloma: diagnosis and treatment // American Family Physician. — 2017. — Vol. 95, № 6. — P. 373–383.
- Soekojo Ci. Y., Ooi M., De Mel S. and Chng W. J. Immunotherapy in Multiple Myeloma // Cells. — 2020. — Vol. 9, № 3. — P. 601; doi:10.3390/cells9030601.
- Chen, M., Zhao, Y., Xu C., et al. Immunomodulatory drugs and the risk of serious infection in multiple myeloma: systematic review and meta-analysis of randomized and observational studies. // Annals of Hematology. — 2018. — Vol. 97, № 6. — P. 925-944.
- Ying L., YinHui T., Yunliang Z., Sun H. Lenalidomide and the risk of serious infection in patients with multiple myeloma: a systematic review and meta-analysis. // Oncotarget. — 2017. — Vol. 8, № 28. — P. 46593–46600; doi: 10.18632/oncotarget.16235
- Valkovic T., Gacic V., Ivandic J., et. al. A. Infections in Hospitalised Patients with Multiple Myeloma: Main Characteristics and Risk Factors. // Turkish Journal of Haematology. — 2015. — Vol. 32, № 3. — P. 234-242; doi: 10.4274/tjh.2013.0173.
- Teh B. W., Teng J. C., Urbancic K., et al. Invasive fungal infections in patients with multiple myeloma: a multi- center study in the era of novel myeloma therapies. // Haematologica. 2015; 100(1): e28-e31. doi:10.3324/ haematol.2014.114025
- Ullmann A. J., Aguado J. M., Arikan-Akdagli S., Denning D. W., et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline // 2018. — Clinical Microbiology and Infection pii: S1198–743X(18)30051-X; DOI: DOI: 10.1016/ j. cmi.2018.01.002
- Garcia-Vidal, C.; Peghin, M.; Cervera, C.; Gudiol, C.; Ruiz-Camps, I.; Moreno, A.; Royo-Cebrecos, C.; Rosello, E.; de la Bellacasa, J. P.; Ayats, J.; et al. Causes of death in a contemporary cohort of patients with invasive aspergillosis // PLoS ONE. — 2015. — 10, e0120370.
- Dib R. W., Hachem R. Y., Chaftari A-M., Ghaly F., Jiang Y. and Raad I. Treating invasive aspergillosis in patients with hematologic malignancy: diagnostic- driven approach versus empiric therapies // BMC Infectious Diseases. — 2018. — Vol. 18: 656; https://doi.org/10.1186/s12879–018–3584–9.


