Использование метода ОТ-ПЦР для выявления генома вируса болезни Акабане в органах и крови экспериментально зараженных морских свинок
Автор: Никитина Е.Г., Сальников Н.И., Каторкин С.А., Балашова Е.А., Цыбанов С.Ж., Колбасов Д.В., Луницин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиология, вирусология, молекулярная биология
Статья в выпуске: 6 т.49, 2014 года.
Бесплатный доступ
Болезнь Акабане - трансмиссивная арбовирусная инфекция крупного и мелкого рогатого скота, вызываемая вирусом серогруппы Simbu семейства Bunyaviridae. Болезнь наносит большой экономический ущерб, причиняемый животноводческой отрасли в результате эпизоотий, поскольку при заболевании происходят прямые потери от гибели животных, снижения продуктивности домашних жвачных животных и нарушения воспроизводительной функции у больных животных. Болезнь протекает в виде эпизоотии, характеризуется географической приуроченностью, выраженной сезонностью (август-октябрь, февраль) и периодичностью возникновения с интервалом в несколько лет. Для накопления вируса Акабане обычно используют 1-2-суточных белых мышей-сосунов, которые представляют собой наиболее чувствительную систему для изоляции всех буньявирусов. Ранее во Всероссийском НИИ ветеринарной вирусологии и микробиологии (ВНИИВиМ) была разработана тест-система для выявления РНК вируса болезни Акабане на основе ОТ-ПЦР в режиме реального времени и подтверждена ее эффективность при обнаружении вируса у экспериментально зараженных мышей и в инфицированных культурах клеток. Однако представляло интерес, с одной стороны, оценить возможности предложенной тест-системы при расширении круга исследуемых объектов, с другой - найти новые модели для изучения и накопления вируса. В настоящей работе мы использовали здоровых морских свинок ( n = 20, масса каждая особи - по 400 г). Эксперимент по заражению морских свинок проводили в трех повторностях. Животных заражали концентрированным культуральным материалом, содержащим вирус болезни Акабане (штамм В8935) с инфекционной активностью 7,0 lg ТЦД 50/см 3. Начиная со 2-х по 6-е сут после заражения, у всех животных ежедневно отбирали пробы крови. В пробах крови от всех морских свинок геном вируса болезни Акабане был обнаружен только на 4-е сут после заражения. Одна особь пала на 1-е сут после заражения (возможно, вследствие неспецифической реакции, так как выявить геном вируса болезни Акабане при исследовании образцов органов, взятых post mortem у этого животного, не удалось). Дополнительно для получения биоматериала на 4-е сут после заражения у нескольких морских свинок были отобраны органы (мозг, легкое, почки, лимфоузел, сердце), в тканях которых также обнаружили вирус Акабане. Этим подтверждается эффективность разработанной тест-системы при диагностике вируса болезни Акабане и возможность использовать для его накопления еще один модельный объект - морских свинок.
Болезнь акабане, вирус болезни акабане, морские свинки, комары culicoides, от-пцр, тест-система
Короткий адрес: https://sciup.org/142133556
IDR: 142133556 | УДК: 636.2/.3:619:578:57.083 | DOI: 10.15389/agrobiology.2014.6.67rus
Текст научной статьи Использование метода ОТ-ПЦР для выявления генома вируса болезни Акабане в органах и крови экспериментально зараженных морских свинок
Болезнь Акабане — трансмиссивная арбовирусная инфекция крупного и мелкого рогатого скота, вызываемая вирусом серогруппы Simbu семейства Bunyaviridae. Болезнь наносит большой экономический ущерб, причиняемый животноводческой отрасли в результате эпизоотий, поскольку при заболевании происходят прямые потери от гибели животных, снижения продуктивности домашних жвачных животных и нарушения воспроизводительной функции у больных особей (1-3). Ареал этого заболевания установлен не окончательно. С 1959 года его регистрируют в Японии, с 1972 года — в Австралии и Новом Южном Уэльсе, c 1969-1970 годов — в Израиле, Корее и Кении (4, 5). Болезнь протекает в виде эпизоотии, характеризуется географической приуроченностью, выраженной сезонностью (август—октябрь, февраль) и периодичностью возникновения с интервалом в несколько лет (1, 2, 6). Вирус переносится кровососущими насекомыми, обычно мелкими комарами рода Culicoides: в Африке — Culicoides milne и Culicoides imicola, в Японии — Culicoides oxystoma, в Австралии — Culicoides brevitarsis и Culicoides wadei. Также вирус выделяли от москитов Aedes vexans и Culex triaeniorhynchus в Японии (6, 7) и Anopheles fenestus в Кении (2-4, 8-10).
В настоящее время актуальность проблемы этой инфекции возрастает. В специальной литературе в последние годы представлены работы по выявлению распространения вируса в разных странах (11-13), изучению его генетических свойств и патогенности (14). В ряде лабораторий выполняются серологические и иммунологические исследования (15, 16), имеются также сообщения о разработках вакцин (17, 18). В этой связи специальное внимание уделяется методам диагностики и индикации вируса (19, 20).
Для диагностики болезни Акабане используют метод флюоресцирующих антител, реакции нейтрализации, задержки гемагглютинации, связывания комплемента, диффузионной преципитации, твердофазный им-муноферментный анализ. Материалом для выделения вируса болезни Акабане служат пробы различных органов и тканей от плодов абортировавших животных (мозг, лимфоузлы, селезенка, почки, скелетные мышцы, плацента, кровь) и кровь больных животных (2, 21).
Для выделения вируса Акабане обычно используют 1-2-суточных сосунков белых мышей, которые представляют собой наиболее чувствительную систему для изоляции всех буньявирусов (21).
Разработанная нами тест-система для обнаружения генома вируса болезни Акабане на основе ПЦР с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени позволяет выявлять геном вируса болезни Акабане в пробах мозга экспериментально зараженных мышей и в инфицированных культурах клеток (22, 23).
Нашей целью было изучение возможности выявления РНК вируса болезни Акабане в крови экспериментально зараженных морских свинок с использованием предложенной тест-системы и получение проб органов от инфицированных особей для дальнейших исследований.
Методика . Для получения культурального вируссодержащего материала проводили заражение культуры клеток CV-1 вирусом болезни Акабане (штамм В8935). Инфицированную культуру инкубировали в стационарных условиях при 37±0,5 ° C в течение 2-3 сут. Титрование вируса проводили в лунках полистироловых пластин с монослойной культурой клеток CV-1. Наблюдение вели в течение 7 сут. Результаты титрования учитывали по цитопатогенному действию (ЦПД).
Здоровых морских свинок (масса каждой по 400 г) заражали концентрированным культуральным материалом, содержащим вирус болезни Акабане (штамм В8935) с инфекционной активностью 7,0 lg ТЦД50/см3. Эксперимент по заражению морских свинок проводили в трех повторностях. Всех морских свинок разделили на две группы. Морским свинкам из I группы вводили культуральный вируссодержащий материал в объеме 50 мкл, при инфицировании особей из II группы дозу увеличивали 10кратно (500 мкл).
Начиная со 2-х по 6-е сут после заражения, у всех животных ежедневно отбирали пробы крови и исследовали с использованием «Тест-системы для выявления РНК вируса болезни Акабане методом ОТ-ПЦР в режиме реального времени» (3, 22, 23). Дополнительно с целью получения биоматериала для дальнейшей научно-исследовательской работы на 4-е сут после заражения у морских свинок из II группы были взяты пробы органов (мозга, легкого, почек, лимфоузла, сердца).
Вирусную РНК из биологического материала выделяли методом нуклеосорбции с использованием набора TRIzol LS Reagent («Invitrogen, Inc.», США) согласно рекомендациям производителя (23, 24).
Постановку ОТ-ПЦР осуществляли в амплификаторе Rotor Gene 6000 («Corbett Research», Австралия) в соответствии с инструкцией к тест-системе (3, 22, 23).
Результаты . Вирус болезни Акабане размножается на куриных эмбрионах и на мышах-сосунах (при внутримозговом заражении у них через 2-3 сут развиваются параличи). К возбудителю чувствительны также перевиваемые клеточные линии различного происхождения — ВНК-21, VERO, HmLu-1 с выраженным ЦПД через 48-72 ч.
Поскольку одной из задач работы было получение проб биоматериала от лабораторных животных для дальнейшего использования в научных исследованиях, в качестве экспериментальных объектов были выбраны именно морские свинки. По живой массе и массе внутренних органов они значительно превосходят лабораторных крыс и мышей, следовательно, для получения определенного количества биоматериала необходимо минимальное число животных.
Предложенная и примененная в настоящем исследовании тест-система основана на детекции продуктов амплификации в режиме реального времени с использованием оригинальных олигонуклеотидных праймеров AV d и AV u, фланкирующих фрагмент размером 113 п.н., который комплементарен последовательности гена нуклеокапсидного белка N и зонда AV z, комплементарного внутреннему фрагменту выбранного участка (технология TaqMan). Эта тест-система обладает высокой чувствительностью: при исследовании тканей и органов соответствующий показатель составил 1,5±0,5 lg МЛД50/см3, при анализе культурального материала — 1,0±0,5 lg ТЦД 50 /см3.
В пробах крови от всех морских свинок геном вируса болезни Акабане обнаруживался только на 4-е сут после заражения. Полученные результаты представлены в таблице. Гибель одной особи из II группы, зарегистрированная уже на 1-е сут после заражения, возможно, была обусловлена неспецифической реакцией, так как нам не удалось выявить геном вируса болезни Акабане при исследовании образцов органов, взятых post mortem у этого животного.
Результаты выявления генома вируса болезни Акабане в крови экспериментально зараженных морских свинок с использованием разработанной тест-системы на основе ОТ-ПЦР в режиме реального времени
Срок после Группа экспериментальных животных заражения, сут I (n = 12) | II (n = 8)
2-е --
3-и --
4-е ++
5-е --
6-е --
Примечание. «+» и « - » — соответственно выявление генома вируса в образцах и отрицательный результат тестирования.
В качестве примера на рисунке 1 представлены результаты амплификации образцов нуклеиновых кислот, выделенных из крови морских свинок в одном из проведенных экспериментов.
При исследовании тканей мозга, легких, почек, лимфоузла, сердца, взятых у животных из II группы, РНК вируса болезни Акабане обнаружили во всех исследуемых образцах. В качестве примера на рисунке 2 представлены типичные результаты амплификации нуклеиновых кислот, выделенных из внутренних органов морских свинок.
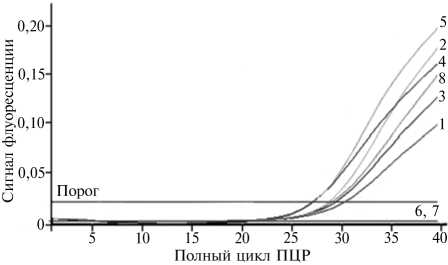
Рис. 1. Графики накопления флуоресцентного сигнала при выявлении генома вируса болезни Акабане в крови морских свинок с использованием разработанной тест-системы на основе ПЦР с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени: 1 — рекомбинантный положительный контроль амплификации; 2-5 — образцы от инфицированных животных (соответственно №№ 1-4); 6 — отрицательный контроль выделения; 7 — отрицательный контроль ПЦР (4-е сут после экспериментального заражения; приведены результаты типичного опыта).
Рис. 2. Графики накопления флуоресцентного сигнала при выявлении генома вируса болезни Акабане в тканях внутренних органов у морской свинки № 4 с использованием разработанной тест-системы на основе ПЦР с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени: 1 — мозг; 2 — легкие; 3 — почка; 4 — лимфоузел; 5 — сердце; 6 — отрицательный контроль выделения; 7 — отрицательный контроль ПЦР; 8 — положительный контроль (4-е сут после экспериментального заражения).
Таким образом, с использованием тест-системы на основе ОТ-ПЦР в реальном времени, разработанной во Всероссийском НИИ ветеринарной вирусологии и микробиологии, РНК вируса болезни Акабане была выявлена в образцах органов и крови экспериментально зараженных морских свинок. Следовательно, животные этого вида могут быть использованы при валидации и апробации подобных тест-систем.


