Использование ультразвуковой микронизации растительного ингредиента фукоидана для применения в технологиях пищевых производств
Автор: Потороко Ирина Юрьевна, Ускова Дарья Геннадьевна, Паймулина Анастасия Валерияновна, Удей Багале
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 1 т.7, 2019 года.
Бесплатный доступ
В статье рассматриваются возможности применения эффектов ультразвукового воздействия для микронизации растительного ингредиента фукоидана, полученного из водорослей дальневосточных океанических вод. Целью работы являлось исследование влияния процесса микронизации сульфатированного гетерополисахарида фукоидана на изменение дисперсного состояния в растворе и обеспечения доступности для проникновения в клеточные системы. В качестве тестовых систем использовались молочнокислые бактерии и дрожжевые клетки. Для микронизации использовали акустический источник упругих колебаний прибор «Волна» модель УЗТА-0,4/22-ОМ (частота колебаний (22 ± 1,65) кГц, максимальная мощность 600 Вт/л). Фукоидан обладает широким спектром биологической активности, антиоксидантными и противовирусными свойствами и др. Фукоидан имеет разный молекулярный вес, в зависимости от способа извлечения, как правило, известны 100~1.000 kDa. Учитывая, что фукоидан является гетерополисахаридом сложной структуры, размеры частиц порошка при его растворении в среднем составляют (1,7 ± 1,3) мкм, что определяет его низкую биодоступность для активных компонентов, выполняющих важную роль в биохимических процессах. Для решения данной проблемы был применен метод ультразвуковой микронизации пищевого ингредиента фукоидана (ПИФузв) в режиме 240 Вт/л в течение 3 минут, который позволил обеспечить тонкое диспергирование частиц. В результате ультразвукового воздействия размеры частиц переходят в разряд наноуровня и укладываются в следующие параметры пофракционно от (376 ± 3,5) нм до (1826 ± 8,3) нм. Полученные данные указывают, что ПИФ благоприятствуют течению физиологических процессов, в поле зрения наблюдаются почкующиеся клетки. Процесс микронизации фукоидана обеспечивает накопление в клеточных культурах запасных веществ - гликогена и волютина. Микронизированный ПИФ позволяет сформировать характерную для йогурта микрофлору в достаточно высоком количестве, включающую Streptoсoссus salivarius ssp. Thеrmophilus (до 5,4×108 КОЕ/г) и Laсtobaсillus delbrueсkii ssp. Bulgariсus (до 4,4×107 КОЕ/г). Таким образом, ультразвуковая микронизация повышает эффективность биотехнологических процессов пищевых производств.
Фукоидан, микронизация, ультразвук, биодоступность, пищевой ингредиент
Короткий адрес: https://sciup.org/147233262
IDR: 147233262 | УДК: 576.32/.36+663.126+ | DOI: 10.14529/food190107
Текст научной статьи Использование ультразвуковой микронизации растительного ингредиента фукоидана для применения в технологиях пищевых производств
Одним из актуальных направлений в реализации процессов получения органической пищи является применение ингредиентов адаптогенного действия, полученных при переработке растительного и животного сырья. При этом важно сохранить функциональность питания для профилактики нарушений гомеостаза в организме человека [2, 6, 7].
В последнее время в пищевой отрасли активно развивается производство продукции, обогащенной пребиотиками различной природы: ди- и трисахаридами; полисахаридами; многоатомными спиртами; аминокислотами, ферментами, низкомолекулярными и полине-насыщенными жирными кислотами, антиок- сидантами и другими биологически активными веществами [12, 13, 15].
Обогащение продуктов питания чаще всего осуществляют для компенсации нутриент-ных недостатков сырья, чаще всего используются нетрадиционные для той или иной отрасли пищевой индустрии ингредиенты. Однако в этих условиях практически не прослеживается механизм встраивания нового компонента в систему пищевой матрицы обогащаемого продукта и его совместимости с нативными макро- и микронутриентами продукта. Разработки последних лет дополнили перечень веществ пребиотического характера ингредиентами, выделенными из гидробионтов. Получение новых фитокомплексов с высокой антиоксидантной активностью (АОА) из водорослей и другого растительного сырья является активно развивающимся направлением [3].
В мировой науке накоплен обширный материал, свидетельствующий о применении полисахаридов морских водорослей и иглокожих в качестве лечебно-профилактических пребиотиков. Причем ресурсный потенциал этого вида сырья достаточно велик, так, моря Дальнего Востока отличаются богатейшими запасами бурых водорослей, которые оцениваются в 14–16 млн тонн (Суховеева, Подко-рытова, 2006) [4, 8, 10].
Экстракты бурых фукусовых водорослей перспективны в качестве антиоксидантных биопрепаратов в связи с высоким содержанием в них полифенолов и фукоидана, а также возможной ролью других биологически-активных веществ водорослей (аскорбиновой кислоты, свободных аминокислот и других). Особое внимание уделяется сложному суль-фатированннному гетерополисахариду бурых водорослей – фукоидану, который содержит редкий моносахарид a-L- фукозы.
По данным Института органической химии им. Н.Д.Зелинского РАН, фукоиданы, содержащиеся в разных видах водорослей, отличаются составом и структурой (табл. 1). Учеными института А.И. Усовым, М.И. Биланом и др. проведено комплексное исследование особой группы полисахаридов ‒ фукози-лированных хондроитинсульфатов, найденных в морских огурцах. Установлено, что величина биологического эффекта в отношении антикоагулянтных и антитромботических свойств определяется именно тонкими деталями структуры полимера [14].
А.Б. Хмельковым, Т.Н. Звягинцевой и др. применена ультразвуковая экстракция полисахаридов из бурой водоросли Fucus evanescens . Авторами изучена структура и биологическая активность новых фракций фукоидана.
Благодаря ультразвуковой экстракции из бурой водоросли Fucus evanescens был получен новый регулярный 1→3; 1→4-α-L-фукан. Он сульфатируется при С2 и ацетилируется при С3 остатка фукозы и проявляет противоопухолевую активность in vitro в отношении клеток карциномы толстой кишки человека, сравнимую с общей фракцией F1 [19].
Для фукоиданов из водорослей Fucus vesiculosus, F. evanescens, F. distichus,
Ascophyllum nodosum характерна цепь, состоящая из чередующихся (1→3)- и (1→4)-связанных-L-фукопиранозных остатков. Фукоза выполняет важные биологические функции в процессах онтогенеза, клеточной дифференциации, а также установлена его роль в формировании иммунитета и в репродуктивных процессах позвоночных. Подтверждена антиоксидантная активность фукоолигосахаридов [16, 20, 22, 23], а также эффективность в отношении профилактики новообразований.
Фукоиданы растворимы в воде, не образуют очень вязких сред. Технология получения может включать в себя экстракцию водой, растворами кислот или солей кальция, дальнейшую обработку ультразвуком или микроволнами. Известно, что фукоидан обладает широким спектром биологической активности, антиоксидантными и противовирусными свойствами и др. [5, 24]. Несмотря на широкую известность этих полисахаридов, не решен вопрос о взаимосвязи биологической активности и химической структуры, так как структуры фукоиданов полностью не установлены. Отсутствует единое мнение о поглощении фукоидана при пероральном введении макромолекул.
Исследования доктора Ирхимехом и др. показали, что при пероральном введении фукоидана, извлечённого из Undaria pinnatifida, у человека произошло увеличение концентрации фукоидана в крови. Особенно когда 3 г 75 % раствора фукоидана, извлечённого из Undaria pinnatifida, вводили перорально каждый день, концентрация в крови была приблизительно 13 мг/л. Эти результаты показывают на то, что различные виды фукоидана имеют различные функции поглощения тела при пероральном введении.
Известно, что фукоидан обладает широким спектром биологической активности, антиоксидантными и противовирусными свойствами и др. [19]. Фукоидан имеет разный молекулярный вес, в зависимости от способа извлечения, как правило, известны 100~1.000 kDa. Низкомолекулярный фукоидан (4 кД) лучше гепарина предотвращал артериальный тромбоз. Полученные с помощью перекиси водороды из высокомолекулярных низкомолекулярные фукоиданы (7,8…8,3 кД) проявляют антикоагулянтную активность [5].
Существует несколько способов корректировки молекулярного веса фукоидана. В полисахариде фукоидан, в его природной
Таблица 1
Характеристика особенностей состава и строения гетерополисахарида фукоидана, выделенного из разных видов водорослей
|
Результаты исследования структуры фукоиданов, извлеченных из разных видов водорослей |
Наименование водорослей и источники информации |
|
1 |
2 |
|
' * Me-/~^ - МеУ ^ГС A zt**^V- OSO3 - oR| 13 Re= ~ 45% OAt, MeV ~ ss% он ....." ** OSO3* R,= ~ 61.596 OSO,', J Rd A ~27%OAC, lill * ■ ~11.5%OH ..... ................. 337 (2002) 719-730. |
Структура фукоидана из Fucus evanescens M.I.Bilan et al. Carbohydr.Res. 337 (2002) 719–730 |
|
СНз^*^"**^^О5О3- &l L-o,s6 J A J 11 3g 4A CH£O I | FUC4C / i ' CH,co\^ 170 160 150 140 130 120 110 100 90 80 70 60 50 40 30 20 ppcr |
Структура фукоидана из водоросли Fucus distichus M.I. Bilan et al. Carbohydr.Res., 339 (2004) 511–517 |
|
so3" so,’ so3" 2 2 2 —>3)-a-L-Fucp-( 1 —>4)-a-L-Fucp-( 1 —>........—>3)-cc-L-Fucp-( 1 ^4)-a-L-Fucp-( 1 —> a-L-Fucp-( 1 —>4)-a-L-Fucp-( 1 —»3)-a-L-Fuc/>-( 1 —>4) 4 2 2 t T T so," so,’ so," . 1 |КЦ 1» 1<: 1 < 11: 110 100 M •> '0 «0 00 «» 10 к и* \ ‘ r |
Структура фукоидана из Fucus serratus M.I.Bilan et al. Carbohydr. Res. 341 (2006) 238–245 |
Продолжение табл. 1
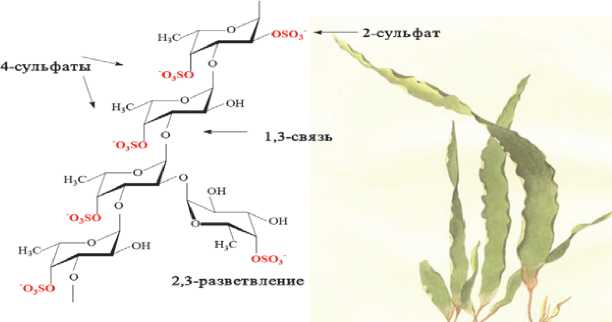
Строение фукоидана из Laminaria saccharina
А.И.Усов и др. Биоорган. химия 24 (1998) 437–445.
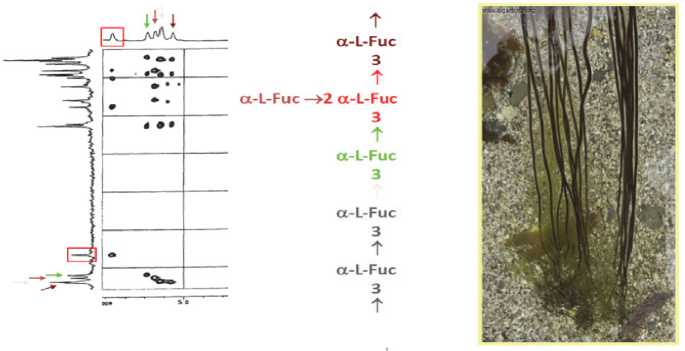
Структура углеводной цепи фукоидана из Chorda filum
A.O.Chizhov et al.

Структура фукоидана из Analipus japonicus
М.И.Билан и др. Био-орган.химия 33 (2007) 38–46 .
Окончание табл. 1
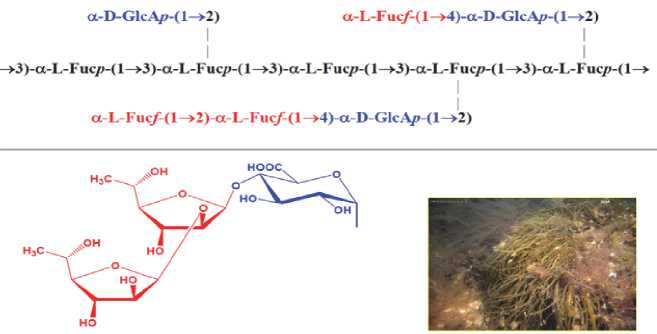
Углеводная цепь фукоидана из Chordaria flagelliformis
форме, молекулы простых сахаров прочно связаны друг с другом в длинные цепи, что делает их разложение и усвоение в пищеварительной системе человека сложной задачей. Несмотря на это, сама природа подсказала, как можно относительно легко разложить прочные молекулы полисахарида фукоидана на части.
Например, такие моллюски, как морское ушко и другие, способны поглощать различные морские водоросли и превращать их в источник энергии. Это становится возможным благодаря особому ферменту фукоиданазе, выделяемому ракообразными, который способен разрезать длинные полисахаридные цепи на куски. Многие новейшие препараты используют данный фермент для коррекции молекулярного веса фукоидана (происходит понижение молекулярного веса до 500 kDa и менее) [9].
Однако было бы неверным сказать, что чем ниже молярный вес фукоидана, тем лучше. Молекулы фукоидана большого размера аккумулируются внутри кишечника и улучшают его внутреннюю бактериальную среду, что служит в качестве второстепенного фактора усиления иммунитета человека. Таким образом, коррекция молекулярного веса фукоидана – это сложный и ответственный процесс, необходимый, чтобы увеличить лечебный эффект фукоидана. Многочисленные исследования, цель которых выяснить взаимоотношение молекулярного веса фукоидана и его лечебных свойств, в данный момент проводятся в Японии и других странах.
В случае применения фукоидана как био- логически активного вещества возникают проблемы его активности (антигенности, однородности, антикоагуляционной активности и т. д.), так как фукоидан представляет сульфатированный полисахарид с очень большим молекулярным весом. Как было описано ранее, высокомолекулярные вещества не всасываются в организме, если не деградируют до самых мелких молекул. Соответственно, возникает необходимость разрушить макромолекулы фукоидана для обеспечения биодоступности, что определило цель исследований.
Объекты и методы исследований
Объектами исследования для достижения цели были определены:
-
- ПИФ № 1 – Фукоидан из бурых водорослей Kjellmaniella crassifolia , выращиваемых в прибрежных территориях г. Далянь (КНР), ферментативно обработанный для получения сырого экстракта [24].
-
- ПИФ № 2 – БАД «FUCOID POWER-U», содержащая фукоидан морских бурых водорослей Undaria pinnatifida (мекабу) и Laminaria japonica (комбу) не менее 66 %, разработанная компанией HAEWON BIOTECH, INC (Южная Корея).
-
- ПИФ № 3 – БАД к пище «Фуколам-С-сырье» (ТУ 9284–067–02698170–2010) на основе полисахарида фукоидана, выделенного из водоросли F. Evanescens. Свидетельство Федерального центра гигиены и эпидемиологии Роспотребнадзора о государственной регистрации № 77.99.23.3.У.739.1.06 от 30.01.06. Правообладателем товарного знака Фуколам-Fucolam является ТИБОХ ДВО РАН (свидетельство № 308197 от 07.06-2006 г).
БАД, на основании экспертной оценки Минздрава России, ГУ НИИ питания РАМН рекомендован в качестве дополнительного источника полисахаридов (фукоидан) и растворимых пищевых волокон (альгинат).
-
- Дрожжи хлебопекарные прессованные ( Saccharomyces cerevisiae ) «Люкс экстра» ТУ 9182-038-48975583-2011, производимые ООО «САФ-НЕВА», г. Санкт-Петербург, Россия.
-
- Производственная закваска прямого внесения LYOBAC YOYO 82Q. В состав используемой закваски входят: Streptoсoссus salivarius ssp. thеrmophilus, Laсtobaсillus delbrueсkii ssp.bulgariсus .
В качестве источника УЗВ был использован акустический источник упругих колебаний ультразвуком – прибор «Волна» модель УЗТА-0,4/22-ОМ, работающий на частоте (22 ± 1,65) кГц и выходной мощности 180–400 Вт.
Для оценки размера частиц использовали анализатор Nanotrac Ultra и Microtrac S3500 (Microtrac Inc., США). Анализ основан на методе динамического рассеяния света. Минимальный размер частиц, обнаруживаемых прибором Nanotrac Ultra – 0,8 нм, Microtrac S3500 – 0,024…2800 мкм. Результаты измерений имеют высокую точность и воспроизводимость.
Исследование колониеобразующих единиц проводилось с помощью метода MALDI TOF MS. Изоляты микроорганизмов выращивали на поверхности питательной среды агара Рогоза. Анализ масс-пиковых списков спектров рибосомных белков проводили с использованием программного обеспечения MALDI Biotyper (Bruker Daltonics, Германия). Источники из микробной коллекции DMZS (Германия), отобранные производителем, были использованы для сравнения штаммов. Результаты были интерпретированы с использованием шкалы, предложенной производителем: показатель Score, равный 2 и более, считался надежным для определения вида, в диапазоне от 1,7 до 2 – надежным для определения рода, менее 1,7 считался ненадежным [1, 17].
Для определения качественного состава микрофлоры заквасок использовали метод микроскопических исследований. Для исследования готовили фиксированные препараты сквашенных сгустков йогуртов, окрашенных комбинированным фиксатором [25, 26].
Для изучения морфологии дрожжей готовили неокрашенные препараты типа «раздавленная капля». Количество гликогена в клет- ках дрожжей оценивали с помощью окрашивания их раствором Люголя. Для окраски включений зерен волютина мазки фиксировали и окрашивали по способу Нейссера.
Результаты и их обсуждение
Для изучения влияния ультразвуковой микронизации на дисперсию частиц пищевого ингредиента фукоидана (ПИФ), готовили водные растворы ПИФ 1 %-ной концентрации, которые затем подвергали УЗВ мощностью 240 Вт/л в течение 3 минут. Процесс микронизации вели с использованием охлаждающей рубашки для стабильности температуры на уровне 40 °С. Данный режим УЗВ был определен как рациональный с учетом возможности настройки аппарата в ходе серии прогностических исследований.
Ультразвуковая технология была использована Welti-Chanes J., Knorr D., Villamiel M. и др. в жидких пищевых средах для дегазации, активации окислительно-восстановительных реакций, экстракции ферментов и белков, инактивации ферментов, а также для модификации продуктов. В молочных продуктах ультразвук используется для инактивации патогенных микроорганизмов и ферментов, гомогенизации молока, экстракции ферментов и гидролиза лактозы [21, 27].
Активность бактериальной микрофлоры, используемой в технологиях пищевых производств, напрямую связана со спиртовым и молочнокислым брожениями. Спиртовое брожение – процесс превращения углеводов в результате культивирования дрожжей в этанол и диоксид углерода. Под действием ферментов дрожжей происходит превращение сахара в спирт и углекислый газ. Молочнокислое брожение является основным процессом в производстве кисломолочных продуктов, а также в производстве ржаного хлеба. Достаточно часто возникают проблемы низкой активности дрожжевых культур и микроорганизмов заквасок, в этой связи поиск путей их активизации весьма актуален.
В качестве модельных биологических объектов были определены:
-
- хлебопекарные дрожжи Saccharomyces cerevisiae (эукариоты, растут очень быстро и также быстро синтезируют белок, единственные анаэробы среди эукариот);
-
- лактобактерии Streptoсoссus salivarius ssp. thеrmophilus, Laсtobaсillus delbrueсkii ssp.bulgariсus ‒ бактерии для технологии йогуртов. Lactobacillus delbrueckii subsp.
bulgaricus получают энергию в результате го-моферментативного молочнокислого брожения. Для роста на питательных средах нуждаются в факторах роста и витаминах. Lactobacillus delbrueckii subsp. bulgaricus продуцирует внеклеточные полисахариды и способна выживать при прохождении через желудочно-кишечный тракт [18].
Учитывая, что фукоидан является гетерополисахаридом сложной структуры, размеры частиц порошка при его растворении в среднем составляют (1,7 ± 1,3) мкм, что определяет его низкую биодоступность для активных компонентов, выполняющих важную роль в биохимических процессах. Для решения данной проблемы был применен метод ультразвуковой микронизации ПИФ в режиме 240 Вт/л в течение 3 минут, который позволил обеспечить тонкое диспергирование частиц.
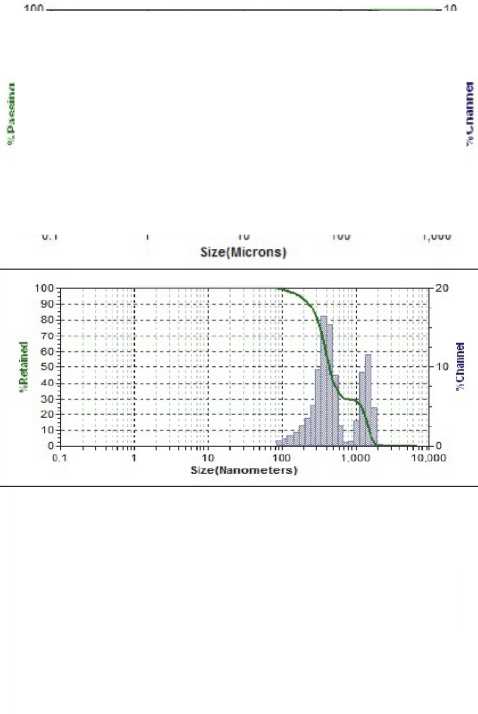
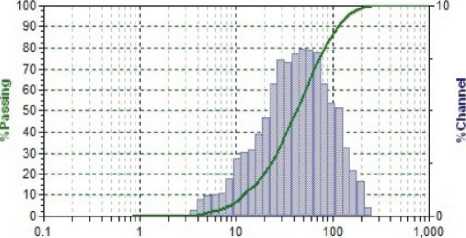
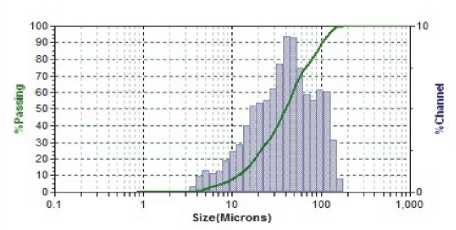
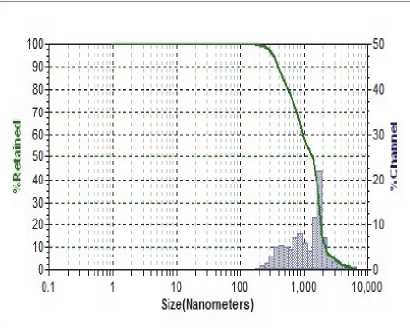
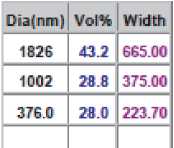
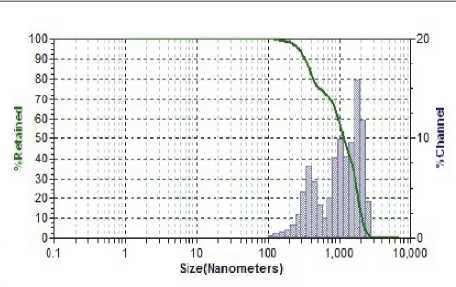
Результаты исследования дисперсного состава растворов фукоиданов после УЗВ по отношению к контролю (табл. 2) указывают на изменение размерного ряда частиц. Так, контрольные образцы растворов фукоидана имели дисперсию с размером частиц в разряде микрометров 16…104 мкм, причем пищевой ингредиент фукоидан из водоросли F. Evanescens содержал фракции частиц наименьших размеров 16,02 мкм (50 %) и 44,44 мкм (50 %). В результате ультразвукового воздействия размеры частиц переходят в разряд наноуровня и укладываются в следующие параметры пофракци-онно от (376 ± 3,5) нм до (1826 ± 8,3) нм.
В дальнейших исследованиях был использован пищевой ингредиент фукоидан из водоросли F. Evanescens (Россия).
Изучение влияния ПИФ на активность дрожжей показало (табл. 3), что у образцов дрожжевых клеток, полученных при использовании нативного ПИФ и ПИФ микронизи-рованного, по отношению к контролю отмечается увеличение числа дрожжевых клеток и активизация физиологических процессов.
Таблица 2
Результаты исследования дисперсного состав фукоданов разного происхождения до и после УЗВ
Образец ПИФ
Фукоидан из бурых водорослей Kjellmaniella crassifolia, (КНР),
Фукоидан из бурых водорослей Kjellmaniella crassifolia , (КНР) после УЗВ
Фукоидан бурых водорослей Undaria pinnatifida и Laminaria japonica (Южная Корея)
Суммарные пики
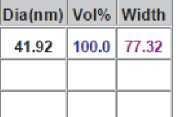
|
Dia(nm) |
Vol% |
Width |
|
1411 |
30.0 |
465.00 |
|
379.0 |
70.0 |
247.20 |
|
Dia(nm) |
Vol% |
Width |
|
102.2 |
21.7 |
44.35 |
|
31.62 |
78.3 |
39.96 |
Размерный ряд частиц
Окончание табл. 2
Образец ПИФ
Суммарные пики
Размерный ряд частиц
Фукоидан водорослей Undaria pinnatifida и
Laminaria japon-ica
(Южная Корея) После УЗВ
|
Dia(nm) |
Vol* |
Width |
|
1794 |
50.8 |
783.00 |
|
893.0 |
25.0 |
367.00 |
|
432.0 |
24.2 |
249.20 |
Фукоидан из водоросли F. Evanescens (Россия )
|
Dia(nm) |
Vol* |
Width |
|
44.44 |
50.0 |
39.69 |
|
16.02 |
50.0 |
12.48 |
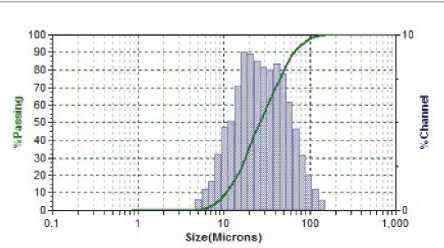
Фукоидан из водоросли F. Evanescens (Россия) после УЗВ
Физиологическую активность дрожжевых клеток определяли по содержанию в них резервного полисахарида – гликогена, а также волютина, обусловливающего рост и размножение дрожжевых клеток. Волютин является резервом полифосфатов в клетке и накапливается как запасное вещество, при голодании его количество уменьшается. Представленные данные указывают, что ПИФ благоприятствуют течению физиологических процессов, в поле зрения наблюдаются почкующиеся клетки. Процесс микронизации фукоидана обеспечивает накопление в клеточных культурах запасных веществ ‒ гликогена и волютина [11].
Для оценки эффективности данного подхода при молочнокислом брожении были по- лучены опытные образцы ферментированного йогуртовой закваской молока. Идентификацию молочнокислой микрофлоры проводили на основе метода MALDI-TOFMS, результаты представлены в табл. 4.
Микронизированный ПИФ вносился в количестве 0,02 % к массе, что было установлено в процессе прогностических исследований, для активации заквасочной микрофлоры. На основании полученных результатов можно утверждать, что микронизация ПИФ позволяет сформировать характерную для йогурта микрофлору в достаточно высоком количестве, включающую Streptoсoссus salivarius ssp. Thеrmophilus (до 5,4×108 КОЕ/г) и Laсto-baсillus delbrueсkii ssp. Bulgariсus (до 4,4×107
Таблица 3
Физиологические характеристики дрожжевых клеток Saccharomyces cerevisiae при культивировании в среде с разным составом
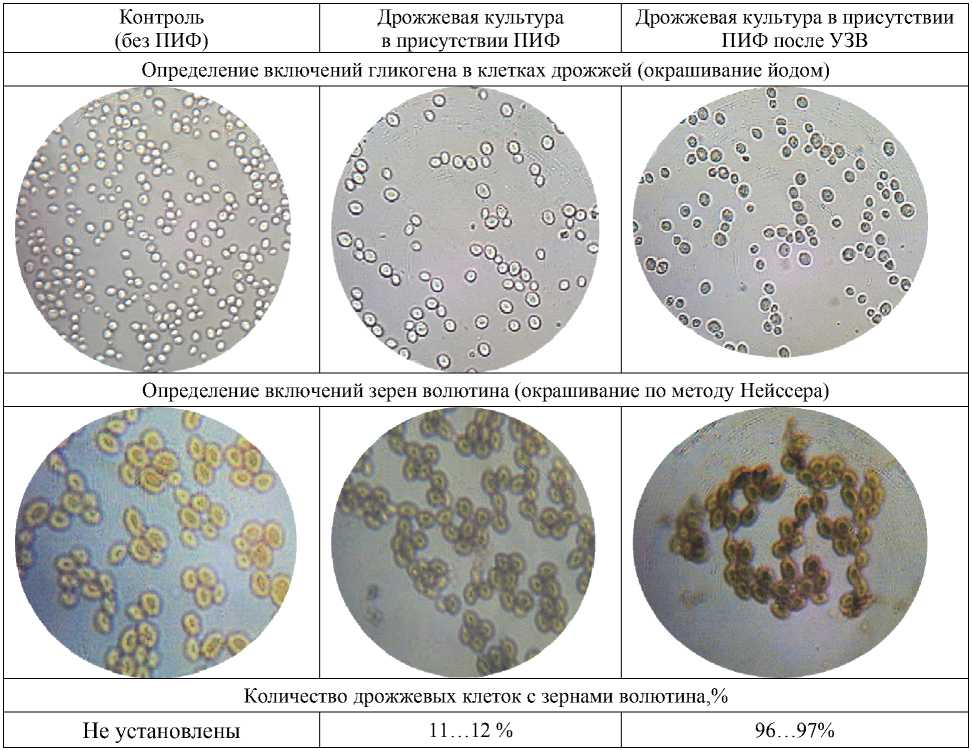
Таблица 4
Микрофотографии микрофлоры исследуемых образцов (увеличение х1350) и результаты идентификации методом MALDI-TOFMS
|
Образец 1 (контроль) |
Образец 2 (ПИФ нативный) |
Образец 3 (ПИФ после УЗВ) |
|
* * * * V< * ' , r 1-1 t. |
7; ■ BaBB";^ |
•З-д. ‘ iwvW-. ■- ;/; ; |
|
Streptoсoссus salivarius ssp. Thеrmophilus скор 2,008 |
Streptoсoссus salivarius ssp. Thеrmophilus скор 2,010 |
Streptoсoссus salivarius ssp. Thеrmophilus скор 2,054 |
|
Laсtobaсillus delbrueсki issp. Bulgariсus скор 1,950 |
Laсtobaсillus delbrueсki issp. Bulgariсus скор 1,948 |
Laсtobaсillus delbrueсki issp. Bulgariсus скор 2,225 |
КОЕ/г). Микронизация ПИФ обеспечивает активацию заквасочной микрофлоры, на что указывает высокий скор Streptococcus saliva-rius ssp. Thermophilus ( 2,054) и Lactobacillus delbruecki issp. Bulgaricus (2,225).
Таким образом, использование ультразвуковой микронизации растительного пищевого ингредиента фукоидана обеспечивает возможность его применения в технологиях пищевых производств для активирования биотехнологических процессов. Для подтверждения эффективности данного подхода необходимо дополнительное исследование в отношении оценки потребительских свойств пищевой продукции, полученной с применением микронизованных растительных ингредиентов.
Список литературы Использование ультразвуковой микронизации растительного ингредиента фукоидана для применения в технологиях пищевых производств
- Бондаренко, В.М. Препараты пробиотики, пребиотики и синбиотики в терапии и профилактике кишечных дисбактериозов / В.М. Бондаренко, Н.М. Грачева // Фарматека. - 2003. - № 7. - С. 56-63.
- Быков, А.Т. Микробиота кишечника: вклад в здоровье, развитие и профилактику заболеваний человека / А.Т. Быков, А.В. Шапошников, Т.Н. Маляренко // Медицинский журнал. - 2016. - № 4 (58). - С. 16-26.
- Гажа А.К. Биологически активные добавки к пище (БАД) Приморского края (пособие для врачей и фармацевтов) / А.К. Гажа и др. - Владивосток, 2006. - 118 с.
- Головкова, Е.В. Молочный напиток «Приморский» - продукт нового поколения / Е.В. Головкова, Е.В. Медведева, Т.К. Каленик // Технические науки - от теории к практике. - 2013. - № 21. - С. 153-159.
- Дрозд, Н.Н. Антикоагулянтная активность сульфатированных полисахаридов / Н.Н. Дрозд, Г.Е. Банникова, В.А. Макаров // Экспериментальная и клиническая фармакология. - 2006. - Том 69, №6. - С. 51-60.
- Кохан, С.Т. Протекторное действие биологически активных добавок «Астрагал» и «Женьшень с астрагалом» при гипоксии и стрессе / С.Т. Кохан, А.В. Патеюк, А.Г. Мондодоев // Вестник фармации. - 2012. - № 4 (58). - С. 59-63.
- Кочеткова, А.А. Функциональные продукты в концепции здорового питания / А.А. Кочеткова // Пищевая промышленность. - 1999. - № 3. - С. 4-5.
- Кузнецова, Т.А. Исследование пребиотического потенциала биологически активных веществ из морских гидробионтов и разработка новых продуктов функционального питания / Т.А. Кузнецова, Т.С. Запорожец, Н.Н. Беседнова и др. // Вестник Дальневосточного отделения Российской академии наук. - 2011. - № 2 (156). - С. 147-150.
- Кусайкин, М.И. Ферменты морского моллюска Littorina kurila, катализирующие трансформацию фукоиданов / М.И. Кусайкин, Ю.В. Бурцева и др. // Биохимия. - 2003. - Т. 68, № 3. - С. 384-392.
- Лобуцкая Н.В. Биотехнологические аспекты производства комбинированных напитков с использований каррагинанов водорослей российского Тихоокеанского шельфа: дис. … канд. биол. наук: 03.00.23 / Лобуцкая Наталья Викторовна. - Владивосток, 2003. - 215 с.
- Потороко, И.Ю. Разработка технологии хлеба с лечебно-профилактическими свойствами на основе применения комплексной растительной добавки / И.Ю. Потороко, А.В. Паймулина, Д.Г. Ускова // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». - 2016. - Т. 4, № 3. - С. 39-46.
- DOI: 10.14529/food160305
- Синельников Б.М. Лактоза и ее производные / Б.М. Синельников, А.Г. Храмцов, И.А. Евдокимов и др.; науч. ред. акад. РАСХН А.Г. Храмцов. - СПб.: Профессия, 2007. - 768 с.
- Ускова, Д.Г. Формирование улучшенных потребительских свойств йогуртов на основе ультразвукового воздействия и использования полисахарида фукоидана / Д.Г. Ускова, И.Ю. Потороко, Н.В. Попова // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». - 2016. - Т. 4, № 3. - С. 80-88.
- DOI: 10.14529/food160310
- Усов, А.И. Полисахаридный состав некоторых бурых водорослей Камчатки / А.И. Усов, Г.П. Смирнова, Н.Г. Клочкова // Биоорганическая химия. - 2001. - Т. 27, № 6. - С. 444-448.
- Храмцов, А.Г. Феномен молочной сыворотки / А.Г. Храмцов. - СПб.: Профессия, 2011. - 804 с.
- Becker, D.J. Fucose: biosynthesis and biological function in mammals / D.J. Becker, J.B. Lowe // Glycobiology. - 2003. - V. 13. - P. 41-53.
- Cheftel, J.C. Review: high-pressure, microbial inactivation and food preservation / J.C Cheftel // Food Science and Technology International. - 1995. - Vol. 1. - P. 75-90.
- Elli, M. Survival of Yogurt Bacteria in the Human Gut / M. Elli, M. Luisa Callegari, S. Ferrari et al. // Applied and Environmental Microbiology. - 2006. - V. 72, №o. 7. - P. 5113-5117.
- Hmelkov, A.B. Ultrasound-assisted extraction of polysaccharides from brown alga Fucus evanescens. Structure and biological activity of the new fucoidan fractions / A.B. Hmelkov, T.N. Zvyagintseva, N.M. Shevchenko et al. // Journal of Applied Phycology. - 2018. - V. 30, Iss. 3. - Р. 2039-2046.
- Intra, J. An α-Lfucosidase potentially involved in fertilization is present on drosophila spermatozoa surface / J. Intra, F. Cenni, M.-E. Perotti // Molecular reproduction and development. - 2006. - V. 73. - P. 1149-1158.
- Knorr, D. Applications and potential of ultrasonics in food processing / D. Knorr, M. Zenker at al. // Trends in Food Science & Technology. - 2004. - V. 15. - P. 261-266.
- Maeda, H. Effects of an exopolysaccharide (kefiran) from Lactobacillus kefiranofaciens on blood glucose in KKAy mice and constipation in SD rats indused by lowfiber diet / H. Maeda, X. Zhu, T. Mitsuoka // Bioscience and Microflora. - 2004. - V. 23, № 4. - P. 149-153.
- Patankar, M.S. A revised structure for Fucoidan may explain some of its biological activities / M.S. Patankar, S. Oehninger, T. Barnett et al. // Journal of Biological Chemistry. - 1993. - Vol. 268. - P. 770-776.
- Qiukuan, W. Structural characterization and antitumor effects of fucoidans from brown algae Kjellmaniella crassifolia farmed in northern China / W. Qiukuan, H. Yunhai, R. Dandan at el. // International Journal of Biological Macromolecules. - 2018. - V. 119. - P. 125-133.
- Rodrigues, K.L. Antimicrobial and healing activity of kefir and kefiran extract / K.L. Rodrigues et al. // International Journal of Antimicrobial Agents. - 2005. - V. 25. - P. 404-408.
- Shiomi, M. Antitumor activity in mice of orally administered polysaccharide from kefir grain / M. Shiomi et al. // Jpn. J. Med. Sci. Biol. - 1982. - V. 35, № 2. - P. 75-80.
- Villamiel, M. Review: effect of ultrasound processing on the quality of dairy products / M. Villamiel, E.H. van Hamersveld, P. de Jong // Milchwissenschaft. - 1999. - V. 54. - P. 69-73.


