Исследование алкилирования 3,5-диметилпиразола методом хроматомасс-спектрометрии
Автор: Ким Дмитрий Гымнанович, Бердникова Елена Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.6, 2014 года.
Бесплатный доступ
Изучено взаимодействие 3,5-диметилпиразола с аллилбромидом, металлилхлоридом, этилбромидом и 4-бутенилбромидом в щелочной среде. Методом масс-спектрометрии исследованы 1-(2-метил-2-пропенил)-3,5- диметилпиразол, 4-(2-метил-2-пропенил)-3,5-диметил-1 Н-пиразол, 1,4-ди-(2- метил-2-пропенил)-3,5-диметилпиразол, 4-этил-3,5-диметил-1 Н-пиразол, 1-(3- бутенил)-3,5-диметилпиразол и 4-(3-бутенил)-3,5-диметил-1 Н-пиразол.
5-диметилпиразол, алкилирование, 3-бромпропен, 2-метил-3-хлорпропен, иодэтан, 4-бромбутен, хроматомасс-спектрометрия
Короткий адрес: https://sciup.org/147160287
IDR: 147160287 | УДК: 547.77
Текст научной статьи Исследование алкилирования 3,5-диметилпиразола методом хроматомасс-спектрометрии
Соединения, имеющие в структуре пиразольный фрагмент, входят в состав многих лекарственных средств [1], успешно применяются для синтеза координационных соединений [2], поэтому вызывают повышенный интерес. Известно, что пиррол алкилируется аллилбромидом в щелочной среде с образованием N- и C-производных [3, 4]. В молекуле 3,5-диметилпиразола имеются две электронодонорные метильные группы, поэтому теоретически алкилирование возможно так же, как и в пирроле по атомам азота и углерода. По литературным данным алкилирование 3,5-диметилпиразола идет по атому азота [5]. Целью настоящей работы является исследование алкилирования 3,5-диметилпиразола методом хроматомасс-спектрометрии.
Обсуждение результатов
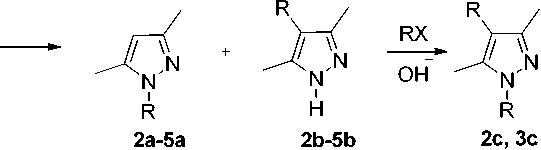
Методом хроматомасс-спектрометрии нами установлено, что 3,5-диметилпиразол (1) реагирует с 3-бромпропеном (аллилбромид) в изопропиловом спирте в присутствии изопропилата натрия или гидроксида калия с образованием смеси 1-аллил-3,5-диметилпиразола (2а) , 4-аллил-3,5-диметил-1 Н -пиразола (2b) и 1,4-диаллил-3,5-диметилпиразола (2c) . Идентификацию соединений 2a–2с осуществили путем сравнения с масс-спектрами соответствующих соединений, имеющихся в базе данных NIST 08 [6]. По литературным данным аллилирование 3,5-диметилпиразола аллилбромидом в тетрагидрофуране в присутствии диизопропилэтиламина [7] протекает по атому азота.
Аналогично с образованием трех производных протекает алкилирование 3,5-диметилпиразола 2-метил-3-хлорпропеном (металлилхлорид) в изопропиловом спирте в присутствии изопропилата натрия. При этом образуется смесь 1-(2-метил-2-пропенил)-3,5-диметилпиразола (3а) , 4-(2-метил-2-пропенил)-3,5-диметил-1 Н -пиразола (3b) и 1,4-ди(-(2-метил-2-пропенил)-3,5-диметилпиразола (3c) .
При алкилировании пиразола 1 менее активным иодэтаном в изопропиловом спирте в присутствии изопропилата натрия образуется смесь 1-этил-3,5-диметилпиразола (4a) и 4-этил-3,5-диметил-1 Н -пиразола (4b) , при этом 1,4-диэтил-3,5-диметилпиразол не обнаружен. В базе данных NIST 08 имеется масс-спектр 1-этил-3,5-диметилпиразола, что позволило идентифицировать соединение 4a в нашем исследовании.
При взаимодействии пиразола 1 с 4-бромбутеном в присутствии КОН или изопропилата натрия в изопропиловом спирте образуется смесь 1-(3-бутенил)-3,5-диметилпиразола (5a) и 4-(3-бутенил)-3,5-диметил-1 Н -пиразола (5b) ,
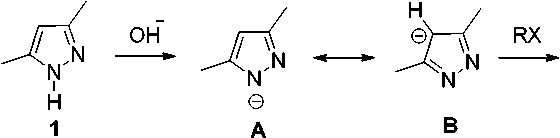
Образование С-производных 2b–5b обусловлено тем, что депротонирование соединения 1 под действием основания осуществляется с образованием аниона А, который резонансно стабилизирован с анионом B (схема 1).
Од 9n R — za~zG ГХ —

3a-3c
5a-5b R=\^4
Схема 1. Алкилирование 3,5-диметилпиразола
Масс-спектры N-производных отличаются от масс-спектров С-производных (см. таблицу).
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m/z (I, %) |
|
1 (C 5 H 8 N 2 ) |
96 [M]+• (100), 95 [M–H]+ (74), 81 (13), 68 (6), 55 (5), 54 (16), 42 (9), 41(10), 39 (9) |
|
2a (C 8 H 12 N 2 ) |
136 [M]+• (63), 135 [M–H]+ (100), 121 [M–CH 3 ]+ (9), 109 [M–C 2 H 3 ]+ (35), 108 (15), 95 [M– C 3 H 5 ]+ (15), 94 (9), 82 (5), 80 (5), 68 (7), 67 (5), 54 (5), 42 (11), 41 (13), 39 (16) |
|
2b (C 8 H 12 N 2 ) |
136 [M]+• (38), 135 [M–H]+ (32), 110 (7), 109 [M–C 2 H 3 ]+ (100), 95 [M–C 3 H 5 ]+ (6), 94 (7), 82 (9), 68 (6), 54 (6), 42 (12), 41 (6), 39 (10) |
|
2c (C 11 H 16 N 2 ) |
176 [M]+• (94), 175 [M–H]+ (100), 161 [M–CH 3 ]+ (33), 150 (7), 149 [M–C 2 H 3 ]+ (64), 147 (6), 146 (5), 135 [M–C 3 H 5 ]+ (18), 134 (10), 133 (13), 132 (5), 121 (6), 120 (11), 119 (5), 109 (18), 108 (7), 107 (5), 106 (6), 95 (6), 94 (9), 93 (7), 92 (6), 91 (10), 80 (7), 79 (10), 77 (9), 68 (8), 67 (6), 65 (6), 53 (9), 42 (15), 41 (27), 39 (13) |
|
3a (C 9 H 14 N 2 ) |
150 [M]+• (83), 149 [M–H]+ (100), 136 (5), 135 [M–CH 3 ]+ (53), 122 [M–C 2 H 4 ]+ (6), 110 (8), 109 [M–C 3 H 5 ]+ (95), 108 (13), 96 (8), 95 [M–C 4 H 7 ]+ (46), 94 (11), 82 (8), 81 (5), 80 (5), 68 (12), 67 (7), 66 (6), 65 (6), 55 (11), 54 (7), 53 (10), 42 (27), 41 (23), 40 (8), 39 (35) |
|
3b (C 9 H 14 N 2 ) |
150 [M]+• (24), 149 [M–H]+ (6), 110 (7), 109 [M–C 3 H 5 ]+ (100), 82 (6), 42 (7), 39 (6) |
|
3c (C 13 H 20 N 2 ) |
204 [M]+• (100), 203 [M–H]+ (99), 190 (5), 189 [M–CH 3 ]+ (32), 164 (8), 163 [M–C 3 H 5 ]+ (64), 161 (7), 149 (15), 148 (11), 147 [M–C 4 H 7 ]+ (20), 135 (5), 134 (5), 133 (10), 121 (5), 109 (18), 108 (7), 107 (5), 95 (8), 94 (5), 93 (5), 81 (5), 79 (5), 77 (5), 68 (5), 55 (16), 53 (7), 42 (9), 41 (6), 39 (7) |
|
4a (C 7 H 12 N 2 ) |
124 [M]+• (27), 109 [M–CH 3 ]+ (23), 97 (7), 96 [M–C 2 H 4 ]+ (100), 95 (86), 81 (15), 79 (6), 68 (12), 65 (8), 55 (8), 54 (21), 53 (6), 52 (5), 42 (20), 41 (17), 39 (20) |
|
4b (C 7 H 12 N 2 ) |
124 [M]+• (84), 110 (6), 109 [M–CH 3 ]+ (100), 82 (6), 81 (58), 65 (7), 63 (5), 54 (6), 53 (28), 52 (7), 51 (6), 39 (12) |
|
5a (C 9 H 14 N 2 ) |
150 [M]+• (36), 149 [M–H]+ (17), 136 (9), 135 [M–CH 3 ]+ (100), 134 (5), 109 [M–C 3 H 5 ]+ (28), 108 (6), 96 (28), 95 [M–C 4 H 7 ]+ (44), 94 (5), 68 (5), 55 (8), 54 (6), 53 (5), 42 (7), 41 (6), 39 (9) |
|
5b (C 9 H 14 N 2 ) |
150 [M]+• (56), 149 [M–H]+ (37), 135 [M–CH 3 ]+ (13), 123 (5), 122 [M–C 2 H 4 ]+ (17), 110 (7), 109 [M–C 3 H 5 ]+ (100), 108 (15), 96 (20), 95 [M–C 4 H 7 ]+ (20), 82 (8), 81 (5), 80 (7), 79 (7), 68 (11), 53 (7), 42 (15), 41 (14), 39 (11) |
Пики с интенсивностью менее 5 % не учитывались.
В масс-спектрах всех С-производных 2b-5b максимальным является пик с m/z 109, соответствующий ароматическому катиону 3,6-диметил-1 Н -пиридазиния, который может образоваться по схеме 2. Вторым по интенсивности является пик молекулярного иона.
Ким Д.Г., Бердникова Е.В.
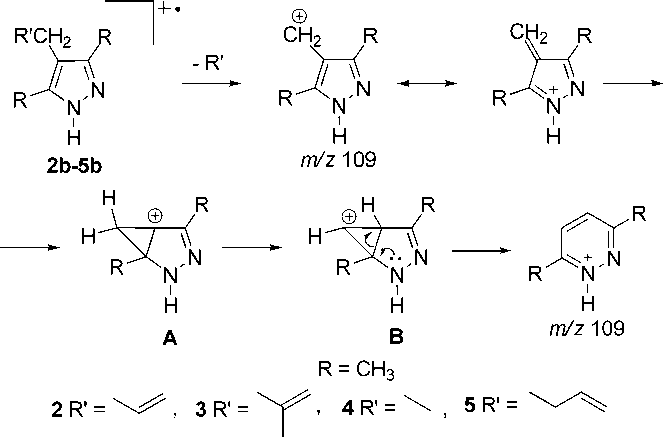
Схема 2. Образование катиона 3,6-диметил-1 Н -пиридазиния
В масс-спектре N-металлильного производного 3a пик [М–Н]+ является максимальным, что обусловлено образованием устойчивого 2,5,7-триметил-1 Н -пиразоло[1,2- a ]пиразолиевого катиона С (схема 3). Пик молекулярного иона является вторым по интенсивности. Имеется пик [М–СН 3 ]+, обусловленный образованием 5,7-диметил-1 Н -пиразоло[1,2- a ]пиразолиевого катиона D, пик с m/z 109, который обусловлен образованием 3,5-диметил-1-метилен-1 Н -пиразолиевого катиона и пик с m/z 95, обусловленный отщеплением металлильного фрагмента.
Аналогичная фрагментация наблюдается для N-аллилпиразола 2а (см. таблицу).
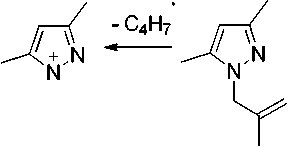
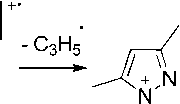
D
m/z 109
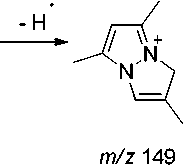
Схема 3. Основные процессы фрагментации 1-(2-метилаллил)- 3,5-диметилпиразола
Образование катиона 3,5-диметил-1-метилен-1 Н -пиразолия с m/z 109 описано в работе [8]. Он образуется при фрагментации 1-(2-хлорэтил)-3,5-диметилпиразола и является максимальным пиком.
Пик [М–СН 3 ]+ в соединении 2а является значительно менее интенсивным, чем в соединении 3а . Это обусловлено тем, что метильный радикал в соединении 2а отщепляется только из ароматического пиразольного кольца.
В масс-спектре N-этильного производного 4а максимальным является пик с m/z 96 , который является катион-радикалом 3,5-диметилпиразола и образуется при выбросе молекулы этилена. Вторым по интенсивности является пик с m/z 95, обусловленный выбросом этильного радикала и образованием катиона 3,5-диметилпиразолия.
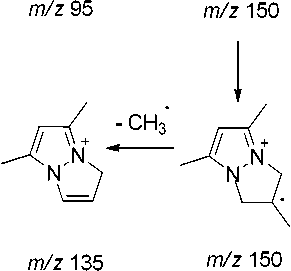
В масс-спектре N-бутенильного производного 5а максимальным является пик с m/z 135, который, на наш взгляд обусловлен не только выбросом метильной группы с пиразольного кольца, но и образованием 5,7-диметил-1 Н -пиразоло[1,2- а ]пиразолиевого катиона (схема 4). Об этом свидетельствует то, что в масс-спектре исходного соединения 1 пик [M–15]+ является малоинтенсивным (13 %).
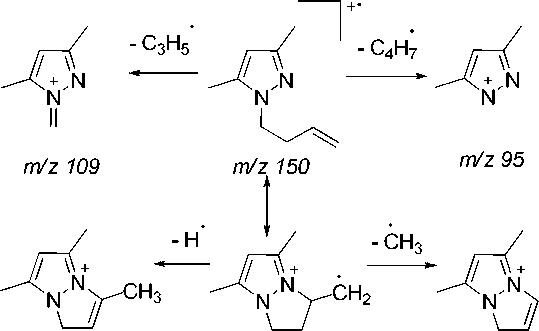
m/z 149 m/z 150
m/z 135
Схема 4. Основные процессы фрагментации 1-(бутенил-3)- 3,5-диметилпиразола
Следует отметить, что все С-аллильные производные 2b–5b имеют немного большее время удерживания, чем соответствующие N-аллильные производные 2а–5а .
Масс-спектры диаллильных соединений 2с и 3с имеют подобную фрагментацию с соответствующими N-аллильными соединениями 2а и 3а и близко совпадают со спектром 1-аллил-3,5-диметил-4-формилпиразола, который описан в работе [9].
Экспериментальная часть
Масс-спектры электронного удара сняты на газовом хроматомасс-спектрометре GCMS-QP2010 Ultra фирмы Shimadzu при энергии ионизации 70 эВ.
Получение замещенных 3,5-диметилпиразолов 2a–2c, 3a–3c, 4a–4b, 5a–5b (общая методика). 0,046 г (2 ммоль) Na растворяют в 4 мл изопропилового спирта, приливают раствор 0,096 г (1 ммоль) 3,5-диметилпиразола в 2 мл изопропилового спирта, 0,13 мл (1,5 ммоль) бромистого аллила или 0,15 мл (1,5 ммоль) хлористого металлила или 0,12 мл (1,5 ммоль) иодистого этила или 0,20 мл (1,5 ммоль) бромистого бутенила. Смесь кипятят с обратным холодильником 4 часа, охлаждают, отфильтровывают. Фильтрат после испарения растворителя экстрагируют CH 2 Cl 2 . После отгонки CH 2 Cl 2 получают маслообразные вещества.
Заключение
Установлено, что аллилирование 3,5-диметилпиразола бромистым аллилом и хлористым металлилом протекает с образованием смеси трех производных: N-, C- и ди-замещенных 3,5-диметилпиразола. Алкилирование соединения 1 иодэтаном и 4-бромбутеном протекает с образованием N- и C-замещенных 3,5-диметилпиразолов.
Список литературы Исследование алкилирования 3,5-диметилпиразола методом хроматомасс-спектрометрии
- Targets in Heterocyclic Systems. Chemistry and Properties/J. Elguero, P. Goya, N. Jagerovic, A.M.S. Silva//Rome.: Italian Soc. Chem. -2002. -V. 6. -P. 53.
- Dias H.V.R., Diyabalange H.V.K., Rawashdeh-Omary M.A., Frazman M.A., Omary M.A. Bright Phosphorescence of a Trinuclear Copper(I) Complex: Luminescence. Thermochromism, Solvatochromism, and “Concentration Luminochromism”. J. Am. Chem. Soc., 2003, vol. 125, p. 12072
- Bright Phosphorescence of a Trinuclear Copper(I) Complex: Luminescence. Thermochromism, Solvatochromism, and “Concentration Luminochromism”/H.V.R. Dias, H.V.K. Diyabalange, M.A. Rawashdeh-Omary et al.//J. Am. Chem. Soc. -2003. -V. 125. -P. 12072.
- Химия пиррола. Новые страницы/Б.А. Трофимов, А.И. Михалева, Е.Ю. Шмидт, Л.Н. Собенина. -Новосибирск: Наука, 2012. -382 с.
- Пожарский, А.Ф. Теоретические основы химии гетероциклов/А.Ф. Пожарский. -М.: Химия, 1985. -280 с.
- Electron Ionization (EI) mass spectral library -NIST 08. База данных масс-спектров.
- Синтез и реакции 4-формилзамещенных пиразолов/Е.В. Рудякова, В.А. Савосик, Л.К. Паперная и др.//Журнал органической химии. -2009. -Т. 45, № 7. -С. 1053-1057.
- К вопросу формилирования 1-(β-оксиэтил)-3,5-диметилпиразола по методу Вильсмайера-Хаака. Письмо в редакцию/О.С. Аттарян, С.К. Антаносян, Р.Т. Григорян и др.//Химический журнал Армении. -2005. -Т. 58, № 1-2. -С. 131-133.
- Основные закономерности фрагментации дитио-и оксатиоацеталей пиразолкарбальдегидов при электронной и химической ионизации/Л.В. Клыба, Л.К. Паперная, Е.Р. Санжеева и др.//Журнал органической химии. -2011. -Т. 47, № 12. -С. 1813-1822.


