Исследование фазовых равновесий в водно-солевых системах, содержащих компоненты молочной сыворотки
Автор: Плотникова С.Е., Горбунова Е.М., Нифталиев С.И., Бочарова Л.В., Лучко А.М.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 4 (98) т.85, 2023 года.
Бесплатный доступ
В настоящее время экологичным и перспективным является использование молочной сыворотки для получения лактозы, лактулозы и других ценных продуктов, полезных для здоровья человека. Однако сыворотка содержит достаточно большое количество минеральных солей, что затрудняет процессы переработки. В процессе деминерализации широко применяются нонофильтрационные, катионо- и анионообменные мембраны и др., которые загрязняются образующимися кристаллами солей. Наименее растворимыми из неорганических веществ, присутствующих в сыворотке являются соли кальция, в связи с этим представляет интерес трехкомпонентная система Ca(H2PO4)2 - CaCl2 - H2О. Диаграмма состояния системы Ca(H2PO4)2 - CaCl2 - H2О при температуре 20 ºС содержит информацию о фазовых равновесиях. По точкам, отвечающим составу равновесных жидких фаз, построена линия моновариантного равновесия, под которой находится область ненасыщенных растворов. Методом Скрейнемакерса установлено, что в области, прилежащей к стороне Ca(H2PO4)2 - H2О кристаллизуется моногидрат дигидрофосфата кальция. Для области, примыкающей к вершине CaCl2, происходит совместная кристаллизация трех солей: Са(Н2РО4)2 + СaCl2 + СaCl2·6H2O. На треугольнике составов присутствуют две области совместного существования раствора и кристаллов L + Са(Н2РО4)2·H2O + Са(Н2РО4)2 и L + Са(Н2РО4)2 + СaCl2·6H2O. Состав кристаллизующихся твердых фаз подтвержден химическим анализом. Используя полученные данные можно создать условия для предварительной кристаллизации солей, входящих в состав молочной сыворотки, и выделение их из раствора, что уменьшит забивание пор мембран в дальнейшем процессе деминерализации сыворотки.
Молочная сыворотка, деминерализация, диаграмма состояния, получение лактозы, получение лактулозы
Короткий адрес: https://sciup.org/140304439
IDR: 140304439 | УДК: 640 | DOI: 10.20914/2310-1202-2023-4-139-144
Текст научной статьи Исследование фазовых равновесий в водно-солевых системах, содержащих компоненты молочной сыворотки
DOI:
Сыворотка является ценнейшим пищевым продуктом, включающим все необходимые организму аминокислоты, минеральные вещества, витамины, лактозу. Сыворотка содержит более 200 полезных для человека ингредиентов [1]. Включение данного продукта в рацион способствует регулированию функции желудочнокишечного тракта, улучшает процесс обмена веществ, подавляет аппетит, ускоряет метаболизм и сохраняет мышечную массу при похудении. Кроме того молочная сыворотка улучшает кровообращение, укрепляет стенки кровеносных сосудов и нормализует артериальное давление. Сыворотка способствует выработке глутатиона – антиоксиданта, положительно воздействует на состояние кожных покровов и укрепляет волосяные луковицы. Таким образом, продукты из молочной сыворотки являются важными и принятыми для диетического и лечебного питания [2, 3]. Однако сыворотка содержит достаточно большое количество минеральных солей, что затрудняет использование ее как пищевого продукта и сырья для производства. Поэтому деминерализация молочной сыворотки является актуальной проблемой в настоящее время [4].
В промышленности для деминерализации сыворотки используют 2 основных способа: электродиализная и нанофильтрационная обработка сыворотки [5].
Обессоливание сыворотки методом электродиализа является широко применяемым способом очистки от минеральных солей [6]. Максимальный уровень деминерализации сыворотки при электродиализе может достигать 90%. Получаемая в результате сыворотка имеет высокие органолептические свойства и широкий спектр применения. Однако электродиализная обработка предполагает предварительное проведение сепарирования сыворотки для ее очистки от жира, казеиновой пыли и коагулированных белков, так как в процессе электродиализа они оседают на поверхности мембран, затрудняя их работу.
Одним из перспективных и современных методов является нанофильтрация [7, 8, 9]. Процесс нанофильтрации занимает по размеру пор мембран промежуточное место между ультрафильтрацией и обратным осмосом. Нанофильтрацион-ные мембраны пропускают воду с растворенными в ней одновалентными минеральными веществами и задерживают основные компоненты сыворотки (лактозу, белок и др). Все мембранные методы, включая нанофильтрацию, требуют предварительной очистки сыворотки от жира и взвешенных частиц. Однако при проведении нанофильтрации возникают проблемы загрязнения пор мембран образующимися кристаллами солей [7].
В состав сыворотки входят следующие элементы, представленные в таблице 1.
Таблица 1.
Содержание основных зольных элементов в составе сыворотки
Table 1.
The content of the main ash elements in the composition of the serum
|
Элемент | Element |
Содержание, % | Content, % |
|
Калий | Potassium |
0,09–0,19 |
|
Магний | Magnesium |
0,009–0,02 |
|
Кальций | Calcium |
0,04–0,11 |
|
Натрий | Sodium |
0,03–0,05 |
|
Фосфор | Phosphorus |
0,04–0,10 |
|
Хлор | Chlorine |
0,08–0,11 |
Минеральные вещества в составе сыворотки представлены в виде солей органических и неорганических кислот. Количественное содержание анионов (5,831 г./л) и катионов (3,323 г./л) в молочной сыворотке аналогично содержанию микроэлементов в цельном молоке [10]. Катионы сыворотки представлены К, Na, Ca, Mg, а анионы – радикалами фосфорной, лимонной и соляной кислот. Соотношение форм производных фосфорной кислоты в воде в зависимости от рН представлено в таблице 2.
Таблица 2.
Соотношение форм производных фосфорной кислоты в воде в зависимости от рН (% молей)
Table 2.
Ratio of forms of phosphoric acid derivatives in water depending on рН (% moles)
|
Форма | Form |
рН |
|||||||
|
5 |
6 |
7 |
8 |
8,5 |
9 |
10 |
11 |
|
|
[Н 3 РО 4 ] |
0,1 |
0,01 |
- |
- |
- |
- |
- |
- |
|
[Н 2 РО 4 ] |
97,99 |
83,67 |
33,90 |
4,88 |
1,6 |
0,51 |
0,05 |
|
|
[НРО 42- ] |
1,91 |
16,32 |
66,10 |
95,12 |
98,38 |
99,45 |
99,59 |
99,53 |
|
[РО 43- ] |
- |
- |
- |
- |
0,01 |
0,04 |
0,36 |
3,47 |
Поскольку сыворотка имеет рН среды около 5, то можно предположить, что фосфор находится в молочной сыворотке преимущественно в виде дигидрофосфат-иона [10].
Ионы кальция практически не проходят нанофильтрационную мембрану, что объясняется достаточно большим радиусом в гидратированном состоянии [11]. Кроме того, соли калия и натрия хорошо растворимы, кристаллизации
Плотникова С.Е. и др. Вестник ВГУИТ, 2023, Т. 85, №. 4, С. будут подвергаться, в первую очередь, соли кальция. Что определило объект нашего исследования – трехкомпонентную систему хлорид кальция-дигидрофосфат кальция-вода.
Материалы и методы
Для построения фазовой диаграммы трехкомпонентной системы Ca(Н 2 РО 4 ) 2 -СаСl 2 -Н 2 О при заданной температуре методом Скрейнемакерса были изучены смеси компонентов на концентрационном треугольнике Гиббса–Розебома [12, 13]. 3 сечения с различным соотношением дигидрофосфата кальция и воды 5:95 (I сечение); 10:90 (II сечение); 15:85 (III сечение) представлены на рисунке 1.
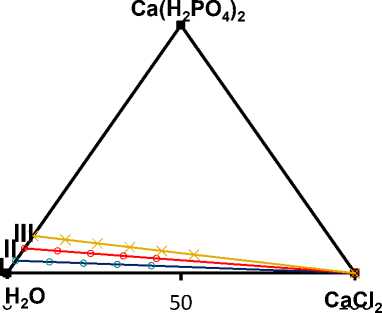
Рисунок 1. Положение разрезов в системе СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 О
Figure 1. The position of the cuts in the СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 О system
Рассчитывали массы навесок и готовили смеси трех компонентов [14]. Растворы термостатировали в течение 2 суток при температуре 20 °С в электрическом суховоздушном термостате ТСО-1/80 СПУ для установления равновесия, аналитическими методами определяли составы раствора и твердой фазы, полученных из исходной смеси. Для каждой точки сечения брали пробу жидкой и кристалллической фазы, взвешивали, растворяли в мерной колбе на 50 см3
и определяли концентрацию ионов Са2+, Cl-и ионов фосфорной кислоты.
Все используемые реактивы имеют классификацию x.ч.
Содержание Са2+ в пробах определяли титрованием в присутствии аммиачного буферного раствора (рН = 9,5) с эриохромом черным Т раствором ЭДТА с молярной концентрацией эквивалента 0,01 моль/дм3 [14]. Содержание Cl– определяли аргентометрическим методом с индикатором хроматом калия (применяли раствор нитрата серебра с молярной концентрацией эквивалента 0,01 моль/дм3).
Определение фосфора проводили фотометрическим методом с ванадато-молибдатофосфа-том [15]. Для проведения анализа применяли реактив, состоящий из смеси растворов А и Б. Раствор А: 2,5 г ванадата аммония растворяли в 500 мл слабокипящей воде, после охлаждения добавляли 20 мл конц. НNО 3 и разбавляли до 1000 мл. Раствор Б: 100г молибдата аммония растворяли в 500 мл воды при 50о С. Раствор охлаждали, смешивали с 100 мл конц. Н 2 SО 4 , вновь охлаждали и разбавляли до 1000 мл. К раствору пробы добавляли 10 мл раствора В и при помешивании 10 мл смеси реактивов А и Б, разбавляли водой до 50 мл. Через 5 мин проводили измерение поглощения при 400 нм в кювете 30 мм относительно дистиллированной воды на КФК-2МП. Концентрацию ионов фосфорной кислоты определяли по градуировочному графику (зависимость концентрации от оптической плотности).
Содержание дигидрофосфаата кальция определяли по данным фотометрического анализа. Содержание хлорида кальция рассчитывали как среднее арифметическое результатов титриметрического анализа ионов Са2+ и ионов Cl-(относительная погрешность не превышала 5%).
Результаты и обсуждения
Результаты анализа для некоторых точек представлены в таблице 3.
Таблица 3.
Состав исходной смеси компонентов, равновесной жидкой и твердой фаз
Table 3.
The composition of the initial mixture of components, equilibrium liquid and solid phase
|
Массовые доли в исходной смеси, % Mass fraction in the initial mixture, % |
Фаза Phase |
Масса пробы для анализа, г Sample weight for analysis, g |
Объем ЭДТА, см3 Volume of EDTA, сm3 |
Объем АgNО 3 , см3 Volume of АgNО 3 , сm3 |
Опти-ческая плотность Optical density |
Массовая доля компонентов, % Mass fraction of components, % |
||||
|
СаСl 2 |
Ca(Н 2 РО 4 ) 2 |
Н 2 О |
СаСl 2 |
Ca(Н 2 РО 4 ) 2 |
Н 2 О |
|||||
|
10 |
4,5 |
85,5 |
ж |
0,4810 |
5,2 |
9,0 |
0,441 |
10,1 |
4,3 |
5,6 |
|
10 |
4,5 |
85,5 |
т |
0,0419 |
0,8 |
0,7 |
0,181 |
9,5 |
10,9 |
9,7 |
|
20 |
4 |
76 |
ж |
0,4038 |
8,1 |
16,5 |
0,335 |
22,0 |
3,5 |
4,5 |
|
20 |
4 |
76 |
т |
0,0947 |
3,0 |
3,0 |
0,366 |
17,6 |
17,1 |
5,4 |
|
10 |
9 |
81 |
ж |
0,3698 |
4,5 |
7,0 |
0,557 |
10,3 |
7,6 |
2,1 |
|
10 |
9 |
81 |
т |
0,0288 |
2,5 |
0,1 |
0,771 |
1,6 |
72,1 |
6,3 |
|
20 |
8 |
72 |
ж |
0,4445 |
9,0 |
16,5 |
0,535 |
20,2 |
6,0 |
3,8 |
|
20 |
8 |
72 |
т |
0,0856 |
2,3 |
3,0 |
0,527 |
18,4 |
15,3 |
6,2 |
По полученным данным строили ноды – линии, соединяющие точки исходной смеси компонентов, жидкой и твердой фазы (рисунок 2).
Три точки одной ноды должны лежать на одной прямой. Положение фигуративной точки твердой фазы на диаграмме растворимости определяется пересечением двух или нескольких лучей.
Состав жидких насыщенных фаз образует линию моновариантного равновесия. Области под линией отвечает жидкая фаза L. В области над линией образуются гетерогенные фазы, содержащие насыщенный раствор и кристаллы. Ноды направлены к точке, отвечающей составу 92,86% дигидрофосфата кальция, 7,14% воды. Это моногидрат дигидрофосфата кальция, устойчивый при данной температуре [16].
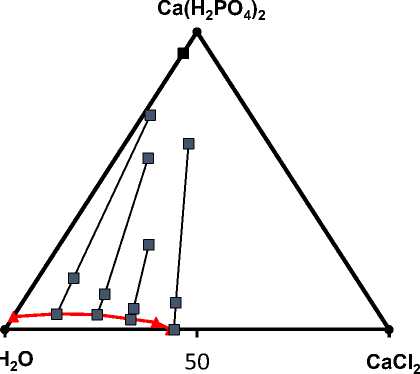
Рисунок 2. Расположение нод в системе СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 О при 20 ºС
Figure 2. Location of nodes in the СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 О system at a temperature of 20 ºС
В соответствии с расположением нод представлено изображение изотермы системы СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 O при 20 ºС (рисунок 3). Известно [17], что при 20 ºС хлористый кальций кристаллизуется из водных растворов в виде гексагидрата СаСl 2 ·6Н 2 O, а дигидрофосфат кальция в виде моногидрата Ca(Н 2 РО 4 ) 2 ·Н 2 O, соответствующие точки нанесены на стороны треугольника составов. На изотерме имеется поле ненасыщенных растворов L, поле криста-лизации моногидрата дигидрофосфата кальция S 1 (L + Са(Н 2 РО 4 ) 2 ·Н 2 O), две области совместного существования раствора и кристаллов S 2 (L + Са(Н 2 РО 4 ) 2 ·Н 2 O + Са(Н 2 РО 4 ) 2 ) и S 3 (L + Са(Н 2 РО 4 ) 2 + СаСl 2 · 6Н 2 O), трехфазная область совместного существования кристаллов трех солей S 4 (Са(Н 2 РО 4 ) 2 + СаСl 2 + СаСl 2 · 6Н 2 O), в которой отсутствует жидкая фаза.
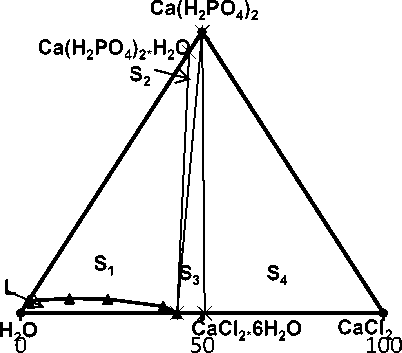
Рисунок 3. Диаграмма состояния системы СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 O при 20 ºС
Figure 3. Diagram of the state of the СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 O system at a temperature of 20 ºС
На диаграмме должно существовать поле кристаллизации гексагидрата хлорида кальция, но в связи с тем, что эта область находится между точкой состава кристаллогидрата (50,7% СаСl 2 , 49,3% Н 2 О) и точкой, отвечающей растворимости хлорида кальция (56,9% СаСl 2 , 43,1% Н 2 О), она мала и определить ее экспериментально сложно.
Заключение
Использование молочной сыворотки как ценного пищевого продукта и сырья для получения диетического и лечебного питания осложняется присутствием в сыворотке большого количества минеральных солей. В процессе деминерализации широко применяются ноно-фильтрационные, катионо- и анионообменные мембраны и др., которые часто загрязняются образующимися кристаллами солей. Наименее растворимыми из неорганических веществ, присутствующих в сыворотке являются соли кальция, в связи с этим представляет интерес трехкомпонентная система хлорид кальциядигидрофосфат кальция-вода.
В результате полученных экспериментальных данных построена диаграмма состояния трехкомпонентной системы СаСl 2 – Са(Н 2 РО 4 ) 2 – Н 2 O при 20 ºС и предложен состав кристаллизующихся твердых фаз, подтвержденный химическим анализом.
Используя полученные данные, можно создать условия для предварительной кристаллизации солей, входящих в состав молочной сыворотки, и выделение их из раствора, что уменьшит забивание пор мембран в дальнейшем процессе деминерализации сыворотки.
Список литературы Исследование фазовых равновесий в водно-солевых системах, содержащих компоненты молочной сыворотки
- Семенова А.А. Пищевая и биологическая ценность молочной сыворотки // Актуальные исследования. 2023. № 1 (131). С. 10–12. URL: https://apni.ru/article/5312-pishchevaya-i-biologicheskaya-tsennost-moloch
- Белякова Т.Н., Печуркина. Д.С. Функциональные продукты как тренд XXI века // Молочная промышленность. 2020. № 2. С. 46–47. Рыбалова Т.И. Молочная индустрия России в 2018 г. // Молочная промышленность. 2019. № 1. С. 4–9.
- Короткий И.А., Плотников И.Б., Мазеева И.А. Современные тенденции в переработке молочной сыворотки // Техника и технология пищевых производств. 2019. Т. 49. № 2. С. 227–234.
- Сенкевич Т., Ридель К.–Л. Молочная сыворотка, переработка и использование в агропромышленном комплексе. М.: Агропромиздат, 2020. 269 с.
- Золотарева М.С., Володин Д.Н., Бессонов А.С. Электродиализ – наиболее эффективный процесс деминерализации молочной сыворотки // Молочная промышленность. 2014. № 3. С. 37–38.
- Тимкин В.А., Новопашин Л.А. Производство концентрата молочной сыворотки баромембранными методами // Научно-технический вестник технические системы в АПК. 2019. № 3(3). С. 91–98.
- Roman A., Wang J., Csanadi J., Partial demineralization and concentration of acid whey by nanofiltration combined with diafiltration // Desalination. 2009. V. 241. P. 288–295. Пат. № 2617940, RU, В01D9/00, В01D61/02, A23C21/00, A23C7/04, A23C1/14.
- Способ переработки молочной сыворотки / Куленко В.Г., Шевчук В.Б., Славоросова Е.В., Дыкало Н.Я., Фиалкова Е.А.; заявитель и патентообладатель ФГОУ ВО "Вологодская государственная молочнохозяйственная академия имени Н.В. Верещагина". Заявл. 18.03.2015; Опубл. 28.04.2017.
- Храмцов А.Г. Новации молочной сыворотки. Санкт-Петербург: Профессия, 2016. 424 с.
- Первов А.Г., Ефремов Р.В., Рудакова Г.Я. Прогноз показателей работы нанофильтрационных мембран и выбор оптимальных доз реагентов при эксплуатации мембранных установок для получения питьевой воды // Водоочистка. 2009. № 1–2. С. 16–21.
- Li D., Meng L., Guo Y., Deng T. et al. Chemical engineering process simulation of brines using phase diagram and Pitzer model of the system CaCl2–SrCl2–H2O // Fluid Phase Equilibria. 2019. № 484. Р. 232–238. doi: 10.1016/j.fluid.2018.11.034
- Нифталиев С.И., Плотникова С.Е., Богданова Т.В., Смольянинова В.С. и др. Влияние температуры на фазообразование в тройной системе Ca(NO3)2-H2 O-n-C3 H7 OH // Конденсированные среды и межфазные границы. 2017. Т. 19. № 3. С. 395–399.
- Плотникова С.Е., Перегудов Ю.С., Горбунова Е.М., Нифталиев С.И. Перспективы применения жидких отходов производства кальцинированной соды в качестве хладоносителя на основе тройной системы CaCl2-K2 Cr2 O7-H2O // Вестник ВГУИТ. 2020. Т. 82. №. 3. С. 233–238.
- ГОСТ 18309–2014. Межгосударственный стандарт. Вода. Методы определения фосфорсодержащих веществ. М.: Стандартинформ. 2014. 24 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ. М.: Химия, 2000. 480 с.
- Киргинцев А.Н., Трушенкова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде. Л.: Химия, 1972. 248 с.
- Tsaturyan A., Arstamyan L., Sargsyan A., Saribekyan J. et al. Development of an efficient method for obtaining lactose and lactulose from whey // Pharmacia. 2023. V. 70. №. 4. P. 1039-1046.
- Paladii I.V., Vrabie E.G., Sprinchan K.G., Bologa M.K. Whey: Review. Part 2. Treatment Processes and Methods // Surface Engineering and Applied Electrochemistry. 2021. V. 57. P. 651-666.
- Hourigan J.A., Lifran E.V., Vu L.T., Listiohadi Y. et al. Lactose: chemistry, processing, and utilization // Advances in dairy ingredients. 2013. P. 21-41.


